Introducción
La lipotransferencia es uno de los principales campos de trabajo en el ámbito de la Cirugía Plástica con varias líneas de investigación a desarrollar. La lipoinyección como tratamiento de los signos de envejecimiento facial puede ser un procedimiento primario o complementario para tratar la atrofia de los tejidos. El injerto de grasa proporciona un rejuvenecimiento volumétrico con un material que se integra al tejido facial y aporta una apariencia natural mantenida en el tiempo. De manera secundaria, el lipoinjerto mejora la calidad del tejido facial por un mecanismo que implica la participación de las células madre derivadas del tejido adiposo (ASC por sus siglas en inglés – adipose stem cells).(1) Las ASC tienen una gran potencialidad terapéutica debido a que su obtención es poco costosa e invasiva y su número es mucho mayor que el de los progenitores de la médula ósea.
En 1994, Coleman(2) introduce el método purificado atraumático y sistematiza el procedimiento de lipoinyección con recomendaciones para cosechar la grasa, centrifugarla e introducirla en múltiples túneles para asegurar un contacto estrecho con un tejido receptor bien vascularizado. En el 2001,(3) un grupo de cirujanos plásticos e investigadores de Pittsburgh demuestra que el tejido adiposo es una gran fuente de células madre mesenquimales adultas (CMM) capaces de diferenciarse en varios tejidos y se identifica la fracción vascular estromal (SVF por sus siglas en inglés – stromal vascular fraction) como fuente de estas células. Coleman(2) menciona que no existe la sustancia ideal para relleno facial, pero que el lipoinjerto parece ser lo más seguro y puede proveer una apariencia natural.
En el 2002 se establece la primera sociedad sobre el tema, la Federación Internacional de Ciencias y Tratamientos de la Grasa (IFATS por sus siglas en inglés – International Federation for Adipose Therapeutics and Science). Desde entonces, las aplicaciones clínicas en Cirugía Plástica al usar injerto de grasa y de células madre derivadas del estroma han tenido una expansión constante. Chajchir y col.(4) en 2007 se interesan en el lipoinjerto para el relleno de surcos o depresiones del contorno facial.
Diferentes autores(1, 5, 6) concuerdan en que parte del éxito del lipoinjerto está en relación directa con las diversas técnicas de preparación y refinamiento previa lipoaspiración antes de su implantación, así como el uso de ciertos factores que promuevan su desarrollo. Es necesario respetar cada aspecto de la técnica para alcanzar los objetivos deseados, evitar complicaciones y lograr una mayor supervivencia del injerto que garantice un mejor resultado.
Un grupo de investigadores del Instituto de Hematología e Inmunología José Manuel Ballester Santovenia y del Servicio de Cirugía Plástica y Caumatología del Hospital Hermanos Ameijeiras en la Habana, Cuba, demostraron durante el año 2020 la factibilidad de aplicar en el sistema de salud cubano la citometría de flujo con el objetivo de identificar las ASC en el tejido adiposo emulsionado obtenido por nanofat. Se encontró un 4% de células progenitoras CD34+ con respecto al total de eventos y más de la mitad de ellas fueron de estirpe hematopoyética CD45+. La viabilidad celular superó el 95% y se mantuvo invariable entre réplicas que se analizaron con idéntica metodología inmediatamente y 72 horas después de su obtención.(7) En Cuba, el método de lipoinyección se comienza a utilizar para el relleno de labios y surcos nasogenianos (SNG) desde 1990, sin que se hayan publicado resultados. Estas técnicas quedaron en desuso dada la no permanencia en el tiempo de los resultados, lo que incentivó la búsqueda de nuevas herramientas terapéuticas. En la actualidad, tras la profundización en el estudio de los factores que intervienen en la supervivencia del injerto graso y el descubrimiento de las ASC, se retoma el procedimiento como opción de mínimo acceso para el tratamiento del vector negativo facial.
A nivel nacional llama la atención la ausencia de publicaciones que justifiquen su aplicación y beneficios en el tratamiento del envejecimiento facial, por lo que esta investigación constituye, hasta donde sabemos, el primer ensayo clínico en Cuba. Es un procedimiento autólogo, atóxico, no inmunorreactivo, ambulatorio, que retrasa cirugías costosas y de riesgo en el tratamiento del envejecimiento facial y constituye el primer paso de obtención de ASC a partir de tejido graso como forma de tratamiento innovador para la regeneración de los tejidos a nivel nacional.
Realizamos la presente investigación con el objetivo de evaluar la eficacia y seguridad de la lipotransferencia por centrifugación asistida con células madre derivadas del tejido adiposo en los pacientes con envejecimiento facial.
Material y método
Ensayo comparativo aleatorizado doble ciego (fase III) con RPCEC00000362, en el Servicio de Cirugía Plástica y Caumatología del Hospital Hermanos Ameijeiras de la Habana (Cuba) en el período comprendido entre septiembre del 2019 y julio del 2021. Incluimos pacientes con edades entre los 25 y 60 años, sin distinción de sexo, con signos de envejecimiento facial, con exámenes complementarios dentro de límites normales y voluntariedad de participar en el estudio previo consentimiento informado por escrito. Excluimos pacientes con antecedentes de trastornos psiquiátricos o coagulopatías, con falsas expectativas, mujeres embarazadas o lactando, antecedentes de queloides, infección cutánea o sistémica, en tratamiento con medicamentos que comprometan la cicatrización o coagulación, con antecedentes de haberse realizado lipotransferencia facial o inyectado otras sustancias de relleno en la cara y con enfermedades crónicas descompensadas. Tomamos como criterios de salida la aparición de eventos adversos graves o muy graves, aquellos que después de haber iniciado el estudio no desearon continuar en el mismo y los que no acudieron a las consultas de control postoperatorio.
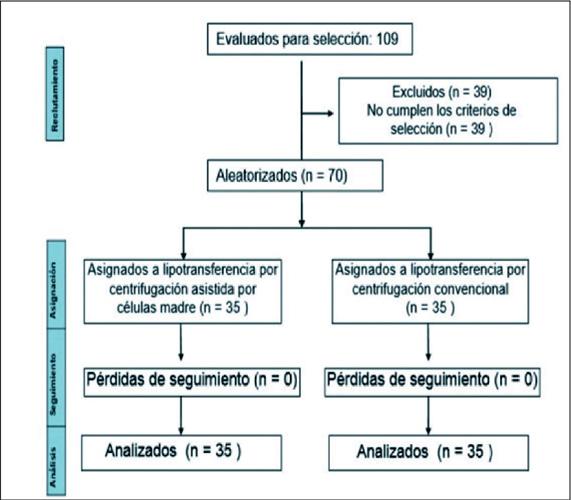
Fueron reclutados 109 pacientes que acudieron de forma consecutiva a la consulta de Cirugía Plástica y Caumatología, de los cuales excluimos 39 por no cumplir los criterios de selección. La muestra quedó constituida por 70 pacientes que dividimos en 2 grupos de tratamiento por técnica de asignación aleatoria (Fig. 1):
Grupo A (grupo estudio o experimental). Quedó constituido por 35 pacientes a los que se les realizó la lipotransferencia facial por centrifugación asistida con ASC.
Grupo B (grupo control). Quedó constituido por 35 pacientes a los que se les realizó la lipotransferencia facial por centrifugación convencional.
Recogimos todos los datos durante el seguimiento postoperatorio en una planilla de recolección de datos. Trasladamos la información obtenida a una base de datos mediante la aplicación Excel Microsoft Office versión XP que posteriormente se exportó al sistema SPSS versión 23.0. Calculamos los tamaños de muestra para comparación de 2 proporciones mediante el programa Epidat 3.1. Tuvimos en cuenta la proporción de éxito en grupo A (0.85) y en grupo B (0.50), potencia de la prueba (80%), y nivel de confianza (95%). El tamaño de muestra mínimo necesario en cada grupo fue de 27 pacientes; ajustado al 20% de pérdidas por razones diversas, el tamaño muestral quedó definido en 35.
La asignación a los grupos de tratamiento fue aleatorizada mediante el programa Epidat 3.1. El listado de números aleatorios para cada grupo se colocó en la consulta de Cirugía Plástica y Caumatología y solo la enfermera tuvo acceso al mismo. Realizamos la asignación cuando se verificó el cumplimiento de los criterios de inclusión y firma del consentimiento informado de participación en el estudio por parte del paciente. En estas condiciones, la enfermera entregó el número correspondiente al paciente de acuerdo al orden de llegada a la consulta y este fue colocado en la historia clínica.
Resumimos las variables cualitativas en números absolutos y porcentajes. Las variables cuantitativas en media y desviación estándar. Para las variables cualitativas detectamos la diferencia significativa entre los grupos de tratamiento y aplicamos la prueba chi cuadrado (χ2); además aplicamos la prueba t de Student en el caso de comparación de medias entre los grupos.
Para la comparación de las proporciones del porcentaje de conservación del volumen del injerto utilizamos la prueba Q de Cochrane. Empleamos la prueba de los rangos con signo de Wilcoxon para la comparación de proporciones relacionadas inicial/final del tratamiento dentro de cada grupo. Utilizamos la prueba de McNemar para la comparación de proporciones relacionadas inicial/final del tratamiento dentro de cada grupo. Para evaluar la concordancia entre observadores empleamos el Coeficiente de Kappa. Prefijamos un nivel de significación α=0.05 en todas las pruebas de hipótesis. Evaluamos el efecto del tratamiento asistido con ASC mediante la reducción absoluta del riesgo “riesgo atribuible”, en este caso “mejoría atribuible”, obtenido mediante la diferencia del riesgo del grupo control y el riesgo del grupo tratado. Obtuvimos la estimación puntual y por intervalo de confianza al 95%.
Para dar respuesta a los objetivos se operacionalizaron las variables
Sexo
Edad
Fototipo de piel según clasificación de Fitzpatrick.(8)
Grado de envejecimiento según clasificación de Glogau.(5)
-
Porcentaje de conservación del volumen del injerto: expresado en mililitros. Establecimos las categorías:
Arrugas en región frontal según la clasificación para las líneas de la frente.(9)
Pliegues en comisuras de los labios según escala de calificación validada para líneas de marioneta.(10)
Complicaciones.
Satisfacción.
-
Evaluación del resultado final. La realizamos teniendo en cuenta la disminución de al menos un grado en la escala de evaluación de arrugas y/o surcos en una de las regiones intervenidas como mínimo, presencia de complicaciones y satisfacción de los pacientes. Clasificamos como:
◦ Bueno: la valoración mediante ultrasonido mostró un resultado del 75% o más de conservación del volumen del injerto, y se cumplieron los criterios descritos con anterioridad.
◦ Regular: la valoración mediante ultrasonido mostró un resultado menor del 75% de conservación del volumen del injerto, y se cumplieron 2 de los 3 criterios descritos previamente.
◦ Malo: la valoración mediante ultrasonido mostró un resultado menor del 75% de conservación del volumen del injerto, y se cumplió con 1 o ninguno de los criterios mencionados.
Técnicas y procedimientos
Preoperatorio.
Chequeo de exámenes complementarios dentro de límites normales. Alprazolam, tableta de 0.25 mg a las 22:00 horas de la noche anterior. Desayuno normal, aseo general de la región facial y abdominal con abundante agua y jabón. Toma de fotografías preoperatorias.
Intraoperatorio.
Previa asepsia y antisepsia de la zona donante, infiltramos solución anestésica de Klein modificada en zona periumbilical con cánula de múltiples orificios de salida para distribución uniforme. Realizamos la lipoaspiración mediante jeringas de 20 ml con cánulas de lipoaspiración de 3 mm de diámetro. Decantamos el tejido graso obtenido durante 10 minutos y centrifugamos a 3000 revoluciones por minuto (rpm) durante 3 minutos. Para el grupo de pacientes de estudio enriquecimos la grasa con ASC, obtenidas al emulsionar 20 ml del tejido adiposo centrifugado.
Para la inyección del injerto graso realizamos asepsia con Hibitane® acuoso (dihidrocloruro de clorhexidina) en la zona receptora respectiva de la región facial; hicimos bloqueo anestésico de los nervios supraorbitario, infraorbitario y mentoniano. Planificamos los puntos de entrada de forma simétrica a nivel del triquion, a 1 cm del canto externo de ambos ojos y a 1 cm de la comisura bucal. El punto del triquion permitió la infiltración de la zona frontal y glabelar. El punto temporal alcanzó la fosa temporal, cola de la ceja, pómulo y región preauricular, y el punto de la comisura en el área peribucal dio acceso al SNG, labio superior, labio inferior y mentón. Por último, aplicamos en la zona a rejuvenecer hasta lograr la simetría en la cara y el volumen en armonía con su contextura física, con cánulas de 3 mm o menos de diámetro en relación con el grosor de la piel, de un solo orificio distal y con punta roma. Inyectamos en retrotrazado en las regiones faciales señaladas. Colocamos el relleno en microdepósitos y diferentes planos hasta lograr corregir el defecto.
Postoperatorio.
Lavado diario de cara, no apoyar el área receptora, presionar la zona donante con faja de compresión media, no realizar esfuerzos físicos, no dormir de lado ni boca abajo, no exponerse al sol ni al vapor, antibiótico profiláctico y analgésicos según necesidad. Citamos a consulta de control a los 4 días de postoperatorio, al mes, a los 3, a los 6 y 12 meses posteriores. Retiramos puntos de la zona donante a los 7 días.
Determinamos el porcentaje de conservación del volumen del injerto mediante estudio ultrasonográfico con un equipo torre de ultrasonido Aplio 300 marca Toshiba® de 3 a 10 megahertzios (MHz) con transductor lineal de alta frecuencia para partes blandas. El profesional en imagenología colocó la pantalla en modo bimodal, corte longitudinal transversal y tomó 3 medidas: ántero-posterior, transversal y cráneo-caudal. El equipo, por medio de su software incorporado, realizó la operación matemática de manera automática para determinar el volumen del injerto en cc o ml. La medición fue realizada durante un mismo momento, en la misma región, por un mismo examinador (especialista en imagenología) que desconocía el grupo de tratamiento al que correspondía el paciente.
Resultados
En nuestro grupo de estudio predominó el sexo femenino con un 88.6% (n=31 pacientes) y una media de edad de 47 años, sin diferencias significativas en cuanto al sexo ni a la edad entre ambos grupos de tratamiento.
Prevaleció el fototipo cutáneo tipo II en el 60% (n=21) de los pacientes del grupo de estudio y en el 62.9% (n=22) de los del grupo control. No existió diferencia significativa en cuanto al fototipo cutáneo (p=0.855). Respecto al grado de envejecimiento hubo prevalencia del tipo III en el grupo de estudio con 57.1% (n=20) y en el grupo control con 42.9% (n=15). No encontramos diferencias significativas (p=0.487) (Tabla I).
Tabla I. Distribución de los pacientes según variables demográficas.
| Variables demográfcas | Grupo de estudio (n= 35) | Grupo control (n= 35) | ||||
|---|---|---|---|---|---|---|
| No | % | No | % | pa | ||
| Sexo | Femenino | 31 | 88,6 | 31 | 88,6 |
1.000a 1,000a |
| Masculino | 4 | 11.4 | 4 | 11.4 | ||
| Edad | Media±DE | 46.5±11.5 | 46.6±8.9 | 0.945b | ||
| Fototipo cutáneo | II | 21 | 60.0 | 22 | 62.9 | 0.855 |
| III | 11 | 31.4 | 10 | 28.6 | ||
| IV | 3 | 8.6 | 3 | 8.6 | ||
| Grado de envejecimiento | II | 10 | 28.6 | 13 | 37.1 | 0.487 |
| III | 20 | 57.1 | 15 | 42.9 | ||
| IV | 5 | 14.3 | 7 | 20.0 | ||
DE: Desviación estándar;
a:Prueba chi cuadrado (χ2) con corrección;
b:prueba t de Student
En la medición del porcentaje de conservación del volumen del injerto a los 3 meses de la intervención constatamos que era del 75% o más en todos los pacientes. Pasados 6 meses el porcentaje de conservación del volumen del injerto fue menor en el grupo control que en el que recibió lipotransferencia asistida con ASC. Este se redujo en menos del 75% en el 60% (n=21) del grupo control y en el 2.9% (n=1) del grupo de estudio. Al año de tratamiento permanecieron con el volumen del injerto de 75% o más el 94.3% (n=33) del grupo estudio y el 8.6% (n=3) del grupo control. Al comparar los 2 grupos de tratamiento, observamos que el volumen del injerto disminuyó en el tiempo de manera significativa en el grupo control (p < 0.001); la disminución en el grupo de estudio no fue significativa (p = 0.223) (Gráfico 1).
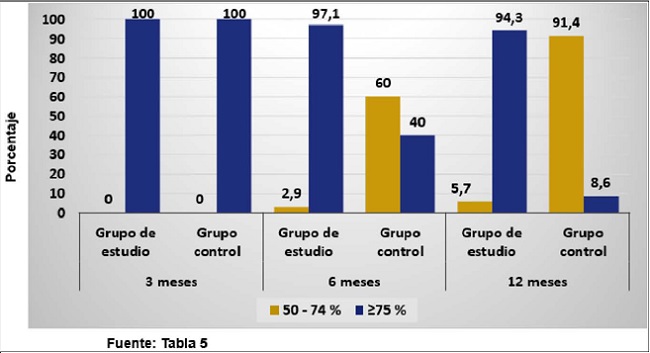
Gráfico 1. Distribución de pacientes según porcentaje de conservación del volumen del injerto en el tiempo por grupo de tratamiento.
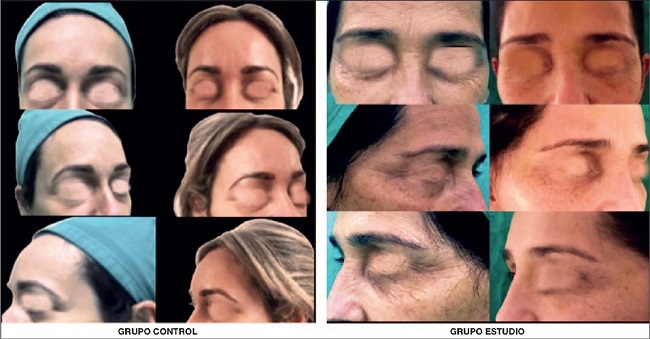
En cuanto a la respuesta clínica al tratamiento, en la región frontal antes de la intervención el mayor porcentaje de los sujetos presentaba arrugas finas en reposo y líneas más profundas con expresión facial, 40.0% (n=14) de los que recibirían lipotransferencia asistida con ASC y 45.7% (n=16) del grupo control. Posterior al tratamiento constatamos mejoría en todos los pacientes, con mejores resultados en el grupo experimental donde quedó sin arrugas el 25.7%, (n=9) y el 37.1% (n=13) finalizaron sin arrugas en reposo (solo líneas finas con expresión facial), que constituyen la mayoría de la muestra. En el grupo control observamos con mayor frecuencia arrugas finas en reposo y líneas profundas con expresión facial en el 51.4% (n=18). El porcentaje de pacientes que al inicio clasificó en la categoría más desfavorable de envejecimiento no fue despreciable (14.3% y 20%, n=5 y n=7 respectivamente). Al término del estudio ningún paciente permaneció en esta categoría. Los cambios ocurridos en los 2 grupos fueron significativos (p < 0.001) (Tabla II) (Fig. 2).
Tabla II. Distribución de pacientes al inicio y al año posterior al tratamiento según arrugas en región frontal.
| Arrugas en región frontal | Grupo de estudio (n= 35) | pa | Grupo control (n= 35) | pa | ||
|---|---|---|---|---|---|---|
| Inicial Nº (%) | Final Nº (%) | Inicial Nº (%) | Final Nº (%) | |||
| Sin arrugas | 0 (0.0) | 9 (25.7) | <0.001 | 0(0,0) | 0(0,0) | <0.001 |
| Sin arrugas en reposo, pero líneas finas con expresión facial | 0 (0.0) | 13 (37.1) | 0 (0.0) | 4 (11.4) | ||
| Arrugas finas en reposo y líneas profundas con expresión facial | 8 (22.9) | 12 (34.3) | 4 (11.4) | 18 (51.4) | ||
| Arrugas finas en reposo y líneas más profundas con expresión facial | 14 (40.0) | 1 (2.9) | 16 (45.7) | 13 (37.1) | ||
| Arrugas más profundas en reposo y surcos más profundos con expresión facial | 13 (37.1) | 0 (0.0) | 15 (42.9) | 0 (0.0) | ||
aPrueba de los rangos con signo de Wilcoxon
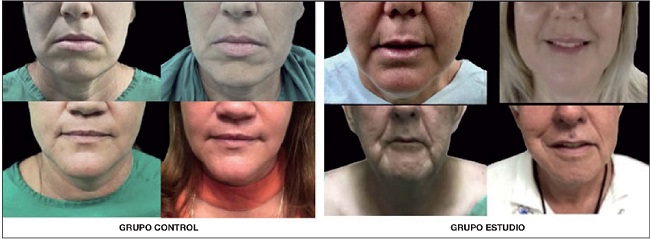
Antes de la intervención, el 37.1% (n=13) de los pacientes a los que se les asignó el grupo experimental tenía pliegues moderadamente profundos con rasgos claros en apariencia normal, pero no cuando se estiraban, así como el 48.6% (n=17) de los del grupo control. En orden de frecuencia, constatamos pliegues extremadamente largos y profundos perjudiciales para la apariencia facial en el 34.3% (n=12) del grupo de estudio y pliegues muy largos y profundos, rasgo facial prominente en el 31.4% (n=11) del grupo control. Al año de la intervención observamos resultados superiores en el grupo experimental. En este grupo, con mayor frecuencia, se presentaron los pacientes sin pliegues visibles, con línea continua de la piel en el 42.9% (n=15); el 25.7% (n=9) presentó pliegues moderadamente profundos y el 22.9% (n=8) poco profundos. En el grupo control, el 48.6% (n=17) presentó pliegues poco profundos pero visibles con una ligera hendidura y el 31.4% (n=11) pliegues moderadamente profundos claros en apariencia normal. Ninguno permaneció en la categoría de mayor envejecimiento de esta región facial. Encontramos diferencias significativas antes/después de la intervención en los 2 grupos de tratamiento (p < 0.001). En el grupo experimental la mejoría fue superior al grupo control, porque en el 42.9% (n=15) desaparecieron los pliegues en las comisuras de los labios, mientras que en el grupo control en 1 solo se logró esta mejoría. (Tabla III) (Fig. 3).
Tabla III. Distribución de pacientes al inicio y al año posterior al tratamiento según pliegues en comisuras de los labios.
| Pliegues en comisuras de los labios | Grupo de estudio (n= 35) | pa | Grupo control (n= 35) | pa | ||
|---|---|---|---|---|---|---|
| Inicial Nº (%) | Final Nº (%) | Inicial Nº (%) | Final Nº (%) | |||
| Sin pliegue visible, línea continua de la piel | 2 (5.7) | 15 (42.9) | 1 (2.9) | 1 (2.9) | ||
| Pliegue poco Profundo pero visible con una ligera hendidura | 1 (2.9) | 8 (22.9) | 0 (0.0) | 17 (48.6) | ||
| Pliegues moderadamente profundos con rasgos claros en apariencia normal pero no cuando se estiran | 13 (37.1) | 9 (25.7) | <0.001 | 17 (48.6) | 11 (31.4) | <0.001 |
| Pliegues muy largos y profundos, rasgo facial prominente | 7 (20.0) | 3 (8.6) | 11 (31.4) | 6 (17.1) | ||
| Pliegues extremadamente largos y profundos perjudiciales para la apariencia facial | 12 (34.3) | 0 (0.0) | 6 (17.1) | 0 (0.0) | ||
aPrueba de los rangos con signo de Wilcoxon
El 100% de la muestra no presentó complicaciones y quedó satisfecho con los resultados al final del tratamiento. Referente a la evaluación del resultado final, en el 94.3% (n=33) resultó buena en el grupo de estudio; en igual proporción de los pacientes del grupo control fue regular. Al comparar los 2 grupos, constatamos diferencias significativas (p < 0.001).
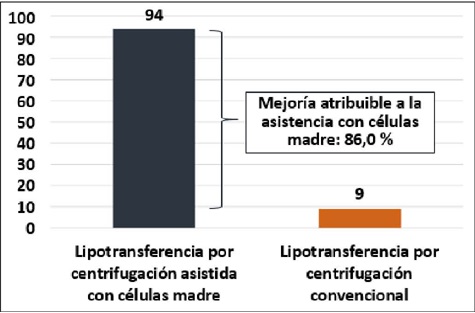
El efecto del tratamiento probado en el envejecimiento facial, medido como la proporción de la mejoría de la conservación del lipoinjerto que se debe al enriquecimiento con células madre (mejoría atribuible), resultó en 0.86 (IC 95 %=0.74-0.98), o sea, el tratamiento asistido con ASC redujo el riesgo de pérdida de conservación del lipoinjerto en un 86% (Gráfico 2).
Discusión
Los resultados de la caracterización de la muestra evidenciaron uniformidad de condiciones de los pacientes en los 2 grupos a comparar, lo que garantiza en cierta medida que las diferencias encontradas en el estudio obedezcan a la introducción de las células madre más que a la presencia de variables de confusión. La valoración de las fotos preoperatorias y postoperatorias, combinadas con los resultados del ultrasonido, indicaron que todos los sujetos recibieron suficiente relleno de tejido blando para mejorar la apariencia del área facial en el postoperatorio inmediato; sin embargo, la grasa trasplantada se absorbió de forma gradual durante los siguientes 3 meses, después de lo cual la absorción del tejido adiposo trasplantado disminuyó hasta los 6 meses para mantenerse estable después del año. Similares resultados a los obtenidos por Coleman y col.,(11) quienes defienden que el volumen final se estabiliza entre 3 y 4 meses, aunque pueden existir disminuciones sutiles durante el primer año con permanencia constante hasta un rango de 8 a 10 años. Durante este período de seguimiento la pérdida del volumen injertado fue mayor en el grupo control, en concordancia con Huang y col.,(12) que informan de una tasa de retención de injerto de tejido graso obtenido por centrifugación del 65.7%. Esto pudiera relacionarse con la acción angiogénica e inmunomoduladora de las ASC que enriquecieron el tejido adiposo transferido en el grupo de estudio.
Varias investigaciones evalúan los efectos del injerto de tejido graso enriquecido con ASC en el aumento de la supervivencia de los adipocitos. Sasaki(1) informa de un estudio prospectivo de 236 pacientes en 4 grupos en el que se utiliza injerto de tejido graso convencional, plasma rico en plaquetas (PRP), fracción vascular estromal (SVF) y la combinación de ambos. Este estudio demuestra que los métodos de enriquecimiento con PRP, SVF y PRP/SVF resultan en una diferencia en la tasa de retención media del injerto significativa a los 12 meses postoperatorios (68.5%, 72.9% y 69.7%, respectivamente), en comparación con los métodos convencionales de lipoinjerto graso (38.3%). Valores superiores de retención del injerto se obtuvieron en esta muestra cuando se enriqueció con ASC obtenidas por nanofat.
En la presente investigación observamos que a los 3 meses la totalidad de la muestra conservó una persistencia del volumen injertado superior al 75%; sin embargo, a los 6 meses destacó una diferencia en la retención del volumen entre el grupo de estudio y el grupo control. En el primero, solo 1 paciente cambió a la categoría de 50 a 75% del volumen inicial, mientras que en el segundo grupo más de la mitad de la muestra descendió a dicho escalón. A los 12 meses casi la totalidad de los pacientes asistidos con ASC mantuvo su volumen, mientras que en el grupo control solo 3 pacientes mantuvieron buena duración del injerto. La pérdida de volumen fue mayor en los primeros 3 meses en ambos grupos de tratamiento, lo que puede estar relacionado con lo planteado por Pu(13) respecto a que la pérdida de volumen del injerto en este período puede estar asociada con la absorción de adipocitos muertos por fagocitosis de los macrófagos, fenómeno que se atenúa con la intervención de las ASC, lo que justifica que la absorción sea mayor en el grupo control que en el grupo de estudio; sin embargo, después de los 6 meses se estabilizó el volumen injertado, más evidente en el grupo de estudio en el que se conservaron 3/4 partes del total, en concordancia con la teoría del reemplazo celular planteada por Pu(13) donde los adipocitos neoformados reemplazaron a los adipocitos muertos que ocupaban su espacio.
Estos resultados concuerdan con la investigación de Matsumoto y col.(5) quienes proponen un método de transferencia de tejido autólogo llamado lipotransferencia asistida por células (CAL por su siglas en inglés – cell assisted lipotranferency) que es el trasplante de tejido graso aspirado al que se adiciona ASC con el objetivo de aumentar la eficacia de la lipoinyección autóloga, lo que resulta en una mayor tasa de conservación y persistencia del tejido graso trasplantado y disminuye los efectos adversos conocidos de la lipoinyección.
Con la estandarización y homogeneidad después de la experiencia de varios autores se consolida el concepto de utilización de la terapia con ASC por su capacidad proangiogénica útil en la duración del injerto, que desecha la opinión de la mayoría de los cirujanos plásticos durante los años 1983 a 1998 que afirmaban que la grasa infiltrada en el cuerpo humano solo sobrevivía 2 meses.(6) Debemos resaltar la similitud en el comportamiento de la permanencia del injerto de tejido adiposo en ambos grupos de tratamiento. Este fenómeno fue corroborado por Girard y col.(6) quienes declaran que la evolución del injerto con el transcurso del tiempo es parecida en los 2 grupos de estudio, con la diferencia de que en el grupo de centrifugación simple la pérdida de volumen a los 3 y 6 meses es mayor que en el grupo de pacientes con lipotransferencia asistida con ASC. Estos autores defienden su resultado con la teoría de que las ASC, gracias a sus propiedades, mediante la sustitución de los adipocitos muertos, mejoran la supervivencia del tejido trasplantado que según Yoshimura y col.(14) implica un 35% más de permanencia del injerto graso. Desde el punto de vista ultrasonográfico se pudo comprobar la integración del tejido adiposo trasplantado al lecho receptor. El injerto se observó como una estructura ecogénica con centro hipoecogénico y bordes definidos que delimitan la zona del depósito graso. Con el paso del tiempo se comprobó pérdida o no de la interfase en correspondencia con la conservación del volumen y la integración al nuevo nicho. También se observaron pequeñas calcificaciones en el plano subdérmico que desaparecieron después de los 6 meses, en que el tejido adiposo adquirió las características del nuevo lecho.
Aunque se ha publicado que las zonas del rostro que mayor mejoría experimentan con el lipoinjerto facial son las arrugas peribucales, los SNG, las depresiones preparotídeas, la frente, la zona glabelar, los malares y el mentón, existen limitadas escalas objetivas que validen los resultados por regiones.(9, 10) De ahí que en el presente estudio evaluamos la región frontal y peribucal. La región frontal, aunque subvalorada en el proceso de envejecimiento facial, es una de las zonas que más se afecta por la exposición solar y que más se modifica con la mímica facial y la expresión de emociones, por lo que presentan mayor ritidosis con atrofia del tejido celular subcutáneo. (9) Su evaluación se realizó de forma estática y dinámica en el pre y postoperatorio. Muy pocos estudios evalúan los cambios en el tercio superior y los que lo hacen están encaminados a los resultados del uso de toxina botulínica y PRP, porque se asocian más las arrugas frontales a la contracción muscular.(1) De las 5 categorías de clasificación evolutiva de las arrugas frontales, la 5 y la 4 fueron las que predominaron en el diagnóstico preoperatorio, seguidas de la 3. No hubo pacientes incluidos en las 2 categorías inferiores en el momento inicial. Un año después de la lipotransferencia todos los pacientes mejoraron de forma significativa, con una diferencia entre grupos de tratamiento que mostró una mejoría en 2 escalones en el grupo de estudio, mientras que en el control predominó la regresión en 1 solo nivel. Además, en el grupo asistido con ASC se logró la desaparición de las arrugas en algunos pacientes, lo que no se constató en el grupo de centrifugación simple.
La aparición de líneas de marioneta es más evidente después de los 50 años de edad, lo que justifica que en este estudio, cuya media de edad fue inferior a los 50 años, sea menor el número de pacientes diagnosticados antes del procedimiento quirúrgico con pliegues extremadamente largos y profundos, perjudiciales para la apariencia facial. El mayor número de pacientes quedó en la clasificación de pliegues moderadamente profundos, con rasgos claros en apariencia normal; pero no cuando se estiran. Evidenciamos una evolución satisfactoria a los 12 meses del lipoinjerto con la inclusión de la mitad de la muestra asistida con ASC en la categoría sin pliegue visible, mientras que en el grupo control la mayoría pasó a tener pliegue poco profundo pero visible. Aunque en ambos grupos la mejoría fue significativa, existió superioridad en el grupo experimental de tratamiento. La lipotransferencia, por la reposición volumétrica que aporta, constituye un tratamiento ideal para la corrección de dicho signo de envejecimiento, y de acuerdo con este planteamiento fueron los resultados obtenidos en el presente ensayo clínico. La mayoría de las publicaciones sobre relleno del área peribucal se refieren al uso de otras sustancias con buenos resultados también.(5, 8, 10) En base a estos efectos insistimos en el uso del tejido adiposo con la ventaja de ser un material autólogo.
No constatamos eventos adversos ni infección en la consulta de seguimiento en ninguno de los 2 grupos, a pesar de incluir en la técnica 2 áreas quirúrgicas, la donante y la receptora, lo cual aumenta el riesgo a pesar de cumplir las normas de asepsia y antisepsia. Múltiples autores(1, 3, 8) señalan con frecuencia enrojecimiento y edema local crónico considerados como parte del proceso inflamatorio inicial. Otros estudios plantean nódulos, fibrosis y asimetría a los 18 meses.(14) Gerth y col.(15) por su parte, presentan 1 caso de hematoma en el sitio donante y Wu y col.(16) recogen 2 casos de eritema postoperatorio. Gornitsky y col.(17) en 2018, informan de un total de 104 complicaciones que incluyeron asimetría, irregularidades de la piel, edema prolongado, hipertrofia del injerto, necrosis grasa, infección, eritema, telangiectasias y activación del acné. Wang y col.(18) en 2021, reportan la presencia de complicaciones vasculares en el 35.3% del total de su muestra, tratando con éxito 1 caso de embolia de la arteria oftálmica y 1 caso de embolia de la arteria cerebral. Mortada y col.(19) en el año 2022, realizan un metanálisis donde incluyen un total de 1052 publicaciones recogiendo complicaciones como tumefacción periorbitaria en el 92.7% y oclusión de la arteria oftálmica en el 50.4%. En la presente investigación no se presentaron complicaciones.
La transferencia de grasa, de modo general, reduce la profundidad y número de arrugas en la cara además de modificar el color, textura y calidad de la piel. En Cirugía Plástica, la satisfacción del paciente es uno de los objetivos finales de las intervenciones. La valoración y medición de las percepciones de estos es de vital importancia. Tuin y col.(20) en 2022 reportan una evaluación de la satisfacción en 33 pacientes mediante la escala de FACE-Q en la que se evidenció una mejoría en esta medición de acuerdo con el objetivo que plantearon en el volumen injertado, con total satisfacción de las pacientes. En la presente investigación la totalidad de la muestra quedó satisfecha con los resultados obtenidos al año de tratamiento.
Otro estudio plantea que las tasas medias de satisfacción fueron superiores en los pacientes del grupo asistido con ASC en relación a los pacientes del grupo control después de los 12 y 24 meses del lipoinjerto.(9) Un total de 9 estudios acerca de lipotransferencia informan sobre una tasa de satisfacción en pacientes del 81% y en cirujanos del 89% en una escala análoga visual en el postoperatorio.(15) En el presente estudio no existieron diferencias en la satisfacción con relación al método utilizado. Esto se podría explicar porque, a pesar de la disminución del volumen del injerto en el grupo control, todos los pacientes tuvieron mejoría después de la intervención en comparación con la apariencia que presentaban antes de la misma.
Respecto a los resultados, Mortada y col.(19) reportan la mejoría completa en la totalidad de la muestra estudiada en su metanálisis de inyección de injerto graso autólogo facial. En el presente estudio el predominio de buenos resultados se produjo en el grupo estudio en relación directa a una mayor conservación del volumen del injerto, en comparación con el grupo control en el que en su mayoría fueron regulares, lo que se vinculó a la acción de las ASC; además, los pacientes que no se incluyeron en el resultado mayoritario de cada grupo pudieron presentar diferencias en otras variables que también pueden influir en la conservación del injerto graso.