Introducción
Las lesiones nerviosas son una entidad frecuente en nuestra sociedad y afectan a más de 1 millón de personas a nivel mundial. Dependiendo de la complejidad de la lesión, tienen como consecuencia neuropatías, disminución de la función motora, así como de la sensitiva.(1) Las lesiones de menor grado pueden presentar una regeneración espontanea, mientras que las más graves, requerirán una reparación microquirúrgica.(2)La reparación ideal se obtiene cuando se tratan de manera inmediata, se desarrolla poca fibrosis y existe la menor tensión posible entre los cabos seccionados. En cambio, si la lesión es muy extensa, es necesaria la colocación de algún injerto para ocupar la brecha generada, siendo el más utilizado el autólogo. De forma alternativa se puede recurrir a técnicas de tubulización con tejidos biológicos o materiales artificiales, como el politetrafluoroetileno (PTFE).(3)
La degeneración nerviosa consiste primeramente en la degeneración distal respecto al sitio de la lesión, la cual es conocida como degeneración walleriana. La reacción proximal respecto al punto de la sección se conoce como degeneración primaria o retrógrada. El tiempo en el que comienza la degeneración es un poco diferente para los segmentos sensitivos y motores.(4-6) En las primeras 72 horas se produce una respuesta a la estimulación, a continuación el segmento distal se fragmenta y la vaina de mielina se encoge. En aproximadamente 30 días los macrófagos culminan con la limpieza de los axones, multiplicándose las células de Schwann para llenar los huecos anteriormente ocupados por los axones. Entre la tercera a cuarta semanas se produce la muerte neuronal o la regeneración de la misma apoyada con los tubos endoneurales ocupados por las células de Schwann.(7) Los brotes axónicos que al migrar no pueden entrar en su tubo porque se interpone tejido cicatricial, pueden introducirse en tubos endoneurales vacíos de otros fascículos lesionados y regenerarse allí, para distribuirse en áreas miotómicas o dermatómicas erroneas.(7)
En cuanto a las técnicas de reparación, la neurorrafia es la de elección para lesiones que no sean amplias.(8) Desafortunadamente, en la mayoría de los casos hay pérdida considerable de segmentos nerviosos, y es necesario recurrir a injertos que cumplan la función de andamio sobre la brecha para la regeneración.(9)
La utilización de conductos de guía nerviosa como el PTFE tiene su antecedente en 1998 por Stanec, quien presentó 2 trabajos utilizando este material como conducto nervioso, llegando a la conclusión de que puede ser utilizado como guía nerviosa para reconstrucción en defectos mayores a 4 cm.(10,11)
El polietilenglicol (PEG) es un polímero hidrofílico que puede reincorporar el axolema de las terminaciones seccionadas de los axones, induciendo la continuidad axonal parcial en un proceso conocido como fusión del PEG.(12-14)
Como antecedentes, diversos estudios basados en ratas han usado un modelo de reparación de nervio ciático (Bittner y col., 2012; Sexton y col., 2012; Rodríguez-Feo y col., 2013; Riley y col., 2014). Estos trabajos indican que esta estrategia reestableció inmediatamente la continuidad eléctrica nerviosa después de la reparación y sugieren que la degeneración walleriana fue retrasada o parcialmente prevenida(12-15)
El objetivo del presente estudio es determinar la superioridad de la combinación de PEG en tubos de PTFE como injerto, sobre el uso aislado del mismo y de un autoinjerto en la regeneración de un modelo experimental animal de nervio ciático.
Material y método
Estudio experimental de casos y controles utilizando como población un total de 30 ratas con los siguientes criterios de inclusión: hembras, cepa Wistar, de 4 meses de edad, con un peso de entre 300 y 350 gr. y buen estado de salud. Los criterios de eliminación fueron: ratas que murieron en el postoperatorio, infección, dehiscencia de herida o complicaciones de salud durante el periodo de regeneración.
Las ratas fueron obtenidas del bioterio de la Facultad de Medicina y Ciencias Biomédicas de la Universidad Autónoma de Chihuahua (Chihuahua, México) con el consentimiento de la Comisión de Ética de la Facultad de Medicina y teniendo como base la Norma Oficial Mexicana NOM-062-ZOO-1999 de título “Especificaciones técnicas para la producción, cuidado y uso de animales de laboratorio”.
En cuanto al tamaño de muestra, se calculó con el programa Statistics Data Analysis para Windows, tomando como variable de referencia el conteo total de axones de nervio ciático obtenido en el estudio de Riley (2012). Con un nivel de confianza del 95% y de error del 5% y un poder de prueba del 90%, el tamaño de la muestra mínimo estimado fue de 32 ratas. Sin embargo, debido a la poca disponibilidad de unidades en el bioterio de la facultad, el presente estudio representa una prueba piloto en el cual fueron valoradas 10 unidades por grupo.
Dividimos las ratas de forma aleatoria en 3 grupos específicos:
Grupo A. Grupo de 10 ratas a las que se sometió a lesión nerviosa y reparación por medio de injerto nervioso autólogo.
Grupo B. Grupo de 10 ratas a las que se sometió a lesión nerviosa y reparación por medio de un conducto de PTFE simple.
Grupo C. Grupo de 10 ratas a las que se sometió a lesión nerviosa y reparación por medio de un conducto de PTFE con aplicación de PEG.
La intervención quirúrgica se llevó a cabo en el Laboratorio de Microcirugía de la Universidad Autónoma de Chihuahua, bajo anestesia intraperitoneal a base de ketamina a una dosis veterinaria de 80 mg/kg. Previo rasurado, asepsia y antisepsia, se incidió sobre la parte dorsal del muslo derecho, disecando los tejidos hasta exponer el nervio ciático; se realizó sección de 10 mm del mismo y se procedió a la reparación por medio de las técnicas antes enlistadas, que describimos a continuación.
Para la reparación del grupo A utilizamos el mismo tejido nervioso seccionado previamente colocado en solución salina durante 5 minutos, para posteriormente injertarlo en el sitio de lesión con sutura de nylon 10-0.
Para la reparación del grupo B utilizamos un injerto (conducto) de PTFE de 1.5 cm que se colocó entre los cabos seccionados del nervio ciático, fijando el injerto con puntos epineuro-tubulares con sutura de nylon de 10-0.
Para la reparación del grupo C realizamos el mismo procedimiento que en el grupo anterior más la aplicación de 10 μL de PEG inyectado en el interior de la luz tubular y en el área perilesional.
Analizamos los datos recabados mediante el cálculo de Chi cuadrada para las variables categóricas y el empleo de tabulación, graficación y cálculo de frecuencias relativas para las variables continuas (Tabla I).
Tabla I. Operacionalización de variables.
| Variable | Definición | Indicador | Escala de medición |
|---|---|---|---|
| Conteo total de axones | Cantidad de axones presentes tras la sección y reparación | Cantidad | Discreta |
| Diámetro de nervio | Línea recta entre dos puntos de una circunferencia, pasando por el centro de la misma | Milímetros | Continua |
| Reacción a cuerpo extraño | Reacción tisular desencadenada por depósito de material ajeno al organismo | Presente Ausente | Binaria |
| Fibrosis | Formación patológica de tejido fibroso en algún tejido u órgano del cuerpo. | Mínima Moderada Severa | Ordinal |
| Adherencia muscular | Disposición de fibras nerviosas dentro de músculo circundante | Leve Moderada Severa | Ordinal |
| Desorganización de las fibras | Disposición desordenada de las fibras nerviosas, sin patrón de regeneración | Mínima Moderada Máxima | Ordinal |
| Reacción inflamatoria | Reacción tisular compleja que consiste en respuestas de los vasos y leucocitos, así como fagocitos tisulares derivados de las células circundantes | Leve Moderada Severa | Ordinal |
| Tejido de granulación | Fase del proceso de cicatrización con proliferación celular y actividad mediada por colonias de granulocitos mediada por el G-CSF | Mínimo Moderado Abundante | Ordinal |
| Alteración en la marcha | Alteración en el proceso de cambio continuo de la postura para el movimiento | Mínima Moderada Severa | Ordinal |
| Atrofia muscular macroscópica | Disminución de la masa del músculo | Mínima Moderada Severa | Ordinal |
| Deformidad de extremidad | Alteraciones en la integridad cutánea, muscular y ósea del miembro pélvico | Mínima Moderada Severa | Ordinal |
Resultados
A continuación, describimos los resultados del manejo estadístico de los datos obtenidos gracias a su observación clínica e histopatológica por la Dra. Francisca Sierra Santiesteban en cada una de las 3 muestras estudiadas.
Resultados histopatológicos
En cuanto al conteo total de axones, se llevó a cabo por microscopía óptica (Tabla II), obteniendo una media de 803 axones para el primer grupo (A), 561.25 para el segundo grupo (B) y 447.77 para el tercer grupo (C).
Tabla II. Conteo total de axones.
| No. Rata/Axones | A | B | C |
|---|---|---|---|
| 1 | 1200 | 550 | 490 |
| 2 | 1100 | 650 | 480 |
| 3 | 850 | 550 | 395 |
| 4 | 800 | 480 | 425 |
| 5 | 630 | 650 | 425 |
| 6 | 650 | 530 | 390 |
| 7 | 700 | 560 | 420 |
| 8 | 750 | 520 | 490 |
| 9 | 700 | 515 | |
| 10 | 650 |
Otra variable medida fue la determinación del grosor en milímetros del nervio, observando una media de 2.15 mm (DE 0.26) para el grupo A; de 1.31 mm (DE 0.26) para el B; y de 1.36 mm (DE 0.15) para el grupo C.
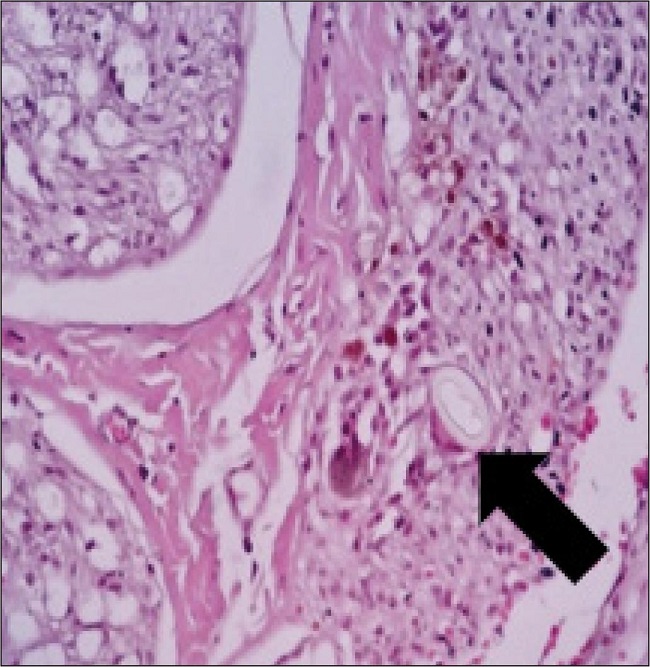
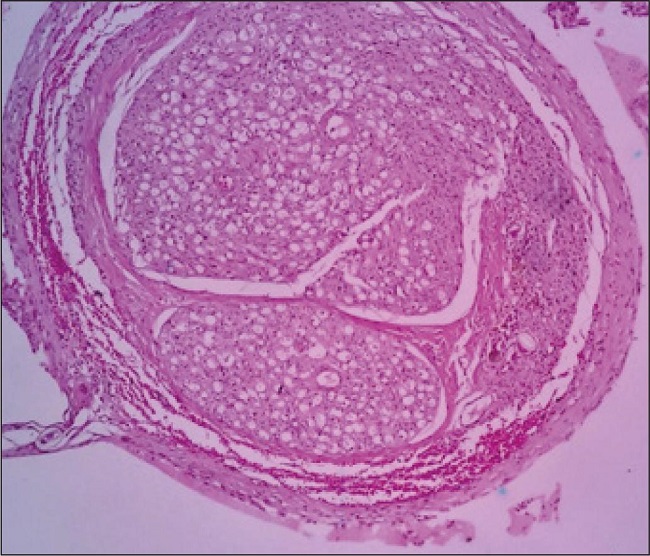
Describimos la reacción a cuerpo extraño a modo de una variable binaria definida como si existía o no. Como se observa en la Fig. 1, esta reacción podría estar relacionada meramente con el material de sutura, ya que no había diferencias significativas entre los 3 grupos (Tabla III).

Figura 1. Presencia de granuloma secundario a reacción a cuerpo extraño en la observación 6 del grupo C.
Tabla III. Reacción a cuerpo extraño.
| No rata/ Presencia | A | B | C |
|---|---|---|---|
| 1 | NO | NO | SI |
| 2 | SI | SI | NO |
| 3 | SI | NO | NO |
| 4 | SI | SI | NO |
| 5 | NO | NO | NO |
| 6 | NO | NO | SI |
| 7 | NO | SI | SI |
| 8 | NO | NO | NO |
| 9 | NO | NO | |
| 10 | NO |
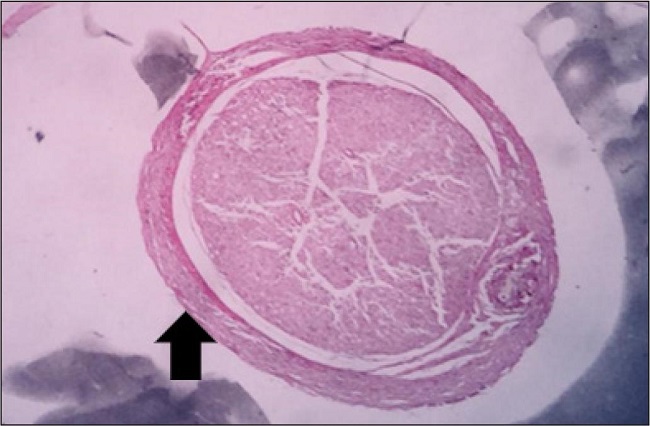
Otra variable binaria observada fue el desarrollo de fibrosis, que estuvo totalmente ausente en el grupo A, un 75% presente en el grupo B y un 100% en el grupo C. Esta fibrosis se describió a modo de un halo circular en la periferia del área de regeneración, constituido principalmente por fibroblastos y bandas de colágena (Fig. 2).
La siguiente variable observada fue el desarrollo de adherencia muscular, definida como la presencia de fibras nerviosas desorganizadas dentro de un área de células musculares estriadas, siendo notable una enorme diferencia entre los grupos estudiados, estando presente en un 40% en el grupo A y totalmente ausente (en un 100%) en los grupos B y C (Fig. 3).
La siguiente variable observada fue el nivel de desorganización de las fibras nerviosas, categorizándola en leve, moderada o severa (Fig. 4). Se realizó comparación por pares utilizando la prueba de Chi cuadrada. Comparando el grupo A con el grupo B, al calcular las frecuencias teóricas y posteriormente el valor de Chi cuadrada, arrojó un valor de p de 0.0025. La segunda comparación fue el grupo A contra el C, obteniendo un valor de p inferior a 0.001. En tercer lugar, comparando el grupo B contra el C se obtuvo un valor de p mayor a 0.10.
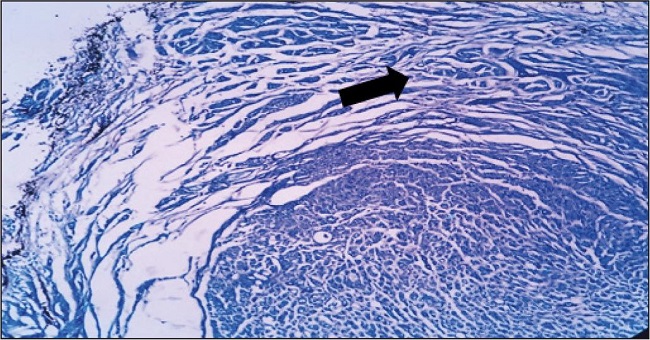
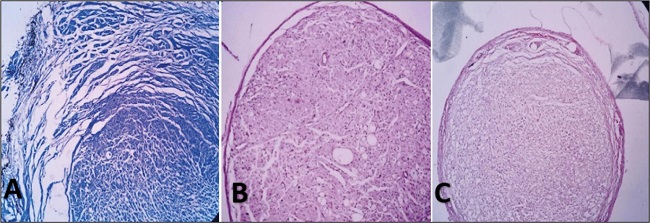
Figura 4. Disposición de fibras nerviosas. A. Desorganización evidente de observación A4. B. Patrón organizado de observación B5. C. Patrón claramente organizado de observación C24.
La reacción inflamatoria se comparó de la misma manera que la variable anterior, obteniendo como resultados un valor de p de 0.025 para la comparación del grupo A contra el grupo B; de 0.0025 en la comparación del grupo A contra el C; y de 0.05 en la comparación del grupo B contra el C.
Como comentamos anteriormente, se hicieron igualmente observaciones clínicas categorizando los resultados como leve, moderado o severo.
El primero de ellos, la alteración de la marcha, se tuvo como criterios el tambaleo, amplitud y arrastre de la extremidad. Se comparó igualmente por grupos, obteniendo como resultados un valor de 0.1 para la comparación del grupo A contra el grupo B; en cuanto al grupo A contra el C se obtuvo un valor de p inferior a 0.001; y para la tercera comparación entre los grupos B contra C se obtuvo un valor de p de 0.0025.
La segunda comparación de resultados clínicos fue la atrofia muscular macroscópica (Fig. 5), siendo superiormente notable entre los grupos A y C, obteniendo un valor de p de 0.0025.
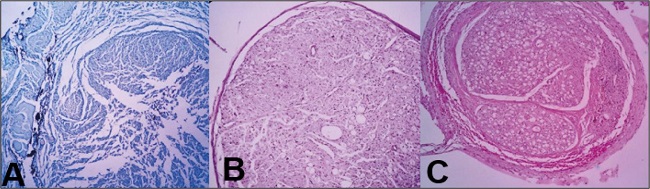
Figura 5. A. Atrofia muscular que permite ver la totalidad del nervio reparado a las 8 semanas en observación A6. B. Músculo preservado que cubre tubo en observación C8.
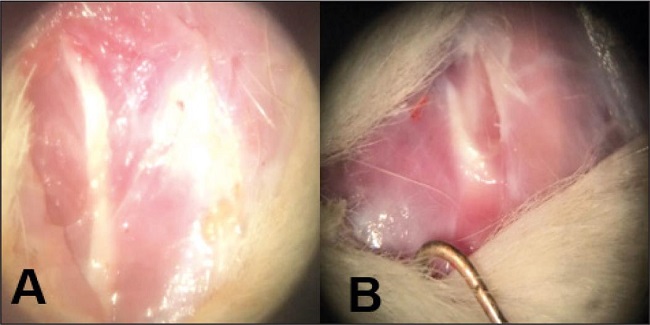
La última observación fue el nivel de la deformidad de la extremidad al final de la comparación, basado en la presencia de úlceras, la conservación de ortejos o la destrucción total. De forma general, se encontró una deformidad consistente en presencia de úlceras, amputación de ortejos y desviación de planta en las observaciones del grupo A; el grupo C se caracterizó por la presencia de una extremidad conservada sin deformidad (Fig. 6).
Discusión
Mediante el conocimiento y la aplicación de los distintos factores influyentes en la regeneración, se pueden conocer nuevos caminos que lleven a un mejor resultado en la regeneración nerviosa.
La primera variable estudiada, el conteo total de axones, es primordial para conocer la eficacia del uso de materiales para la regeneración.(15) Sin duda se obtuvo un conteo mayor en el primer grupo; sin embargo, podría existir el sesgo de que se contabilizó todo el diámetro, incluidas aquellas fibras que se encontraban adheridas a las células musculares circundantes sin un patrón de contención, por lo que al correlacionar clínicamente se pensaría en la posibilidad de la ausencia de viabilidad de las fibras.(16)
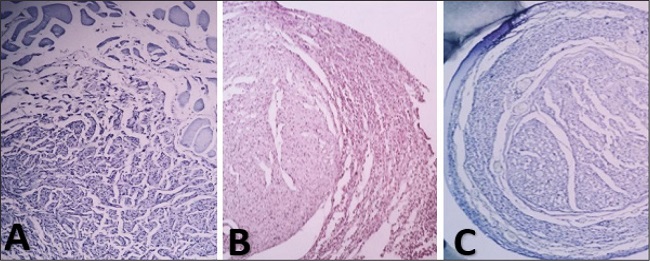
En la medición del diámetro del nervio regenerado en milímetros, se aprecia un notable predominio de frecuencias del grupo A en valores más altos, con una media de 2.15 mm (DE 0.26), en contraste con el grupo B que disminuye a un promedio de 1.31 mm (DE 0.26); en cuanto al grupo C la media mayor que el grupo B de 1.36 mm (DE 0.15). Como se observa en la Fig. 7, la desorganización en el primer grupo de fibras nerviosas y tejido circundante es general, que, al no contar con un sostén, en este caso el tubo, tuvo una proliferación desorganizada, lo que estaría directamente relacionada con el diámetro del nervio. Recordando el estudio de Bittner, difiere con estos resultados, pues describe un diámetro mayor en el grupo tratado con PEG que en sus grupos controles.(15)
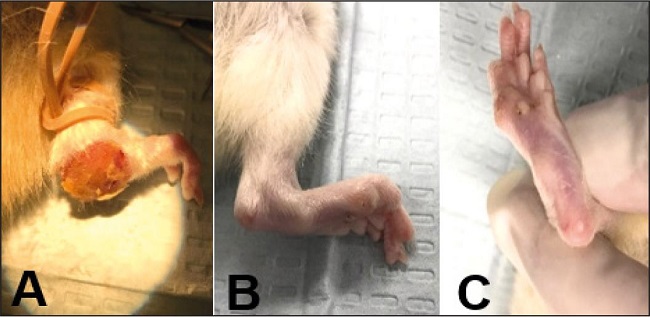
Figura 7. A. Axones dispersos en observación A5. B. Axones totales en observación B4. C. Axones totales en observación C3.
Definiendo la reacción a cuerpo extraño como la reacción celular principalmente por fagocitos y células gigantes multinucleadas con algún cuerpo de inclusión, se podría concluir que no es dependiente del uso de biomateriales para su aparición, sino que cabe la posibilidad de una relación con la sutura. Aquí se añade el cambio vesicular presente únicamente en el grupo C (Fig. 8), que de acuerdo con Fishman (2003), concluiría que estas vesículas parecen ser una estructura temporal que inicialmente ocluye los extremos cortados, lo que permite los procesos de recuperación.(17,18)
La fibrosis se encontró en un 100% de las observaciones del grupo C, sin embargo, pudo no estar interviniendo en la regeneración nerviosa, pues como se observa en la Fig. 9, esta fibrosis se concentra alrededor del sitio de regeneración como un halo periférico a modo de protección.
La adherencia muscular tiene relación con el método de recolección de la biopsia, pues al momento de tomar las muestras del grupo A era casi imposible disecar por la adherencia del nervio a las fibras musculares (Fig. 10). Recordando la literatura, la influencia de células NK y el factor anti-leu-19, influyen en la adhesión de células musculares satélite y en la regeneración de la fibras musculares denervadas; hasta donde conocemos, no existen estudios que expliquen la ausencia de esta adhesión muscular en los grupos protegidos por el tubo de politetrafluoroetileno, pero parece indicar que esta sería la causa directa.(19)
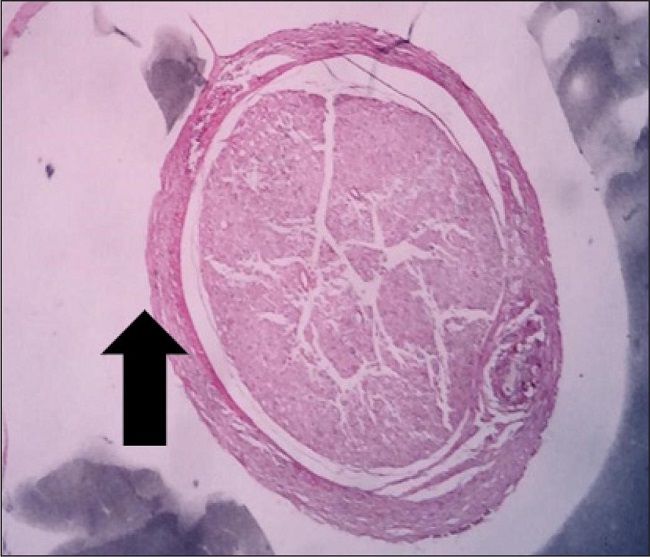
Figura 10. A. Infiltración muscular de fibras nerviosas en observación A2. B. Regeneración nerviosa en observación B2. C. Regeneración nerviosa en observación C4.
Un aspecto muy notable observado por microscopía óptica fue el nivel de desorganización de las fibras nerviosas regeneradas. Se encontró una influencia positiva del tubo en el grupo B (p= 0.0025) en comparación con el grupo A. La segunda evaluación igualmente mostró una superioridad de la combinación del PTFE con PEG frente a un simple autoinjerto para la organización de las fibras (p=<0.001). En contraste, comparando los grupos B y C, no se encontró una diferencia significativa (p=>0.10).
La reacción inflamatoria, definida como la reacción tisular compleja que consiste básicamente en respuestas de los vasos y leucocitos, se observó igualmente por microscopía óptica.(17) La primera comparación concluyó una influencia positiva del tubo de PTFE para el desarrollo de reacción inflamatoria (p=0.025). En cuanto al grupo de autoinjerto contra la combinación de PTFE con PEG, se concluyó una influencia de esta combinación para el desarrollo de la condición (p=0.0025). En tercer lugar, en los grupos B y C, se concluyó una influencia del PEG para desarrollar la inflamación (p=0.05). Bittner describió una menor reacción inflamatoria en sus grupos de estudio tratados con polietilenglicol; esta reacción inflamatoria significaría un esfuerzo mayor por aumentar la permeabilidad y aporte de factores de crecimiento y proliferación como citocinas.(20)
Respecto a las observaciones clínicas, la primera de ellas fue la alteración en la marcha en base a la evaluación veterinaria de la misma, tomando en cuenta la incapacidad del acomodo de la extremidad, amplitud de la base, arrastre, paresia, tambaleo, ataxia, dismetría y apoyo de nudillos.(21,22) Se obtuvo como conclusión una eficacia superior de la combinación del PTFE con PEG (grupo C) frente a únicamente el uso de PTFE (grupo B) (p=0.0025).
La atrofia muscular se evaluó de manera observacional, teniendo en cuenta la masa encontrada al abrir piel e intentar diseccionar el nervio de músculo semitendinoso, bíceps femoral del muslo y gastrocnemio en la pierna. No se observó diferencia significativa en la atrofia muscular entre los grupos A y B, generalmente de músculo bíceps femoral. Con la segunda comparación de los grupos A y C, se encontró una diferencia significativa (p=0.0025) (Fig. 5). En la tercera comparación, entre los grupos B y C, se determinó una influencia positiva del PEG en combinación con el PTFE a modo de injerto (p=0.05). Por lo que se puede concluir un papel determinante para la prevención de la atrofia del PEG.
En cuanto a la deformidad de la extremidad, la primera comparación entre el grupo A y B se concluyó que no tiene una influencia el PTFE como injerto en la prevención de la deformidad del pie de la observación (p=>0.05). En contraste, la combinación del PEG con el PTFE tuvo una relevancia significativa en esta prevención del desarrollo de la deformidad frente al uso únicamente de autoinjerto (grupo C) (p=0.001); al igual que una superioridad frente al uso de solo el tubo de PTFE (grupo B) como injerto (p=0.005).
Conclusiones
En nuestro estudio, encontramos diferencias significativas, sobre todo de carácter clínico e histopatológico, en la combinación del PEG con tubos de PTFE sobre el uso único del tubo a modo de injerto, así como en el uso de únicamente un autoinjerto como reparación de la lesión nerviosa, por lo que podemos afirmar que dicha hipótesis fue confirmada.
El grupo de observaciones reparado únicamente con autoinjerto mostró una evolución clínica desfavorable, con alteraciones importantes en la marcha y deformidad en la extremidad, afirmando un deterioro tanto motor como sensitivo en la regeneración nerviosa.
El grupo de observaciones reparado con injerto de PTFE mostró una regeneración microscópica favorable; sin embargo, la evaluación clínica fue similar al grupo reparado con autoinjerto, concluyendo así mismo una recuperación tanto funcional como de sensibilidad inadecuada.
El grupo de observaciones tratado con la combinación de PEG con PTFE obtuvo un conteo total de axones inferior a los 2 grupos anteriores; sin embargo, por la evaluación clínica adecuada se infiere la superioridad en la combinación de estos materiales para la regeneración nerviosa tanto sensitiva como motora, afirmando de esta forma la eficacia del polietilenglicol en la prevención y detención de la degeneración walleriana.
Por último, cabe destacar la necesidad de implementación de un protocolo de reparación nerviosa en nuestro país, para lo cual es necesario la continuación en la investigación del injerto ideal. Dentro de este estudio destacamos los resultados clínicos, sin embargo, es recomendable continuar investigando para así resolver las dudas acerca de la utilidad del polietilenglicol, lo que podría lograrse con la instauración de técnicas de evaluación clínicas como el índice de función ciática, la evaluación de potenciales de acción (CAPs), y el estudio de microscopía electrónica de las biopsias recolectadas de los nervios reparados, para lo cual, son necesarios múltiples recursos.