My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.98 n.2 Madrid Feb. 2006
TRABAJOS ORIGINALES
Detección de HBsAg usando mezcla de sueros. Estudio coste-beneficio
E. Fernández, L. Rodrigo1, S. García, S. Riestra1 y C. Blanco
Servicio de Análisis Clínicos. Hospital de Cabueñes. Gijón. 1Servicio de Gastroenterología. Hospital Universitario Central de Asturias. Oviedo
RESUMEN
Objetivos: examinar la fiabilidad y realizar un estudio coste beneficio de una estrategia de mezcla de 5 muestras usando un enzimainmunoanálisis (EIA) para el cribado del
HBsAg.
Material y métodos: para evaluar la sensibilidad y especificidad del método de mezcla de sueros se determinaron 40 sueros HBsAg positivos (de débil a intensamente positivos) y 250 sueros HBsAg negativos en mezcla con 4 sueros HBsAg negativos. El límite de detección para el HBsAg/ad y HBsAg/ay se evaluó usando suero de un panel de subtipos purificados. Se llevó a cabo un estudio en condiciones reales usando mezcla de sueros de 314 mujeres gestantes.
Resultados: la sensibilidad y especificidad de esta técnica fue del 100%. El coeficiente de correlación entre los ratios muestra / punto de corte de las 40 muestras estudiadas en determinación simple y en mezcla fue 0,792 (p < 0,005). El método de mezcla de sueros detectó niveles más bajos de HBsAg/ad y HBsAg/ay (0,20 ng/mL y 0,12 ng/mL) que el método simple (0,34 ng/mL y 0,29 ng/mL, respectivamente). Un análisis coste-beneficio mostró que el método de mezcla puede ahorrar de un 30 a un 75% de el coste de la determinación de HBsAg para seroprevalencias de un 10 y 1%, respectivamente.
Conclusiones: el método de determinación de HBsAg en mezcla de sueros no muestra peor rendimiento diagnóstico que el método simple y es una estrategia coste efectiva válida en áreas de baja
prevalencia.
Palabras clave: Antígeno de superficie de la hepatitis B. Mezcla de sueros. Coste-beneficio.
Introducción
Se estima que unos 300 millones de personas a lo largo del mundo están afectadas por el virus de la hepatitis B (VHB) (1). Su principal reservorio son los portadores crónicos de VHB. Las consecuencias médicas de la infección por el VHB son variables e impredecibles, dependiendo de factores tales como la edad y el status inmune del paciente. El VHB es un conocido agente etiológico causante de hepatitis crónica, cirrosis hepática y carcinoma hepatocelular.
No obstante, existen grandes diferencias en la prevalencia de la infección, habiéndose establecido tres áreas de alta, media y baja endemicidad (2). En la mayoría de los países desarrollados la prevalencia de portadores crónicos de HBsAg es menor del 2%, y la transmisión de la enfermedad se produce principalmente en adultos pertenecientes a ciertos grupos de riesgo (usuarios de drogas vía parenteral, homosexuales, heterosexuales promiscuos, personal sanitario) (3). En España se ha encontrado una prevalencia de portadores de HBsAg del 1,2% (4), estando indicada la de determinación de HBsAg en donantes de sangre, gestantes y pacientes en programa de autotransfusión.
La técnica de mezcla de sueros intenta reducir costes sin pérdida de eficacia, y ha sido principalmente empleada en países en desarrollo en la búsqueda de anticuerpos contra el VIH (5-14) y contra el virus de la hepatitis C (15-19). Los resultados obtenidos con este método han sido altamente prometedores y han descendido significativamente el coste de los tests de laboratorio, sin producir un significativo descenso en su sensibilidad. El presente estudiado está dirigido a evaluar si la técnica de mezcla de sueros es aplicable a la detección de HBsAg, y a esclarecer los factores que pueden modificar su sensibilidad, así como a realizar un estudio coste-beneficio de la misma.
Material y métodos
Determinación del HBsAg
Se empleó un enzimainmunoensayo de micropartículas de tercera generación para la determinación de HBsAg (Abbott Laboratories, Abbott Park, IL). La presencia o ausencia de HBsAg se determina comparando la intensidad de formación de producto fluorescente con el punto de corte, que es calculado a partir del nivel de fluorescencia del calibrador negativo (N) (plasma humano no reactivo para HBsAg). El IMx HBsAg calcula el cociente de la intensidad de fluorescencia de la muestra (S) y el nivel de intensidad del calibrador negativo. El punto de corte (S/N) se estableció en 2 para la determinación simple.
La técnica de mezcla de sueros se lleva a cabo añadiendo 200 mL al pocillo, es decir, una mezcla de 40 mL de cada uno de los 5 sueros que componen la mezcla (dilución 1/5). El punto de corte se estableció como la media de las muestras negativas más 3 desviaciones estándar, obteniendo un valor de 1. Se considera, por consiguiente, que existe una muestra no reactiva en el grupo de 5 cuando el cociente S/N es menor que el punto de corte, mientras que un cociente S/N mayor que el punto de corte indicaría la existencia de la presencia de al menos una muestra positiva en la mezcla. En este caso es necesario realizar la determinación en las muestras aisladas para identificar la muestra positiva. Todos los tests fueron hechos en duplicado.
De acuerdo con lo anterior, se realizó un cálculo aproximado de la especificidad mediante la determinación de HBsAg en 50 mezclas de 250 sueros negativos. Para calcular la sensibilidad, 40 sueros con la misma distribución que la población general de la cual fueron extraídos [de débil a intensa positividad (S/N = 2,06-154,9)] fueron determinados en mezcla con 4 sueros negativos.
Subtipos del HBsAg (ad y ay)
El límite de detección del IMx HBsAg para los subtipos ad y ay fue evaluado usando suero de un panel de subtipos HBsAg ad y ay purificados (hepatitis HBsAg sensitivity panel, Abbott Laboratories). Las concentraciones de HBsAg/ad y HBsAg/ay fueron de 0,13 a 2,32 y de 0,21 a 2,24 ng/mL, respectivamente. El límite de detección se determinó en sencillo y en mezcla con 4 sueros HBsAg negativos.
Influencia del nivel de anti-HBs
Para averiguar si la existencia de anticuerpos anti-HBs en los sueros estudiados con el empleo de la técnica de mezcla pueden neutralizar el HBsAg e interferir con la sensibilidad de la técnica, aplicamos el método de mezcla a sueros con una concentración conocida de HBsAg/ad y HBsAg/ay, junto con cuatro sueros con títulos conocidos de anti-HBs. La determinación cuantitativa de anti-HBs fue llevada a cabo mediante un enzimainmunoanálisis de micropartículas usando un autoanalizador AxSYm (AxSYmTM AUSAB, Abbott Laboratories, Abbott Park,IL). Se obtuvieron sueros con títulos elevados de anti-HBs a partir de controles postvacunales y de pacientes recuperados de una hepatitis B.
Mezcla de sueros en el cribado de HbsAg
Para evaluar la utilidad del método de mezcla de sueros, se llevó a cabo una simulación de las condiciones de campo empleando el anterior método con muestras de mujeres gestantes procedentes de un estudio previo de prevalencia de infección por el VHC realizado por nuestro grupo. Las muestras fueron congeladas a -20 ºC tras su obtención. Aleatoriamente se seleccionaron 300 muestras HBsAg negativas y 14 HBsAg positivas. Las determinaciones fueron hechas sin previo conocimiento de la composición de las mezclas.
Reducción en el número de tests
Cuando una mezcla resulta positiva es necesario realizar la determinación con cada uno de sus componentes para identificar la muestra o muestras que son HBsAg positivo. Así, a mayor número de mezclas positivas (es decir, a mayor prevalencia de HBsAg), menor es la reducción en el número de tests realizados. Se calculó el porcentaje de reducción en el número de tests al usar el método de mezcla en las condiciones más desfavorables y más improbables (bajas prevalencias) cuando no existe más de un suero HBsAg positivo en ninguna de las mezclas. Por ejemplo, para una seroprevalencia de HBsAg de un 2%, si se analizan 100 sueros en 20 mezclas, 2 de ellos serán positivos. Por tanto, es necesario añadir 10 determinaciones (10 sueros ensayados individualmente) a los 20 iniciales (20 mezclas), resultando 30 determinaciones en total. En este ejemplo, se ahorra el 70% del coste. Para llevar a cabo un estudio coste-beneficio se calculó el precio de una determinación de HBsAg en 3 euros.
Análisis estadístico
Los datos se recogieron en una base de datos y fueron analizados mediante el paquete informático SPSS para Windows, versión 6.0. Se empleó la correlación no paramétrica de Spearman. Los resultados se expresan como la media ± 2 DE. Se consideró un nivel de p < 00,5 como estadísticamente significativo.
Resultados
Ninguno de las 50 mezclas de HBsAg negativo resultaron positivas (S/N mezcla > 1), obteniéndose en las mezclas los siguientes valores de S/N: 0,767 ± 0,076 (rango 0,67-0,88). En nuestro estudio la especificidad de la técnica de mezcla fue del 100% (IC 95%: 98,1-99,9). De otro lado, los 40 sueros HBsAg proporcionaron valores de S/N > 1 (sensibilidad = 1) cuando se determinaron en mezcla. El coeficiente de correlación entre los cocientes S/N de las determinaciones individuales y en mezcla de las 40 muestras estudiadas fue 0,792 (p < 0,05).
Un 26% de las mezclas con muestras con altos títulos de HBsAg presentaron un S/N incluso mayor que la muestra individual. No obstante, el coeficiente de correlación de las muestras con bajos títulos de HBsAg (S/N individual < 25, n =12) fue excelente (R = 0,9739, p < 0,05), como se muestra en la figura 1.
La figura 2 muestra los resultados de las técnicas en muestra individual y en mezcla de sueros con diferentes concentraciones de HBsAg/ad y HBsAg/ay. El límite de detección usando el método individual fue de 0,34 ng/mL para el subtipo ad y de 0,29 ng/mL para el subtipo ay, mientras que con el método de mezcla se detectaron niveles más bajos de antígeno, 0,20 y 0,12 ng/mL, respectivamente.
La influencia de las diferentes concentraciones de anti-HBs sobre el límite de detección de los subtipos de HBsAg cuando se usa el método de mezcla de sueros se muestra en la figura 3 (media de 2 determinaciones). Cuando el título en la mezcla es menor de 100 UI/L, la técnica no pierde sensibilidad; e incluso cuando el título de anti-HBs alcanza las 10.000 UI/L, la técnica es todavía capaz de detectar concentraciones de HBsAg tan bajas como 1,5 ng/mL.
En la investigación llevada a cabo con sueros de mujeres gestantes bajo condiciones reales, el método de mezcla consiguió la clasificación correcta de todas las muestras analizadas. Consecuentemente, la especificidad y sensibilidad fueron del 100%.
La figura 4 muestra el descenso en el porcentaje de reducción en el número de tests alcanzado con el método de mezcla cuando la seroprevalencia de HBsAg aumenta. Se puede observar que incluso con prevalencias en la muestra estudiada tan elevadas como el 10%, se alcanza un mínimo de ahorro de un 30%.
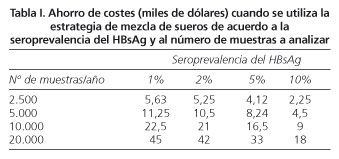
El análisis del beneficio económico de la estrategia de mezcla sérica muestra que el ahorro alcanzado depende tanto de la prevalencia como del número de determinaciones a realizar. Así, para países de baja prevalencia como el nuestro, el método de mezcla reduce el coste del cribado de HBsAg. Por ejemplo, hemos estimado que para un laboratorio que realice 2.500 determinaciones anuales el método de mezcla consigue un ahorro de 5.630 euros, pudiendo llegar a 45.000 euros para el caso de un hospital con 20.000 determinaciones anuales (Tabla I).
Discusión
Una aproximación al método de mezcla consiste en mantener la dilución y el volumen final de la muestra de reacción en cada mezcla, de cara a no perder sensibilidad, para lo que se reduce el diluyente y se reemplaza por el suero adicional. De esta manera no es necesario modificar el punto de corte respecto al método con muestras individuales. No obstante, el método usado en nuestro estudio está automatizado y la dilución de la muestra la realizó un autoanalizador. Por esta razón cada muestra sufrió una dilución a 1/5 al ser mezclada con otros 4 sueros. Por consiguiente, fue necesario en nuestro estudio modificar el punto de corte y limitar el número de sueros en el mezcla de cara a no perder sensibilidad.
En relación con la especificidad, es necesario remarcar que el valor medio de las mezclas cayó justo a 3 desviaciones estándar del punto de corte. Así, un falso positivo podría esperarse en un 1% de los casos. Pensamos que esto es aceptable ya que la especificidad es casi del 100% (99,9%). Para establecer la verdadera especificidad de este ensayo se requiere un estudio con un mayor número de muestras negativas.
Aunque la correlación entre el método de mezcla y el método individual es buena, la línea de regresión intercepta el eje X a un valor de S/N de 3 (el correspondiente valor de Y es 1). Esto puede significar que cualquier muestra con un cociente S/N entre 2 y 3 en el test individual podría tener un valor menor de 1 y no ser detectado, por consiguiente, con el método de mezcla.
Para una prevalencia de HBsAg positivo de un 1%, un modelo matemático descrito por Liu y cols. (19), alcanzó la máxima reducción (80,5%) en el número de tests con un tamaño de mezcla de 11 sueros. No obstante, en nuestra opinión podría surgir un problema con la especificidad debido al efecto del mezcla sobre el nivel de falsos positivos. Un incremento en las proteínas no específicas, como resultado de la mezcla de sueros, podría originar un aumento en el color de fondo. Con el tamaño de mezcla de 5 sueros escogido en nuestro estudio y el cambio del punto de corte de 2 a 1, no se observaron pérdidas en la sensibilidad (falsos negativos) ni en la especificidad (falsos positivos).
Los resultados del presente estudio muestran que la técnica de mezcla sérica para la detección de HBsAg es altamente sensible y específica, permitiendo un considerable ahorro económico. Estos hallazgos son similares a los obtenidos por otros investigadores que aplicaron el método de mezcla al estudio de la infección por VHC y VIH (5-19). Hasta el presente, solamente han sido descritos 2 estudios (20,21) sobre el método de mezcla aplicado al HBsAg. En uno de estos estudios (20), aplicado al cribado de HBsAg prenatal con mezcla de 10 muestras, los autores encontraron una baja prevalencia de portadores crónicos (0,43%), y concluyeron que es un método coste-efectivo y una estrategia válida en áreas de baja prevalencia, con una reducción en la sensibilidad estimada de un 4,2%. En nuestro estudio, la aplicación del método de mezcla a mujeres gestantes, entre las que la prevalencia de HBsAg es del 0,93%, demostró una sensibilidad y especificidad del 100%. La distribución de cada uno de los 2 principales subtipos de HBsAg (ad y ay) en nuestro entorno es aproximadamente del 50%, siendo el subtipo ay más frecuente en adictos a drogas vía parenteral (22). En nuestro estudio hemos demostrado que el método de mezcla mejora la sensibilidad, es decir, desciende el límite de detección del inmunoensayo usado para la determinación de los 2 principales subtipos de HBsAg. Nuestra técnica de mezcla nos permitió detectar cantidades tan pequeñas como 0,20 ng/mL de HBsAg/ay, incluso menores que las obtenidas con el método estándar. El hallazgo de una incrementada sensibilidad con el método de mezcla no es sorprendente y ya ha sido descrito por otros autores (16). Es importante evaluar la sensibilidad del test ELISA usado para el método de mezcla, debido a que no todos los "kits" pueden ser convenientes para métodos de cribado, como se ha demostrado en el caso del anticuerpo del virus de la hepatitis C (23,24).
La presencia de anti-HBs en el mezcla de sueros podría modificar la sensibilidad de la técnica, pero solamente de manera significativa con títulos mayores de 10.000 UI/L vistos solamente en muestras de estudios postvacunales; en esta situación, la determinación de HBsAg no está indicada. De hecho, Cunninghan y cols. (20) encontraron que solamente 4,5% de las mezclas de sueros de mujeres gestantes tenían un título de anti-HBs mayor de 7.500 UI/L. Teniendo presente esta limitación de la sensibilidad de la técnica de mezcla sérica, encontraron una sensibilidad y especificidad cercana al 100%. Nuestros resultados podrían ser reproducibles en otras áreas de baja prevalencia, pero deberían ser demostrados en áreas de alta endemicidad para el VHB. En estas áreas la mayoría de la población está ya inmunizada contra este virus y es posible que los títulos de anti-HBs encontrados en el suero estén ligeramente elevados. Rabenau y cols. (21), usando un ELISA similar al nuestro, estudiaron la fiabilidad de los tests serológicos de HBsAg en mezclas de plasma. En su estudio, la detección de HBsAg estuvo influenciada por la presencia de bajos títulos de anti-HBs después de 5 horas de incubación. No obstante, tras la disociación del inmunocomplejo, el HBsAg fue detectable en el mezcla incluso en presencia de alto contenido en anti-HBs. En nuestro estudio, demostramos que sólo se produce un descenso significativo en la sensibilidad para títulos de anti-HBs mayores de 10.000 UI/L. Estas diferencias pueden ser debidas al hecho de que en nuestro caso las muestras fueron analizadas inmediatamente, sin incubación previa. Esto podría prevenir la neutralización del antígeno debida a la formación de inmunocomplejos. Por consiguiente, pensamos que el título de anti-HBs en suero y el procesamiento previo al análisis de las muestras podría influir en la sensibilidad del método de mezcla sérica. Los laboratorios que usen esta técnica deberían de tener presentes estos dos factores antes de su uso generalizado.
Para la infección por VIH, la OMS acepta el empleo del método de mezcla cuando la mezcla es de 5 sueros y la prevalencia de la enfermedad es menor del 2% (25). Siguiendo estas indicaciones, la mayoría de los estudios aplican y recomiendan el uso de técnicas de mezcla en áreas de baja prevalencia. En nuestro estudio, demostramos que la técnica de mezcla podría también ser coste-efectiva en poblaciones con una alta prevalencia de HBsAg. Esto podría permitir su uso en países pertenecientes a áreas de baja y alta endemicidad de infección por VHB, que coincide en general con países subdesarrollados o en vías de desarrollo, es decir, aquellos que tienen una mayor necesidad de reducir los costes económicos de los tests de laboratorio. No obstante, es necesario llevar a cabo en estas áreas estudios similares para confirmar nuestros resultados. Ya se ha demostrado que en países como Kenia, con una alta frecuencia de infección por VIH (7,3%), la aplicación de la mezcla sérica para su detección podría permitir un ahorro económico del 62%, sin una pérdida significativa de seguridad en las determinaciones (14). En España, un país perteneciente a un área de baja endemicidad de infección por VHB, y con una frecuencia de portadores de HBsAg en la población general del 1,2% (4), podría ser usado en todos aquellos grupos en que el cribado para HBsAg es obligado (tal como donantes de sangre, sujetos en programas de autotransfusión, cribado de gestantes).
El estudio coste-beneficio de aplicar técnicas para la detección de portadores crónicos de VHB, nos permite demostrar que el ahorro económico es mayor cuando se aplica a un gran número de determinaciones en grupos de baja seroprevalencia, y su uso podría ser también coste-efectivo en áreas con alta prevalencia de infección, e incluso en laboratorios que llevan a cabo un pequeño número de determinaciones. La tabla I muestra el ahorro económico, de acuerdo a las diferentes prevalencias de HBsAg y al número anual de determinaciones. En nuestra área la aplicación del método de mezcla podría ahorrar alrededor de un 74% del coste económico, comparado con el método sencillo.
Algunos investigadores han comenzado recientemente a practicar estrategias para la detección de ácidos nucleicos virales en donantes de sangre, usando la reacción en cadena de la polimerasa (PCR), con el fin de incrementar la seguridad de la transfusión de hemoderivados (26-29). Debido al hecho de que no es posible llevar a cabo el cribado individual por los problemas económicos y la carga de trabajo implicada, está en uso el método de mezcla de las muestras serológicas negativas. Este mecanismo podría aumentar la seguridad de la sangre mediante el cribado sistemático de donaciones de sangre a coste relativamente bajo. Dado que una de las principales limitaciones de emplear estos métodos es la económica, pensamos que con nuestro estudio habría una base teórica para el empleo del cribado de infección por VHB, VHC y VIH en dos etapas a un coste económico relativamente bajo. En la primera fase, un ELISA comercial podría ser aplicado a una mezcla de donantes de sangre; en la segunda fase, la aplicación de técnicas de PCR a una mezcla de muestras seronegativas podría incrementar la seguridad del análisis. Hasta que futuros estudios puedan probar el valor de esta técnica con donantes de sangre, pensamos que podría ser aplicada únicamente con un fin diagnóstico y epidemiológico. Podemos concluir que la aplicación de un ELISA a una mezcla de sueros, es un método sensible y específico en la detección de los 2 principales subtipos de HBsAg en un área de baja seroprevalencia. La sensibilidad solamente decrece cuando existen títulos muy altos de anti-HBs en el mezcla de sueros. La técnica de mezcla es un método que podría también permitir un ahorro económico si se emplea en el estudio de poblaciones con una alta prevalencia de portadores de HBsAg. Se requieren más estudios para confirmar estos hallazgos.
Agradecimientos
Damos las gracias a David H. Wallace (member of the European Association of Science Editors and the Council of Biological Editors) por la traducción al inglés de este artículo.
Bibliografía
1. Maynard JE. Hepatitis B: global importance and need for control. Vaccine 1990; 8 (Supl.): 18s-20s. [ Links ]
2. Margolis HS, Alter MJ, Hadler SC. Hepatitis B: evolving epidemiology and implications for control. Sem Liver Dis 1991; 11: 84-92. [ Links ]
3. Alter MJ, Mast EE. The epidemiology of viral hepatitis in the United States. Gastroenterol Clin North Am 1994; 23: 437-55. [ Links ]
4. Suárez A, Riestra S, Navascués CA, et al. Positive HBsAg blood donors in Asturias (Spain): current prevalence and its significance. (Engl abstract). Med Clin (Barcelona) 1994; 102: 329-32. [ Links ]
5. Emmanuel JC, Basset MT, Smith HJ, Jacobs JA. Pooling of sera for human immunodeficiency virus (HIV) testing: an economical method for use in developing countries. J Clin Pathol 1988; 41: 582-5. [ Links ]
6. Kline RL, Brothers TA, Brookmeyer R, et al. Evaluation of human immunodeficiency virus seroprevalence in population surveys using pooled sera. J Clin Microbiol 1989; 27: 1449-52. [ Links ]
7. Cahoon-Young B, Chandler A, Livermore T, et al. Sensitivity and specificity of pooled versus individual sera in a human immunodeficiency virus antibody prevalence study. J Clin Microbiol 1989; 27: 1893-5. [ Links ]
8. Frosner GG, Dobler G, von Sonnenburg FJ. Cost reduction of unlinked testing for anti-HIV by investigation of pooled sera. AIDS 1990; 4: 73-5. [ Links ]
9. Behets F, Bertozzi S, Kasali M, et al. Sucessful use of pooled sera to determine HIV-1 seroprevalence in Zaire with development of cost-efficiency models. AIDS 1990; 4: 737-41. [ Links ]
10. Monzon OT, Paladin FJ, Dimaandal E, et al. Relevance of antibody content and test format in HIV testing of pooled sera. AIDS 1992; 6: 43-8. [ Links ]
11. Tamashiro H, Maskill W, Emmanuel J, et al. Reducing the cost of HIV antibody testing. Lancet 1993; 342: 87-90. [ Links ]
12. Perriens JH, Magazani K, Kapila N, et al. Use of a rapid test and an ELISA for HIV antibody screening of pooled serum samples in Lubumbashi, Zaire. J Virol Methods 1993; 41: 213-21. [ Links ]
13. McMahon EJ, Fang C, Layug L, Sandler SG. Pooling blood donor samples to reduce the cost of HIV-1 antibody testing. Vox Sang 1995; 68: 215-9. [ Links ]
14. Verstraeten T, Farah B, Duchateau L, Matu R. Pooling sera to reduce the cost of HIV surveillance: a feasibility study in a rural Kenyan district. Trop Med Int Health 1998; 3: 747-50. [ Links ]
15. Kamel MA, Ghaffar YA, Wasef MA, et al. High HCV prevalence in Egyptian blood donors. Lancet 1992; 340: 427. [ Links ]
16. Neil AGS, Conradie JD. Low cost anti-HCV screening of blood donors. Lancet 1992; 340: 1096. [ Links ]
17. Fernández E, Riestra S, García S, Rodríguez S. Pool tests for detection of hepatitis C virus infection. J Hepatol 1995; 23: 236. [ Links ]
18. García Z, Taylor L, Ruano A, et al. Evaluation of a pooling method for routine anti-HCV screening of blood donors to lower the cost burden on blood banks in countries under development. J Med Virol 1996; 49: 218-22. [ Links ]
19. Liu P, Shi ZX, Zhang YC, et al. A prospective study of a serum-pooling strategy in screening blood donors for antibody to hepatitis C virus. Transfusion 1997; 37: 732-6. [ Links ]
20. Cunningham R, Northwood JL, Kelly CD, et al. Routine antenatal screening for hepatitis B using pooled sera: validation and review of 10 years experience. J Clin Pathol 1998; 51: 392-5. [ Links ]
21. Rabenau H, Schutz R, Berger A, et al. How accurate is serologic testing of plasma pools for hepatitis B virus surface antigen, anti-human immunodeficiency virus 1 and 2, and anti-hepatitis C virus? (Engl abstract). Infus Transfus 1996; 23: 124-30. [ Links ]
22. Echevarría JE, León P, López JA, et al. HBsAg subtype distribution among different populations of HBsAg carriers in Spain. Eur J Epidemiol 1995; 11: 39-45. [ Links ]
23. Neill AGS, Conradie JD. Pool tests for hepatitis C virus. Lancet 1994; 343: 738. [ Links ]
24. Liu P, Shi ZX, Zhang YC, Zhang XY. Comparative study on 4 EIA kits for screening antibody to hepatitis C virus in pooled sera. Biomed Environ Sci 1998; 11: 75-80. [ Links ]
25. Recommendations for testing for HIV antibody on serum pool. WHO Weekly Epidemiol Rec 1991; 44: 316-27. [ Links ]
26. Lefrere JJ, Coste J, Defer C, et al. Screening blood donations for viral genomes: multicenter study of real-time simulation using pooled samples on the model of hepatitis C virus RNA detection. Transfusion 1998; 38: 915-23. [ Links ]
27. Yerly S, Pedrocchi M, Perrin L. The use of polymerase chain reaction in plasma pools for the concomitant detection of hepatitis C virus and HIV type 1 RNA. Transfusion 1998; 38: 908-14. [ Links ]
28. Schottstedt V, Tuma W, Bunger G, Lefevre H. PCR for HBV, HCV and HIV-1 experiences and first results from a routine screening programme in a large blood transfusion service. Biologicals 1998; 26: 101-4. [ Links ]
29. Morandi PA, Schockmel GA, Yerly S, et al. Detection of human immunodeficiency virus type 1 (HIV-1) RNA in pools of sera negative for antibodies to HIV-1 and HIV-2. J Clin Microbiol 1998; 36: 1534-8. [ Links ]











 text in
text in