My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.98 n.8 Madrid Aug. 2006
TRABAJOS ORIGINALES
Resonancia magnética y ecoendoscopia para el estadiaje del cáncer gástrico
MRI and endoscopic ultrasonography in the staging of gastric cancer
M. G. Arocena, A. Barturen1, L.
Bujanda2, O. Casado3, M. M. Ramírez4,
J. M. Oleagoitia1, M. Galdiz Iturri, P. Múgica, A. Cosme2,
M. A. Gutiérrez-Stampa2, E. Zapata y M. Echenique-Elizondo5
Servicio de Cirugía. Hospital San Eloy. Baracaldo, Vizcaya.
1Servicio de Digestivo. Hospital de Cruces. Baracaldo, Vizcaya.
2Servicio de Digestivo. Hospital Donostia. San Sebastián, Guipúzkoa.
3Servicio de Radiología. OSATEK.
4Servicio de Anatomía Patológica. Hospital San Eloy. Baracaldo, Vizcaya.
5Departamento de Cirugía. Universidad del País Vasco
Dirección para correspondencia
RESUMEN
Objetivo: determinar cuál de las dos técnicas: ultrasonografía endoscópica (USE) o resonancia magnética (RM) permite una mejor estadificación preoperatoria del cáncer gástrico
(CG). Material y métodos: se diseñó un estudio prospectivo de los pacientes con CG diagnosticados de noviembre del 2002 a junio del 2003. A los pacientes se les realizó una RM y una USE previa a la cirugía. El diagnóstico final de los pacientes se estableció mediante el estudio anatomopatológico de la pieza quirúrgica y/o laparotomía.
Resultados: se incluyeron 17 pacientes. El grado de infiltración tumoral de la pared gástrica (T) obtenida por RM se confirmó en el 53% de los casos y por USE en el 35%. Cuando se agrupaban los estadios T1 y T2 el diagnóstico era correcto en el 67% de los casos tanto por la RM como para la EUS. Cuando se agrupaban el estadio T3 con el T4 el diagnóstico fue correcto en el 87,5% de los casos por RM y en el 62,5% por EUS (p < 0,05). El grado de infiltración tumoral de los ganglios (N) por RM obtuvo confirmación en el 50% de los casos y por USE en el 42%. Al clasificar los ganglios en positivos (N1, N2 y N3) y negativos (N0) la USE fue superior a la RM (73 vs. 54%).
Conclusiones: la infiltración tumoral del CG en la pared gástrica fue mejor valorada con la RM. La USE era mejor que la RM para valorar el estadio T1 y la infiltración tumoral de adenopatías.
Key words: Resonancia magnética. Ultrasonografía endoscópica. Cáncer gástrico.
Introducción
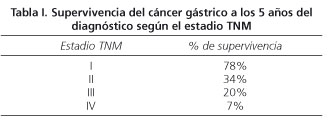
El cáncer gástrico (CG) es uno de los tumores gastrointestinales más frecuentes. El pronóstico y la supervivencia del CG en estadios avanzados es desfavorable (1) (Tabla I). El 44% de los enfermos con CG en estadio T2 y el 64% con un estadio T3 presenta infiltración tumoral de los ganglios linfáticos (2). El único tratamiento curativo es la cirugía. Sin embargo, en el momento del diagnóstico muy pocos pacientes son resecables. Además, la cirugía presenta una morbilidad nada despreciable, por lo que es muy importante establecer con la máxima exactitud posible el estadio tumoral.
Entre las técnicas para establecer el estadio tumoral del CG está la tomografía computerizada (TC). La seguridad diagnóstica de la TC en la infiltración de la pared oscila entre el 25 y 66%, en la infiltración de ganglios entre el 25 y 68%, y en la identificación de metástasis a distancia entre un 65 y 72% (3). Es por este motivo que sea necesario introducir otras técnicas que permitan realizar un diagnóstico más preciso del estadio tumoral del CG.
En los últimos años se han introducido varias técnicas de imagen, como la resonancia magnética (RM) y la ultrasonografía endoscópica (USE), para valorar el estadio del CG. La RM se ha comparado con el TC obteniendo resultados similares e incluso mejores en el estadiaje tumoral (4,5). La USE es otra técnica que ha mostrado gran precisión en valorar el estadio de diferentes tumores, como por ejemplo en el cáncer de esófago (6) y en el cáncer de recto (7). Hay trabajos que demuestran cómo la USE es un procedimiento con una gran seguridad diagnóstica en establecer el grado de infiltración tumoral de CG en la pared y en los ganglios (8-10).
El objetivo de este trabajo era determinar cuál de las dos técnicas, RM o USE, tiene mayor seguridad diagnóstica en el estadio del CG.
Material y métodos
Se realizó un estudio prospectivo con el objetivo de valorar la seguridad diagnóstica de la RM y la USE en el estadio del CG. Se incluyeron todos los pacientes (n = 21) que fueron diagnosticados de CG por biopsias obtenidas por endoscopia entre noviembre del 2002 y junio del 2003 en el Hospital de San Eloy (Baracaldo, Vizcaya). La prueba de referencia para el estadio del CG fue la anatomía patológica de la pieza quirúrgica en los pacientes resecados o la laparotomía en los casos no resecados. Los criterios de exclusión fueron: pacientes portadores de marcapasos, claustrofobia, tumores con estenosis que impiden el paso del endoscopio, pacientes con metástasis hepáticas y/o pulmonares, una demora mayor de 7 días entre las diferentes técnicas diagnósticas o un tiempo de demora entre el diagnóstico endoscópico y la cirugía, mayor a 20 días. La estadificación del CG se realizó siguiendo la clasificación TNM, 4ª edición (11) (Tabla II).
El tratamiento quirúrgico se llevó a cabo por dos cirujanos de la unidad esofagogástrica. El estudio anatomopatológico fue realizado por un patólogo especializado en tumores gástricos de nuestro hospital. El patólogo, el radiólogo y el ecoendoscopista emitían un informe sin conocer los resultados de las otras pruebas realizadas para el estadiaje del CG.
El comité de ensayos clínicos del Hospital aprobó el estudio. Los pacientes dieron su consentimiento por escrito para participar en el estudio.
La RM fue interpretada por un radiólogo con experiencia y dedicación especial a la patología gástrica. Se utilizó un imán de 1T, en decúbito supino, inmediatamente después de la toma por el paciente de 400 ml de gadolinio oral diluido (dilución 1/10). No se administraron espasmolíticos. Se realizaron secuencias T1 GE fase y fuera de fase (TR:135, TE:3,7, grosor de corte: 7 mm) con suspensión de la respiración al menos en dos planos que siempre incluía el plano axial desde la unión gastroesofágica hasta el polo inferior de los riñones, HASTE T2 (TR:1100, TE:120, grosor de corte: 5 mm) con suspensión de la respiración en los tres planos limitados al estómago, T1 (TR:587, TE:12, grosor de corte: 8 mm) y STIR (TR:5000, TE:60, TI:130, grosor de corte: 7-8 mm) axiales desde la cúpula hepática hasta debajo de los riñones. En caso necesario se obtuvieron también planos oblicuos coronales o sagitales al tumor en secuencia T1 GE fase y fuera de fase. Finalmente, se realizó un estudio T1 GE fase y fuera de fase con suspensión de la respiración, dinámico, con gadolinio intravenoso axial (TR:135, TE:3,7, grosor del corte: 7 mm). Se consideraron ganglios positivos cuando medían más de 10 mm.
La USE fue realizada por un ecoendoscopista experto con un ecoendoscopio radial de 7,5 MHz (Pentax FG-36UX). Además, todos los pacientes fueron estudiados con una minisonda de 12 MHz. Los ganglios se consideraron positivos para malignidad cuando eran homogéneos, hipoecoicos y median más de 5 mm (12). No se realizó punción de los ganglios.
Estudio estadístico
Se determinó la sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo y seguridad diagnóstica para la RM y USE, en el estadio T y N, a partir de una tabla de contingencia tetracónica (2 x 2). Para obviar artefactos matemáticos se aplicó el método exacto binomial de Miettinen o el de Fleiss. Se analizó por el test de Wilcoxon si existían diferencias significativas entre ambas técnicas. Se consideró diferencia significativa, cuando la p era menor de 0,05. Se estableció que los parámetros expresados en porcentaje no eran estadísticamente significativos, si incluían en su intervalo de confianza, el 50% o el 1 para los cocientes de probabilidad positivos y cocientes de probabilidad negativos.
Resultados
De los 21 pacientes incluidos, 19 fueron operados. En 2 pacientes no se realizó intervención quirúrgica, uno por edad avanzada y patología asociada, y el otro por presentar ascitis carcinomatosa. De los 19 pacientes intervenidos, 5 casos no fueron resecados por presentar infiltración local extensa y/o carcinomatosis. De los 19 pacientes operados todos tenían RM, y 17 tenían RM y USE. En 2 pacientes no se realizó USE por no cumplir el protocolo, uno por demora mayor de 7 días, y el otro, por estenosis tumoral en el antro que impedía una correcta valoración. Otro caso precisó de dilatación endoscópica neumática, a nivel del cardias, para completar el protocolo.
De los 19 pacientes intervenidos, 14 fueron hombres y 5 mujeres. La edad media fue de 70 años (entre 56 y 81 años). La localización tumoral fue en antro 12 casos (63%), en cuerpo 3 casos (15%) y subcardial 4 (21%). El tipo histológico fue adenocarcinoma de tipo intestinal en 11 pacientes y de tipo difuso en 8 (todos los no resecados estaban en este grupo).
La técnica quirúrgica practicada fue una gastrectomía, omentectomía y linfadenectomía D1-D2. Se practicó gastrectomía total en 5 pacientes, y en 9 pacientes se realizó una gastrectomía subtotal con reconstrucción tipo Billroth I, II o III, en función de las condiciones locales y de las preferencias del cirujano. Se aislaron con la pieza quirúrgica entre 8 y 29 ganglios, con una media de 15 ganglios.
No hubo mortalidad postoperatoria. En 5 pacientes (35%) hubo complicaciones postoperatorias. Las complicaciones presentadas fueron 3 fístulas de bajo débito, una linforragia y un absceso subhepático. Todas las complicaciones se solucionaron con tratamiento médico, excepto el absceso que se solucionó con drenaje quirúrgico.
El estadio final de los tumores fue en un paciente T1, en 7 pacientes T2, en 3 pacientes T3 y en 6 un estadio T4. Con relación al estadio N, 6 pacientes fueron N0 y 11 tenían ganglios infiltrados por el tumor. Ningún paciente presentó metástasis (M0).
En la evaluación de la infiltración de la pared gástrica (T), la RM permitió hacer una estadificación correcta en el 53% de los casos, en 23,5% de los casos los infraestadio y en 23,5% los sobreestadio. La USE acertó el 35% de los casos, infraestadio el 47% y sobreestadio el 18% de los casos. La sensibilidad de la USE para el estadio T4 fue del 20%.
En el conjunto de enfermos en estadio T1 y T2, la USE fue correcta en el 67% de los casos, semejante al obtenido por RM. Cuando se agrupaban el estadio T3 y T4, la USE diagnóstico correctamente el 62,5% de los casos frente al 87,5% de la RM, siendo estadísticamente significativas estas diferencias (Tabla III). Sólo hemos tenido un paciente T1 que fue diagnosticado correctamente por USE. La RM lo clasificó como un T3.
En la evaluación de los ganglios (N), la RM acertó el 50% de los casos, infraestadio el 25% y sobreestadio el 25% de los casos. La USE acertó el 42% de los casos, infraestadio 42% y sobreestadio el 16% de los casos. La sensibilidad de la RM para valorar el N0 fue del 50% frente a un 67% de la USE. Cuando se clasificaban el N1, N2 y N3 como N positivos observamos como la RM diagnóstico correctamente el 60% de los casos y la USE el 70,5% (Tabla IV). No hubo diferencias significativas entre las dos técnicas diagnósticas. El uso de ambas técnicas, de manera conjunta, no mejoró la rentabilidad diagnóstica. En la tabla V se exponen los resultados de la serie con cada una de las técnicas.
Discusión
Las técnicas preoperatorias que tratan de valorar el estadio del CG, con frecuencia fallan y hace que algunos pacientes sean operados sin conseguir la resección del tumor (2). Actualmente existen dos técnicas novedosas (USE y RM) que evalúan el estadiaje del CG. Estudios in vitro han mostrado cómo la RM tiene una seguridad diagnóstica en la valoración de la infiltración tumoral de la pared gástrica próxima al 100% (13). En nuestro estudio la precisión diagnóstica de la RM obtuvo una exactitud diagnóstica del 76% para el estadio T. Estos resultados son similares a los aportados a otros estudios en el que comparan la RM con la TC (Tabla VI).
La USE es la técnica más precisa para valorar la infiltración tumoral en la pared en el cáncer de esófago (6) o de recto (7). Los estudios que valoran la USE el estadio del CG son escasos. En nuestro estudio, la precisión diagnóstica de la USE para valorar la infiltración tumoral de la pared gástrica cuando se agrupaban T1 con T2 y T3 con T4 fue baja (65%), inferior a los resultados obtenidos en otros tumores como en el cáncer de esófago (6). Esta baja precisión puede ser debida a que sólo hubo un paciente con un tumor T1 y a la dificultad que tiene la USE en diferenciar la invasión de estructuras vecinas de los fenómenos inflamatorios adyacentes al tumor.
El estudio y diagnóstico preoperatorio de adenopatías infiltradas por el tumor es también importante debido a que va a guiar a realizar cirugías más o menos agresivas y/o tratamientos complementarios como la quimioterapia o radioterapia. La exactitud diagnóstica de infiltración tumoral de adenopatías de la TC helicoidal es inferior al 75% para la mayoría de los autores (4,5,20,21). Cuando se compara la TC con la RM en el estudio de infiltración tumoral de adenopatías en el CG los resultados son similares (Tabla VI). Nuestros resultados muestran cómo la seguridad diagnóstica de la RM eran bajos (53%), y similares a la USE. Los malos resultados obtenidos con la USE y la RM en la valoración de la infiltración por el tumor de los ganglios puede deberse a que no existe un consenso sobre que tamaño de las adenopatías debe considerarse patológico. Así, en algunos estudios lo establecen en 5 mm, otros en 8 mm y otros en 10 mm. Otros factores de confusión, pueden deberse a los cambios inflamatorios en los ganglios o a infiltraciones tumorales microscópicas que no afectan al tamaño del ganglio. La RM valora con dificultad los ganglios que se encuentran muy cerca de la pared gástrica, mientras que la USE valora peor los ganglios situados a una mayor distancia del tumor.
Otras técnicas como por ejemplo, la TC en tres dimensiones, la hidro-TC, la tomografía por emisión de positrones (PET), etc., están surgiendo con resultados iniciales muy prometedores para valorar el estadio del CG (22-24). La ecografía a través de la laparoscopia tiene una seguridad diagnóstica para detectar infiltración de la pared gástrica del 47%, para la infiltración de ganglios regionales del 60 al 90% y para la identificación de metástasis a distancia del 80 al 90% (2).
A pesar de las limitaciones de nuestro estudio y el escaso número de pacientes creemos que la USE debe realizarse cuando la RM o TC nos indican un estadio T1 o T2, en ausencia de metástasis a distancia. Se requieren más estudios que nos ayuden a clarificar los datos aquí obtenidos.
Agradecimientos
Agradecemos a la Dra. S. Álvarez Ruiz del Servicio de Medicina Nuclear, Hospital Santiago Apóstol de Vitoria-Álava, su inestimable ayuda en la revisión de los datos estadísticos de este trabajo.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Luís Bujanda.
Avda. Sancho El Sabio 21, 3º C.
20010 San Sebastián. Guipúzcoa.
Fax: 943 006 407. E-mail: castro@medynet.com
Recibido: 14-07-05
Aceptado: 22-02-06
Bibliografía
1. Koh TJ, Wang TC. Tumors of the stomach. En: Feldman M, Friedman LS, Slesinger MH, editors. Gastrointestinal and liver diseases. 7ª ed. Philadelphia: Saunders; 2002. p. 829-48. [ Links ]
2. Hohenberger P, Gretschel S. Gastric cancer. Lancet 2003; 362: 305-15. [ Links ]
3. Fukuya T, Honda H, Haneko K, Kmoiwa T, Yoshimitsu K, Irie E, et al. Efficacy of helical CT in T staging of gastric cancer. J Comput Assist Tomogr 1997; 21: 73-81. [ Links ]
4. Sohn KM, Lee JM, Lee SY, Ahn BY, Park SM, Kim KM. Comparing MR imaging and CT in the staging of gastric carcinoma. AJR 2000; 174: 1551-7. [ Links ]
5. Kim AY, Han JK, Seong CK, Kim TK, Choi BI. MRI in staging advanced gastric cancer: Is it useful compared with spiral CT? J Comput Assist Tomogr 2000; 24: 389-94. [ Links ]
6. Penman ID, Shen EF. EUS in advanced esophageal cancer. Gastrointest Endosc 2002; 56 (Supl. 4): 2-6. [ Links ]
7. Savides TJ, Master SS. EUS in rectal cancer. Gastrointest Endosc 2002; 56 (Supl. 4): 12-8. [ Links ]
8. Botet JF, Lightdale CJ, Zauber AG, Gerdes H, Winawer SJ, Urmacher C, et al. Preoperative staging of gastric cancer: comparison of endoscopic US and dynamic CT. Radiology 1991; 181: 426-32. [ Links ]
9. Lightdale CJ. Endoscopic ultrasonography in the diagnosis, staging and follow-up of esophageal and gastric cancer. Endoscopy 1992; 24: 297-303. [ Links ]
10. Ziegler K, Sanft C, Zimmer T, Zeitz M, Felsenberg D, Stein H, et al. Comparison of computed tomography, endosonography, and intraoprative assessment in TN staging of gastric carcinoma. Gut 1993; 34: 604-10. [ Links ]
11. Hermanek P, Sobin LH. Digestive system tumors. In: Hermanek P, Sobin LH, eds. TNM classification of malignant tumors. 4th ed, 2nd rev. New York: Springer-Verlag, 1992. p. 45-8. [ Links ]
12. Vickers J, Alderson D. Oesophageal cancer staging using endoscopic ultrasonography. Br J Surg 1998; 85: 994-8.10. [ Links ]
13. Sato C, Naganawa S, Kumada H, Miura S, Ishigaki T. MR imaging of gastric cancer in vitro: accuracy of invasion depth diagnosis. Eur Radiol 2004; 14: 1543-9. [ Links ]
14. Grimm H, Soehendra N, Hamper K, Maas R. Contribution of endosonography to preoperative staging in esophageal and stomach cancer. Chirurg 1989; 60: 684-9. [ Links ]
15. Natterman C, Galbenu-Grunwald R, Nier H, Dancygier H. Endoscopic ultrasound in TN staging of stomach cancer. A comparison with computerized tomography and conventional ultrasound. Z Gesamte Inn Med 1993; 48: 60-4. [ Links ]
16. Isozaki H, Okajima K, Nomura E, Fujii K, Sako S, Izumi N, et al. Preoperative diagnosis and surgical treatment for lymph node metastasis in gastric cancer. Gan To Kagaku Ryoho 1996; 23: 1275-83. [ Links ]
17. Perng DS, Jan CM, Wang WM, Chen LT, Su YC, Liu GC, et al. Computed tomography, endoscopic ultrasonography and intraoperative assessment in TN staging of gastric carcinoma. J Formos Med Assoc 1996; 95: 378-85. [ Links ]
18. Polkowski M, Palucki J, Wronska E, Szawlowski A, Nasierowska-Guttmejer A, Butruk E. Endosonography versus helical computed tomography for locoregional staging of gastric cancer. Endoscopy 2004; 36: 617-23. [ Links ]
19. Bhandari S, Shim CS, Kim JH, Jung IS, Cho JY, Lee JS, et al. Usefulness of three-dimensional, multidetector row CT (virtual gastroscopy and multiplanar reconstruction) in the evaluation of gastric cancer: a comparison with conventional endoscopy, EUS, and histopathology. Gastrointest Endosc 2004; 59: 619-26. [ Links ]
20. Fukuya T, Honda H, Hayashi T, Kaneko K, Tateshi Y, Ro T, et al. Lymph-node metastases: efficacy of detection with helical CT in patients with gastric cancer. Radiology 1995; 197: 505-11. [ Links ]
21. Adachi Y, Sakino I, Matsumata T, Iso Y, Yoh R, Kitano S, et al. Preoperative assessment of advanced gastric carcinoma using computed tomography. Am J Gastroenterol 1997; 92: 872-5. [ Links ]
22. Yun M, Lim JS, Hoh SH, Hyung WJ, Cheong JH, Bong JK, et al. Lymph node staging of gastric cancer using (18) F-FDG PET: a comparison study with CT. J Nucl Med 2005, 46: 1582-8. [ Links ]
23. Kim AY, Kim HJ, Ha HK. Gastric cancer by multidetector row CT: preoperative staging. Abdom Imaging 2005; 30: 465-72. [ Links ]
24. D'Elia F, Zingarelli A, Palli D, Grani M. Hydro-dynamic CT preoperative staging of gastric cancer: correlation with pathological findings. A prospective study of 107 cases. Eur Radiol 2000; 10: 1877-85. [ Links ]











 text in
text in 







