Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.98 no.9 Madrid sep. 2006
TRABAJOS ORIGINALES
Efecto de la desfuncionalización colónica en un modelo experimental de cáncer de colon
Effect of defunctionalization on colon carcinogenesis in the rat
S. Pérez-Holanda, L. Rodrigo1, J. Viñas-Salas2, C. Piñol-Felis2 y C. Ildefonso3
Servicio de Cirugía. Hospital Valle del Nalón. Langreo. Asturias.
1Departamento de Medicina. Facultad de Medicina. Universidad de Oviedo. Asturias.
2Departamento de Medicina y Departamento de Cirugía. Facultad de Medicina.
Hospital Universitario Arnau de Vilanova. Universidad de Lleida. 3Servicio de Cirugía. Hospital Grande Covián. Arriondas, Asturias
Dirección para correspondencia
RESUMEN
Objetivo: examinar el efecto de la ausencia fecal en la aparición y desarrollo de la carcinogénesis colónica en ratas de ambos sexos.
Material y métodos: ciento treinta y ocho ratas "Sprague-Dawley' de 10 semanas de vida, de ambos sexos, divididas en 5 grupos: A) 20 ratas, sin tratamiento; B) 26 ratas, con una desfuncionalización colónica; C) 30 ratas, 18 dosis semanales de 21 mg/kg peso de dimetilhidracina (DMH) desde el principio del estudio; D) 20 ratas, 18 semanas con ácido etilen-diamino-tetracético; y E) 42 ratas, igual técnica quirúrgica que B, y las mismas inyecciones que C. El sacrificio tuvo lugar a las 25-27 semanas. Se estudió la incidencia de tumores colorrectales, su localización y los hallazgos anátomo-patológicos, comparando entre grupos.
Resultados: la ausencia de carcinógeno no desarrolló tumores. No hubo diferencias significativas entre el número total de tumores inducidos ni en el promedio de tumores por rata entre las ratas C y las E. La ausencia fecal provocó unos tumores de menor tamaño (p = 0,007), los cuales presentaron estirpes más glandulares (p = 0,00009), mejor diferenciadas (p = 0,0054) y menos invasivas (p = 0,015). Así mismo, la ausencia fecal modificó tanto el predominio natural de los machos sobre las hembras para desarrollar un mayor número de tumores colónicos DMH-inducidos (p = 0,025), como el predominio en el colon derecho de los carcinomas mucinosos DMH-inducidos (p = 0,0065).
Conclusiones: la desfuncionalización colónica en ratas provoca en los segmentos desfuncionalizados una alteración de los patrones de la carcinogénesis DMH-inducida.
Palabras clave: Cáncer. Carcinogénesis. Colon. Desfuncionalización. Dimetilhidracina. Neoplasia. Tumores.
Introducción
El cáncer colorrectal (CCR) de elevada mortalidad en Occidente (1) es el segundo de mayor incidencia en Asturias (13% de cánceres diagnosticados anualmente), causando 3,7% del total de los fallecimientos y 14,1% de las muertes por cáncer (2). Un metanálisis realizado demostró el papel ambiental en su inducción (3), pudiéndose reducir su incidencia en 30-35% con los hábitos alimentarios (4). También en modelos experimentales, la ausencia fecal colónica protegería frente al CCR (5), aunque los tumores inducidos no mostrarían variaciones histológicas (6). La carcinogénesis también podría ser diferente entre el colon izquierdo y el derecho (7). Los tumores en presencia fecal serían mayores y más numerosos que los desarrollados en su ausencia (8,9). Por fin, el factor sexual también puede mostrar diferencias en la carcinogénesis.
Dada la dificultad técnica de estudios prospectivos a largo plazo (10), el estudio del CCR inducido con 1,2 dimetilhidracina (DMH) en ratas es un modelo experimental válido actualmente, superponible al humano, tanto en sus características macro-microscópicas como en su comportamiento clínico (11-13).
Nuestro objetivo es examinar el efecto de la ausencia fecal en la aparición y desarrollo de la carcinogénesis colónica en ratas de ambos sexos.
Material y métodos
No se realizó ninguna preparación preoperatoria ni ayuno. Se practicó una anastomosis término-lateral (T-L) íleo-rectal a las ratas de los grupos B y E:
-Pesado; preparación del anestésico: hidrato de cloral (Panreac®, Barcelona) 4,5% intraperitoneal, a 1 ml/100 g (14).
-Anestesia, rasurado y colocación del animal.
-Colocación de microscopio óptico (x 4).
-Antisepsia. Incisión (2,5-3 cm). Colocación de paño fenestrado (15,16).
-Sección ileal a 5 mm de la válvula ileocecal (17), ligadura-sección vascular con seda 4/0 (18).
-Ligadura con seda 2/0 del íleon terminal, y sección proximal congruente (19).
-Incisión rectal de 5 mm a 3 cm del ano (9).
-Anastomosis íleo-rectal T-L con seda 4/0, con dos suturas continuas anudadas en sus extremos, que atraviesan todo el espesor de la pared intestinal.
-Cierre de pared continua monoplano de seda 2/0; piel a puntos simples.
El tiempo de la intervención aproximado fue de 35 min, devolviéndose a su jaula en decúbito lateral.
Los animales siguieron vigilancia clínica al menos de una vez al día, constatando su estado general y su grado de postración postanestésica. Iniciaron tolerancia oral hídrica en el momento del despertar y de la dieta a las 12 horas, viéndose restablecimiento del tránsito intestinal a las 48 horas. La inducción carcinogénica se inició al octavo día (20,21).
Se estableció un número mínimo de 20 ratas por grupo en base a una inducción tumoral conocida de 76-90% (22-23); para una tasa de tumores de 1,87; y una mortalidad variable y elevada (20,24-27).
138 ratas "Sprague-Dawley' de 10 semanas de vida (Lab. Letica®, Barcelona, España), de ambos sexos y de igual línea genética, fueron distribuidas en cinco grupos: A) 20 ratas: sin tratamiento; B) 26 ratas: intervención; C) se tomaron 30 ratas por la alta mortalidad obtenida en el mismo grupo en estudios previos (23-25); 18 inyecciones subcutáneas semanales continuadas de 21 mg/kg peso de 1,2 dimetilhidracina (DMH; Fluka Chemica A.G., Sigma Co.®, St. Louis, Missouri, EE.UU.) desde la semana 10 de vida. Se preparó semanalmente (23,28), aplicándose en la región lumbar; D) 20 ratas: mismo volumen de EDTA que C, mezclada con agua destilada, sin DMH; y E) se tomaron 42 ratas debido a la alta mortalidad obtenida en este grupo en estudios previos (26). Fueron intervenidas con la misma técnica que B y al octavo día (20), fueron tratadas con las mismas dosis de DMH que C. Para realizar la comparación tumoral entre los grupos C y E, aquellos obtenidos en colon descendente con heces, en la anastomosis y lo localizados en recto fueron excluidos del estudio.
La alimentación estándar (dieta ITM-R20, Lab. Letica®, Barcelona, España) tiene un 3% de grasa y un 5% de fibra, y la cantidad consumida en los grupos se controló durante el estudio. El 50% de los animales de cada grupo eran pesados semanalmente hasta el momento del sacrificio. El animalario se mantuvo a una temperatura y una humedad constantes, con un ciclo circadiano de luz-oscuridad de 12 horas (15,29). Los animales se separaron con un máximo de tres por jaula, y sin juntar distintos sexos, para evitar autofagia (23-25,28) y agresiones.
Se siguieron las recomendaciones del Comité Europeo de Ética (Directiva de la CEE 1986/609) y Real Decreto 1201/2005 sobre protección de animales utilizados para experimentación, en cuanto a protección, condiciones de cuidado, manejo, identificación, transporte, registro, confinamiento, condiciones estructurales, anestesia y competencias del personal.
Se sacrificaron entre las semanas 25 y 27 mediante una dosis letal de hidrato de cloral intraperitoneal. Un número fijo e igual de ratas de cada grupo se sacrificaron semanalmente (23,28).
En la autopsia se examinaron las cavidades torácica y abdominal. Se registró el número de tumores, su localización y su tamaño. El tamaño se expresa en media ± desviación estándar (en milímetros cuadrados, obtenido de sus diámetros mayores longitudinal y transversal) (28,30). Se tomaron muestras para el estudio histológico de los tumores, tanto a nivel del ciego y ascendente (colon derecho) como del transverso y descendente desfuncionalizado (izquierdo). Se tiñeron con hematoxilina-eosina. Se siguieron los criterios de Grau de Castro y Piqué Badía (31) y Lev (32), según su grado de invasión parietal, de su diferenciación, de su estirpe histológica (definiendo al carcinoma mucinoso cuando su componente de mucina es superior al 50%). Se registró su asociación a placa linfoide y su aspecto macroscópico. Se registraron otros hallazgos encontrados.
En la aplicación informática SPSS se registraron los datos, y se utilizó el test bivariante, con la corrección exacta de Fisher si fuera necesario, para comparar las diferentes variables entre los grupos C y E. Las diferencias fueron significativas cuando el valor de p resultó igual o menor que 0,05. Los resultados se presentan como media ± desviación estándar (SD).
Resultados
No completaron el estudio 27 ratas (19,6%): 10 ratas B (38,5%), 2 ratas C (6,7%) y 15 ratas E (35,7%).
Fallecieron el 80% (4 de 5) de los machos B: 2 por peritonitis fecaloidea por dehiscencia de sutura (a las 72 h); una por oclusión de asa ciega de colon; y otra por oclusión por estenosis anastomótica (primera semana). Seis hembras B no completaron el estudio (28,6%): una por obstrucción de delgado por adherencias (quinta semana); otra con caquexia extrema y heces líquidas, sin tumores (séptima semana); 1 por canibalismo (novena semana); y en 3 no se encontró causa (10, 12 y 13 semanas).
En el grupo C fallecieron 1 rata macho y una rata hembra sin causa aparente, sin tumores.
En el grupo E fallecieron 57,1% de los machos (12 de 21): 4 por dehiscencia de sutura y peritonitis fecaloidea (72 horas); 3 por oclusión de delgado (7 días); 2 machos por canibalismo (10 y 12 semana); 2 con sendos tumores colónicos, no siendo posible su estudio microscópico; y 1 con tumor maligno anastomótico oclusivo. En las hembras E se encontraron 3 muertes anticipadas (14,3%): 1 con oclusión del colon desfuncionalizado (7 días); 1 con adherencias e isquemia intestinal (14 semana), sin tumores; y 1 (14 semana), con oclusión de delgado por úlcera benigna anastomótica.
En los grupos B y E se perdieron el 80 y 57,1% de los machos y el 28,6 y 14,3% de las hembras, respectivamente (Fisher, p = 0,31).
La mortalidad postoperatoria global fue 17,6% (12 de 68); en machos fue del 42,3% (11 de 26) y en hembras del 2,4% (1 de 42) (p < 0,00001).
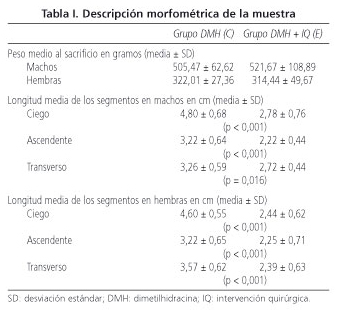
No hubo diferencias significativas entre el peso de los animales del grupo C y del E (Tabla I). En las ratas E, los segmentos excluidos tuvieron significativamente menor longitud comparados con las ratas C, tanto en los machos como en las hembras (Tabla I).
En los grupos A, B y D no se encontraron tumores. Se observaron 25 tumores en las 28 ratas C, y 10 en las 27 ratas E (Tabla II). En el grupo E los tumores se localizaron 2 en ascendente, 4 en transverso, 4 en descendente desfuncionalizado, 10 en la anastomosis y 13 en el recto.
Hubo un menor número de animales machos libres de tumor que de hembras libres de tumor, tanto en las ratas C (14,3 vs. 78,6%; p = 0,0006) como en el grupo E (0 vs. 50%; p = 0,011) (Tabla II). En presencia de carcinógeno, el predominio natural de los machos sobre las hembras para desarrollar un mayor número de tumores colónicos, fue alterado por efecto de la ausencia fecal, siendo la proporción de tumores en hembras C del 12%, y del 50% en hembras E (p = 0,025) (Tabla II).
En cuanto a las características macroscópicas estudiadas (Tabla III), los tumores de los segmentos excluidos del grupo E fueron significativamente de menor tamaño que los tumores del grupo C (p = 0,007). Sin embargo, no hubo variaciones significativas ni en su aspecto ni en su localización.
En cuanto a las características microscópicas de los tumores (Tabla IV), en los segmentos excluidos se presentaron un mayor número de adenocarcinomas (frente a carcinomas mucinosos, considerando un componente mucinoso > 50% del adenocarcinoma; p = 0,00009), un mejor grado de diferenciación tumoral (p = 0,0054), y un menor grado de invasión parietal (p = 0,015), frente a los tumores de los segmentos funcionalizados del grupo C. No hubo diferencias entre ambos grupos en la asociación de los tumores con tejido linfoide.
Las ratas C presentaron un mayor número de carcinomas mucinosos en el colon derecho (75%) comparado con el izquierdo (17,6%) (p = 0,006). Se observan diferencias significativas con respecto al grupo E (p = 0,0065), en el que la estirpe adenocarcinoma predomina tanto en los tumores de colon derecho (100%) como en el colon izquierdo (100%) (Tabla V).
Se encontraron en sendas ratas C un tumor de intestino delgado y un tumor ótico. Una rata macho E presentó una carcinomatosis peritoneal, y una rata hembra E presentó múltiples metástasis hepáticas y esplénicas, comprobadas microscópicamente.
Discusión
La mortalidad global en estudios quirúrgicos en ratas (28), es alta; por ello, su rendimiento es bajo (16,33,34). En nuestro estudio perdimos al 19,6% de ellas, incluyendo los grupos no intervenidos. Nuestra mortalidad postoperatoria fue 17,9%, lo cual también consideramos un rendimiento adecuado (7,19,35). Esa rentabilidad fue superior en las hembras frente a los machos.
La atrofia macro-microscópica de segmentos desfuncionalizados (7,36) explica la menor longitud encontrada, tanto en machos como en hembras.
La incidencia de carcinogénesis colónica espontánea es menor de 2-3 ratas/100.000 ratas observadas (37). En ausencia de carcinogénico no esperamos encontrar ningún tumor, como así resultó. La 1,2-dimetilhidracina (DMH) en ratas provoca tumores colónicos equiparables y superponibles en patología humana (11-13). Tiene propiedades mutagénicas (38) sobre el epitelio intestinal, con un efecto aditivo tanto por vía sanguínea como luminal (11). En nuestras ratas E, esta vía hematógena explica que no desapareciera por completo el efecto carcinogénico.
En España, la incidencia del cáncer colorrectal (CCR) pasó de 10 casos en 1990 (39,40), a 32/100.000 habitantes/año en 1998 (41). Estratificada por sexos es superior para hombres, que para mujeres (42). La evidencia epidemiológica de una menor incidencia de CCR en mujeres fue reproducible en nuestro modelo. Se comenta un menor riesgo de CCR asociado al uso de anticonceptivos orales, o a la edad temprana del primer embarazo (43); también (44) la hormonoterapia sustitutiva reduciría el riesgo de desarrollar pólipos adenomatosos colónicos. Para constatar estas diferencias en este estudio hemos utilizado animales de ambos sexos, encontrándose un menor número de animales machos libres de tumor con respecto a las hembras, en los grupos DMH-inducidos. La anulación significativa de la proporción del número de tumores en el grupo E de los machos con respecto a las hembras parece un resultado contradictorio con la hipótesis de la protección hormonal frente al CCR. En un importante estudio (45) se postula que este efecto protector hormonal en hembras, es mediado a través de la reducción de la concentración de ácidos biliares secundarios fecales, y de la modulación de la absorción de calcio de las células colónicas tumorales. Lo cual explica nuestros hallazgos.
Estudios epidemiológicos avalan la mayor incidencia de CCR con el incremento de la edad. Iniciamos la inducción tumoral en la semana 10 en el grupo control, y en la 11 en el grupo intervenido. Esto podría suponer un defecto del diseño del estudio. Un estudio (46) que compara la inducción tumoral colónica en animales jóvenes y viejos ha señalado igual riesgo en ambos casos. Otros autores observan un mayor riesgo de CCR en animales con edades más tardías, asociado a déficits de coenzimas (47) o enzimas (48). No parece pues, que la diferencia de 7 días en el inicio de la inducción tumoral en nuestras ratas haya influido en nuestros resultados; además, corresponde la menor inducción tumoral al grupo de edad más tardía, y no al contrario.
El tamaño tumoral en ausencia fecal fue significativamente inferior. Parece explicarse por la más lenta progresión de la secuencia adenoma-carcinoma (8,49) debido a la ausencia de la vía carcinogénica intraluminal y a la ausencia del efecto cocarcinogénico fecal (1,32,50-53).
La mayor incidencia de tumores DMH-inducidos en el colon izquierdo viene explicada por la mayor susceptibilidad de la mucosa, la mayor concentración de carcinógeno tras la deshidratación fecal y la reducción del tránsito intestinal (54). En estudios experimentales pareados (54,55), el índice de criptas aberrantes DMH-inducidas en el colon izquierdo es alta, no evidenciándose este efecto en el colon derecho, reflejo de la secuencia adenoma-carcinoma en la carcinogénesis izquierda, y una carcinogénesis de novo en el colon derecho (7). En nuestras ratas, no hubo diferencias significativas ni en el número ni en el tamaño de los tumores en el colon derecho de las ratas C respecto al grupo E. Estos hallazgos sugieren que la ausencia fecal en el colon derecho no tiene repercusiones en la carcinogénesis en dicho segmento, como parece desprenderse de los autores mencionados. Sin embargo, no coincidimos con otros estudios (6), que indican que los tumores inducidos tanto en los segmentos excluidos como en los funcionales no muestran diferencias histológicas entre sí, ya que, si bien el colon izquierdo muestra este comportamiento, el colon derecho de nuestros animales no.
Diversos estudios asocian la localización derecha de los tumores con su peor diferenciación histológica (28,51). En nuestro estudio se observó en las ratas C un mayor número de carcinomas mucinosos en el colon derecho respecto al colon izquierdo. Dicho comportamiento dejó de observarse en las ratas E, donde el predominio de los tumores del colon derecho correspondió a formas bien diferenciadas de la estirpe adenocarcinoma; comportamiento similar a la patología humana (54).
Concluimos que:
-Las características microscópicas de los tumores colónicos en ausencia fecal fueron significativamente de menor agresividad que en su presencia.
-En nuestro estudio, la ausencia fecal en el colon derecho modificó las estirpes histológicas tumorales encontradas.
-Las ratas hembras mostraron mejor rendimiento experimental con mayor resistencia frente a agresiones externas (intervenciones) y agentes químicos carcinogénicos (DMH).
![]() Dirección para correspondencia:
Dirección para correspondencia:
S. Pérez-Holanda.
Castiello, 22.
33394 Gijón.
Fax: 985 134 108.
e-mail: sergio.perez-holanda@sespa.princast.es
Recibido: 19-02-06.
Aceptado: 17-05-06.
Bibliografía
1. Greenwald P. Colon cancer overview. Cancer 1992; 70 (Supl. 5): 1206s-15s. [ Links ]
2. Rayón Suárez C. Programa de Atención al Cáncer 2005-2007. Servicio de Salud del Principado de Asturias. Servicio de Publicaciones del Principado de Asturias. Oviedo: Imprenta Narcea SL, 2005. p. 31. [ Links ]
3. Trock B, Lanza E, Greenwald P. Dietary fiber, vegetables and colon cancer: Critical review and meta-analyses of the epidemiologic evidence. J Natl Cancer Inst 1990; 82: 650-61. [ Links ]
4. Vargas PA, Alberts DS. Primary prevention of colorectal cancer through dietary modifications. Cancer 1992; 70: 1229-35. [ Links ]
5. Nigro ND, Bull AW. Experimental intestinal carcinogenesis. Br J Surg 1985; 72 (Supl. 9): S36-7. [ Links ]
6. Rubio CA, Nylander G. Further studies on the carcinogenesis of the colon of the rat with special reference to the absence of intestinal contents. Cancer 1981; 48: 951-3. [ Links ]
7. Celik C, Mittelman A, Paolini NS, Lewis D, Evans JT. Effects of 1,2-symmetrical-dimethylhydrazine on jejunocolic transposition in Sprague-Dawley rats. Cancer Res 1981; 41: 2908-11. [ Links ]
8. Rubio CA, Nylander G, Santos M. Experimental colon cancer in the absence of intestinal contents in Sprague-Dawley rats. J Natl Cancer Inst 1980; 3 (64): 569-72. [ Links ]
9. Lewin MR, Ferulano GP, Cruse JP, Clark CG. Experimental colon carcinogenesis is facilitated by endogenous factors in the intestinal contents. Carcinogenesis 1981; 2: 1363-6. [ Links ]
10. Weisburger JH. Causes, relevant mechanisms and prevention of large bowel cancer. Semin Onco 1991; 18: 316-36. [ Links ]
11. Banerjee A, Quirke P, Path FRC. Experimental models of colorectal cancer. Dis Colon Rectum 1998; 41: 490-505. [ Links ]
12. Barkla DH, Tutton PJ. Ultrastructure of 1,2-dimethylhydrazine-induced adenocarcinomas in rat colon. J Natl Cancer Inst 1978; 61: 1291-9. [ Links ]
13. Druckrey H, Preussman R, Matzkies F. Selektive Erzeugung von Darmkaebs bei Ratten durch 1,2-Dimethylhydrazin. In: Barkla DH, Tutton PJ. Ultrastructure of 1,2-dimethylhydrazine-induced adenocarcinomas in rat colon. J Natl Cancer Inst 1978; 61: 1291-9. [ Links ]
14. Pérez-Ruiz L, Gómez Quiles L. ¿Protege la colostomía proximal la anastomosis colo-cólica? Estudio experimental. Coloproctology 1993; 9 (3): 83-6. [ Links ]
15. Hardman WE, Cameron IL. Colonic crypts located over lymphoid nodules of 1,2-dimethylhydrazine-treated rats are hyperplastic and at high risk of forming adenocarcinomas. Carcinogenesis 1994; 15: 2353-61. [ Links ]
16. Zhang J, Lam LK. Colonoscopic colostomy model in rats for colon tumorigenesis studies. Carcinogenesis 1994; 15 (8): 1571-6. [ Links ]
17. Brink MA, Méndez-Sánchez N, Carey MC. Bilirubin cycles enterohepatically after ileal resection in the rat. Gastroenterol 1996; 110: 1945-57. [ Links ]
18. Heppell J, de Zubiria M, Brais MF, Durh MA, Carioto S, Boivin Y, et al. An assessment of the risk of neoplasia in long-term ileal resevoirs using the DMH-rodent model. Dis Colon Rectum 1990; 33 (1): 26-31. [ Links ]
19. Salim AS. Removing oxygen-derived free radicals delays hepatic metastases and prolongs survival in colonic cancer: A study int the rat. Oncology 1992; 49 (1): 58-62. [ Links ]
20. Noguera Aguilar JF, Tortajada Collado C, Morón Canis JM, Plaza Martínez A, Amengual Antich I, Pujol Tugores JJ. Modelo experimental para el estudio de la recidiva locorregional del cáncer colorrectal. Rev Esp Enferm Dig 2002; 94 (3): 131-8. [ Links ]
21. Chang WW. Morphological basis of multistep process in experimental colonic carcinogenesis. Virchows Arch B Cell Pathol Incl Mol Pathol 1982; 41 (1-2): 17-37. [ Links ]
22. Hupp T, Buhr HJ, Ivancovic S, Beck N. Animal experiment studies of carcinogen-induced tumour development in colostomies in relation to suture materials. Langenbecks Arch Chir 1992; 377 (1): 9-13. [ Links ]
23. Viñas Salas J, Biendicho Palau P, Piñol Felis C, Miguelsanz García S, Pérez-Holanda S. Calcium inhibits colon carcinogenesis in an experimental model in the rat. Eur J Cancer 1998; 34: 1941-5. [ Links ]
24. Buenestado García J, Reñé Espinet JM, Piñol Felis C, Viñas Salas J. Modelo experimental de cáncer colorrectal. Rev Esp Enferm Dig 2002; 94 (6): 367-71. [ Links ]
25. Buenestado García J, Piñol Felis C, Reñé Espinet JM, Pérez-Holanda S, Viñas Salas J. Silk suture promotes colon cancer in an experimental carcinogenic model. Dig Liver Dis 2002; 34 (8): 609-10. [ Links ]
26. Viñas-Salas J, Piñol Felis C, Fermiñán A, Egido R, Pérez-Holanda S, Biendicho P, et al. Traumatismos repetitivos sobre la mucosa promueven cáncer de colon en un modelo experimental en ratas. Rev Esp Enferm Dig 2001; 93 (3): 140-7. [ Links ]
27. Noguera Aguilar JF, Amengual Antich I, Plaza Martínez A, Tortajada Collado C, Morón Canis JM, Pujol Tugores JJ. Influencia de la manipulación quirúrgica del colon en la carcinogénesis cólica inducida en ratas. Rev Esp Enferm Dig 2004; 96 (5): 322-30. [ Links ]
28. Pérez-Holanda S, Rodrigo L, Viñas-Salas J, Piñol-Felis C. Efecto de la ingesta de etanol en un modelo experimental de cáncer de colon. Rev Esp Enferm Dig 2005; 97 (2): 87-96. [ Links ]
29. Glauert HP, Bennink MR. Influence of diet or intrarectal bile acid injections on colon epithelial cell proliferation in rats previously injected with 1,2-dimethylhydrazine. J Nutr 1983; 113: 475-82. [ Links ]
30. Ma Q, Hoper M, Anderson N, Rowlands BJ. Effect of supplemental L-arginine in a chemical-induced model of colorectal cancer. World J Surg 1996; 20: 1087-91. [ Links ]
31. Grau de Castro JJ, Piqué Badía JM. Cáncer colorrectal. En: Monografías clínicas en oncología. Barcelona: Ed. Doyma SA 1990; 8 (6): 63-75. [ Links ]
32. Lev R. Adenomatous polyps of the colon: Pathological and clinical features. New York: Springer-Verlach Inc; 1990; 1-2. p. 1-18. [ Links ]
33. Morvay K, Szentléleki K, Török G, Pintér A, Börzsönyi M, Nawroth R. Effect of change of faecal bile acid excretion achieved by operative procedures on 1,2-dimethylhydrazine-induced colon cancer in rats. Dis Colon Rectum 1989; 32 (10): 860-3. [ Links ]
34. Tempero MA, Zetterman RK. Effects of sodium cholate on experimental carcinogenesis and cell proliferation in an excluded colonic segment. J Surg Oncol 1987; 36 (4): 253-8. [ Links ]
35. Bristol JB, Davies PW, Williamson RCN. Subtotal jejunoileal bypass enhances experimental colorectal carcinogenesis unless weight reduction is profound. En: Malt RA, Williamson RCN. Colonic carcinogenesis. MTP Press Limited, Harvard Medical School, Boston 1982; 26: 275-81. [ Links ]
36. Kanazawa K, Mitsuoka T, Arai K, Yamamoto T, Hino Y. Amounts of intestinal microflorae in relation to colon carcinogenesis: an experimental study. Gastroenterol Jpn 1980; 15 (2): 177-83. [ Links ]
37. Winkler R, Pfeiffer M, Ayisi K, Dörner A. Spontaneous colostomy cancer in rat: a handly model of colonic carcinogenesis. En: Malt RA, Williamson RCN. Colonic carcinogenesis. MTP Press Limited. Boston: Harvard Medical School; 1982; p. 245-52. [ Links ]
38. Wakabayashi K, Nagao M, Esumi H, Sugimura T. Food-derived mutagens and carcinogens. Cancer Res. 1992; 52: 2092s-8s. [ Links ]
39. Obrador A, Benito E. Epidemiología. En: Grau JJ, Piqué JM. Monografías clínicas en Oncología: Cáncer colorrectal. Barcelona: Ed. Doyma; 1990. p. 1-11. [ Links ]
40. Cerdán FJ, Balsa T, Díez M, Martínez S, Torres-Melero J, Balibrea JL. Cáncer colorrectal: ¿Ha mejorado su diagnóstico en la última década? Rev Esp Enferm Dig 1996; 88 (1): 26-8. [ Links ]
41. López-Abente G, Pollán M, Aragonés N, Pérez Gómez B, Hernández Barrera V, Lope V, et al. State of cancer in Spain: incidence. An Sist Sanit Navar 2004; 27 (2): 165-73. [ Links ]
42. Bouché O, Faivre J. Cancers du côlon: Épidémiologie, facteurs de risque et dépistage. La lettre du cancérologue 1996 (Supl. 12): 20s-6s. [ Links ]
43. Martínez ME, Grodstein F, Giovannucci E, Colditz GA, Speizer FE, Hennekens C, et al. A prospective study of reproductive factors, oral contraceptive use, and risk of colorectal cancer. Cancer Epidemiol Biomarkers Prev 1997; 6 (1): 1-5. [ Links ]
44. Peipins LA, Newman B, Sandler RS. Reproductive history, use of exogenous hormones, and risk of colorectal adenomas. Cancer Epidemiol Biomarkers Prev 1997; 6 (9): 671-5. [ Links ]
45. Woodson K, Lanza E, Tangrea JA, Albert PS, Slattery M, Pinsky J, et al. Hormone replacement therapy and colorectal adenoma recurrent among women in the Polyp Prevention Trial. J Natl Cancer Inst 2001; 23: 1799-805. [ Links ]
46. Chung H, Wu D, Gay R, Han SN, Goldin B, Bronson R, et al. Effect of age on susceptibility to azoxymethane-induced colonic aberrant crypt foci formation in C57BL/6JNIA mice. J Gerontol A Biol Sci Med Sci 2003; 58: B400-B405. [ Links ]
47. Choi SW, Friso S, Dolnikowski GG, Bagley PJ, Edmondson AN, Smith DE, et al. Biochemical and molecular aberrations in the rat colon due to folate depletion are age-specific. J Nutr 2003; 133: 1206-12. [ Links ]
48. Xiao ZQ, Moragoda L, Jaszewski R, Hatfield JA, Fligiel SE, Majumdar AP. Aging is associated with increased proliferation and decreased apoptosis in the colonic mucosa. Mech Ageing Dev 2001; 122 (15): 1849-64. [ Links ]
49. Morson B. The polyp-cancer sequence in the large bowel. Proc R Soc Med 1974; 67: 451-7. [ Links ]
50. Sutherland LA, Bird RP. The effect of chenodeoxycholic acid on the development of aberrant crypt foci in the rat colon. Cancer Lett 1994; 76 (2-3): 101-7. [ Links ]
51. Klurfeld DM. Dietary fiber-mediated mechanisms in carcinogenesis. Cancer Res 1992; 52 (Supl. 7): 2055s-9s. [ Links ]
52. O'Brien MJ, O'Keane JC, Zauber A, Gottlieb LS, Winawer SJ. Precursors of colorectal carcinoma: Biopsy and biologic markers. Cancer 1992; 70: 1317-27. [ Links ]
53. Goldin B, Gorbach SL. Alterations in faecal microflora enzymes related to diet, age, Lactobacillus supplements, and dimethylhydrazine. Cancer 1977; 40: 2421-6. [ Links ]
54. McGarrity TJ, Peiffer LP, Colony PC. Cellular proliferation in proximal and distal rat colon during 1,2-dimethylhydrazine-induced carcinogenesis. Gastroenterology 1988; 95: 343-8. [ Links ]
55. Park HS, Goodlad RA, Wright NA. The incidence of aberrant crypt foci and colonic carcinoma in dimethylhydrazine-treated rats varies in a site-specific manner and depends on tumor histology. Cancer Res 1997; 57 (20): 4507-10. [ Links ]











 texto en
texto en