Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Española de Enfermedades Digestivas
versão impressa ISSN 1130-0108
Rev. esp. enferm. dig. vol.99 no.11 Madrid Nov. 2007
Granulocitoaféresis en la enfermedad inflamatoria intestinal. Eficacia a 32 semanas con protocolo de inducción y sesiones de mantenimiento
Granulocytapheresis in inflamatory bowel disease. Efficacy of an induction plus maintenance sessions protocol at 32 weeks
F. J. Fernández Pérez, F. Rodríguez, C. de Sola, N. Fernández Moreno, I. Méndez, F. Vera, R. Rivera y A. Sánchez Cantos
Unidad de Aparato Digestivo. Hospital Costa del Sol. Marbella
Dirección para correspondencia
RESUMEN
Introducción:
la granulocitoaféresis (GCAF) retira de la circulación granulocitos-monocitos activados, modificando el pool circulante e induciendo una reducción en la inflamación intestinal.Objetivo: valorar la eficacia de la GCAF en la enfermedad inflamatoria intestinal (EII) mediante sesiones de inducción y mantenimiento.
Material y método: análisis retrospectivo en pacientes con EII activa corticodependiente y corticorrefractaria. Aplicamos 5 sesiones de inducción en colitis ulcerosa (CU) y 7 en enfermedad de Crohn (EC) y 1 sesión mensual hasta semana 32. Evaluamos indices clínicos de actividad y empleo de corticoides.
Resultados: incluimos a 18 pacientes (10 CU, 8 EC), 10 de ellos corticodependientes y 8 corticorrefractarios. Catorce pacientes eran refractarios y 4 intolerantes a inmunosupresores (IS). No completaron la inducción 2-CU (brotes graves) y 1-EC (secundarismos). Abandonaron el mantenimiento 1-CU y 3-EC. De aquellos que completaron inducción alcanzaron respuesta o remisión el 87,5% de las CU (2 y 5 pacientes), y el 71,4% de EC (1 y 4 pacientes) respectivamente. Estos resultados a 32 semanas eran del 75% en CU (3 y 3 pacientes) y del 42,8% en EC (1 y 2 pacientes) respectivamente. De los que completaron la inducción, suprimieron corticoides el 14,2% de EC por el 62,5% de CU (25% de estas en remisión y 37,5% en respuesta). Registramos 2 secundarismos graves (tromboflebitis y síncope). Ninguna CU que completó inducción sufrió colectomía tras 97,6 (72-128) semanas de seguimiento.
Conclusiones: tanto CU como EC responden bien a inducción con GCAF pero mientras la CU mantiene tras 32 semanas tasas similares de respuesta-remisión (87,5 vs. 75%) casi 1/3 de los pacientes con EC recaen tras alcanzar respuesta. La granulocitoaféresis es una alternativa de tratamiento para inducir y mantener remision en CU, ahorrando corticoides, pero en la EC se precisa una adecuada selección de pacientes y un esquema de mantenimiento aún por definir.
Palabras clave: Granulocitoaféresis. Enfermedad inflamatoria intestinal. Enfermedad de Crohn. Colitis ulcerosa.
ABSTRACT
Introduction:
granulocytapheresis (GCAP) eliminates activated granulocytes-monocytes from peripheral blood, thus modifying the circulating pool of leukocytes and reducing intestinal inflammation.Objective: tto evaluate the efficacy of GCAP in inflammatory bowel disease (IBD) using an induction and maintenance protocol.
Material and method: a retrospective study including patients with active corticosteroid-dependent or refractory IBD. Induction included 5 sessions in ulcerative colitis (UC) and 7 sessions in Crohn´s disease (CD); one monthly session was used thereafter until week 32. Clinical activity indices and use of corticosteroids were monitored.
Results: eighteen patients were included (10 with UC, 8 with CD), 10 of them dependent on and 8 refractory to corticosteroids. Fourteen of them were refractory and a further 4 were intolerant to immunosuppressants (IS). Induction was not completed in 2 UC (severe relapses) and 1 CD (side-effects) patients. One UC and 3 CD patients withdrew during maintenance. Among patients who completed induction, response or remission was achieved in 87.5% of UC cases (2 and 5 patients) and 71.4% of CD cases (1 and 4 patients), respectively. At week 32 response-remission rates reached 75% in CU (3 and 3 patients) and 42.8% in CD (1 and 2 patients) cases, respectively. Corticosteroid withdrawal was possible in 14.2% of CD and in 62.5% of UC patients (25% in remission and 37.5% with response). There were two major side effects (thrombophlebitis and syncope). No colectomies were performed for UC patients who completed GCAP induction after a mean follow-up of 97.6 weeks (range: 72-128).
Conclusions: both UC and CD respond well to GCAP induction. At 32 weeks UC patients maintain similar response-remission rates (87.5 vs. 75%), whereas almost one-third of CD patients loose response. Granolocytapheresis is an alternative, steroid-sparing treatment modality to induce and maintain remission in UC, while good patient selection and a maintenance protocol not well defined yet are needed for CD.
Key words: Granulocytoapheresis. Inflammatory bowel disease. Crohn's disease. Ulcerative colitis.
Introducción
En la actualidad disponemos de diversas modalidades terapéuticas para el control de la actividad inflamatoria de pacientes con enfermedad inflamatoria intestinal (EII). Dichos tratamientos pretenden inducir la remisión de la enfermedad y mantenerla a largo plazo. Con los diversos recursos farmacológicos hoy disponibles (aminosalicilatos, probióticos, prebióticos, antibióticos, corticoides, inmunosupresores y agentes biológicos) se logra un buen control de la enfermedad en un porcentaje amplio de pacientes. No obstante casi la tercera parte de los pacientes con colitis ulcerosa (CU) y algo más de la mitad de los afectos de enfermedad de Crohn (EC) deben ser sometidos a cirugía por mal control médico.
Recientemente se ha incorporado la granulocitoaféresis (GCAF) al arsenal terapéutico disponible en la EII. Consiste en un dispositivo que recibe sangre del paciente y que, antes de serle nuevamente infundida, se hace pasar a través de una membrana de acetato de celulosa que adhiere granulocitos y monocitos del pool circulante del paciente, y que así son retirados de la circulación. De esta manera se estimula la incorporación al torrente circulatorio de leucocitos y monocitos no activados procedentes de la médula ósea, lo que parece reducir la densidad de leucocitos activados y citoquinas en la pared intestinal, mejorando la inflamación. La experiencia disponible es aún escasa, si bien parece que la GCAF es eficaz en inducir la remisión y ahorrar corticoides tanto en CU como en EC, aunque es en el mantenimiento de la remisión donde más necesidad hay de perfilar estrategias de tratamiento.
Objetivos
Determinar la eficacia de la GCAF en inducir y mantener la remisión clínica en un grupo de pacientes con EII (CU, EC) que habían seguido un protocolo de inducción y sesiones de mantenimiento.
Material y método
Valoramos de forma retrospectiva desde septiembre de 2004 a marzo de 2006 los resultados de la aplicación de sesiones de granulocitoaféresis (GCAF) sobre un grupo de pacientes de nuestro centro con EII activa corticodependiente o corticorrefractaria y que habían presentado refractariedad o efectos adversos al uso de inmunosupresores. Nuestro protocolo aplicaba sesiones de inducción y 6 sesiones mensuales de mantenimiento, siendo valorados los resultados de la inducción en semana 8 y los del mantenimiento en semana 32 (4 semanas después de finalizar la inducción y 4 semanas tras la última sesión de mantenimiento, respectivamente). La inducción incluía 5 sesiones de aféresis en 5 semanas para los pacientes con CU (una sesión por semana) y 7 sesiones en 5 semanas (dos sesiones semanales las dos primeras semanas y una semanal las tres siguientes) en pacientes con EC. Cada sesión de aféresis consistía en un volumen de filtrado de 1.800 ml de sangre con velocidad de bombeo de 30 ml/minuto mediante sendos abordajes venosos antecubitales (con catéteres intravasculares 18G) o, en caso de imposibilidad a vías periféricas, mediante catéter central tipo Hickmann de doble luz. Cada sesión de GCAF se programó para un tiempo de 60 minutos y en régimen de hospital de día. Empleamos filtros de acetato de celulosa (Adacolumn®, Otsuka Pharmaceuticals. Japan Inmunoresearch Laboratories, Takasaki, Japan).
La actividad clínica de los pacientes fue valorada mediante el índice clínico de Truelove-Witts modificado (TW) para los pacientes con CU y mediante el Crohn's Disease Activity Index (CDAI) para los pacientes con EC. Consideramos remisión clínica en la CU con valores de TW de 6 puntos y en la EC con CDAI < 150 puntos, siendo considerada respuesta clínica una caida en la puntuación del TW ≥ 3 puntos respecto de la situación basal o una caída del CDAI ≥ 100 puntos.
Consideramos reducción significativa de la dosis de corticoides en cada uno de los momentos de valoración (8 y 32 semanas) si estos habían sido reducidos en al menos un 50% de la dosis previa a la GCAF, siendo la pauta de reducción de corticoides dependiente en cada caso de las necesidades clínicas de cada paciente.
El análisis estadístico se ha llevado a cabo mediante estadística descriptiva teniendo en cuenta lo reducido de la muestra, siendo empleado el test de t-Student para comparación de variables cuantitativas, emplendo el paquete estadístico SPSS 12.0.
Resultados
Incluimos a 18 pacientes (10 hombres, 8 mujeres) con edad media de 36 años (rango 18-72). El tipo de EII fue CU en 10 pacientes y EC en 8 pacientes. Las características de los pacientes incluidos se refieren en la
tabla I.Cinco de los 10 pacientes con CU eran corticodependientes, siendo los 5 restantes refractarios a corticoides. Ocho pacientes mostraban refractariedad a inmunosupresores (80%), y otros 2 habían presentado intolerancia o efectos adversos a los inmunosupresores empleados, obligando a su suspensión (20%). Respecto de la topografía lesional, seis pacientes tenían pancolitis (60%), dos pacientes colitis izquierdas (20%), uno con cuffitis (10%) y uno con proctitis (10%). El índice de TW al inicio de la GCAF era de 10 puntos (rango: 8-13).
Cinco de los 8 pacientes con EC eran corticodependientes y los otros 3 corticorrefractarios. De ellos 6 eran refractarios a inmunosupresores (75%), habiendo presentando efectos adversos o intolerancia a inmunosupresores otros 2 pacientes (25%). Respecto del tipo de EC, seis presentaban un patrón mixto inflamatorio-fistulizante (75%) por 2 con patrón inflamatorio puro (25%). De los pacientes con patrón mixto, dos presentaban fístulas perianales activas al momento de iniciarse las sesiones de GCAF. Cuatro de los 8 pacientes con EC habían presentado abscesos intraabdominales resueltos con anterioridad al inicio de las aféresis. Un paciente con patrón inflamatorio puro presentaba un pyoderma gangrenoso periileostomía refractario a corticoides, azatioprina, infliximab y tacrólimus, y en el que decidimos probar con CGAF. El valor del CDAI al inicio del tratamiento con GCAF era de 206,63 puntos (rango: 161-305), mostrando todos los pacientes con EC cifras de CDAI superiores a 150 puntos al inicio del tratamiento.
Salvo en una paciente con EC en que por falta de accesos venosos periféricos hubo de emplearse un catéter central tipo Hickmann, todos los demás pacientes tratados lo fueron a través de accesos venosos periféricos. En algunos pacientes hubo de reducirse el flujo del Adamonitor a 20 ml/min, para lograr completar el prodecimiento, lo que prolongó discretamente el tiempo de dichas sesiones de aféresis. De esta forma lograron completar el ciclo de inducción 7 de los 8 pacientes con EC (87,5%) y 8 de los 10 pacientes con CU (80%). Las causas de no poder completar el ciclo de inducción fueron efectos adversos serios en un paciente con EC (cefalea intensa seguida de síncope vasovagal tras cada una de las dos sesiones de aféresis realizadas, la segunda con premedicación) y brotes graves intratratamiento en dos pacientes con CU-pancolitis que habían precisado con anterioridad uso de ciclosporina-A para control de brotes y que estaban en tratamiento con azatioprina, siendo ambos sometidos a colectomía.
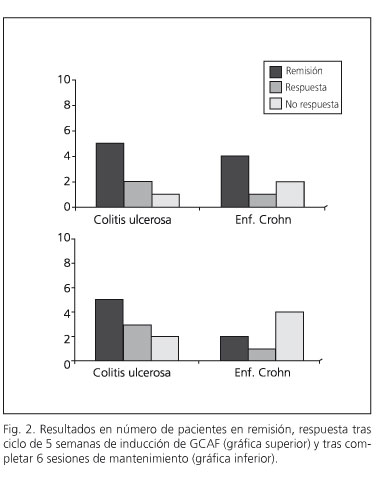
De los 7 pacientes con EC que completaron el ciclo de inducción y que iniciaron los mantenimientos, dos de ellos abandonaron el protocolo. Uno de ellos por ineficacia (el paciente afecto del pyoderma refractario) y otro por presentar una tromboflebitis séptica de vena yugular común y subclavia secundarias al acceso venoso central (en la paciente portadora de Hickmann). En el caso de los pacientes con CU que completaron la inducción, todos completaron las sesiones de mantenimiento (
Fig. 1).A las 4 semanas de finalizar el ciclo de inducción (semana 8) realizamos la valoración post-inducción respecto de la actividad clínica y dosis necesaria de fármacos en relación a los empleados antes de iniciar la GCAF. De forma similar valoramos los resultados tras completar las seis sesiones de mantenimiento en la semana 32. Consideramos valorables los pacientes que habían logrado completar al menos el ciclo de inducción.
De los 8 pacientes con CU que completaron las 5 sesiones de inducción, cinco de ellos (62,5%) se encontraban en remisión clínica (TW 6 puntos), por otros dos que habían experimentado respuesta (25%), siendo sólo un paciente el que no presentó respuesta (12,5%). Por ello habría que considerar respuesta-remisión en 7 de los 8 pacientes (87,5%). La puntuación del índice de Truelove-Witts modificado al final del ciclo de inducción fue de 7 (rango: 6-11). De las 5 CU en remisión tras el ciclo de inducción, tres habían reducido la dosis de corticoides, un paciente pudo suspenderlos y otro mantenía una dosis similar. De las dos CU en respuesta tras el ciclo de inducción, ambas habían reducido la dosis de corticoides.
Al final del periodo de mantenimiento, en la semana 32, tres pacientes con CU se encontraban en remisión (37,5% de las CU que completaron la inducción, 30% de todas las CU en intención de tratar) y otros 3 pacientes se encontraban en respuesta clínica (37,5% de las CU que completaron el ciclo de inducción), mientras que un paciente había experimentado un rebrote leve-moderado intratratamiento (12,5% de los que completaron la inducción, 10% del total de CU sometidas a GCAF) que respondió a pulso de corticoides. El que tenía una cuffitis recidivó a final de protocolo y optamos por infliximab (10% del total). Ello nos da una tasa de respuesta-remisión a 32 semanas del 75% (60% de las CU incluidas con intención de tratar). La puntuación del TW modificado en semana 32 era de 6,8 (6-9). Respecto del ahorro de corticoides, cinco pacientes estaban a 6 meses sin corticoides (62,5% de las CU que finalizaron la inducción, 50% del total de CU en intención de tratar) y un paciente mantenía dosis inferiores a la de inicio sin haber podido suspenderlos.
De los 8 pacientes con EC a los que aplicamos GCAF, 7 completaron el ciclo de inducción (87,5%), debiendo ser suspendido el procedimiento en un paciente por efecto adverso grave (síncope vasovagal). De los 7 pacientes con EC que completaron las 7 sesiones de inducción en 5 semanas, 4 se encontraban en remisión (57,1%) y 1 en respuesta (14,3%), mientras que los restantes dos pacientes no habían obtenido respuesta (28,6%). Pese a que al final del periodo de inducción ningún paciente estaba sin corticoides, cinco habían logrado reducir la dosis respecto de la previa a las sesiones de GCAF (71,4%) mientras que 2 mantenían una dosis similar (28,6%).
De los 7 pacientes con EC que completaron la inducción sólo 4 completaron las seis sesiones de retratamiento (57% de los que completaron inducción, 50% de las EC con intención de tratar). Los 3 restantes (43%) abandonaron el protocolo por efecto adverso grave en un caso (tromboflebitis) y por ineficacia en dos. En la semana 32 y refiriéndonos a los que finalizaron los retratamientos, 2 de ellos se encontraban en remisión (28,6% de las EC que completaron ciclo de inducción, 25% del total de pacientes con EC en intención de tratar) y 1 paciente en repuesta (14,3% de las EC que completaron inducción, 12,5% de las EC en intención de tratar). En el paciente en el que tras completar las sesiones de retratamiento no se alcanzó respuesta o remisión, se decidió tratamiento con infliximab. El valor medio del CDAI tras la las sesiones de mantenimiento fue de 153,75 (rango: 70-250). Con relación al uso de corticoides, al final del protocolo sólo 1 paciente se mantenía sin corticoides (14,3% de los que completaron la inducción, 12,5% de los pacientes con EC con intención de tratar). De los restantes uno había logrado reducir la dosis previa a la GCAF pero no suspenderlos (14,3% de los que completaron inducción) y los dos restantes habían tenido que mantener o aumentar la dosis de corticoides pese a la GCAF (28,6% de los que completaron la inducción, 25% de los pacientes con EC con intención de tratar), datos estos reflejados en las figuras
1, 2 y 3.Cuando valoramos los cambios experimentados en los niveles de proteína C reactiva (PCR) en pacientes con EC o CU sometidos a sesiones de GCAF, comprobamos ausencia de cambios estadísticamente significativos en la PCR de pacientes con EC (basal: 1,82 ± 1,41; semana 8: 1,72 ± 1,7; semana 32: 2,4 ± 2,15; p = ns, t-Student) pero un descenso significativo de la PCR en los pacientes con CU (basal: 2,51 ± 2,43; semana 8:1,48 ± 1,42; semana 32: 1,2 ± 1,17; p < 0,05, t-Student), como refleja la
figura 4. Respecto de los niveles de leucocitos y granulocitos de sangre periférica, no apreciamos cambios significativos tras las repetidas sesiones de GCAF respecto de sus valores basales (EC-basal 9,84.103 ± 3,45.103/mcl; EC-8 semanas: 9,75.103 ± 2,97.103/mcl; EC-32 semanas: 9,52.103 ± 3,12.103/mcl. CU-basal: 6,91.103 ± 1,91.103/mcl; CU-8 semanas: 7,66.103 ± 3,15.103/mcl; CU-32 semanas: 8,48.103 ± 3,02.103/mcl).En cuanto a lo que se refiere a la seguridad del procedimiento, la mayoría de los pacientes no presentaron ningún efecto adverso (61%). Cinco pacientes refirieron cefalea de carácter transitorio (27%), y tan sólo dos pacientes presentaron un efecto adverso serio (11% del total de pacientes), consistentes en síncope vasovagal en un paciente y tromboflebits séptica en otro paciente portador de catéter central.
Respecto de la necesidad de cirugía, sólo dos pacientes con CU requirieron colectomía (los dos pacientes con CU que presentaron un brote grave durante el ciclo de inducción), lo que representa el 20% de las CU con intención de tratar. De los pacientes con CU o EC que completaron la inducción ninguno requirió colectomía en un seguimiento medio de 97,6 semanas (rango: 72-128).
Discusión
En la enfermedad inflamatoria intestinal se detectan en sangre niveles elevados de inmunocomplejos, proteínas proinflamatorias y células blancas que parecen jugar un importante papel en la iniciación y perpetuación de los fenómenos inflamatorios de la pared intestinal (1-4), fenómenos que parecen depender de una susceptibilidad genética individual y de una compleja y no totalmente aclarada interacción con la flora intestinal del sujeto, con ruptura de la tolerancia inmunológica y cronificación de la respuesta inflamatoria local (5,6).
Los diversos fármacos que empleamos actualmente en el tratamiento de la EII pretenden modificar la respuesta inflamatoria mediante bloqueo a diversos niveles de los mecanismos celulares y moleculares de la cascada de la inflamación (7). Con este mismo objetivo se han comenzado a aplicar técnicas de aféresis selectiva de células sanguíneas (citoaféresis), que permiten retirar de la circulación leucocitos activados y reducir así el aflujo de estos a la pared intestinal.
De entre las diversas técnicas aferéticas, la granulocitoaféresis (GCAF) extrae de la sangre venosa hasta un 65% de los granulocitos y un 58% de los monocitos-macrófagos al hacerla pasar a través del filtro de acetato de celulosa mediante un circuito extracorpóreo accionado por una bomba. Aunque su mecanismo de acción no está totalmente dilucidado, se argumenta que la adsorción de los granulocitos y macrófagos-monocitos al filtro se logra a través de la activación del complemento en presencia de calcio y de inmunoglobulina G, lo que determinaría la producción de factores antiinflamatorios (IL-1ra), modificación de la expresión de proteínas de superficie leucocitarias que dificultan su migración al tejido y, por consiguiente, la reducción de la densidad leucocitaria intestinal y de la liberación local de citoquinas proinflamatorias (8,9).
La información disponible sobre la eficacia de la GCAF en la EII es aún escasa. Así en la CU corticodependiente Shimoyama y cols. (10) trataron a 52 pacientes con 10 sesiones y pauta decreciente de corticoides frente a otros 52 pacientes con ascenso de las dosis de corticoides, logrando al finalizar la inducción tasas de remisión-respuesta del 58,5% en el primer grupo frente al 44,2% del segundo grupo (p < 0,05). En nuestro país, Doménech y cols. realizaron un estudio multicéntrico prospectivo incluyendo a 14 pacientes con CU corticodependiente a los que al inicio de las sesiones de GCAF (5 sesiones en 5 semanas) se administraba una dosis inicial de 60 mg de prednisona con reducción semanal de 10 mg de la dosis de corticoides, comprobando una remisión clínica en el 60% de los pacientes a 6 semanas con reducción en la dosis de esteroides en el 90% y mantenimiento de la remisión en el 75% de los respondedores tras 12,6 meses de seguimiento (11). En CU corticorrefractaria merece la pena comentar el estudio más amplio en cuanto a pacientes, llevado a cabo por Hanai y cols. con 31 pacientes que se sometieron hasta a 11 sesiones de aféresis en 11 semanas, con una tasa de remisión a semana 12 del 81%, manteniéndose en remisión a los 12 meses el 79% (12). En CU naïve para corticoides Yamamoto y cols. trataron a 30 colitis izquierdas o proctosigmoiditis con 5 sesiones de aféresis y 5-ASA oral con una remisión clínica del 70% a 6 semanas (13). En el estudio de Suzuki y cols. 20 pacientes con CU moderada-grave no respondedores a 5-ASA fueron tratados con 6-10 sesiones de GCAF con 85% de remisión clínica inicial y mantenida en el 50% tras 8 meses (14). Una reciente publicación europea de Ljung y cols. (15) sobre 100 pacientes de 24 centros escandinavos, 52 de ellos con CU corticodependiente o corticorrefractaria y con esquema de 5 sesiones y retratamientos discrecionales, lograban a 4 semanas tras la última sesión de aféresis de inducción una respuesta-remisión del 75%.
En nuestro centro no hemos tratado pacientes con CU naïve para corticoides pero sí pacientes corticodependientes y corticorrefractarios, buena parte de los cuales habían requerido numerosos fármacos para lograr el control clínico de su EII a lo largo de la evolución de su enfermedad, y que al inicio del tratamiento con GCAF se encontraban con enfermedad clínicamente activa (Tabla I). Así de las CU tratadas mediante GCAF por nosotros, cinco eran corticodependientes (4 de ellas refractarias a IS) por otras 5 corticorrefractarias (2 de ellas refractarias a IS). Tras completar el ciclo de inducción cinco CU estaban en remisión en semana 8 (2 CU-corticodependientes y 3 CU-corticorrefractarias), mientras que en la semana 32, y tras 6 sesiones de mantenimiento, eran 3 las CU en remisión (1 CU dependiente de corticoides y 2 CU corticorrefractarias). La tasa de remisión en CU a 8 semanas fue del 62,5%, por 37,5% a 32 semanas, lo que viene a decir que el 60% de los pacientes en remisión en semana 8 se mantenían en remisión en semana 32. Cuando analizamos estos datos según la corticodependencia o corticorrefractariedad, resulta que a 8 semanas todos los pacientes con CU corticorrefractaria que habían completado la inducción (3/3) estaban en remisión, y de ellos 2/3 mantenían remisión a las 32 semanas. En el caso de las CU corticodependientes, a las 8 semanas 2/5 estaban en remisión (40% de estos), y sólo 1/5 a 32 semanas (20% de los corticodependientes). Aún así, teniendo en cuenta el carácter retrospectivo de nuestro trabajo y lo limitado del número de pacientes tratados, no podemos afirmar que las CU corticorrefractarias respondan mejor si se logra completar el ciclo de inducción inicial, pues además son precisamente estos pacientes los que en nuestra serie han precisado cirugía por brote grave intratratamiento (dos casos durante la inducción, uno en mantenimiento). Con todo nuestra serie muestra tasas de remisión tras el ciclo de inducción similares a las descritas en el estudio multicéntrico español (Doménech y cols.) y, considerando respuesta-remisión, discretamente superiores a las del trabajo de Ljung y cols. No obstante a 32 semanas de seguimiento sólo el 60% de las CU en remisión en semana 8 permanecen en remisión aún con tratamiento de mantenimiento mensual, cifras similares a las proporcionadas por el estudio multicéntrico escandinavo a 36 semanas. Teniendo además en cuenta que de que las 2 CU que tras la inducción lograron respuesta clínica (uno corticodependiente, otro corticorrefractario, ambos refractarios a IS) ninguna alcanzó remisión pese a los mantenimientos (aunque sí pudieron suspender ambos los corticoides) y que un paciente con CU que no respondió a la inducción (corticodependiente y refractario a IS) experimentó un brote grave en retirada de corticoides durante el mantenimiento; po-dríamos decir al comparar con los resultados de otros grupos que las sesiones de mantenimiento no ofrecen ventajas sobre la inducción sola en CU.
Respecto de la EC, los trabajos publicados son escasos y la mayoría incluye a un reducido número de pacientes. El trabajo que incluye a un mayor número de pacientes con EC es el de Ljung y cols., con 44 pacientes tratados, y de los cuales un 64% (28/44) alcanzan respuesta-remisión a las 4 semanas de finalizar un ciclo de 5 sesiones de aféresis. De estos, 7 pacientes recibieron ciclos de retratamiento, siendo la tasa de remisión a 36 semanas cercana al 30% de los que lograron remisión inical. En nuestro país, Doménech y cols. realizaron 5 sesiones en 10 pacientes con EC corticodependiente en paralelo con dosis de inicio de metilprednisolona de 60 mg/día y reducción paulatina de la dosis hasta su supresión, logrando remisión clínica en 7 pacientes aunque tras un año de seguimiento sólo 1 paciente mantenía la remisión (11). Cuenca y cols. trataron a 3 pacientes refractarios a corticoides e inmunosupresores convencionales mediante 5 sesiones y sesiones de mantenimiento, logrando mantenerles en remisión al año y habiendo reducido la dosis de esteroides (16). En forma de abstract Petermann y cols. trata a 8 pacientes con 9 sesiones en 6 semanas, logrando remisión en la mitad de los pacientes, 3 de ellos manteniendo remisión y sin corticoides a 4 meses. El trabajo de Matsui y cols. sobre 7 pacientes con EC refractaria a tratamiento convencional con 5-6 sesiones de GCAF logra la remisión en 5 de 7 pacientes, apuntando que la localización colónica y el corto tiempo de evolución de la enfermedad se asociaban a mejor respuesta (17).
De los 8 pacientes con EC tratados por nosotros, 5/8 eran corticodependientes por 3/8 corticorrefractarios. De ellos 6/8 eran refractarios a inmunosupresores y 2/8 ha-bían presentado efectos adversos a IS que obligaron a suspenderlos. De los que lograron finalizar la inducción, 4/7 EC estaban en remisión en semana 8 (57,1% de este grupo, 50% del grupo con intención de tratar). A la semana 32 el 50% de los que lograron la remisión en semana 8 la mantenían (2/7), lo que supone el 28,6% de los pacientes que completaron el ciclo de inducción (20% de los pacientes incluidos con intención de tratar). En nuestra serie observamos que ocurre en la EC lo contrario que en la CU, pues se logra obtener remisión más en los sujetos corticodependientes que en los corticorrefractarios. Así en la semana 8 tres pacientes con EC corticodependientes por 1 EC corticorrefractaria se encontraban en remisión (60% de las EC corticodependientes y el 50% de las EC corticorrefractarias), mientras que en semana 32 el paciente con EC corticorrefractaria había perdido la remisión y la mantenían 2 de los 3 corticodependientes que la lograron en la semana 8. Pese a lo reducido del grupo de pacientes tratados que impide sacar conclusiones sólidas, nuestros resultados son equiparables a los de los trabajos publicados en cuanto a remisión tras inducción pero difieren en cuanto a tasas de remisión a medio plazo, alcanzando discretos mejores resultados a expensas de sesiones de mantenimiento mensuales. Con todo, los resultados se nos antojan pobres en el medio plazo, a lo que consideramos pueda haber contribuido lo heterogéneo del grupo tratado.
En cuanto al ahorro de corticoides al final del seguimiento y considerando aquellos pacientes que completaron el ciclo de inducción, sólo un paciente con EC en remisión logró suspender corticoides (14,2%), resultados que nos parecen insatisfactorios. Por el contrario, el porcentaje de pacientes con CU que lograron suspender los corticoides alcanzó el 62,5%, reflejando un claro beneficio de la GCAF en cuanto al ahorro de corticoides en este grupo de pacientes, en la línea de los resultados proporcionados por otros grupos.
Respecto del perfil de seguridad del procedimiento, en consonancia con lo comunicado por otros grupos, consideramos que la GCAF es un procedimiento seguro (18). En nuestra experiencia el 88% de los pacientes o no presentaron efecto adverso alguno o estos fueron leves (cefalea leve y transitoria). Tan sólo hemos consignado dos efectos adversos serios en sendos pacientes (11,1% del total de pacientes): uno por complicaciones inherentes al catéter central (tromboflebitis séptica de subclavia yugular común) y en otro paciente con antecedentes de jaqueca un cuadro sincopal vasovagal por cefalea intensa que se volvió a repetir en una segunda sesión pese a premedicación con analgésicos y ansiolíticos. No obstante su importancia, creemos que deben ponerse en relación con el total de las sesiones de aféresis practicadas, en total 175 sesiones, lo que supone que los efectos adversos graves descritos suponen el 1,7% de todas las sesiones llevadas a cabo.
Consideramos que nuestros resultados deben ser contemplados con la necesaria perspectiva que ofrece la severidad de la EII de la mayoría de los pacientes sometidos a GCAF, como deja entrever la medicación que había sido preciso emplear en buena parte de ellos para control clínico de brotes previos de su enfermedad. Así, siete de las 10 CU incluidas habían requerido en alguna ocasión tratamiento con ciclosporina A o tacrólimus, mientras que la mayoría de los pacientes con EC tratados por nosotros lo fueron con un patrón mixto de enfermedad (6/8 con patrón inflamatorio-fistulizante, 6/8 con tratamientos previos con infliximab), lo que a priori hacía preveer pobres resultados en cuanto a respuesta clínica, como otros autores han apuntado (19). A todos ellos se les planteó la GCAF ante la falta de mejores opciones terapéuticas (téngase en cuenta que, por ejemplo, el tratamiento de las CU con infliximab aún no había sido autorizado en nuestro país a fecha de inclusión de nuestros pacientes en sesiones de GCAF). Con todo, y pese al carácter retrospectivo de este trabajo, creemos que es una serie representativa pues aunque la mayoría de los pacientes incluidos iniciaron las sesiones de GCAF con anterioridad a la publicación del texto de Cabriada y cols., en el que se plasma el consenso español respecto de las recomendaciones de uso de la GCAF en la EII, todos los pacientes tratados por nosotros se adecuan con exactitud a lo recomendado en dicho documento como pacientes candidatos a sesiones de granulocitoaféresis.
En conclusión consideramos que la granulocitoaféresis es un novedoso procedimiento terapéutico aplicable en pacientes con CU y EC con escasos secundarismos asociados y que puede ofrecer un beneficio en el control clínico de la enfermedad permitiendo además el ahorro de corticoides. La GCAF parece ser más efectiva en la CU que en la EC. Así, nuestros resultados a 32 semanas son similares en respuesta-remisión a lo descrito en otros estudios donde no se ha aplicado mantenimiento, lo que podría indicar que las sesiones de mantenimiento en la CU pueden ser innecesarias, pese a lo cual consideramos necesario particularizar en casos concretos. Respecto de la EC parece imprescindible una adecuada selección de los pacientes candidatos a este tratamiento, posiblemente pacientes con un patrón inflamatorio puro puedan responder mejor, y muy probablemente requiriendo un esquema de mantenimiento frecuente para mantener la remisión a medio-largo plazo, aún por definir en futuros estudios.
Bibliografía
1.Mahida YR. The key roleof macrophages in the immunopathogenesis of inflammatory bowel disease. Inflamm Bowel Dis 2000: 6; 21-33. [ Links ]
2.Rugtveit J, Brandtzaeg P, Halstensen TS, et al. Increased macrophage subset in inflammatory bowel disease: Apparent recruitment from peripheral blood monocytes. Gut 1994; 35: 669-74. [ Links ]
3.Nikolaus S, Bauditz J, Gionchetti P, et al. Increased secretion of pro-inflammatory cytokines by circulating polymorphonuclear neutrophils and regulation by interleukin 10 during intestinal inflammation. Gut 1998; 42: 470-6. [ Links ]
4.Papadakis KA, Targan SR. Role of cytokines in the pathogenesis of inflammatory bowel disease. Annu Rev Med 2000; 51: 289-98. [ Links ]
5.Loftus EV Jr. Clinical epidemiology of inflammatory bowel disease: Incidence, prevalence and environmental influences. Gastroenterology 2004; 126: 1504-17. [ Links ]
6.Hanauer SB. Inflammatory bowel disease: Pathogenesis and theraputic opportunities. Inflamm Bowel Dis 2006: S3-S9. [ Links ]
7.Solem CA, Loftus EV Jr. Management of refractory inflammatory bowel disease. Gastroenterol Clin North Am 2004; 33: 319-34. [ Links ]
8.Yamaji K, Tsuda H, Hashimoto H. Current topics on cytapheresis technologies. Ther Apher 2001; 5: 287-92. [ Links ]
9.Sandborn WJ. Preliminary data on the use of apheresis in inflammatory bowel disease. Inflamm Bowel Dis 2006; 12: S15-S21. [ Links ]
10.Shimoyama T, Sawada K, Hiwatashi N, et al. Safety and efficacy of granulocyte and monocyte apheresis versus prednisolone in patients with active ulcerative colitis: A multicenter study. J Clin Apheesis 2001; 16: 1-9. [ Links ]
11.Doménech E, Hinojosa J, Esteve-Comas M, et al. Granulocytoapheresis in steroid-dependent inflammatory bowel disease: A prospective, open, pilot study. Aliment Pharmacol Ther 2004; 20: 1347-52. [ Links ]
12.Hanai H, Watanabe F, Takeuchi K, et al. Leukocyteadsrptive apheresis for the treatment of active ulcerative colitis: A prospective uncontrolled, pilot study. Clin Gastroenterol Hepatol 2003; 1: 28-35. [ Links ]
13.Yamamoto T, Umegae S, Kitagawa T, et al. Granulocyte and monocyte adsorptive apheresis in the treatment of active distal ulcerative colitis. A prospective pilot study. Aliment Pharmacol Ther 2004; 20: 783-92. [ Links ]
14.SuzukiY, Yoshimura N, Saniabadi AR, et al. Selective granulocyte and monocyte adsorptive apheresis as first-line treatment for steroid naïve patients with active ulcerative colitis: A prospective uncontrolled study. Dig Dis Sci 2004; 49: 565-71. [ Links ]
15.Ljung T, Thomsen O, Vatn M, et al. Granulocyte, monocyte/macrophage apheresis for inflammatory bowel disease: The first 100 patients treated in Scandinavia. Scand J Gastroenterol 2007; 42: 221-7. [ Links ]
16.Cuenca F, García PJ, Mendoza JL, et al. Experiencia con la granulocitoaféresis en la enfermedad de Crohn. Rev Esp Enferm Dig 2004; 96: 501-6. [ Links ]
17.Matsui T, Nitshimute T, Mateke H, et al. Granulocytapheresis for Crohns disease: A report on seven refractory patients. Am J Gastroenterol 2003; 98: 511-2. [ Links ]
18.Nagase K, Sawada K, Ohnishi K, et al. Complications of leukocytapheresis. Ther Apher 1998; 2: 120-4. [ Links ]
19.Cabriada JL, Doménech E, Gomollón F, et al. Documento de consenso en el uso de la granulocitoaféresis en pacientes con enfermedad inflamatoria intestinal. Gastroenterol Hepatol 2006; 29 (2): 85-92. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Francisco José Fernández Pérez.
Unidad de Aparato Digestivo. Hospital Costa del Sol.
Ctra. Nacional 340, km 187. 29600 Marbella, Málaga.
Fax. 952 861 707
e-mail: pacof@hcs.es
Recibido: 22-02-07.
Aceptado: 02-08-07.