Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.100 no.2 Madrid feb. 2008
Papel de la ecoendoscopia en el estudio etiológico de la pancreatitis aguda idiopática
The role of endoscopic ultrasonography in the etiological evaluation of idiopathic acute pancreatitis
J. J. Vila, F. Borda y F. J. Jiménez
Servicio de Aparato Digestivo. Hospital de Navarra. Pamplona
Dirección para correspondencia
RESUMEN
Hasta el 30% de los pacientes con pancreatitis aguda son diagnosticados de una pancreatitis aguda idiopática tras un estudio inicial que debe incluir una anamnesis completa, exploración física, análisis con determinación de calcio y triglicéridos y al menos una ecografía abdominal. Esta situación representa un reto diagnóstico, aunque en la mayoría de los casos se encuentra una causa que justifique la pancreatitis tras realizar diferentes exploraciones diagnósticas. En los últimos años la ecoendoscopia está demostrando ser de gran utilidad en el estudio de estos pacientes, produciendo a cambio una baja morbilidad. En este artículo hacemos una revisión del papel de la ecoendoscopia en el estudio etiológico de la pancreatitis aguda idiopática.
Palabras clave:Ultrasonografía endoscópica. Pancreatitis. Etiología.
ABSTRACT
Up to 30% of patients with acute pancreatitis are diagnosed of idiopathic acute pancreatitis after an initial evaluation including a complete clinical history, physical examination, analysis with calcium and triglycerides determination, and at least one transabdominal ultrasonography. Unexplained pancreatitis represents a diagnostic challenge, although after different explorations a cause is found in the majority of these patients. During the last years endosonography has proved to be a low morbidity exploration very useful in the evaluation of patients with this entity. In this article we review the role of endosonography in the etiologic study of patients with idiopathic acute pancreatitis.
Key words: Endosonography. Pancreatitis. Etiology.
Introducción
En el estudio inicial de una pancreatitis aguda se descubre la causa en el 70-90% de los casos. Este estudio inicial debe incluir: historia clínica detallada incluyendo procesos infecciosos, traumatismos abdominales o cirugía recientes; antecedentes de ingesta enólica, ingesta de fármacos y enfermedades sistémicas. Además deben ser valorados los antecedentes familiares de pancreatopatía; análisis con determinación de niveles séricos de calcio y triglicéridos, y al menos una ecografía abdominal que descarte la existencia de litiasis en el árbol biliar. En nuestro servicio realizamos al menos dos ecografías abdominales si en la primera no se identifica litiasis biliar. Cuando tras este estudio inicial no encontramos la causa de la pancreatitis, hablamos de pancreatitis aguda idiopática (PAI), que es el tercer grupo etiológico más frecuente en la mayoría de las series tras la pancreatitis biliar y enólica (1,2).
Sin embargo, el hecho de diagnosticar o no la causa de la pancreatitis en pacientes con PAI depende de hasta dónde lleguemos en el estudio diagnóstico. Realizando determinadas exploraciones diagnósticas como un estudio microscópico biliar (EMB), una ecoendoscopia (USE), una colangiografía por resonancia magnética (CRNM) o una colangiopancreatografía retrógrada endoscópica (CPRE) podremos diagnosticar la causa de la pancreatitis en hasta el 90% de los casos de PAI.
La estrategia de estudio que seguimos en nuestro servicio ante un cuadro de PAI consiste en realizar una USE como primera exploración. Para ello nos basamos en el rendimiento diagnóstico que ha demostrado la USE en estos pacientes en diferentes estudios (3-5), además de su baja tasa de complicaciones a pesar de tratarse de una exploración invasiva.
El objetivo de este artículo es realizar una revisión del papel de la USE en el estudio de los pacientes con PAI, teniendo en cuenta las diferentes etiologías implicadas. Previamente repasaremos las causas que pueden estar implicadas en una PAI, y que se descubren tras profundizar en el estudio etiológico. Por otro lado, evaluamos los datos disponibles en la literatura acerca de la influencia de determinadas condiciones de los pacientes con PAI en el rendimiento diagnóstico de la USE.
Causas de PAI
Es importante identificar la causa de una PAI, dado que el hecho de no actuar sobre la misma puede favorecer que se produzcan recidivas de la pancreatitis. El índice de recidivas varía entre el 4 y el 70%, en función de cuál sea la causa real de la pancreatitis (6-8). Así, se ha descrito que cuando la causa de la pancreatitis es barro biliar o microlitiasis y no se hace ningún gesto terapéutico sobre la misma, la tasa de recurrencia oscila entre el 30 y el 70% durante un seguimiento de 2 a 3 años (9,10). Otros autores han descrito recidivas del 50% en el primer año, con incremento de la tasa de recidiva conforme aumenta el seguimiento (11,12). Además el índice de mortalidad global de la pancreatitis se encuentra entre el 4 y el 9%, pero para la pancreatitis aguda idiopática este índice puede ser todavía superior (13).
En los pacientes con vesícula in situ la causa más frecuente de PAI y que llega a justificar hasta el 80% de los casos es la microlitiasis biliar (9,14,15). El patrón oro para el diagnóstico de microlitiasis hoy en día sigue siendo el EMB (16,17), con una sensibilidad que varía entre el 65 y el 90%, y una especificidad del 88-100% (18). Sin embargo, esta técnica no está exenta de problemas. Entre el 29 y el 50% de los pacientes con litiasis vesicular conocida presentan un EMB negativo (3,19). En nuestra experiencia el EMB es una técnica costosa en tiempo que no es raro que se prolongue hasta 1 hora de duración y, además, en un 20% de los casos no es posible su realización debido a una mala tolerancia por parte del paciente, a que no se consiga el sondaje duodenal, o bien debido a que se aspire un material inadecuado. Esta tasa observada en nuestra experiencia coincide con la de otros grupos en nuestro medio (20).
Una vez que se demuestra la existencia de microlitiasis estos pacientes deben ser sometidos a una colecistectomía (9,14). Se ha demostrado que de esta manera la recurrencia de la pancreatitis baja de aproximadamente el 66-75% en pacientes no tratados a menos del 10% en los pacientes a los que se les realiza colecistectomía (9,14,20). En caso de que el riesgo quirúrgico sea excesivo, se puede hacer un tratamiento endoscópico mediante esfinterotomía, o médico con ácido ursodeoxicólico (6,14).
La segunda anomalía más frecuente que encontramos en estos pacientes es la disfunción del esfínter de Oddi. Puede llegar a justificar hasta un 30% de los casos de PAI, y es uno de los diagnósticos más frecuentes en los pacientes colecistectomizados con PAI (3,4,6,15,21-23). Para confirmarlo se puede realizar una manometría del esfínter de Oddi, sobre todo en aquellos pacientes con sospecha de disfunción del esfínter de Oddi tipos II y III (23). La manometría del esfínter de Oddi es una técnica disponible en pocos centros, que puede producir un cuadro de pancreatitis aguda entre el 17 y el 33% de los pacientes (24-27), por lo que debe realizarse en unidades de referencia (28). El tratamiento de elección para aquellos casos con disfunción del esfínter de Oddi es la esfinterotomía endoscópica, aunque podemos encontrarnos recidivas de la pancreatitis en hasta el 25% de los pacientes (21). En ese caso, se aconseja realizar una esfinterotomía del esfínter pancreático (21,23).
Otras causas de pancreatitis que podemos encontrar cuando profundizamos en el estudio de estos pacientes son las anomalías anatómicas. La más frecuentemente encontrada es el pancreas divisum. Sin embargo, aunque se ha descrito la existencia de pancreas divisum en hasta un 26% de los pacientes con PAI, todavía existe debate en cuanto a si esta anomalía puede llegar a ser considerada la causa de una PAI, dado que es muy prevalente en la población general (15,29,30). Se acepta que puede ser la causa cuando se demuestra, mediante un test de Warshaw, la presencia de una estenosis de la papila minor (6). Su tratamiento consiste en realizar una esfinterotomía endoscópica de la papila minor (21,31).
Otra anomalía que nos podemos encontrar es la presencia de un conducto común para el Wirsung y el conducto biliar demasiado prolongado, definido como aquel mayor de 15 mm (32). Su tratamiento también debe hacerse mediante una esfinterotomía endoscópica (31).
Otras anomalías anatómicas que pueden justificar un episodio de pancreatitis aguda son la presencia de coledococele, estenosis del Wirsung, páncreas anular, divertículo periampular y quiste de duplicación duodenal (3,4,6,15,23). En global, las anomalías anatómicas pueden justificar hasta el 20% de las PAI (15).
Entre el 5 y el 7% de los casos de PAI son provocados por un tumor bilio-pancreático (3,23). Se ha descrito una relación de la incidencia de estos tumores con la edad, así en un estudio publicado tan sólo en forma de resumen, se describe una incidencia de tumores biliopancreáticos del 3% en pacientes con PAI menores de 40 años, del 21% entre los 40 y los 60 años, y en los mayores de 60 años del 25% (33). Esto orienta a que es una causa en la que debemos pensar sobre todo en aquellos pacientes con PAI mayores de 40 años, como también indican otros autores (3,34).
La pancreatitis crónica está considerada también como posible causa de PAI, cuando no era conocida previamente. El diagnóstico de este proceso puede hacerse mediante distintas técnicas como la realización de test de función pancreática exocrina, TAC abdominal, CPRE, USE o CRNM, o muchas veces mediante la combinación de varias de estas exploraciones (35). La pancreatitis crónica puede ser tanto causa como consecuencia de la PAI, y este es un dilema clínico de difícil solución que se nos puede plantear en estos pacientes (6,23,24,36). De todas formas, es importante que si existe una pancreatitis crónica esta sea diagnosticada, dado que esto va a tener una influencia importante en el manejo del paciente (23).
En los últimos años un proceso que ha ido adquiriendo mayor importancia como causa de PAI es la pancreatitis autoinmune. Para diagnosticar esta entidad es útil la determinación de anticuerpos antinucleares e IgG4 (37).
Cuando llegamos a este punto y se han investigado todas las causas comentadas, es aconsejable que nos volvamos a replantear la posibilidad de que se trate de una pancreatitis enólica, dado que debido a las connotaciones negativas de este hábito no es raro que los pacientes sean reticentes a reconocerlo.
Si no se consigue diagnosticar ninguna de las causas de PAI previamente descritas, se considera que lo más probable es que se trate de una pancreatitis de origen genético, por mutaciones en genes como el del tripsinógeno catiónico (PRSS1), inhibidor de proteasa Kazal tipo I (SPINK-1), receptor regulador de la conductancia transmembrana de la fibrosis quística (CFTR) y déficit de la α1-antitripsina. Puede llegar a plantearse la determinación de estas mutaciones sobre todo en pacientes jóvenes, aunque no se recomienda en la práctica clínica diaria debido a las nulas implicaciones terapéuticas de un resultado positivo (3,22,23). En general, se considera que las causas genéticas pueden llegar a justificar hasta un 5% de los cuadros de PAI (15).
Cuando tampoco se demuestra ninguna de estas causas nos encontramos ante una pancreatitis verdaderamente idiopática.
Ultrasonografía endoscópica en la pancreatitis aguda idiopática
Basta ver la relación de causas de PAI comentadas para darnos cuenta de que, al menos teóricamente, con la USE podemos llegar a diagnosticar la gran mayoría de ellas. De hecho, el rendimiento diagnóstico teórico es muy similar al de la CPRE, salvo por la imposibilidad de diagnosticar la disfunción del esfínter de Oddi (38).
Con la USE el diagnóstico de litiasis se realiza ante imágenes hiperecogénicas arciformes que dejan una sombra posterior localizadas en la vesícula o colédoco. El barro biliar se traduce como presencia de material hiperecogénico que forma sedimento. La microlitiasis como la presencia de ecos puntiformes de ecogenicidad media o alta y aparición fugaz en el interior de la vesícula (Fig. 1).
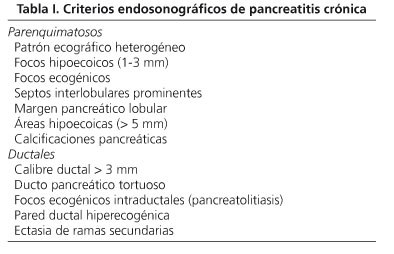
Por otro lado, la USE está considerada hoy día como una de las técnicas más sensibles para hacer el diagnóstico de pancreatitis crónica (39,40). Para ello disponemos de una serie de criterios parenquimatosos y ductales (Tabla I). Se admite que la presencia de 3 de estos criterios indica ya la existencia de una pancreatitis crónica (39). Si queremos aumentar la especificidad, la presencia de al menos 5 de estos criterios ofrece una sensibilidad en torno al 60% y una especificidad del 83%, con un alto valor predictivo positivo, una excelente correlación con la CPRE para las pancreatitis crónicas moderadas-graves (κ = 0,82), además de una buena correlación interobservador (κ = 0,45) (41-43). Cuando están presentes menos de tres criterios diagnósticos, es muy poco probable que se trate de una pancreatitis crónica (VPN > 85%) (41). La USE permite también realizar un análisis cuantitativo del parénquima pancreático que podría aumentar la sensibilidad para el diagnóstico de pancreatitis crónica en fase precoz (39,44).
La USE es además una de las técnicas más sensibles para detectar la existencia de tumores pancreáticos, especialmente en pacientes con tumores menores de 2,5 cm de diámetro, con precisión diagnóstica significativamente superior a la del TAC (45,46), y un valor predictivo negativo que ronda el 100% (47). Además en estos casos la USE permite realizar una correcta estadificación, con una precisión diagnóstica de resecabilidad del 67% (48) y obtener un diagnóstico citológico con una sensibilidad en torno al 89%, una especificidad del 99% y una precisión diagnóstica del 96% (49) (Fig. 2).
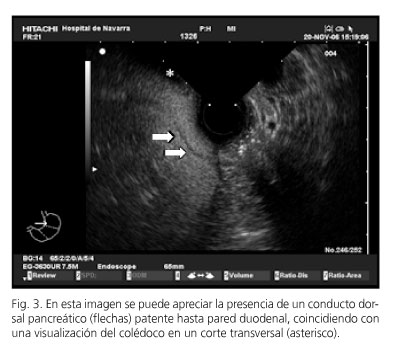
Seguramente el diagnóstico más exigente desde el punto de vista técnico y para el que se necesita amplia experiencia es el de pancreas divisum. Para realizar este diagnóstico se han descrito varios signos ecográficos. Uno de ellos es la ausencia del stack sign, es decir, de la visualización de colédoco y Wirsung en un corte longitudinal a nivel de duodeno, confluyendo hacia la papila. Este signo está presente en el 33% de los pacientes con pancreas divisum frente al 83% de los pacientes que no presenta esta anomalía anatómica (p = 0,04) (50). Otro signo descrito que parece más específico consiste en valorar la presencia de conducto Santorini hasta la pared duodenal (51,52) (Fig. 3). Si se identifica, se debe intentar descartar el paso de algún conducto pancreático de porción ventral a dorsal. La USE tiene un alto valor predictivo negativo cuando demuestra el paso de conducto pancreático de páncreas ventral a dorsal (52). El diagnóstico de pancreas divisum parece que puede ser más sencillo con el ecoendoscopio sectorial, con el que se ha descrito una precisión diagnóstica del 97% (53).
Por otro lado, se ha descrito una correlación aceptable del test de Warshaw mediante USE con la manometría del esfínter de Oddi para el diagnóstico de disfunción del esfínter de Oddi (κ = 0,53) con valor predictivo positivo y negativo del 80%, pero con baja sensibilidad, de tan sólo el 57% (54). Sin embargo, no han sido publicados resultados similares por otros autores.
En los últimos años se han publicado varios trabajos que evalúan como objetivo principal o secundario, el rendimiento diagnóstico de la USE en los casos de PAI (51,52,55-61). Aunque existe algún trabajo publicado de mayor nivel de evidencia científica (57,61), la mayoría de estos estudios se encuadrarían en un nivel de evidencia científica IV con grado de recomendación C (62). El rendimiento diagnóstico de la USE comunicado en estas publicaciones varía desde el 60 hasta el 80%, aunque hay consideraciones en estos estudios que se deberían tener en cuenta a la hora de valorar sus resultados.
El primer estudio publicado fue el de Dahan y cols. (61), cuyo objetivo fue el de comparar la precisión diagnóstica de la USE frente al MBE para el diagnóstico de microlitiasis en pacientes con cólico biliar o PAI. Incluyeron a 45 pacientes y obtuvieron una precisión diagnóstica significativamente mayor con la USE. Sin embargo, no se han publicado nuevos trabajos en los que se hayan obtenido resultados similares.
Norton y cols. (55) valoraron en 44 pacientes el rendimiento diagnóstico de la USE en PAI para el diagnóstico de litiasis no conocida previamente, comparándolos con un grupo control de 25 pacientes. Encontraron patología biliopancreática en 32 pacientes (72%), siendo el hallazgo más frecuente la litiasis biliar, presente en 26 pacientes (59%) aunque con dos falsos positivos de coledocolitiasis.
Posteriormente, Frossard y cols. (56) evaluaron la utilidad de la USE para el diagnóstico de patología biliar o pancreatitis crónica en 168 pacientes con PAI, tomando como patrón oro el resultado de la cirugía en 101 casos, de la CPRE en 49 y de MBE o control clínico evolutivo en los restantes 18 pacientes. En 135 de estos pacientes (80%) la USE encontró patología, siendo esta biliar en 124. Al comparar con el patrón oro, el diagnóstico emitido por la USE fue correcto en el 92% de los pacientes.
En un estudio posterior, Liu y cols. (57) evaluaron la utilidad de la USE para detectar la presencia de colelitiasis y otras posibles etiologías en 18 pacientes con PAI. Encontraron litiasis vesicular en 14, en 3 de ellos con coledocolitiasis coexistente, resultados que se confirmaron en la cirugía o CPRE.
Tandon y cols. (51) estudiaron con USE a 31 pacientes con PAI, encontrando en 21 (78%) la existencia de una causa potencial: en 5 pacientes microlitiasis, en 14 pancreatitis crónica, en 2 pacientes pancreas divisum, uno de ellos con pancreatitis crónica coexistente, y en 1 paciente se diagnosticó un tumor de páncreas. Para valorar los resultados de este estudio hay que tener en cuenta que no excluyen pacientes con ingesta de alcohol moderada o incluso alta. De hecho, en los 14 pacientes en los que diagnostican una pancreatitis crónica, 10 habían reconocido una ingesta enólica moderada o importante. Por tanto, es posible que no se tratara de pacientes con PAI sino de brotes de agudización en pacientes con pancreatitis crónica enólica. Además, el hecho de incluir a estos pacientes con probable pancreatitis enólica aumenta la probabilidad pre-test de encontrar datos de pancreatitis crónica (38). Esto, unido a que consideran diagnóstico de pancreatitis crónica la presencia de tres signos en la USE, justificaría el elevado porcentaje de pacientes con este diagnóstico en esta serie (45%).
Coyle y cols. (58) determinaron el rendimiento diagnóstico de la CPRE con MBE y/o manometría del esfínter de Oddi asociada, y de USE en los pacientes con PAI. Para ello incluyeron a 90 pacientes, a los que realizaron CPRE en 88, manometría del esfínter de Oddi en 67 y USE en 56. Combinando estas exploraciones diagnosticaron una disfunción del esfínter de Oddi en 28 pacientes (31%), litiasis biliar en 18 (20%), pancreatitis crónica en 18 (20%), pancreas divisum en 18 (20%) y un tumor de páncreas en 8 pacientes (8,9%). No encontraron ninguna causa en 18 pacientes (20%).
Tanto en el trabajo de Tandon y cols. como en el de Coyle y cols., consideran suficiente la presencia de tres criterios ecográficos de pancreatitis crónica para realizar este diagnóstico. En nuestra unidad exigimos la existencia de al menos 5 criterios de pancreatitis crónica, cuestión en la que coincidimos con otros autores (38,52). Esto disminuye la sensibilidad, pero aumenta la especificidad y VPP (41-43,63).
El estudio más amplio realizado hasta la fecha ha sido el realizado por Yussoff y cols. (52). En esta serie se incluyeron los resultados de USE realizadas a 370 pacientes con PAI. En aquellos pacientes con vesícula in situ en los que la USE fue normal, se aspiró bilis durante la misma para realizar MBE. Excluyendo a la pancreatitis crónica como causa de PAI, encontraron una causa con USE en 108 pacientes (29,2%): litiasis biliar en cualquiera de sus presentaciones en 50 pacientes (13%), pancreas divisum en 27 (7,3%), tumor mucinoso intraductal u otros tumores quísticos de páncreas en 10 pacientes (2,7%), tumor sólido de páncreas en 3 (0,8%) y miscelánea en 18 pacientes (4,8%). Por otro lado, en 109 pacientes (29,4%) se cumplían criterios de USE de pancreatitis crónica, de forma que, incluyendo esta como causa de PAI, el rendimiento de la USE se elevaría al 58,6%, más cercano al de los demás trabajos publicados. La pancreatitis crónica fue así la causa más frecuentemente encontrada tanto en los pacientes con vesícula in situ como en los colecistectomizados, y fue significativamente más frecuente en los pacientes con PAI recurrente. En este estudio el único factor que mostró asociación con hallazgos positivos en la USE fue la edad, de forma que a mayor edad, mayores posibilidades de encontrar la causa de la PAI en la USE.
En este estudio no queda claro si consideran como hallazgo positivo de la USE la presencia de signos ecográficos de microlitiasis, dado que parece que sólo valoran la presencia de colelitiasis o coledocolitiasis y barro biliar. Sí que consideran a la microlitiasis como causa de PAI y realizan EMB a 80 pacientes con vesícula in situ en los que la USE es normal y diagnostican la presencia de microcristales en 38. Aunque el EMB sigue siendo considerado como la técnica de elección para el diagnóstico de microlitiasis (16,17), lo cierto es que en estudios previos la USE ha demostrado ser superior a la MBE para detectar la presencia de microlitiasis vesicular (61). Por otro lado, también llama la atención el elevado porcentaje de pacientes con signos de pancreatitis crónica. Esto puede ser debido a que en este estudio no incluyen a pacientes con ingesta enólica importante en las dos semanas previas al proceso de PAI, pero no hacen referencia a la ingesta enólica previa por lo que es posible que pacientes con importante consumo de alcohol y una pancreatitis crónica secundaria hayan sido incluidos.
En el último estudio publicado, Garg y cols. realizan CPRE, MBE y USE a 75 pacientes con PAI, encontrando una posible causa en 57 pacientes (76%), siendo las más frecuentes la pancreatitis crónica y la microlitiasis (60). Además de en los pacientes adultos, la USE también ha demostrado su utilidad en pacientes en edad pediátrica con PAI (59).
A pesar de que en todos estos estudios se pone de manifiesto el enorme rendimiento diagnóstico de la USE en los pacientes con PAI, en tan sólo dos de ellos se realiza un seguimiento a los pacientes a los que se les realiza USE (51,57). En el estudio de Liu y cols. (57) realizaron un seguimiento medio de 20 meses durante el cual no realizaron nuevos diagnósticos de colelitiasis en los pacientes en los que la USE no había detectado litiasis vesicular. Tandon y cols. (51) realizaron un seguimiento medio de 16 meses (rango: 4-44 meses) durante el cual el diagnóstico etiológico aportado por la USE se mantuvo en el 87% de los casos.
Parece por tanto, según estos dos estudios, que la USE no sólo demuestra la existencia de posibles etiologías de la PAI, sino que estos diagnósticos son consistentes y se mantienen a lo largo de la evolución en la gran mayoría de los pacientes, aunque serían necesarios nuevos estudios que valoren de manera más adecuada este aspecto (52).
Consideraciones adicionales
Mediante la USE y teniendo en cuenta los resultados de los estudios disponibles en la literatura, podemos llegar a encontrar la causa de una PAI en un porcentaje que varía entre el 60 y el 80% de los pacientes. Sin embargo, debemos hacer unas consideraciones adicionales en determinadas situaciones. Existe Discusión en cuanto a si el rendimiento diagnóstico de la USE justifica su realización tanto tras una PAI recurrente, como tras el primer episodio de PAI; a si se debe hacer tanto en pacientes con vesícula in situ como en pacientes colecistectomizados; o en cuanto a cuál es el mejor momento tras el proceso agudo para realizar la USE.
En cuanto a la conveniencia de realizar USE tras el primer episodio de PAI o tan sólo cuando se trata de una PAI recurrente, existe controversia en la literatura con autores que dudan de la utilidad de la USE en los pacientes con PAI recurrente (38). Sin embargo, en los estudios publicados en los que se aporta este dato no se objetivan diferencias significativas en el rendimiento de la USE en pacientes con PAI recurrente con respecto a los que tan sólo han presentado un episodio de PAI (51,52,58). En el estudio de Coyle y cols. (58) el rendimiento diagnóstico de la USE es similar en los 24 pacientes con primer episodio de PAI y los 66 pacientes con PAI recurrente, con una tendencia a presentar mayor proporción de tumores pancreáticos en el grupo de PAI recurrente, pero sin diferencias significativas. Precisamente en el trabajo publicado por Yusoff y cols. (52), uno de los objetivos principales que se plantean es dilucidar si el rendimiento de la USE es similar en ambos grupos de pacientes. En los 246 pacientes con vesícula in situ la USE identificó una causa en el 31,3% de los pacientes con primer episodio de PAI y en el 32,1% de los de PAI recurrente (p = 0,89). Al incluir la pancreatitis crónica como causa de PAI, la USE tuvo un rendimiento significativamente mayor en los pacientes con cuadro recurrente: 53 vs. 74,1% respectivamente (p = 0,0009). En los pacientes colecistectomizados no se encontraron diferencias en cuanto al rendimiento de la USE en función de si era el primer episodio de pancreatitis o esta era recurrente, independientemente de si se incluía la pancreatitis crónica (46,3 vs. 56,1%; p = 0,28), como si no (29,9 vs. 17,5%; p = 0,14).
Ante estos resultados publicados hasta el momento, podemos decir que el rendimiento diagnóstico de la USE es similar tras el primer episodio de PAI como en la PAI recurrente, y por tanto útil en ambas situaciones. Esta opinión es compartida por otros autores (64).
Otra cuestión a tener en cuenta cuando nos enfrentamos a un paciente con PAI es si está colecistectomizado o tiene vesícula in situ. Lo cierto es que en los estudios que han sido publicados no es una cuestión que se haya evaluado correctamente, dada la escasa cantidad de pacientes colecistectomizados incluidos (51,55,57). En otros trabajos no se tiene en cuenta este factor a la hora de valorar y categorizar los resultados (56,58). Un estudio en el que sí se clasifican los resultados de la USE según sean pacientes colecistectomizados o con vesícula in situ es el de Yusoff y cols. (52). En esta serie incluyen a 246 pacientes con vesícula in situ y 124 pacientes colecistectomizados. Al realizar la USE encuentran una causa en el 31,7 y el 24,2% de los pacientes respectivamente. Cuando incluyen la pancreatitis crónica como posible etiología el porcentaje de pacientes con causa en la USE asciende al 62,6 y 50,8% respectivamente. Podemos ver que el porcentaje es siempre superior en el grupo de pacientes con vesícula in situ. Esto está en relación con el diagnóstico mediante la USE de litiasis vesicular, ya sea en forma de colelitiasis, barro biliar o microlitiasis. Como ya se ha comentado, hay estudios en los que hasta el 80% de los pacientes con PAI presentan microlitiasis (4,9,15).
Dado que en los pacientes colecistectomizados la causa de PAI que se encuentra con mayor frecuencia es la pancreatitis crónica y las variantes anatómicas, podría plantearse como primera exploración en estos pacientes la realización de una CRNM. Esta es una exploración no invasiva que también permite realizar el diagnóstico de estas entidades con una buena precisión (5,65-67). Aunque no hay estudios que comparen el rendimiento de CRNM y USE en pacientes con PAI, la USE sí ha demostrado mejores resultados para el diagnóstico de coledocolitiasis de pequeño tamaño (68,69), una de las causas frecuentemente encontrada en estos pacientes (Fig. 4). Teniendo esto en cuenta y la mayor accesibilidad de la USE en nuestro servicio, nosotros preferimos realizar una USE como primera exploración para profundizar en el estudio etiológico de estos pacientes. De todas formas, no existen datos en la literatura que apoyen concluyentemente la utilización de una u otra exploración, y elegir una de las dos debe ser seguramente una decisión individualizada en cada paciente e incluso en cada centro (69).
En cuanto al momento ideal para realizar la USE tras el episodio de PAI tampoco está claro y varía según los autores. Norton realiza la USE cuando los pacientes comen con normalidad (55), Liu cuando el episodio de pancreatitis aguda se ha resuelto y realiza la mayoría de las exploraciones durante el mismo ingreso de la PAI (57), Tandon realiza la USE cuando los síntomas de la pancreatitis han remitido, en la mayoría de los casos 2-3 semanas tras el alta (51), Yusoff realiza la USE al menos 4 semanas después del último episodio de PAI, buscando asegurar que las alteraciones parenquimatosas que se encuentren sean en relación con pancreatitis crónica y no por inflamación residual (52).
En nuestra unidad coincidimos con este último autor y preferimos hacer la USE al menos 4 semanas después del alta. Esto lo hacemos para evitar identificar como causa una microlitiasis biliar secundaria a la estasis biliar producida por el ayuno que mantiene el paciente en la fase aguda de la pancreatitis. Por otro lado, buscamos que los focos residuales de inflamación aguda que pudieran persistir los días posteriores al cuadro agudo de pancreatitis se hayan resuelto.
Conclusiones
Como conclusión podemos decir, por tanto, que la USE es una técnica que ofrece un alto rendimiento diagnóstico en los pacientes con PAI, pudiendo diagnosticar la causa de la pancreatitis en hasta el 80% de los casos. Este rendimiento es similar en pacientes con un único episodio de PAI, pacientes con PAI recurrente, pacientes con vesícula in situ y pacientes colecistectomizados. Sería muy recomendable la realización de estudios prospectivos y controlados que comparen la utilidad de la USE con la de la CRNM en estos pacientes.
A pesar de que los estudios publicados acerca de este tema son escasos y su nivel de evidencia científica moderado, dado el rendimiento diagnóstico descrito y la baja tasa de complicaciones relacionadas con la realización de la USE, similar al de una gastroscopia (70,71), en nuestra unidad realizamos la USE como primera exploración en pacientes con PAI. Esto lo hacemos incluso tras el primer episodio, sobre todo en pacientes con vesícula in situ aunque también en pacientes colecistectomizados, y al menos cuatro semanas tras el alta hospitalaria.
Bibliografía
1. Steinberg W, Tenner S. Acute pancreatitis. N Eng J Med 1994; 330: 1198-210. [ Links ]
2. Mergener K, Baillie J. Fornightly review: Acute pancreatitis. Br Med J 1998; 316: 44-8. [ Links ]
3. Draganov P, Forsmark E. Idiopathic pancreatitis. Gastroenterology 2005; 128: 756-63. [ Links ]
4. Wilcox CM, Varadarajulu S, Eloubeidi M. Role of endoscopic evaluation in idiopathic pancreatitis: A systematic review. Gastrointest Endosc 2006; 63: 1037-45. [ Links ]
5. Khalid A, Peterson M, Slivka A. Secretin-stimulated magnetic resonance pancreaticogram to assess pancreatic duct outflow obstruction in evaluation of idiopathic acute recurrent pancreatitis: A pilot study. Dig Dis Sci 2003; 48: 1475-81. [ Links ]
6. Bank S, Indaram A. Causes of acute and recurrent pancreatitis. Gastroenterol Clin North Am 1999; 28: 571-88. [ Links ]
7. Ballinger AB, Barnes E, Alstead EM, Fairclough PD. Is intervention necessary after a first episode of acute idiopathic pancreatitis? Gut 1996; 38: 293-5. [ Links ]
8. Bradley EL. A clinically based classification for acute pancreatitis. Arch Surg 1993; 128: 586-90. [ Links ]
9. Lee SP, Nicholls JF, Park HZ. Biliary sludge as a cause of acute pancreatitis. N Engl J Med 1992; 326: 589-93. [ Links ]
10. Marotta P, Gregor J, Taves D. Biliary sludge: A risk factor for "idiopathic" pancreatitis? Can J Gastroenterol 1996; 6: 385-8. [ Links ]
11. Reber HA. Idiopatic pancreatitis. Management of the patients with recurrent pancreatitis. Gut 1988; 348-52. [ Links ]
12. Howard MJ. Gallstone pancreatitis. In: Howard MJ, Jordan GL Jr, Reber HA, editors. Surgical diseases of the pancreas. Philadelphia: Lea & Febiger; 1987. p. 269. [ Links ]
13. Kohut M, Nowak A, Nowakowska-Dulawa E, Kaczor R, Marek T. The frequency of bile duct crystals in patients with presumed biliary pancreatitis. Gastrointest Endosc 2001; 54: 37-41. [ Links ]
14. Ros E, Navarro S, Bru C, García-Puges A, Valderrama R. Occult microlithiasis in idiopatic acute pancreatitis: Prevention of relapses by cholecystectomy or ursodeoxycholic acid therapy. Gastroenterology 1991; 101: 1701-9. [ Links ]
15. van Brummelen SE, Vennemann NG, van Erpecum KJ, van Berge-Henegouwen. Acute idiopathic pancreatitis: Does it really exist or is it a Myth? Scand J Gastroenterol 2003; 239 (Supl.): 117-22. [ Links ]
16. Levy MJ. The hunt for microlithiasis in idiopathic acute recurrent pancreatitis: Should we abandon the search or intensify our efforts? Gastrointest Endosc 2002; 55: 286-93. [ Links ]
17. Ko CW, Sekijima JH, Lee SP. Biliary sludge. Ann Intern Med 1999; 130: 301-11. [ Links ]
18. Neoptolemos JP, Davidson BR, Winder AF, Vallance D. Role of duodenal bile crystal analysis in the investigation of "idiopathic" pancreatitis. Br J Surg 1988; 75: 450-3. [ Links ]
19. Moskowitz M, Min TC, Gavaler JS. The microscopic examination of bile in patients with biliary pain and negative imaging test. Am J Gastroenterol 1986; 81: 329-33. [ Links ]
20. Reyes-López A, Miño-Fugarolas G, Costán-Rodero G, Pérez-Rodríguez E, Montero-Álvarez JL, Cabrera D. The predictive value of the duodenal probe in the ethiological diagnosis of acute pancreatitis. Rev Esp Enferm Dig 1993; 83: 363-6. [ Links ]
21. Testoni PA, Caporuscio S, Bagnolo F, Lella F. Idiopathic recurrent pancreatitis: Long-term results after ERCP, endoscopic sphincterotomy, or ursodeoxycholic acid treatment. Am J Gastroenterol 2000; 95: 1702-7. [ Links ]
22. Baillie J. What should be done with idiopathic recurrent pancreatitis that remains "idiopathic" after standard investigation? JOP J Pancreas 2001; 2: 401-5. [ Links ]
23. Levy MJ, Geenen JE. Idiopathic acute recurrent pancreatitis. Am J Gastroenterol 2001; 96: 2540-55. [ Links ]
24. Venu RP, Geenen JE, Hogan W, et al. Idiopathic recurrent pancreatitis, an aproach to diagnosis and treatment. Dig Dis Sci 1989; 34: 56-60. [ Links ]
25. Sherman S, Ruffolo TA, Hawes RH, et al. Complications of endoscopic sphincterotomy. A prospective study with emphasis on the increased risk associated with sphincter of Oddi dysfunction and nondilated ducts. Gastroenterology 1991; 101: 1068-75. [ Links ]
26. Tarnasky P, Cunningham J, Cotton P, et al. Pancreatic sphincter hypertension increases the risk of post-ERCP pancreatitis. Endoscopy 1997; 29: 252-7. [ Links ]
27. Maldonado ME, Brady PG, Mamel JJ, Robinson B. Incidence of pancreatitis in patients undergoing sphincter of Oddi manometry (SOM). Am J Gastroenterol 1999; 94: 387-90. [ Links ]
28. Baillie J. Sphincter of Oddi dysfunction: Overdue for an overhaul. Am J Gastroenterol 2005; 100: 1217-20. [ Links ]
29. Cotton PB. Congenital anomaly of pancreas divisum as a cause of obstructive pain and pancreatitis. Gut 1980; 21: 105-14. [ Links ]
30. Bernard JP, Sahel J, Giovannini M, Sarles H. Pancreas divisum is a probable cause of acute pancreatitis: A report of 137 cases. Pancreas 1990; 5: 248-54. [ Links ]
31. Kaw M, Brodmerkel GJ. ERCP, biliary crystal analysis, and sphincter of Oddi manometry in idiopathic recurrent pancreatitis. Gastrointest Endosc 2002; 55: 157-62. [ Links ]
32. Schulte SJ. Embryology and congenital anomalies of the bile and pancreatic ducts. In: Silvis S, Rohrmann CA, Ansel HJ, editors. Text and atlas of endoscopic retrograde cholangiopancreatography. New York: Igaku-Shoin; 1995. p. 114-45. [ Links ]
33. Choudari CP, Fogel EL, Sherman S, Lehman GA. Idiopathic pancreatitis: Yield of ERCP correlated with patient age. Am J Gastroenterol 1998; 93: 1654A. [ Links ]
34. Testoni PA. Aetiologies of recurrent acute pancreatitis: Acute or chronic relapsing disease? JOP J Pancreas 2001; 2: 357-67. [ Links ]
35. Wiersema KN, Hawes RH, Lehman GA, Kochman ML, Sherman S, Kopecky KK. Prospective evaluation of endoscopic ultrasonography and endoscopic retrograde cholangiopancreatography in patients with chronic abdominal pain of suspected pancreatic origin. Endoscopy 1993; 25: 555-64. [ Links ]
36. Seidensticker F, Otto J, Lankisch PG. Recovery of the pancreas after acute pancreatitis is not necessarily complete. Int J Pancreatol 1995; 17: 225-9. [ Links ]
37. Silverman WB. Autoimmune pancreatitis: More common and important than we thought? Gastrointest Endosc 2007; 65: 109-10. [ Links ]
38. Chen RYM, Hawes RH. Idiopathic acute pancreatitis: Is EUS worth doing? Am J Gastroenterol 2002; 97: 1244-6. [ Links ]
39. Irisawa A, Katakura K, Ohira H, Sato A, Bhutani MS, Hernández LV, et al. Usefulness of endoscopic ultrasound to diagnose the severity of chronic pancreatitis. J Gastroenterol 2007; 42 (Supl. XVII): 90-4. [ Links ]
40. Catalano MF. Diagnosing early-stage chronic pancreatitis: Is endoscopic ultrasound a reliable modality? J Gastroenterol 2007; 42 (Supl. XVII): 78-84. [ Links ]
41. Sahai AV, Zimmerman M, Aabakken L, Tarnasky PR, Cunningham JT, van Velse A, et al. Prospective assessment of the ability of endoscopic ultrasound to diagnose, exclude, or establish the severity of chronic pancreatitis found by endoscopic retrograde cholangiopancreatography. Gastrointest Endosc 1998; 48: 18-25. [ Links ]
42. Wallace MB, Hawes RH, Durkalski V, Chak A, Mallery S, Catalano MF, et al. The reliability of EUS for the diagnosis of chronic pancreatitis: Interobserver agreement among experienced endosonographers. Gastrointest Endosc 2001; 53: 294-9. [ Links ]
43. Raimondo M, Wallace MB. Diagnosis of early chronic pancreatitis by endoscopic ultrasound. Are we there yet? JOP J pancreas 2004; 5: 1-7. [ Links ]
44. Miyakawa H, Suga T, Okamura K. Usefulness of endoscopic ultrasonography for the diagnosis of chronic pancreatitis. J Gastroenterol 2007; 42 (Supl. XVII): 85-9. [ Links ]
45. DeWitt J, Devereaux B, Chriswell M, McGreevy K, Howard T, Imperiale TF, et al. Comparison of endoscopic ultrasonography and multidetector computed tomography for detecting and staging pancreatic cancer. Ann Intern Med 2004; 141: 753-63. [ Links ]
46. Ho S, Bonasera RJ, Pollack BJ, Grendell J, Feuerman M, Gress F. A single-center experience of endoscopic ultrasonography for enlarged pancreas on computed tomography. Clin Gastroenterol Hepatol 2006; 4: 98-103. [ Links ]
47. Klapman JB, Chang KJ, Lee JG, Nguyen P. Negative predictive value of endoscopic ultrasound in a large series of patients with a clinical suspicion of pancreatic cancer. Am J Gastroenterol 2005; 100: 2658-61. [ Links ]
48. Soriano A, Castells A, Ayuso C, Ayuso JR, de Caralt MT, Ginés MA, et al. Preoperative staging and tumor resectability assessment of pancreatic cancer: Prospective study comparing endoscopic ultrasonography, helical computed tomography, magnetic resonance imaging, and angiography. Am J Gastroenterol 2004; 99: 492-501. [ Links ]
49. Chen VK, Arguedas MR, Kilgore ML, Eloubeidi MA. A cost-minimization analysis of alternative strategies in diagnosing pancreatic cancer. Am J Gastroenterol 2004 ;99: 2223-34. [ Links ]
50. Bhutani MS, Hoffman BJ, Hawes RH. Diagnosis of pancreas divisum by endoscopic ultrasonography. Endoscopy 1999; 31: 167-9. [ Links ]
51. Tandon M, Topazian M. Endoscopic ultrasound in idiopathic acute pancreatitis. Am J Gastroenterol 2001; 96: 705-9. [ Links ]
52. Yusoff IF, Raymond G, Sahai AV. A prospective comparison of the yield of EUS in primary vs. recurrent idiopathic acute pancreatitis. Gastrointest Endosc 2004; 60: 673-8. [ Links ]
53. Lai R, Freeman ML, Cass OW, Mallery S. Accurate diagnosis of pancreas divisum by linear-array endoscopic ultrasonography. Endoscopy 2004; 36: 705-9. [ Links ]
54. Catalano MF, Lahoti S, Alcocer E, Geenen JE, Walter JH. Dynamic imaging of the pancreas using real-time endoscopic ultrasonography with secretin stimulation. Gastrointest Endosc 1998; 48: 580-7. [ Links ]
55. Norton SA, Alderson D. Endoscopic ultrasonography in the evaluation of idiopathic acute pancreatitis. Br J Surg 2000; 87: 1650-5. [ Links ]
56. Frossard JL, Sosa-Valencia L, Amouyal G, Marty O, Hadengue A, Amouyal P. Usefulness of endoscopic ultrasonography in patients with “idiopathic” acute pancreatitis. Am J Med 2000; 109: 196-200. [ Links ]
57. Liu CL, Lo CM, Chan JFK, Poon RTP, Fan ST. EUS for detection of occult cholelithiasis in patients with idiopathic pancreatitis. Gastrointest Endosc 2000; 51: 28-32. [ Links ]
58. Coyle WJ, Pineau BC, Tarnasky PR, Knapple WL, Aabakken L, Hoffman BJ, et al. Evaluation of unexplained acute and acute recurrent pancreatitis using endoscopic retrograde cholangiopancreatography, sphincter of Oddi manometry and endoscopic ultrasound. Endoscopy 2002; 34: 617-23. [ Links ]
59. Varadarajulu S, Wilcox M, Eloubeidi MA. Impact of EUS in the evaluation of pancreatobiliary disorders in children. Gastrointest Endosc 2005; 62: 239-44. [ Links ]
60. Garg PK, Tandon RK, Madan K. Is biliary microlithiasis a significant cause of idiopathic recurrent acute pancreatitis? A long-term followup study. Clin Gastroenterol Hepatol 2007; 5: 75-9. [ Links ]
61. Dahan P, Andant C, Levy P, Amouyal P, Amouyal G, Dumont M, et al. Prospective evaluation of endoscopic ultrasonography and microscopic examination of duodenal bile in the diagnosis of cholecystolithiasis in 45 patients with normal conventional ultrasonography. Gut 1996; 38: 277-81. [ Links ]
62. Oxford Centre for Evidence-Based Medicine. Levels of Evidence and Grades of Recommendation; 2001. Available at: http://www.cebm.net/levels_of_evidence.asp [ Links ]
63. Sahai AV, Zimmerman M, Aabakken L, Tarnasky PR, Cunningham JT, van Velse A, et al. Prospective assessment of the ability of endoscopic ultrasound to diagnose, exclude, or establish the severity of chronic pancreatitis found by endoscopic retrograde cholangiopancreatography. Gastrointest Endosc 1998; 48: 18-25. [ Links ]
64. Seewald S, Omar S, Soehendra N. Acute pancreatitis: The acute attack. Acute recurrent pancreatitis. Endoscopy 2006; 38: S21-2. [ Links ]
65. Hellerhoff KJ, Helmberger H 3rd, Rosch T, Settles MR, Link TM, Rummeny EJ. Dynamic MR pancreatography after secretin administration: Image quality and diagnostic accuracy. Am J Roentgenol 2002; 179: 121-9. [ Links ]
66. Sugiyama M, Haradome H, Atomi Y. Magnetic resonance imaging for diagnosing chronic pancreatitis. J Gastroenterol 2007; 42 (Supl. XVII): 108-12. [ Links ]
67. Matos C, Winant C, Delhaye M, Deviere J. Functional MRCP in pancreatic and periampullary disease. Int J Gastrointest Cancer 2001; 30: 5-18. [ Links ]
68. Kondo S, Isayama H, Akahane M, Toda N, Sasahira N, Nakai Y, et al. Detection of common bile duct stones: Comparison between endoscopic ultrasonography, magnetic resonance cholangiography, and helical-computed-tomographic cholangiography. Eur J Radiol 2005; 54: 271-5. [ Links ]
69. Verma D, Kapadia A, Eisen GM, Adler DG. EUS vs. MRCP for detection of choledocholithiasis. Gastrointest Endosc 2006; 64: 248-54. [ Links ]
70. Bournet B, Migueres I, Delacroix M, Vigouroux D, Bornet JL, Escourrou J, et al. Early morbidity of endoscopic ultrasound: 13 years’ experience at a referral center. Endoscopy 2006; 38: 349-54. [ Links ]
71. Standards of practice committee. ASGE guideline: Complications of EUS. Gastrointest Endosc 2005; 61: 8-12. [ Links ]
![]() Dirección para correspondencia:Juan J. Vila Costas.
Dirección para correspondencia:Juan J. Vila Costas.
C/ Irunlarrea, 3.
31008 Pamplona.
e-mail: juanjvila@gmail.com
Recibido: 26-03-07.
Aceptado: 10-09-07.