My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.100 n.8 Madrid Aug. 2008
Efecto de la pentoxifilina en la supervivencia, la función cardiaca y en la hemodinámica portal y sistémica de la cirrosis alcohólica avanzada
Effect of pentoxiphylline on survival, cardiac function, and portal and systemic hemodynamics in advanced alcoholic cirrhosis - a randomized double-blind placebo-controlled trial
C. M. Fernández-Rodríguez, J. L. Lledó, P. López-Serrano, M. L. Gutiérrez, S. Alonso, M. T. Pérez-Fernández, M. Fernández Gil, R. Pazos1, R. Tolon1, T. Hernández2 y P. Sanz3
Unidad de Gastroenterología y Hepatología.
1Laboratorio de Investigación.
2Unidad de Radiología Intervencionista.
3Unidad de Cardiología. Hospital Universitario Fundación Alcorcón. Madrid
Dirección para correspondencia
RESUMEN
Objetivo: valorar el efecto de la pentoxifilina (un potente inhibidor del factor de necrosis tumoral alfa) en la supervivencia, en la hemodinámica sistémica y portal y en la función cardiaca en la cirrosis alcohólica avanzada.
Diseño: estudio aleatorizado, doble-ciego, controlado con placebo.
Contexto: estudio unicéntrico utilizando grupos de pacientes en paralelo para comparar pentoxifilina y placebo.
Pacientes: se incluyeron 24 pacientes con cirrosis alcohólica (8 en estadio B de Child-Pugh y 16 en estadio C de Child-Pugh).
Intervención: los pacientes fueron aleatorizados a recibir pentoxifilina (400 mg, 3 veces al día, n = 12) o placebo (n = 12) durante 4 semanas.
Determinaciones: el objetivo principal fue la supervivencia a corto/largo plazo. Los objetivos secundarios fueron observar beneficios hemodinámicos (mejoría en la función cardiaca y/o en el índice de resistencias vasculares sistémicas o disminución de la presión portal).
Resultados: la presión portal y la función cardiaca no se modificaron y no hubo diferencias en la supervivencia a corto y largo plazo entre los grupos tratados y placebo. Los índices de resistencia vascular sistémica y cardiaco cambiaron en el grupo de pentoxifilina (de 1.721 ± 567 a 2.082 ± 622 Din.seg 1 cm-5 m-2 y de 4,17 ± 1,4 a 3,4 ± 0,9 lm-2, p = 0,05).
Conclusiones: aunque la pentoxifilina parece producir algún beneficio hemodinámico a corto plazo en pacientes con cirrosis alcohólica avanzada, no tiene efecto sobre la tasa de supervivencia, la función cardiaca ni sobre la presión portal en estos pacientes.
Palabras clave: Inhibición del TNF-a. Hemodinámica. Miocardiopatía cirrótica. Cirrosis alcohólica.
ABSTRACT
Objective: to assess the effect of pentoxiphylline (a potent inhibitor of tumor necrosis factor alpha) on survival, on systemic and portal hemodynamics, and on cardiac function in patients with alcoholic cirrhosis.
Design: a randomized double-blind placebo-controlled trial.
Setting: a single center using parallel groups of patients to compare pentoxiphylline with placebo.
Patients: we recruited 24 patients with alcoholic cirrhosis (8 Child-Pugh B and 16 Child-Pugh C).
Interventions: patients were randomly assigned to receive pentoxiphylline (400 mg tid; n = 12) or placebo (n = 12) over a 4-week period.
Outcome measures: the primary outcome was to extend short-term and long-term survival. Secondary outcomes included hemodynamic benefits (improvement in cardiac function and/or systemic vascular resistance index, or decrease in portal pressure).
Results: portal pressure and cardiac function remained unchanged and there were no significant differences in short-term or long-term survival between treatment and placebo groups. The group on pentoxiphylline increased systemic vascular resistance and decreased cardiac indices (from 1,721 ± 567 to 2,082 ± 622 dyn.sec-1 cm-5 m-2 and from 4.17 ± 1.4 to 3.4 ± 0.9 l.m-2, p = 0.05).
Conclusions: although pentoxiphylline seems to provide some short-term aemodynamic benefits in patients with advanced alcoholic cirrhosis, this drug has no effect on survival or portal pressure in these patients.
Key words: TNF-a inhibition. Haemodynamics. Cirrhotic cardyomyopathy. Human cirrhosis.
Introducción
Los pacientes con cirrosis descompensada presentan cambios hemodinámicos entre los que se incluyen una disminución de las resistencias vasculares periféricas y un aumento del gasto cardiaco con aumento del volumen sanguíneo (1-4). Se cree que estos cambios son responsables de la disminución del volumen sanguíneo arterial efectivo y juegan un papel crucial en la activación de los sistemas vasopresores y retenedores de sodio y agua, que generan ascitis y disfunción renal (5). Estas alteraciones hemodinámicas predicen una supervivencia menor en estos pacientes (6). Estos pacientes también presentan modificaciones cardiacas subclínicas como una disfunción diastólica y disminución de la contractilidad cardiaca con el esfuerzo físico o cuando son sometidos a una sobrecarga farmacológica, lo que puede contribuir al empeoramiento de las alteraciones hemodinámicas sistémicas (7,8). Ma y Lee fueron los primeros en describir esta miocardiopatía (8), que se asocia a la aparición de áreas de fibrosis ventricular, focos de edema e hipertrofia o dilatación (9,10). La causa exacta de estos cambios es desconocida, pero se cree que es el resultado de una disfunción autonómica con alteraciones funcionales de los receptores b-adrenérgicos (11) o de factores depresores cardiacos tales como endotoxinas o citoquinas, especialmente el TNF-a, que media la activación del óxido nítrico (NO) (12). La traslocación bacteriana intestinal desencadena un aumento de la síntesis de citoquinas proinflamatorias y una activación de la oxido nítrico sintetasa endotelial (eNOS) (13). Recientemente, West y cols. observaron un aumento de la producción de NO y sobreexpresión de eNOS inducido por TNF-a en ratas cirróticas con translocación bacteriana (14,15). Además, la inhibición del TNF-a mejora la circulación hiperdinámica de la hipertensión portal en ratas (13,16) y se ha observado un aumento de la producción del TNF-α en los ganglios linfáticos mesentéricos de pacientes con cirrosis descompensada sometidos a trasplante (17).
La pentoxifilina es un potente inhibidor de la síntesis del TNF-a con efecto antioxidante y antifibrogénico (18,19) que prolonga la supervivencia en pacientes con hepatitis alcohólica grave (20) y mejorar la función cardiaca y la supervivencia en pacientes con miocardiopatía dilatada (21).
Hemos diseñado este estudio para determinar los efectos de la pentoxifilina sobre la supervivencia, la función cardiaca, las alteraciones hemodinámicas de la cirrosis y la hipertensión portal.
Pacientes y métodos
Estudio unicéntrico, controlado con placebo de grupos paralelos, comparando pentoxifilina con placebo. El estudio fue aprobado por el comité ético local y se ha desarrollado de acuerdo con la declaración de Helsinki para los estudios médicos en humanos. Los detalles de la naturaleza del estudio fueron entregados por escrito a cada paciente incluido (o al familiar responsable), antes de obtener el consentimiento.
Los pacientes (n = 24) presentaban cirrosis alcohólica; 8 en estadio B de Child-Pugh y 16 en estadio C de Child-Pugh (Tabla I).
Se excluyeron los pacientes con cirrosis de otras etiologías no alcohólicas (infección por virus B o C), con sangrado gastrointestinal reciente o activo (1 semana antes de la inclusión de los pacientes), encefalopatía grado III-IV, patología renal o cardiaca primaria, diabetes mellitus insulina-dependiente, infección bacteriana, trombosis completa de la vena porta, pacientes en tratamiento con fármacos con efectos hemodinámicos como los betabloqueantes, nitritos o antiinflamatorios no esteroideos en la semana previa al reclutamiento. Todos los pacientes incluidos habían sufrido con descompensación ascítica como motivo del ingreso. Para determinar la función hepática se utilizó el estadio de Child-Pugh (22).
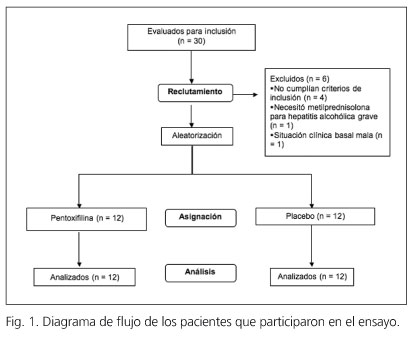
De los 30 pacientes seleccionados, 6 fueron excluidos por infección por VHC (n = 2), trombosis completa de la vena porta (n = 1), situación clínica basal mala (n = 1) y necesidad de corticoterapia por hepatitis alcohólica severa (n = 1) (Fig. 1).
El grupo de pacientes incluido (edad media: 53 ± 9 años) estaba formado por 20 hombres y 4 mujeres. Los pacientes fueron aleatorizados en una proporción de 1:1 a recibir pentoxifilina 400 mg, 3 veces al día, después de las comidas, o placebo de idéntica apariencia. Después de la primera fase del estudio, los pacientes acudieron a revisión en consultas a la 2ª y 3ª semana del tratamiento para asegurar el cumplimiento y registrar los efectos secundarios. En la 4ª semana de tratamiento, los participantes acudieron al hospital para la realización del resto de pruebas incluidas en el protocolo.
El periodo de reclutamiento comenzó en marzo de 2001 y el estudio concluyó en abril de 2007. El seguimiento se extendió hasta el 28 abril de 2008. La aleatorización se realizó de acuerdo con el estadio de Child-Pugh (22), pero sin estratificación porque únicamente fueron incluidos los pacientes en estadio B y C. El tamaño muestral fue calculado con un poder estadístico del 80% y un error a del 0,05, asumiendo una reducción de la presión portal con la pentoxifilina de la misma magnitud que la publicada por Elephteriadis y cols. usando pentoxifilina intravenosa (23).
Los pacientes mantuvieron reposo relativo y recibieron una dieta de 80 mmol/día de sodio durante 5 días. Las muestras de sangre fueron extraídas tras el ayuno nocturno y se recogieron muestras de orina de 24 horas para estudio de la función renal. El 5º día a las 9:00 h se extrajeron las muestras de sangre de una vena periférica para un análisis de rutina y se congelaron a -70 ºC hasta la finalización del estudio, para la determinación en plasma de la actividad de renina (ARP), la concentración de aldosterona plasmática (CAP) y la determinación de IL-6, sTNF-R1 y NO2/NO3.
Estudios hemodinámicos
Después del ayuno nocturno, se realizó un ecocardiograma en decúbito lateral izquierdo. El volumen sistólico se midió por eco-Doppler bidimensional, usando el método de flujo de salida del ventrículo izquierdo. Existe una buena correlación entre esta técnica y el método de termodilución (24-27). Para minimizar la variabilidad interobservador, el mismo observador (PS) realizó todos los procedimientos durante el estudio. La variabilidad interobservador fue menor del 5%. El gasto cardiaco se calculó como el producto del volumen sistólico y la frecuencia cardiaca. El ecocardiograma basal se comparó con el de 14 voluntarios sanos de la misma edad y género. La presión arterial se determinó de manera no invasiva. Las resistencias vasculares sistémicas se calcularon mediante la siguiente fórmula:
RVS: [(PAM-PVC) ÷ GC] x 80
Donde la PAM es la presión arterial media en mmHg y el GC es el gasto cardiaco en l/min.
El índice cardiaco y el índice de resistencias vasculares sistémicas fueron calculados mediante las siguientes fórmulas:
IC: GC/SCT
IRVS: [(PAM-PVC) ÷ IC] x 80 expresado en Din.seg-1 cm-5 m-2
Donde la SCT es la superficie corporal total y la PVC la presión venosa central en mmHg.
El índice de trabajo sistólico del ventrículo izquierdo (IVEVI) fue usado como marcador de la contractilidad del ventrículo izquierdo (28) y se calculó de la siguiente manera:
IVEVI: (PAS x VS) x 0,0136/SCT y se expresó en g.m.m-2
Los volúmenes del ventrículo izquierdo fueron calculados según el método de De Simone (27). La tensión de la pared del ventrículo izquierdo fue considerada como un marcador indirecto de la postcarga. La medida no invasiva de la tensión de la pared del ventrículo izquierdo al final de la sístole (σm) se calculó de la siguiente forma (28):
σm (es) = 0,334 (PAS) (VTSVIs) / h (1 + h/VTSVIs)
Donde VTSVI es el diámetro telesistólico del ventrículo izquierdo y h es el grosor de la pared posterior del ventrículo izquierdo.
Los estudios ecocardiográficos fueron realizados también en un grupo de 14 voluntarios sanos de la misma edad y género (grupo control).
La presión de la vena suprahepática enclavada, libre y el gradiente de presión venosa hepático se obtuvieron mediante estudio hemodinámico portal en todos los pacientes excepto uno. Para el estudio hemodinámico hepático se utilizaron catéteres con balón de oclusión (OB/5/5/100, Boston Scientific, Cork, Irlanda) acoplado a un monitor Viridian 24CT (Hewlett-Packard) y a un trasductor de presión 6I-HF-1019-01 (Monitoring kit Transpac, Abbott, Sligo, Irlanda). La presión venosa central se estuvo registrando durante todo el procedimiento. El flujo arterial de la arteria mesentérica superior se calculó por eco-Doppler según Iwao y cols. (29).
Parámetros sanguíneos
La actividad de renina plasmática se midió mediante radioinmunoensayo para angiotensina I (angiotensin radioimmunoassay test; Diasorin, Saluggia, Italia). La concentración plasmática de aldosterona se midió mediante radioinmunoensayo directo (aldosterone II RIA diagnostic kit; Diasorin, Saluggia, Italia). Las muestras de suero para determinar sTNF-a-R1se pudieron obtener de 17 pacientes (11 eran del grupo de los tratados con el fármaco). Se eligió este marcador porque ha mostrado un mejor valor pronóstico de supervivencia que el TNF-a en la hepatitis alcohólica (30). La medición del sTNF-a-R1 se realizó mediante inmunoensayo de sensibilidad enzimática amplificada (Biosource Europe, Nivelles, Bélgica). Para medir la interleuquina-6 se utilizó el método ELISA (IBL Immunobiological Laboratories; Hamburg, Alemania). Los nitratos y nitritos se midieron mediante ensayo colorimétrico (Cayman Chemical; Ann Arbor, MI, EE. UU.). Este ensayo está basado en la conversión del ión nitrato en nitrito por la acción de la nitrato-reductasa. El exceso de NADPH es eliminado por la lactato deshidrogenasa y el nitrito se mide mediante la reacción de Griess a 540 nm. El sistema inmunoensayo automático "triturus" se utilizó para minimizar el error aleatorio del recuento manual.
Aleatorización
Un miembro de la farmacia del hospital, que no formaba parte del estudio, realizó las asignaciones de acuerdo con series aleatorias generadas por un ordenador. La secuencia era oculta para la asignación del fármaco. La asignación de códigos fue guardada en sobres sellados en la farmacia del hospital hasta el día del análisis. Los pacientes, al igual que los investigadores, desconocían el tratamiento asignado. Los comprimidos de pentoxifilina (400 mg) y el placebo, de apariencia idéntica, fueron suministrados de acuerdo con el código aleatorio. Los resultados fueron analizados según el principio por intención de tratar.
Objetivos
Los dos objetivos principales fueron predeterminados. El primero fue evaluar la seguridad y el efecto de la pentoxifilina sobre la supervivencia a largo plazo. El segundo fue evaluar la función cardiaca y los parámetros hemodinámicos de la circulación sistémica. El efecto sobre la ARP, CAP TNF-a, IL-6, NO2/NO3, función hepática y renal fueron obtenidos a posteriori, una vez que los investigadores conocieron el tratamiento que había sido repartido a cada paciente.
Análisis estadístico
Los resultados se expresaron como desviación media y desviación estándar en el caso de variables que seguían una distribución normal, y como mediana y rango en aquellas variables que no se distribuían según una curva de Gauss. Se utilizaron los valores delta para realizar comparaciones entre grupos. El test de Wilcoxon y la t de Student se utilizaron para comparar variables pareadas. La correlación entre variables se analizó mediante el test de Pearson y la regresión de Spearman. Se consideraron variables estadísticamente significativas aquellas con una p < 0,05. Para calcular la supervivencia al final del periodo de seguimiento, se utilizaron las curvas logarítmicas de Kaplan-Meier (Fig. 2) y el análisis de supervivencia proporcional de riesgo de Cox ajustado.
Resultados
La mediana del periodo de seguimiento fueron 42 meses (con un rango de 1-84). No hubo diferencias significativas con respecto a la función renal y hepática basal, o los parámetros hemodinámicos sistémicos y portales (Tabla I). Los pacientes que recibieron pentoxifilina tenían una función hepática peor (según el estadio de Child-Pugh) y de ellos, un número significativo de pacientes presentaba un índice de Maddrey ≥ 32.
Si comparamos con el grupo control, los pacientes presentaban un diámetro telesistólico de ventrículo izquierdo menor (30,38 ± 2,8 vs. 26 ± 6.4; p = 0,03) y mayor fracción de eyección del VI (70,5 ± 8 vs. 62 ± 6; p < 0,01). Además, presentaban un menor cociente E/A (1,12 ± 0,25 vs. 1,54 ± 0,36; p < 0,001). Lo que sugiere que los pacientes con cirrosis tienen un territorio vascular arterial de baja resistencia.
La mayoría de los pacientes en ambos grupos permanecieron en abstinencia de alcohol o con un consumo significativamente menor del mismo durante el estudio. Por lo tanto, tanto los pacientes del grupo placebo como los del grupo tratado con pentoxifilina, mejoraron significativamente su función hepática.
La dosis de diuréticos fue similar en ambos grupos a lo largo de todo el estudio (espirolactona: 117 ± 19 vs. 68 ± 64 y furosemida 24,44 ± 28 vs. 12,7 ± 18,5; NS).
El gradiente de presión portal y el flujo en la arteria mesentérica superior no se modificó durante el tratamiento (Tabla II). No hubo variaciones en el aclaramiento de creatinina o en la excreción urinaria de sodio.
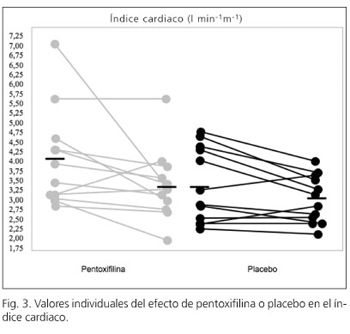
Los pacientes tratados con pentoxifilina, comparados con el grupo placebo, presentaban un aumento del iRVS (Fig. 2) y una reducción del gasto cardiaco (Fig. 3). A pesar de este aumento en el iRVS, no hubo cambios en la fracción de eyección del ventrículo izquierdo, índice de trabajo sistólico del ventrículo izquierdo o en la tensión de la pared del ventrículo izquierdo. Además, la pentoxifilina no parece ejercer ningún efecto sobre el cociente E/A o sobre el grosor de la pared del ventrículo izquierdo (Tabla III).
Existió una correlación directa entre las variables basales del flujo de la arteria mesentérica superior y el GPVH (r = 0,62; p < 0,01).
Los valores del sTNF-a-R1, IL-6, NO2/NO3, ARP o CAP no se modificaron (Tabla IV).
Los efectos secundarios, principalmente molestias o dolor epigástrico, aparecieron con más frecuencia en el grupo tratado con pentoxifilina (Tabla V); 2 pacientes no toleraron el tratamiento por dispepsia, y en un tercer paciente hubo que disminuir la dosis de pentoxifilina al 50% por dolor epigástrico.
No se detectaron diferencias estadísticamente significativas en cuanto a la supervivencia entre los dos grupos (Fig. 4). No se produjo ningún fallecimiento entre los pacientes en estadio B de Child-Pugh que fueron tratados con pentoxifilina. No obstante, el escaso número de pacientes en esta categoría impide un análisis por subgrupos. Después de realizar el ajuste de las covariables que influyen en la supervivencia (tales como el estadio de Child-Pugh, el índice de Maddrey y el gasto cardiaco), el análisis de riesgo proporcional de Cox ajustado no mostró diferencias en cuanto a la supervivencia en ambos grupos, por análisis por intención de tratar (HR = 1,46; IC95%: 0,5-4,28; p = 0,48). No hubo ninguna diferencia por géneros en la supervivencia (HR = 1,32, IC95%: 0,41-4,22; p = 0,46).
Discusión
Los principales hallazgos del estudio fueron la ausencia de beneficio clínico de la pentoxifilina en pacientes con cirrosis alcohólica avanzada. El aumento del índice de resistencias vasculares sistémicas en el grupo de pacientes tratado con pentoxifilina y la disminución del índice cardiaco en pacientes con cirrosis alcohólica descompensada, sin que se hayan producido cambios significativos en cuanto a la supervivencia, función cardiaca, circulación esplácnica o presión portal puede deberse al azar, por un tamaño muestral limitado, considerando que no se traduce en ningún beneficio clínico. El intervalo de confianza fue p = 0,05 y, por lo tanto, en el límite de la significación.
Si comparamos con el grupo control, los pacientes presentaron un diámetro telesistólico del VI menor y una mayor fracción de eyección, lo que es coherente con una disminución de la postcarga arterial en pacientes con cirrosis y ascitis.
El análisis no ajustado de los primeros resultados obtenidos revela que no hay diferencias estadísticamente significativas en cuanto a la supervivencia a largo plazo entre los dos grupos comparados. Un sesgo potencial en relación a la comparación de la supervivencia consistió en que los pacientes que recibieron tratamiento con pentoxifilina presentaban una peor función hepática, según el estadio de Child-Pugh y el índice de Maddrey. Una vez controladas estas potenciales variables de confusión, el análisis de riesgo proporcional de Cox ajustado no mostró ninguna diferencia estadísticamente significativa entre ambos grupos.
Una limitación de este estudio fue el pequeño tamaño muestral en cada grupo. Es probable también que un tamaño muestral mayor hubiera mostrado mayores diferencias en relación con cambios hemodinámicos en la circulación sistémica. Sin embargo, es improbable que un tamaño muestral mayor hubiera mostrado un efecto significativo en la supervivencia, la función cardiaca o en la presión portal, ya que no se ha observado ninguna tendencia con el actual número de pacientes en el grupo tratado con pentoxifilina.
El beneficio hemodinámico observado a corto plazo en el grupo tratado con pentoxifilina no se tradujo en un beneficio clínico real. Cabe especular que para detectar una mejoría en la supervivencia habrían sido necesarias mejorías más sustanciales en los parámetros hemodinámicos, para lo cual habría sido necesario un tratamiento más prolongado con pentoxifilina. No se han apreciado diferencias significativas entre ambos grupos en el cociente E/A o cualquier otro parámetro estructural cardiaco. Esto puede deberse a que el fármaco no es efectivo o a que se necesitan periodos de tratamiento más prolongados para inducir modificaciones estructurales cardiacas. En los pacientes con miocardiopatía dilatada, se ha descrito un aumento en la supervivencia con 6 meses de tratamiento con pentoxifilina (21). Comparado con los controles sanos, los pacientes mostraron un menor volumen telesistólico del ventrículo izquierdo y una mayor fracción de eyección del ventrículo izquierdo, lo que confirma que los pacientes cirróticos con ascitis presentan baja resistencia en el territorio arterial sistémico (31-35). La presión venosa suprahepática fue discretamente superior a lo publicado anteriormente. No obstante, hay que destacar que la persona que realizó la medición de las presiones fue la misma (TH) en todos los pacientes excepto en uno, no objetivándose reducciones significativas en el gradiente de presión venosa hepática tras la administración de pentoxifilina.
La disminución del gasto cardiaco después del tratamiento con pentoxifilina puede ser en parte explicado por la disminución en la precarga o por el efecto cronotrópico negativo, ya que la presión venosa central, la PVSH-L y la frecuencia cardiaca disminuyeron tras el tratamiento. Los indicadores de función inotrópica, tales como el volumen sistólico del VI, la fracción de eyección del VI y la tensión de la pared del VI, permanecieron sin cambios. Además, no se produjo una disminución en los indicadores indirectos de volumen arterial efectivo, tales como la ARP o la CAP después del tratamiento con pentoxifilina. La dosis de diuréticos a lo largo del estudio no puede explicar estas diferencias, ya que fueron las mismas en todos los grupos de pacientes. Por lo tanto, el efecto sobre el índice de resistencias vasculares sistémicas debe ser secundario a una reducción en el gasto cardiaco, sin que se hayan demostrado cambios significativos en el volumen arterial efectivo.
No hubo una disminución en la vasodilatación arteriolar esplácnica (medida en la arteria mesentérica superior) en los pacientes tratados con pentoxifilina.
La función hepática mejoró de la misma manera en los pacientes que recibieron placebo y en los pacientes tratados con pentoxifilina. Este hecho se explica por la abstinencia o la reducción significativa en la ingesta de alcohol que la mayoría de los pacientes reconoce haber mantenido durante la realización del estudio. No observamos ningún beneficio clínico específico sobre la función hepática atribuido a la pentoxifilina.
Aunque el mecanismo subyacente a la mejoría hemodinámica observada es desconocido, no se puede concluir que se deba a la mejoría en la función hepática, tanto en el grupo de la pentoxifilina como en el grupo placebo, ya que esta última ha sido sólo significativa en el grupo de la pentoxifilina. Hay que añadir que no podemos demostrar que la inhibición de la síntesis del TNF-a contribuya a esta mejoría, como se deduce de la falta de reducción significativa en el s-TNF-aR1 en el grupo de la pentoxifilina.
La administración intravenosa de pentoxifilina reduce la presión portal en un estudio experimental (36) y la presión de las varices en pacientes cirróticos como consecuencia de un descenso de la viscosidad sanguínea (23). En nuestro estudio no hemos observado ninguna reducción de la presión portal ni del flujo de la arteria mesentérica superior tras la administración crónica de pentoxifilina. Dos estudios publicados en forma de abstract obtuvieron resultados conflictivos, por ejemplo, no demostraron obtener ningún efecto sobre la presión portal o la hemodinámica esplácnica (37) o una mínima disminución de la presión portal del 13,6%, lo cual no tuvo ninguna repercusión sobre la hemodinámica esplácnica (38). En estudios experimentales con ratas con cirrosis inducida con CCl4, no se observó ningún efecto sobre la presión arterial media, el gasto cardiaco, las resistencias periféricas, el flujo venoso portal, el flujo arterial hepático o el shunt porto-sistémico en ambos grupos de ratas con hipertensión portal; aunque sí se produjo una disminución en la presión portal en las ratas cirróticas (39). No obstante, la dosis intravenosa de pentoxifilina utilizada en los estudios experimentales fue mucho mayor que en la práctica clínica.
En un estudio abierto, Austin y cols. (40) demostraron la ausencia de efecto sobre la presión portal y la hemodinámica sistémica con la pentoxifilina en 9 pacientes, mientras que la talidomida (otro inhibidor del TNF-a) inducía una reducción significativa de la presión portal. No obstante, 7 pacientes se retiraron del estudio y los pacientes recibieron el tratamiento durante sólo dos semanas a pesar de que se había documentado que el beneficio se hacía evidente tras la segunda semana de tratamiento (20). Otro motivo de estas discrepancias fue la diferente dosis utilizada; la pentoxifilina produce disminución de la viscosidad sanguínea a dosis bajas, mientras que concentraciones altas inducen hemólisis (36). En este estudio se utilizó la dosis convencional. A pesar de que no se realizaron mediciones de la viscosidad sanguínea, ninguna disminución de la viscosidad produciría aumento de las resistencias vasculares sistémicas sino que, por el contrario, causaría una disminución de las mismas de acuerdo con la ley de Poiseuille. Además, una disminución en la viscosidad de la sangre provocaría un aumento de la velocidad sanguínea. No obstante, estos cambios en la velocidad máxima del flujo sanguíneo no se detectaron mediante Doppler, por tanto, es improbable que haya habido cambios reológicos relevantes.
Se ha descrito que la pentoxifilina mejora la supervivencia de los pacientes con cirrosis alcohólica severa (20). No obstante, la población de nuestro estudio no es comparable con la del estudio de Akriviadis y cols., ya que se incluyeron únicamente pacientes con un índice de Maddrey superior a 32, mientras que en nuestro estudio sólo 12 de 24 pacientes tenían un índice de Maddrey superior a 32.
La validez externa de nuestro estudio puede estar limitada por los criterios de inclusión estrictos, ya que la presentación clínica de estos pacientes frecuentemente incluye disfunción renal, encefalopatía hepática o infecciones bacterianas; todas las cuales fueron criterios de exclusión del presente estudio. Aunque no se retiró ningún paciente, 2 pacientes en el grupo de la pentoxifilina no toleraron el tratamiento y 1 paciente tuvo que reducir la dosis a la mitad. En la práctica clínica, un aumento gradual de la dosis mejoraría la tolerancia y el cumplimiento del tratamiento para estudios futuros.
En resumen, la pentoxifilina no tiene efecto estadísticamente significativo sobre la supervivencia a corto o largo plazo, la función cardiaca o la presión portal.
Agradecimientos
Queremos agradecer a Ferrer Pharmaceutical Company (Barcelona, España) por suministrar el placebo y al Dr. Carlos Guijarro, la Dra. Patricia San Martín y la Dra. Montserrat Pérez-Encinas por su inestimable colaboración.
Bibliografía
1. Groszman RJ. Hyperdynamic circulation of liver disease 40 years later: pathophysiology and clinical consequences. Hepatology 1994; 20: 1359-63. [ Links ]
2. Martin PY, Schrier RW. Pathogenesis of water and sodium retention in cirrhosis. Kidney Int Suppl 1997; 59: S43-9. [ Links ]
3. Ginés P, Fernández-Esparrach G, Arroyo V, Rodés J. Pathogenesis of ascites in cirrhosis. Semin Liver Dis 1997; 17: 175-89. [ Links ]
4. Shapiro MD, Nicholls KM, Groves BM, Kluge R, Chung HM, Bichet DG, et al. Interrelationship between cardiac output and vascular resistance as determinants of effective arterial blood volume in cirrhotic patients. Kidney Int 1985; 2: 206-11. [ Links ]
5. Schrier RW, Arroyo V, Bernardi M, Epstein M, Henriksen JH, Rodés J. Peripheral arterial vasodilation hypothesis: a proposal for the initiation of renal sodium and water retention in cirrhosis. Hepatology 1988; 8: 1151-7. [ Links ]
6. Llach J, Ginês P, Arroyo V, Rimola A, Titó L, Badalamenti S, et al. Prognostic value of arterial pressure, endogenous vasoactive systems, and renal function in cirrhotic patients admitted to the hospital for the treatment of ascites. Gastroenterology 1988; 94: 482-7. [ Links ]
7. Wong F, Liu P, Lilly L, Bomzon A, Blendis L. Role of cardiac structural and functional abnormalities in the pathogenesis of hyperdynamic circulation and renal sodium retention in cirrhosis. Clin Sci 1999; 97: 259-67. [ Links ]
8. Ma Z, Lee SS. Cirrhotic cardiomyopathy: getting to the heart of the matter. Hepatology 1996; 24: 451-9. [ Links ]
9. Möller S, Henriksen JH. Cirrhotic cardiomyopathy: a pathophysiological review of circulatory dysfunction in liver disease. Heart 2002; 87: 9-15. [ Links ]
10. Möller S, Henriksen JH. Cardiovascular dysfunction in cirrhosis: pathophysiological evidence of a cirrhotic cardiomyopathy. Scand J Gastroenterol 2001; 36: 785-94. [ Links ]
11. Ma Z, Lee SS, Meddingd JB. Effects of altered cardiac membrane fluidity on beta-adrenergic receptor signalling in rats with cirrhotic cardiomyopathy. J Hepatol 1997; 26: 904-12. [ Links ]
12. Liu H, Ma Z, Lee SS. Contribution of nitric oxide to the pathogenesis of cirrhotic cardiomyopathy in bile duct-ligated rats. Gastroenterology 2000; 18: 937-44. [ Links ]
13. López-Talavera JC, Cadelina G, Olchowski J, Merrill W, Groszman RJ. Thalidomide inhibits tumor necrosis factor-a, decreases nitric oxide synthesis, and ameliorates the hyperdynamic circulatory syndrome in portal-hypertensive rats. Hepatology 1996; 23: 1616-21. [ Links ]
14. Wiest R, Das S, Cadelina G, García-Tsao G, Milstien S, Groszmann RJ. Bacterial translocation in cirrhotic rats stimulates eNOS-derived NO production and impairs mesenteric vascular contractility. J Clin Invest 1999; 104: 1223-33. [ Links ]
15. Wiest R, Cadelina G, Milstien S, McCuskey RS, García-Tsao G, Groszmann RJ. Bacterial translocation up-regulates GTP-cyclohydrolase I in mesenteric vasculature of cirrhotic rats. Hepatology 2003; 38: 1508-15. [ Links ]
16. López-Talavera JC, Merrill W, Groszmann RJ. Tumor necrosis factor-alpha: a major contributor to the hyperdynamic circulation in prehepatic portal hypertensive rats. Gastroenterology 1995; 108: 761-7. [ Links ]
17. Genescà J, Martí R, Rojo F, Campos F, Peribáñez V, González A, Castells I, et al. Increased tumour necrosis factor-production in mesenteric lymph nodes of cirrhotic patients with ascites. Gut 2003; 52: 1054-9. [ Links ]
18. Bataller R, Brenner D. Liver fibrosis. J Clin Invest 2005; 115: 209-18. [ Links ]
19. Cogni A, Paul JL, Durbled B, Atger V, Lenoble M, Moatti N. Oxidative modification of high density lipoprotein 3 induced by human polimorphonuclear neutrophils. Protective effect of pentoxifylline. Eur J Biochem 1999; 259: 32-9. [ Links ]
20. Akriviadis E, Botla R, Briggs W, Han S, Reynolds T, Shakill O. Pentoxifylline improves short-term survival in severe acute alcoholic hepatitis: a double-blind, placebo-controlled trial. Gastroenterology 2000; 119: 1637-48. [ Links ]
21. Sliwa K, Skudicky D, Candy G, Wisenbaugh T, Sarelli P. Randomized investigation of effects of pentoxifylline on left ventricular performance in idiopathic dilated cardiomyopathy. Lancet 1998; 351: 1091-3. [ Links ]
22. Pugh RN, Murray-Lyon IM, Dawson JL, Pietroni MC, Williams R. Transection of the oesophagus for bleeding oesophageal varices. Br J Surg 1973; 60: 646-9. [ Links ]
23. Elefthearidis E, Kotzampassi K, Koufogianis D. Modulation of intravariceal pressure with pentoxifylline: a possible new approach in the treatment of portal hypertension. Am J Gastroenterol 1998; 93: 2431-5. [ Links ]
24. Labovitz AJ, Buckingham TA, Habermehl K, Nelson J, Kennedy HL, Williams GA. The effects of sampling site on the two-dimensional echo-Doppler determination of cardiac output. Am Heart J 1985; 109: 327-32. [ Links ]
25. McLennan FM, Haites NE, Mackenzie JD, Daniel MK, Rawles JM. Reproducibility of linear cardiac output measurement by Doppler ultrasound alone. Br Heart J 1986; 55: 25-31. [ Links ]
26. Julius S. Validation of non-invasive measurement of cardiac output. The Ann Arbor experience. Eur Heart J 1990; 11: 144-7. [ Links ]
27. De Simone G, Devereux RB, Ganau A, Hahn RT, Saba PS, Mureddu GF, Roman MJ, et al. Estimation of left ventricular chamber and stroke volume by limited M-mode echocardiography and validation by two-dimensional and Doppler echocardiography. Am J Cardiol 1996; 78: 801-7. [ Links ]
28. Reichek N, Wilson J, St John Sutton M, Plappert TA, Goldberg S, Hirshfeld JW. Noninvasive determination of left ventricular end-systolic stress: validation of the method and initial application. Circulation 1982; 65: 99-108. [ Links ]
29. Iwao T, Oho K, Sakai T, Sato M, Nakano R, Yamayaki M, Toyonaga A, et al. Noninvasive hemodynamic measurements of superior mesenteric artery in the prediction of portal pressure response to propranolol. J Hepatol 1998; 28: 847-55. [ Links ]
30. Spahr L, Giostra E, Frossard JL, Bresson-Hadni S, Rubbia-Brandt L, Hadengue A. Soluble TNF-R1, but not tumor necrosis factor alpha, predicts the 3-month mortality in patients with alcoholic hepatitis. J Hepatol 2004; 41: 229-34. [ Links ]
31. Ginès P, Schrier RW. Hepatorenal syndrome and renal dysfunction associated with liver disease. In: Schrier RW, Gottschalk CW, editors. Diseases of the kidney. Volume 3. 6th ed. Boston: Little Brown; 1997. p. 2099-127. [ Links ]
32. Møller S, Christensen E, Henriksen JH. Continuous blood pressure monitoring in cirrhosis: relations to splanchnic and systemic hemodynamics. J Hepatol 1997; 27: 284-94. [ Links ]
33. Fernández-Seara J, Prieto J, Quiroga J, Zozaya JM, Cobos MA, Rodríguez Eire JL, et al. Systemic and regional hemodynamics in patients with liver cirrhosis and ascites with and without functional renal failure. Gastroenterology 1989; 97: 1304-12. [ Links ]
34. Clària J, Jiménez W, Ros J, Asbert M, Castro A, Arroyo V, et al. Pathogenesis of arterial hypotension in cirrhotic rats with ascites: role of endogenous nitric oxide. Hepatology 1992; 15: 343-9. [ Links ]
35. Fernández-Rodríguez CM, Prieto J, Zozaya JM, Quiroga J, Guitán R. Arteriovenous shunting, hemodynamic changes, and renal sodium retention in liver cirrhosis. Gastroenterology 1993; 104: 1139-45. [ Links ]
36. Sánchez S, Albornoz L, Bandi JC, Gerona S, Mastai R. Pentoxifylline, a drug with rheological effects, decreases portal pressure in an experimental model of cirrhosis. Eur J Gastroenterol Hepatol 1997; 7: 27-31. [ Links ]
37. Feu F, García-Pagán JC, Ruiz del Árbol L, Cirera J, Pizcueta P, Bosch J. Lack of effect of pentoxifylline on portal pressure and hepatic hemodynamics in cirrhosis. J Hepatol 1990; 10: S87 (Abstract). [ Links ]
38. Grange J, Jaillon P, Noblinski B. La pentoxifylline: un traitment potentiel des cirroses avec hipertensión portale? Gastroenterol Clin Biol 1987; 11: 161 A (Abstract). [ Links ]
39. Dagenais M, Pomier-Layrargues G, Rocheleau B, Giroux I, Huet PM. Systemic and splanchnic hemodynamic effects of pentoxifylline in rats with portal hypertension. Clin Sci 1992; 83: 41-5. [ Links ]
40. Austin AS, Mahida YR, Clarke D, Ryder SD, Freeman JG. A pilot study to investigate the use of oxpentifylline (pentoxifylline) and thalidomide in portal hypertension secondary to alcoholic cirrhosis. Aliment Pharmacol Ther 2004; 19: 79-88. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Conrado M. Fernández-Rodríguez.
Unidad de Gastroenterología y Hepatología.
Fundación Hospital Alcorcón.
Avda. Budapest, 1.
28922 Alcorcón, Madrid.
e-mail: cfernandez@fhalcorcon.es
Recibido: 12-05-08.
Aceptado: 19-05-08.