Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.101 no.11 Madrid nov. 2009
Síndrome hepatocerebral crónico secundario a cirrosis por esteatohepatitis no alcohólica
Acquired chronic hepatocerebral degeneration due to cirrhosis from non-alcoholic steatohepatitis
A. Burgos, P. E. Bermejo1, J. L. Calleja, A. Vaquero1 y L. E. Abreu
Servicios de Gastroenterología y Hepatología y 1Neurología. Hospital Universitario Puerta de Hierro. Majadahonda, Madrid
Dirección para correspondencia
RESUMEN
Fundamento y objetivo: el síndrome hepatocerebral crónico, también denominado degeneración hepatolenticular crónica adquirida (DHCA) o pseudo-Wilson, es un trastorno poco frecuente de origen hepático. Los casos recogidos en la literatura son escasos y frecuentemente es confundido con la encefalopatía hepática y con la enfermedad de Wilson. El objetivo de este artículo es presentar un paciente que sufre este trastorno de forma secundaria a una cirrosis por esteatohepatitis no alcohólica.
Caso clínico: se trata de un varón de 54 años diagnosticado de cirrosis en grado funcional de Child-Pugh B9 que presentó un cuadro progresivo de bradilalia, temblor postural y de acción leve y, en ocasiones, desorientación temporoespacial. Los estudios complementarios evidenciaron una elevación de las transaminasas hepáticas y una hiperintensidad de los núcleos basales en la resonancia magnética cerebral estableciéndose el diagnóstico de DHCA.
Conclusiones: la DHCA es un trastorno poco descrito en la literatura que en ocasiones es confundido con otras entidades. Es necesario descartar la presencia de esta patología en los pacientes cirróticos con alteraciones neurológicas tras una enfermedad hepática.
Palabras clave: Degeneración hepatolenticular crónica adquirida. Encefalopatía hepática. Síndrome hepatocerebral. Enfermedad de Wilson.
ABSTRACT
Introduction and objective: acquired chronic hepatocerebral degeneration, acquired hepatolenticular degeneration or pseudo-Wilson is an infrequent disorder with a hepatic origin. Cases in the literature are scarce and it is frequently confused with hepatic encephalopathy and Wilson's disease. The aim of this essay is to report a patient suffering from this disorder due to cirrhosis from non-alcoholic steatohepatitis.
Case report: we present a 54-year-old man diagnosed from cirrhosis grade B9 of the Child Pugh classification. He progressively developed a picture with bradylalia, mild postural and action tremor and spatial and temporal disorientation. Further studies demonstrated an increase of the values of hepatic transaminases and a hiperintensity in the basal nuclei in the cerebral magnetic resonance imaging. Clinical and radiological data established the diagnosis of hepatocerebral degeneration.
Conclusions: acquired chronic hepatocerebral degeneration is a disorder rarely reported in the literature that it is usually confused with other diseases. We alert about the need of having this diagnosis into account with patients developing neurological symptoms after hepatic disease.
Key words: Acquired hepatolenticular degeneration. Hepatic encephalopathy. Acquired chronic hepatocerebral degeneration. Wilson's disease.
Introducción
El síndrome hepatocerebral crónico, degeneración hepatolenticular crónica adquirida (DHCA) o pseudo-Wilson es un trastorno neurológico poco frecuente de origen hepático que se suele confundir con la encefalopatía hepática y con la enfermedad de Wilson. Fue descrita por primera vez por Van Woerkom (1) en 1914 aunque no fue hasta 1965 cuando Victor y cols. (2) realizaron una descripción anatomopatológica completa, que pretendió fundamentalmente hacer una distinción entre esta enfermedad y la enfermedad de Wilson. Los hallazgos neuropatológicos incluían pérdida neuronal laminar cortical "en fragmentos", pérdida neuronal en cerebelo y núcleos basales, proliferación de los astrocitos Alzheimer tipo II y presencia de gránulos citoplasmáticos de glucógeno en los núcleos basales (3,4).
La DHCA se ha descrito en pacientes con enfermedad hepática grave de múltiples causas, fundamentalmente en pacientes con shunt porto-sistémico quirúrgico o espontáneo. Otras causas incluyen enfermedades hepáticas con afección del parénquima como la cirrosis, las hepatitis agudas o crónicas o la hemocromatosis o bien, enfermedades colestásicas como la colangitis esclerosante o la cirrosis biliar primaria. Sin embargo también se han descrito cuadros similares a los de la degeneración hepatolenticular crónica adquirida en pacientes sin evidencia o historia de enfermedad hepática (5).
A pesar de estos antecedentes los casos descritos en la literatura son anecdóticos, muchos aspectos de la enfermedad no están aclarados y los pacientes responden pobremente a la terapia convencional. Presentamos un paciente que sufre este trastorno de forma secundaria a una cirrosis por esteatohepatitis no alcohólica.
Caso clínico
Se trata de un varón de 54 años con los antecedentes de obesidad y diabetes mellitus tipo 2, diagnosticado de cirrosis en grado funcional de Child-Pugh, Model for end Stage Liver Disease (MELD) 19 con signos de hipertensión portal (esplenomegalia, importante circulación colateral y varices esofágicas) de 7 años de evolución que realizaba revisiones periódicas ambulatorias en nuestro servicio. El estudio de hepatopatía convencional fue negativo, incluyendo ausencia de hábito enólico, serologías virales, metabolismo del cobre y del hierro, estudio inmunológico y alfa1-antitripsina. Se realizó una biopsia hepática en la que se objetivó una cirrosis de predominio micronodular y un parénquima hepático con citoplasmas claros, hepatocitos balonizados con hialina de Mallory, frecuente degeneración grasa macrovacuolar, megamitocondrias y ausencia de depósitos de hemosiderina, lo que permitió junto al cuadro clínico el diagnóstico de cirrosis por esteatohepatitis no alcohólica.
Con estos antecedentes, el paciente presentó un cuadro progresivo, de dos meses de evolución de bradilalia, temblor postural y de acción leve y, en ocasiones, desorientación temporoespacial, que no respondió al tratamiento con lactulosa y paramomicina.
En la exploración neurológica, se obtuvo una puntuación en el test minimental de Folstein de 29/30 y en el test del Reloj de 10/10. Destacó la presencia de disartria con bradilalia, temblor leve postural y de acción más acusado en el lado izquierdo sin asterixis, fenómeno de rueda dentada y lentitud de movimientos alternantes en miembro superior izquierdo. Los hallazgos de laboratorio mostraron trombocitopenia de 105.000 plaquetas/dl, actividad de protrombina de 57%, aminotransferasa glutámico purúvica (GPT) 36 U/l, aminotransferasa glutámico-oxalacética (GOT) 52 U/l, bilirrubina 8,1 mg/dl, fosfatasa alcalina 85 U/l, gamma glutamiltronferasa (GGT) 77 U/l, albúmina de 3,3 g/100 ml, glucosa 130 mg/100 ml y lactato deshidrogenasa (LDH) 494 U/l. El resto de parámetros, incluyendo tirotropina (TSH), vitamina B12 y ácido fólico, se encontraron dentro de límites normales. Se realizó un electroencefalograma que mostró datos de lentificación difusa de la actividad cerebral (6 ciclos por segundo), sin asimetrías ni actividad paroxística asociada. En la tomografía computerizada cerebral, se visualizó leucoaraiosis mientras que en la resonancia magnética (RM) cerebral se identificaron lesiones hiperintensas en las secuencias T1 y T2 en los núcleos basales y los pedúnculos cerebrales (Fig. 1). Debido a la sintomatología y pruebas de imagen, se diagnosticó de síndrome hepatocerebral crónico. Se inició tratamiento con lactulosa y paramomicina pero, a pesar de presentar una mejoría inicial, esta se siguió de un deterioro cognitivo progresivo en los meses posteriores, por lo que se programó para trasplante hepático, lo que se consideró como la mejor opción terapéutica ante el fracaso de las medidas habituales.
Discusión
Aunque la fisiopatología de la DHCA no está completamente aclarada, se relaciona con la acumulación de sustancias tóxicas como el amonio, los aminoácidos aromáticos y el manganeso, que se suman a la susceptibilidad de determinadas áreas cerebrales a la hipoperfusión cerebral (3,6-9). En concreto, el manganeso es aclarado por el sistema hepatobiliar y las concentraciones del mismo en sangre periférica y líquido cefalorraquídeo están aumentadas en pacientes con DHCA por lo que se ha postulado que el depósito de manganeso en el cerebro puede inducir degeneración difusa del parénquima cerebral. Otras teo-rías relacionan la DHCA con los mismos mecanismos osmóticos que existen en la mielinolisis pontina-extrapontina, dado que, en muchos casos, la imagen radiológica suele ser similar a la de esta entidad (10).
La variabilidad de síntomas que puede producir es muy amplia. Incluye desde alteraciones cognitivas o psiquiátricas como apatía, letargia, somnolencia o incluso demencia (11-13) hasta trastornos del movimiento entre los que se incluyen corea, distonías focales, temblor postural, mioclonías (8) o parkinsonismo (6), alteraciones del cerebelo como ataxia o disartria (14,15) o mielopatía en forma de mielitis transversal (16-21). Lo más frecuente es la manifestación como alteraciones cognitivas, movimientos anormales o ambos y dentro de este último grupo, el temblor y la corea (3).
La RM cerebral muestra hiperintensidad en la secuencia T1 en los núcleos basales (3,6,7) y se observa con relativa frecuencia atrofia cortical frontoparietal y cerebelosa. Existe una correlación demostrada entre el grado y la extensión de la hiperintensidad en las secuencias T1 y la gravedad de la afección hepática (22,23), pero no para el grado de afectación neurológica (23-26). Aunque la causa de esta hiperintensidad radiológica continúa siendo desconocida, recientes estudios por espectroscopia RM han demostrado que esta lesión es reversible y puede reflejar cambios metabólicos cerebrales como el depósito de sustancias paramagnéticas que no son sometidas al proceso de detoxificación hepático debido a un bypass portocava o a una disfunción hepatocitaria (26).
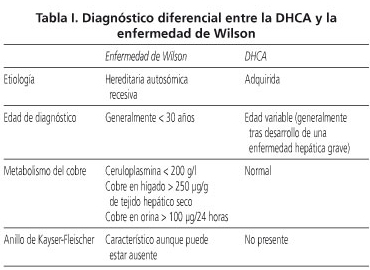
En algunos pacientes se aprecia una hiperintensidad de señal en los núcleos dentados bilateralmente en T2, indistinguible de la enfermedad de Wilson. Los síntomas clínicos, hallazgos neuropatológicos e imágenes en la RM son también similares a los objetivados en la enfermedad de Wilson, por ello a la DHCA también se le denomina pseudo-Wilson. Se pueden establecer ciertas diferencias para discriminar entre una y otra entidades como son la edad de comienzo (superior en la DHCA y habitualmente tras el desarrollo de una hepatopatía), el metabolismo del cobre (alterado únicamente en la enfermedad de Wilson) y presencia o no del anillo de Kayser Fleischer (característico de la enfermedad de Wilson, aunque no siempre presente, y ausente en la DHCA). Las diferencias entre ambas entidades se recogen en la tabla I.
Además, la enfermedad también se distingue de los episodios agudos y transitorios de la encefalopatía hepática: los síntomas neurológicos de esta última desaparecen cuando la enfermedad remite y no se produce daño orgánico cerebral. Sin embargo, los individuos con DHCA generalmente han sufrido varios episodios de encefalopatía hepática previos hasta que posteriormente se produce un daño orgánico y comienzan a desarrollar los síntomas típicos de la DHCA de forma gradual (Tabla II).
Algunos pacientes con DHCA responden a lactulosa (3) o aminoácidos de cadena ramificada (27) además de los correspondientes tratamientos sintomáticos como la levodopa para los síntomas parkinsonianos (6). También se ha descrito que la oclusión de un shunt porto-sistémico es temporalmente efectivo. El trasplante hepático puede ser curativo en casos seleccionados (6-8,27), pero algunos pacientes han sufrido deterioro tras un periodo de aparente mejoría de varios meses (28,29). La recuperación total se ha descrito asociada a la desaparición de la hiperintensidad en los núcleos de la base (19,30,31) aunque esta mejoría no ha sido observada en todos los casos (13). Por otro lado, no se deben olvidar los efectos neurotóxicos que ejercen ciertos inmunosupresores como los inhibidores de la calcineurina (ciclosporina y tacrolimus) utilizados en el tranplante hepático.
La DHCA se trata de una entidad poco frecuente, pero cada vez más diagnosticada en base a hallazgos clínicos y radiológicos. Es necesario descartar la presencia de esta entidad en los pacientes cirróticos en los que fracasa el tratamiento convencional de la encefalopatía hepática.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Aurora Burgos García.
Avda. General Perón, 4, 7o E. 28020 Madrid.
e-mail: burgos.aurora@gmail.com
Recibido: 20-01-09.
Aceptado: 12-02-09.
Bibliografía
1. Van Woerkom W. La Cirrhose hepatique avec alteration dans les centres nerveux evoulant chez de sujets d'age moyen. Nouvelle iconographie de la Salpetriere. Clin Maladies System Nerveux 1914; 7 :41-51. [ Links ]
2. Victor M, Adams RD, Cole M. The acquired (non-Wilsonian) type of chronic hepatocerebral degeneration. Medicine (Baltimore) 1965; 44: 345-96. [ Links ]
3. Jog MS, Lang AE. Chronic acquired hepatocerebral degeneration: case reports and new insights. Mov Disord 1995; 10: 714-22. [ Links ]
4. Levy VG, Cameron E, Ollat H, Opolon P, Darnis F, Contamin F. Chronic hepatic encephalopathies. Acquired cerebral degeneration not due to Wilson's disease. Sem Hop 1983; 59: 1369-73. [ Links ]
5. Saporta MA, Andre C, Bahia PR, Chimelli L, Pais PH, Silva TS, et al. Acquired hepatocerebral degeneration without overt liver disease. Neurology 2004; 63: 1981-2. [ Links ]
6. Burkhard PR, Delavelle J, Du Pasquier R, Spahr L. Chronic parkinsonism associated with cirrhosis: a distinct subset of acquired hepatocerebral degeneration. Arch Neurol 2003; 60: 521-8. [ Links ]
7. Condat B, Dusoleil A, Bernardeau M, Roche A, Pelletier G, Buffet C. Chronic acquired hepatocerebral degeneration: the role of manganese and treatment by endovascular occlusion of a porto-systemic shunt. Gastroenterol Clin Biol 1999; 23: 268-70. [ Links ]
8. Layrargues GP. Movement dysfunction and hepatic encephalopathy. Metab Brain Dis 2001; 16: 27-35. [ Links ]
9. Hawker K, Lang AE. Hypoxic-ischemic damage of the basal ganglia. Case reports and a review of the literature. Mov Disord 1990; 5: 219-24. [ Links ]
10. Kleinschmidt-DeMasters BK, Filley CM, Rojiani AM. Overlapping features of extrapontine myelinolysis and acquired chronic (non-Wilsonian) hepatocerebral degeneration. Acta Neuropathol 2006; 112: 605-16. [ Links ]
11. Schomerus H, Hamster W. Neuropsychological aspects of portal-systemic encephalopathy. Metab Brain Dis 1998; 13: 361-77. [ Links ]
12. Weissenborn K, Ennen JC, Schomerus H, Ruckert N, Hecker H. Neuropsychological characterization of hepatic encephalopathy. J Hepatol 2001; 34: 768-73. [ Links ]
13. Lewis M, Howdle PD. The neurology of liver failure. QJM 2003; 96: 623-33. [ Links ]
14. Park SA, Heo K. Prominent cerebellar symptoms with unusual magnetic resonance imaging findings in acquired hepatocerebral degeneration. Arch Neurol 2004; 61: 1458-60. [ Links ]
15. Lewis MB, MacQuillan G, Bamford JM, Howdle PD. Delayed myelopathic presentation of the acquired hepatocerebral degeneration syndrome. Neurology 2000; 54: 1011. [ Links ]
16. Spencer DC, Forno LS. February 2000: dementia with motor dysfunction in a patient with liver disease. Brain Pathol 2000; 10: 315-6, 9. [ Links ]
17. Spitaleri DL, Vitolo S, Fasanaro AM, Valiani R. Choreoathetosis. Uncommon manifestation during chronic liver disease with portocaval shunt. Riv Neurol 1983; 53: 293-9. [ Links ]
18. Thobois S, Giraud P, Debat P, Gouttard M, Maurizi A, Perret-Liaudet A, et al. Orofacial dyskinesias in a patient with primary biliary cirrhosis: a clinicopathological case report and review. Mov Disord 2002; 17: 415-9. [ Links ]
19. Stracciari A, Guarino M, Pazzaglia P, Marchesini G, Pisi P. Acquired hepatocerebral degeneration: full recovery after liver transplantation. J Neurol Neurosurg Psychiatry 2001; 70: 136-7. [ Links ]
20. Stracciari A, Mattarozzi K, D'Alessandro R, Baldin E, Guarino M. Cognitive functioning in chronic acquired hepatocerebral degeneration. Metab Brain Dis 2008; 23: 155-60. [ Links ]
21. Lee J, Lacomis D, Comu S, Jacobsohn J, Kanal E. Acquired hepatocerebral degeneration: MR and pathologic findings. AJNR Am J Neuroradiol 1998; 19: 485-7. [ Links ]
22. Pujol A, Graus F, Peri J, Mercader JM, Rimola A. Hyperintensity in the globus pallidus on T1-weighted and inversion-recovery MRI: a possible marker of advanced liver disease. Neurology 1991; 41: 1526-7. [ Links ]
23. Pujol A, Pujol J, Graus F, Rimola A, Peri J, Mercader JM, et al. Hyperintense globus pallidus on T1-weighted MRI in cirrhotic patients is associated with severity of liver failure. Neurology 1993; 43: 65-9. [ Links ]
24. Kulisevsky J, Ruscalleda J, Grau JM. MR imaging of acquired hepatocerebral degeneration. AJNR Am J Neuroradiol 1991; 12: 527-8. [ Links ]
25. Krieger S, Jauss M, Jansen O, Theilmann L, Geissler M, Krieger D. Neuropsychiatric profile and hyperintense globus pallidus on T1-weighted magnetic resonance images in liver cirrhosis. Gastroenterology 1996; 111: 147-55. [ Links ]
26. Spahr L, Vingerhoets F, Lazeyras F, Delavelle J, DuPasquier R, Giostra E, et al. Magnetic resonance imaging and proton spectroscopic alterations correlate with parkinsonian signs in patients with cirrhosis. Gastroenterology 2000; 119: 774-81. [ Links ]
27. Ueki Y, Isozaki E, Miyazaki Y, Koide R, Shimizu Z, Yagi K, et al. Clinical and neuroradiological improvement in chronic acquired hepatocerebral degeneration after branched-chain amino acid therapy. Acta Neurol Scand 2002; 106: 113-6. [ Links ]
28. Servin-Abad L, Tzakis A, Schiff ER, Regev A. Acquired hepatocerebral degeneration in a patient with HCV cirrhosis: complete resolution with subsequent recurrence after liver transplantation. Liver Transpl 2006; 12: 1161-5. [ Links ]
29. Papapetropoulos S, Tzakis A, Sengun C, Reddy C, Boukas K, Zitser J, et al. Case of pediatric acquired chronic hepatocerebral degeneration. Pediatr Neurol 2008; 38: 67-70. [ Links ]
30. Parkes JD, Murray-Lyon IM, Williams R. Neuropsychiatric and electro-encephalographic changes after transplantation of the liver. Q J Med 1970; 39: 515-27. [ Links ]
31. Powell EE, Pender MP, Chalk JB, Parkin PJ, StrongR, Lynch S, et al. Improvement in chronic hepatocerebral degeneration following liver transplantation. Gastroenterology 1990; 98: 1079-82. [ Links ]











 texto en
texto en