My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.102 n.6 Madrid Jun. 2010
Factor de crecimiento hepatocitario y hepatitis crónica C
Hepatocyte growth factor and chronic hepatitis C
E. Marín Serrano1, C. Rodríguez Ramos1, F. Díaz García1, L. Martín Herrera1, C. Fernández Gutiérrez del Álamo2 y J. A. Girón González3
Servicios de 1Aparato Digestivo, 2Microbiología y 3Medicina Interna. Hospital Universitario Puerta del Mar. Cádiz
Dirección para correspondencia
RESUMEN
Objetivo: el factor de crecimiento hepatocitario (HGF) es una citocina pleiotrópica producida por las células estrelladas hepáticas, que está implicada en la regeneración y la fibrosis hepática. La concentración sérica del HGF en las enfermedades hepáticas es variable, reflejando daño hepático y disfunción hepatocelular. En este estudio se ha analizado la concentración sérica del HGF en pacientes con hepatitis crónica por virus de la hepatitis C (VHC) y su relación con los datos bioquímicos, histológicos y virológicos.
Pacientes y métodos: se determinó la concentración sérica de HGF mediante ELISA en sándwich y se analizó la correlación entre los niveles del HGF y los datos histológicos (actividad necroinflamatoria, estadio de fibrosis), bioquímicos (transaminasas, actividad de protrombina, albúmina, bilirrubina) y virológicos (carga viral VHC) en 45 pacientes con hepatitis crónica C (HCC). También fueron evaluadas las cifras del HGF en el suero de un subgrupo de pacientes de la muestra original sometidos a tratamiento antiviral con interferón y ribavirina.
Resultados: la concentración sérica del HGF en pacientes con HCC fue significativamente mayor que la medida en controles sanos. Los pacientes con fibrosis hepática significativa (F ≥ 2) tenían una edad significativamente mayor, unas cifras plaquetarias significativamente inferiores y concentraciones séricas significativamente superiores de AST, GGT y HGF, en comparación con aquellos pacientes con un índice de fibrosis F < 2. En el análisis multivariante la concentración de HGF fue la única variable independiente asociada a la fibrosis significativa. El área bajo la curva ROC (receiver operating curve), usando las concentraciones séricas de HGF, mostró valores similares a los obtenidos con otros índices, previamente validados, que estiman fibrosis significativa en pacientes con HCC. Sin embargo, las cifras del HGF no descendieron de modo significativo en aquellos pacientes con respuesta sostenida a tratamiento antiviral.
Conclusión: la concentración sérica del HGF se correlaciona con el índice de fibrosis en pacientes con HCC, pero es un marcador poco sensible para monitorizar la respuesta inducida por el tratamiento antiviral.
Palabras clave: Hepatitis crónica C. Fibrosis hepática. Factor de crecimiento hepatocitario (HGF).
ABSTRACT
Objective: the hepatocyte growth factor (HGF) is a pleiotropic cytokine produced by hepatic stellate cells and implicated in liver regeneration and fibrosis. Serum levels of HGF vary in liver diseases, reflecting hepatic damage and hepatocellular dysfunction. In this study, serum levels of HGF and the relationship between HGF and biochemical, histological and virological data, have been analysed in patients suffering from chronic hepatitis C (CHC).
Patients and methods: serum HGF concentration was measured by ELISA in sandwich in 45 patients with CHC. Correlation between HGF levels and histological (necroinflammatory activity and fibrosis score) and biochemical (transaminases, prothrombin activity, albumin, bilirubin), or virological (hepatitis C virus load) parameters was analyzed. Serum HGF concentration was also studied in a subgroup of the original sample treated with interferon and ribavirin.
Results: sserum HGF concentrations of patients with CHC were significantly higher than those detected in healthy controls. Patients with significant fibrosis (F ≥ 2) had a significantly older age, lower count of platelets and higher values of AST, GGT and HGF, than those patients with a fibrosis score F < 2. HGF concentration was identified by multivariate analysis as the only independent factor associated with significant fibrosis. Moreover, area under receiver operating curve, using HCG levels, showed similar values to those of previously validated non-invasive indexes of fibrosis. However, levels of HGF did not show a significant decrease in patients with a sustained response to anti-virus C therapy.
Conclusion: serum HGF concentration correlates with fibrosis score in patients with CHC, but is insensitive to monitor changes induced by anti-virus C therapy
Key words: Chronic hepatitis C. Liver fibrosis. Hepatocyte growth factor (HGF).
Introducción
Inflamación, apoptosis y respuesta inmune específica son piezas clave en el desarrollo de una adecuada respuesta defensiva antiviral en el huésped (1). No obstante, una respuesta inflamatoria incontrolada resulta nociva y puede generar daño hepático y fibrosis (2). Cuando el hígado es agredido de forma aguda, los hepatocitos muertos mediante apoptosis y/o necrosis son reemplazados mediante regeneración celular y la matriz extracelular reparada y reensamblada mediante un depósito limitado de proteínas. Por el contrario, si el estímulo lesivo se perpetúa en el tiempo, la regeneración celular queda bloqueada y los hepatocitos sustituidos paulatinamente por colágeno fibrilar (3-5).
La regeneración hepática es un proceso con al menos dos pasos críticos: la fase de iniciación o priming, que hace entrar al hepatocito quiescente en competencia replicativa y, la progresión más allá del punto de restricción en la fase G1 del ciclo. Ambas fases se hallan bajo distinto control; mientras que los promotores de la iniciación son el factor de necrosis tumoral alfa y las citocinas de la familia de la interleucina 6, la progresión en el ciclo celular va a ser regulada por factores de crecimiento, fundamentalmente por el factor de crecimiento hepatocitario (HGF) (6,7).
La morbimortalidad del paciente afecto de una hepatitis crónica C (HCC) viene marcada por el desarrollo de fibrosis hepática, la evolución a cirrosis y sus complicaciones (8).
El HGF es una citocina de naturaleza glicoproteica sintetizada por células mesenquimales de diferentes órganos, entre ellos el hígado, implicado en la regeneración hepática (9) y considerado factor pronóstico de enfermedades hepáticas, tales como la HCC. Esto se debe a su relación con el daño y la disfunción hepatocelular y, a su utilidad como marcador tumoral en el diagnóstico del hepatocarcinoma (10-12). Los niveles séricos de HGF en las enfermedades hepáticas son variables, pero muestran una correlación negativa con la concentración de albúmina y el tiempo de protrombina en pacientes cirróticos; individuos en estadio C de Child tienen mayores niveles séricos del HGF que aquellos en estadio A o B (13-15).
En este estudio se ha analizado la concentración sérica del HGF en pacientes con HCC con el objetivo de evaluar la relación entre el HGF y los datos histológicos (actividad necroinflamatoria y fibrosis), bioquímicos (transaminasas, albúmina, bilirrubina y actividad de protrombina) y virológicos (carga viral del virus de la hepatitis C -VHC-). Dado que la concentración sérica del HGF podría reflejar los mecanismos reparadores asociados indisolublemente al daño hepático, se han estudiado asimismo los niveles séricos de HGF de un subgrupo de pacientes de la muestra original sometidos a tratamiento antiviral con interferón y ribavirina, asumiendo que la eliminación del patógeno debiera inducir una regulación a la baja del HGF.
Pacientes y métodos
Pacientes y controles
Se incluyeron en este estudio 45 pacientes diagnosticados de HCC y atendidos en el Servicio de Aparato Digestivo del Hospital Universitario Puerta del Mar, Cádiz.
Se definieron los siguientes criterios de inclusión: a) infección por el VHC (demostración de la presencia de anticuerpos anti-VHC mediante ELISA de tercera generación y viremia demostrada mediante reacción en cadena de la polimerasa (PCR); b) hipertransaminasemia mantenida al menos durante 6 meses; y c) biopsia hepática compatible, realizada en los 6 meses previos a la inclusión en el estudio.
Los criterios de exclusión fueron los siguientes: a) antígeno de superficie del virus de la hepatitis B positivo; b) anticuerpos frente al virus de la inmunodeficiencia humana; c) otras enfermedades hepáticas: infecciosas, tóxicas, autoinmunes, tumorales, biliares o vasculares; d) etilismo activo y/o consumo de otras drogas; f) evidencia clínica y/o analítica de descompensación hepática (Child B-C); g) evidencia clínica de infección, incluida la peritonitis bacteriana espontánea (PBE); h) tratamientos que pudieran modificar la determinación del HGF (esteroides, antiinflamatorios no esteroideos o drogas inmunodepresoras); e i) transfusión de glóbulos rojos o de plasma en el mes previo a la inclusión en el estudio; fue excluida ante la posibilidad de interferencias y/o contaminación entre estos elementos y la respuesta antiinflamatoria o inmune del huésped.
Se seleccionaron 15 controles sanos trabajadores del hospital; la ausencia de patología se confirmó mediante historia clínica, exploración física y datos de laboratorio. Se obtuvo el consentimiento informado de los pacientes y controles. El estudio siguió los principios definidos en la Declaración de Helsinki de 1975 y fue aprobado por el Comité Ético del Hospital.
Protocolo de tratamiento anti-VHC
Las indicaciones para tratamiento con interferón alfa y ribavirina se basaron en datos clínicos, histológicos y virológicos, según el protocolo de consenso vigente en el momento de la inclusión (16,17). Se exigió la presencia de una fibrosis hepática > 1 para el inicio de tratamiento.
Se definieron como criterios de exclusión para dicho tratamiento antiviral: a) terapia previa con interferón o ribavirina; b) índice de Karnofsky < 80; c) un recuento absoluto de neutrófilos < 1.500 células/ml, de plaquetas < 90.000 células/ml o una hemoglobina < 11,0 g/dl; d) hemólisis; e) enfermedad psiquiátrica; f) comorbilidad: insuficiencia cardiaca descompensada, enfermedad pulmonar con limitación funcional, insuficiencia renal crónica, enfermedades autoinmunes, trastornos convulsivos, retinopatía severa, trasplante previo con injerto funcionante; g) gestación o lactancia; y h) contraindicación para el uso de anticonceptivos orales.
A partir de la muestra inicial, se administró tratamiento antiviral combinado a 25 pacientes con HCC. La duración del tratamiento era de 48 semanas para los genotipos 1 ó 4 y de 24 semanas para los genotipos 2-3. La dosis de ribavirina de 800 mg/día para los genotipos 2 ó 3 y ajustada al peso (de 1.000 a 1.200 mg/día) para los genotipos 1 ó 4. Tras el inicio de tratamiento antiviral, los pacientes fueron sometidos a seguimiento en las semanas 0, 2, 4, 6, 8, 12, 24, 48 y 72, mediante evaluación clínica, analítica básica y monitorización de tratamiento, en relación con la aparición de efectos adversos y necesidad de modificación de dosis y/o suspensión del mismo. En la semana 12 de tratamiento la carga viral periférica del VHC en pacientes con genotipo 1-4 era cuantificada; en aquellos casos donde la viremia no hubiese descendido al menos dos logaritmos (respuesta virológica precoz) en relación con la carga viral basal, el tratamiento era suspendido. La viremia periférica era nuevamente determinada al finalizar el tratamiento y en el caso de que esta fuese negativa, volvía a medirse a los 6 meses de seguimiento.
Se definieron como criterios de abandono de tratamiento: a) necesidad de tratamiento inmunosupresor; b) por decisión propia del paciente; y c) descenso de la carga viral inferior a dos logaritmos en a la semana 12 de tratamiento, para los genotipos 1-4.
Los pacientes fueron clasificados en tres grupos según la respuesta a tratamiento: a) no respondedores: descenso inferior a dos logaritmos en la carga viral a la semana 12 de tratamiento o carga viral detectable al finalizar el tratamiento; b) respuesta sostenida, cuando la carga viral determinada mediante PCR era negativa tanto al finalizar el tratamiento como a los 6 meses de seguimiento; y c) respuesta parcial (recaídas), si la carga viral determinada mediante PCR era negativa al finalizar el tratamiento y positiva a los 6 meses de seguimiento.
Los niveles séricos de HGF fueron cuantificados en situación basal, al finalizar el tratamiento y, en respondedores también a los seis meses tras tratamiento.
Determinaciones analíticas y estudio histológico
La determinación de hemograma, glucemia, iones, función renal y hepática, láctico deshidrogenasa, proteínas totales, albúmina, colesterol total, triglicéridos, ácido úrico, alfa-1-antitripsina, ceruloplasmina, porfirinas, parámetros de autoinmunidad (ANA, AMA, SMA, LKM, TPO y anti-tiroglobulina), hormonas tiroideas, metabolismo del hierro, actividad de protrombina y serología para el VHA, VHB y VIH fueron realizados de forma automatizada en el laboratorio del Hospital Universitario Puerta del Mar.
Para establecer el diagnóstico de infección por el VHC se solicitó enzimoinmunoanálisis de tercera generación (EIA-3) (Ortho Diagnostic System, Raritan, NJ, EE. UU.) e inmunoblot recombinante de segunda generación (RIBA-2) (Ortho Diagnostic System, Raritan, NJ, EE. UU.). Para la cuantificación de la carga viral del VHC se utilizó la reacción en cadena de la polimerasa Monitor HCV Amplicor (Roche Diagnostic Systems, Neuilly, Francia). El estudio del genotipo viral se llevó a cabo mediante "line probe assay" (INNO-LiPA HCV; Innogenetics, Antwerp, Belgium).
Las muestras de sangre recogidas en tubos estériles Vacutainer (Becton-Dickinson Vacutainer System, Meylan Cedex, Francia) a controles sanos y a pacientes con HCC fueron centrifugadas (3.500 rpm durante 15 min a 4 oC) y almacenadas en menos de 4 horas a -80 oC en tubos estériles de polietileno (Biofreeze, Costar, EE. UU.) hasta que el HGF fue determinado mediante ELISA en sándwich (R&D, Minneapolis, MI, EE. UU.) de acuerdo a las instrucciones del fabricante, siendo el límite mínimo de detección menor de 40 pg/ml.
Las biopsias hepáticas (cilindros hepáticos de más de 10 mm) fueron fijadas en parafina y teñidas con hematoxilina-eosina y con tricrómico de Masson. Las muestras fueron evaluadas por un patólogo experto. Para cada muestra se estableció un índice definido por el grado de actividad necroinflamatoria y el estadio de fibrosis, según el Índice de Actividad Histológica (Histology Activity Index -HAI-) propuesta por Knodell (18) y modificada por Scheuer y Desmet (19).
Índices predictivos de fibrosis
Distintos autores han validado modelos no invasivos que predicen la severidad de la fibrosis hepática mediante tests de laboratorio utilizados en la práctica clínica habitual. Para este estudio hemos seleccionado dos de estos índices elaborados con el objetivo de discriminar fibrosis significativa (F ≥ 2) y que han sido sometidos a validación interna y externa (20,21). El índice de Forns y cols. se calcula aplicando la siguiente ecuación de regresión:
7.811 - 3.131 ln (plaquetas, 109/l) + 0,781 ln (GGT, UI/l) + 3.467 ln (edad, años) - 0,014 (colesterol, mg/dl).
El índice de Wai y cols., conocido como índice APRI, se calcula dividiendo el valor de AST (UI/l), expresado como el número de veces por encima de la concentración considerada como límite alto de la normalidad (LAN), por el valor absoluto de plaquetas (109/l):
AST (/LAN) x 100/plaquetas (109/l).
Análisis estadístico
Las variables cuantitativas fueron expresadas a través de la media y el intervalo de confianza para la media al 95% y las cualitativas como número absoluto y porcentaje. La comparación de las variables cualitativas entre dos grupos se efectuó mediante la prueba de la Chi-cuadrado, o bien con la prueba exacta de Fisher. Los datos de dos grupos independientes fueron comparados con el test de la U de Mann-Whitney. La significación de los parámetros de cada grupo fue evaluada mediante el test de Wilcoxon. Las relaciones entre variables cuantitativas se establecieron mediante estudio de correlaciones bivariadas.
Se estudió la relación entre las variables bioquímicas y el índice de fibrosis hepática. Las variables con significación estadística fueron introducidas en un modelo de regresión logística, donde una fibrosis ≥ 2 fue la variable dependiente. La capacidad predictora del modelo fue evaluada mediante curvas ROC (receiver operating characteristic curves).
Las diferencias fueron consideradas estadísticamente significativas si p < 0,05. El análisis estadístico se ha llevado a cabo mediante el software SPSS versión 11.5 (SPSS Inc, Chicago, Illinois, EE. UU.).
Resultados
Características basales y relación de HGF con fibrosis hepática
Los caracteres demográficos, virológicos e histológicos de los pacientes con HCC se muestran en la tabla I. Las concentraciones basales del HGF fueron significativamente mayores en enfermos que las detectadas en los controles sanos [3,08 (3,01-3,15) vs. 2,73 (2,55-2,87) Log pg/ml, p < 0,001].
La concentración sérica del HGF en pacientes con HCC mostró una correlación positiva con las siguientes variables: edad (r = 0,37, p = 0,013), AST (r = 0,51, p = 0,000), ALT (r = 0,36, p = 0,015), gammaglutamiltranspeptidasa (GGT) (r = 0,48, p = 0,001) e índice de fibrosis (r = 0,55, p = 0,000). Sin embargo, HGF no mostró una relación significativa con la carga viral del VHC (r = -0,04, p = 0,799), actividad necroinflamatoria (r = 0,20, p = 0,211), o parámetros relacionados con la función hepática, tal como la bilirrubina (r = -0,12, p = 0,432), albúmina (r = -0,11, p = 0,478) o actividad de protrombina (r = 0,02, p = 0,907).
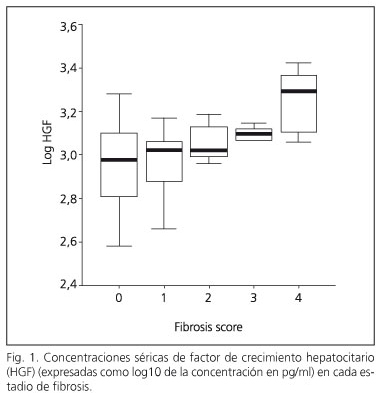
Los pacientes con HCC se clasificaron en dos grupos en función de la presencia de fibrosis clínicamente significativa en la biopsia hepática (pacientes con F < 2 y F ≥ 2). Aquellos pacientes con un índice de fibrosis F ≥ 2, tenían una edad significativamente mayor, unas cifras plaquetarias significativamente menores y unas concentraciones séricas de AST, GGT y HGF significativamente superiores que aquellos pacientes con un índice de fibrosis F < 2. El análisis multivariante mostró que las concentraciones séricas de HGF fueron la única variable independiente asociada con la fibrosis clínicamente significativa (Tabla I). Las concentraciones séricas del HGF en cada uno de los estadios de fibrosis se muestran en la figura 1.
Analizamos a continuación la capacidad de los índices no invasivos de fibrosis para predecir fibrosis hepática en nuestra muestra. El área bajo las curvas ROC basadas en los modelos de Forns y cols. y de Wai y cols., así como la basada en las concentraciones séricas de HGF fueron similares (0,769, 0,779 y 0,759, respectivamente) (Fig. 2).
Evolución tras tratamiento antiviral
Un grupo de 25 pacientes recibió tratamiento combinado frente al VHC: veinte pacientes (80%) fueron tratados con interferón alfa-2a o alfa-2b a dosis de 3 millones, 3 veces por semana y, a cinco pacientes (20%) se les administró interferón pegilado alfa-2a a dosis de 180 mg por vía subcutánea cada semana.
En función de la respuesta a tratamiento, los pacientes fueron clasificados como respondedores (10 casos, 40,0%), recaídas (3 casos, 12,0%) y no respondedores (12 casos, 48,0%). Con el objetivo de analizar la evolución de la concentración sérica de HGF durante el tratamiento, los pacientes fueron divididos en dos grupos: pacientes con respuesta sostenida a tratamiento (respondedores) y aquellos sin respuesta (no respondedores y recaídas). Aquellos pacientes con respuesta sostenida a tratamiento presentaron un perfil genotípico del VHC más favorable, así como unas cifras significativamente menores de ferritina y de carga viral, en relación con aquellos pacientes no respondedores. En ambos grupos se analizaron los niveles de HGF a nivel basal y al finalizar el tratamiento y en respondedores también tras seis meses de seguimiento. En el grupo de respondedores, la concentración de HGF basal tras finalizar el tratamiento y tras seis meses de seguimiento fue de 3,01 (2,92-3,09), 3,02 (2,79-3,17) y 2,93 (2,79-3,046) Log pg/ml, respectivamente, mientras que en el grupo de no respondedores, la concentración de HGF basal y al finalizar el tratamiento fue de 2,96 (2,58-3,17) y 2,96 (2,69-3,33), respectivamente.
Los niveles séricos del HGF no se modificaron al finalizar el tratamiento antiviral en ambos grupos y, tanto a nivel basal como al final del tratamiento, la concentración sérica de HGF en pacientes con o sin respuesta completa a tratamiento fue similar (p > 0,05).
Discusión
El HGF, identificado y clonado inicialmente como un potente mitógeno de hepatocitos maduros, muestra además propiedades antiapoptóticas, angiogénicas e inmunoreguladoras (22). En este trabajo, nuestra hipótesis de trabajo plantea que la concentración sérica del HGF podría reflejar los mecanismos reparadores indisolublemente asociados con el daño hepático.
El HGF está producido mayoritariamente en el hígado por las células estrelladas (22), que son el principal productor de colágeno hepático y en consecuencia consideradas cruciales en el desarrollo de fibrosis hepática (23). Mediante un mecanismo de acción autocrino o paracrino, el HGF disminuye la expresión de colágeno en modelos animales (24). Este efecto antifibrosante del HGF parece deberse a la supresión de la expresión del factor fibrogénico conocido más potente, el factor de crecimiento transformante b1 (TGF-b1), que impide la proliferación y activación de las células estrelladas (25). Además, HGF inhibe la síntesis de colágeno I y IV (26) y restaura la actividad colagenasa en las células estrelladas (27). Entonces podríamos decir que las células estrelladas en respuesta a un estímulo lesivo mantenido intentan reparar la lesión hepática, no sólo incrementando el depósito y alterando la composición de la matriz extracelular, sino induciendo la regeneración hepática y regulando a la baja el exceso de secreción de colágeno a través del HGF. Por consiguiente, la elevación de los niveles séricos del HGF detectados en nuestro trabajo en pacientes con HCC, debería ser considerada como reactiva y, posiblemente, como un mecanismo compensatorio implicado en la reparación del daño hepático. Esto explicaría los valores del HGF significativamente más elevados en pacientes con mayor fibrosis hepática. De hecho, se detectó una correlación positiva entre la concentración sérica del HGF y estadios avanzados de fibrosis hepática. Es más, la curva ROC, usando el HGF como índice no invasivo predictor de fibrosis, fue similar a la obtenida por otros modelos validados como el de Forns y cols. y Wai y cols. Obviamente, estos datos necesitan ser confirmados en un grupo de validación para demostrar su aplicabilidad en la práctica clínica. Por tanto, según los datos aportados es nuestro estudio, HGF podría ser un marcador sérico útil de fibrosis clínicamente significativa en pacientes con HCC. La importancia del HGF, no sólo fisiopatológica sino pronóstica, debería en consecuencia ser considerada.
La fibrosis hepática es definida en la actualidad como un proceso dinámico que podría ser interrumpido, reducido e incluso revertido mediante terapias antifibrosantes. El IFN-a es una citocina multifactorial que lograría, no sólo prevenir el desarrollo de fibrosis hepática, sino degradar las fibras de colágeno mediante la inhibición de la secreción del TGF-b1 (al igual que el HGF), impidiendo la activación de las células estrelladas hepáticas y estimulando su apoptosis (28). Por tanto, el tratamiento de la HCC con interferón y ribavirina, además de resolver la infección del VHC en el 40-60% de los casos, mejoraría el índice METAVIR de fibrosis en 0,88 unidades en pacientes con respuesta sostenida (29) y revertiría casi el 50% de las cirrosis (30). Hasta ahora, sólo unos cuantos trabajos han analizado la relación entre el HGF y el tratamiento de la HCC (15, 31). En nuestro estudio, los niveles de HGF no fueron útiles para estimar la eficacia del tratamiento.
En conclusión, el HGF, una glicoproteína sintetizada por las células estrelladas, se correlaciona con el índice de fibrosis en pacientes con HCC. Sus niveles séricos pudieran ser, en caso de validarse, útiles como marcador no invasivo de fibrosis hepática. Sin embargo, la determinación de HGF es insensible para monitorizar los cambios inducidos por el tratamiento frente al VHC.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Eva Marín Serrano.
Servicio de Aparato Digestivo.
Hospital Universitario Puerta del Mar.
Avda. Ana de Viya, 21. 11009 Cádiz.
email: evamarins@hotmail.com
Recibido: 13-10-09.
Aceptado: 22-01-10.
Bibliografía
1. Valiente N, D'Andrea A, Corta S, Lechner F, Klenerman P, Nuti S, et al. Life, activation and death of intrahepatic lymphocytes in chronic hepatitis C. Immunol Rev 2000; 174: 77-89. [ Links ]
2. Winwood PJ, Arthur MJ. Kupffer cells: their activation and role in animal models of liver injury and human liver disease. Semin Liver Dis 1993; 13: 50-9. [ Links ]
3. Bataller R, Brenner DA. Liver fibrosis. J Clin Invest 2005; 115: 209-18. [ Links ]
4. Friedman SL. Liver fibrosis-from bench to bedside. J Hepatol 2003; 38 (Supl. 1): S38-S53. [ Links ]
5. Marín Gabriel JC, Solís Herruzo JA. Predicting liver fibrosis with non-invasive tests-a hope for the future. Rev Esp Enferm Dig 2008; 100: 605-10. [ Links ]
6. Fausto N. Liver regeneration. J Hepatol 2000; 32: 19-31. [ Links ]
7. Zimmermann A. Liver regeneration. Nephrol Dial Transplant 2004; 19 (Supl. 4): iv6-iv10. [ Links ]
8. Poynard T, Bedossa P, Opolon P. Natural history of liver fibrosis progression in patients with chronic hepatitis C. Lancet 1997; 349: 825-32. [ Links ]
9. Xue F, Takahara T, Yata Y, Kuwabara Y, Shinno E, Nonome K, et al. Hepatocyte growth factor gene therapy accelerates regeneration in cirrhotic mouse livers after hepatectomy. Gut 2003; 52: 694-700. [ Links ]
10. Yamagami H, Moriyama M, Tanaka N. Detection of serum and intrahepatic human hepatocyte growth factor in patients with type C liver diseases. Intervirology 2001; 44: 36-42. [ Links ]
11. Yamagami H, Moriyama M, Matsumura H, Aoki H, Shimizu T, Saito T, et al. Serum concentrations of human hepatocyte growth factor is a useful indicator for predicting the occurrence of hepatocellular carcinomas in C-viral chronic liver diseases. Cancer 2002; 95: 824-34. [ Links ]
12. Okano J, Shiota G, Kawasaki H. Expression of hepatocyte growth factor (HGF) and HGF receptor (c-met) proteins in liver diseases: an immunohistochemical study. Liver 1999; 19: 151-9. [ Links ]
13. Shiota G, Okano J, Kawasaki H, Kawamoto T, Nakamura T. Serum hepatocyte growth factor levels in liver diseases: clinical implications. Hepatology 1995; 21: 106-12. [ Links ]
14. Bilezikci B, Haberal AN, Demirhan B. Hepatocyte growth factor in patients with three different stages of chronic liver disease including hepatocellular carcinoma, cirrhosis and chronic hepatitis: an immunohistochemical study. Can J Gastroenterol 2001; 15: 159-65. [ Links ]
15. Anatol P, Robert F, Danuta P. Effect of interferon alpha2b plus ribavirin treatment on selected growth factors in respect to inflammation and fibrosis in chronic hepatitis C. World J Gastroenterol 2005; 11: 1854-8. [ Links ]
16. McHutchison PG, Poynard T. Combination therapy with interferon plus ribavirin for initial treatment of chronic hepatitis C. Semin Liver Dis 1999; 19: 57-65. [ Links ]
17. Bisceglie DI, Hoofnagle JH. Optimal therapy of hepatitis C. Hepatology 2002; 36: S121-S127. [ Links ]
18. Knodell RG, Ishak KG, Black WC, Chen TS, Craig R, Kaplowitz N, et al. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology 1981; 1: 431-5. [ Links ]
19. Desmet VJ, Gerber M, Hoofnagle JH, Manns M, Scheuer PJ. Classification of chronic hepatitis: diagnosis, grading and staging. Hepatology 1994; 19: 1513-20. [ Links ]
20. Forns X, Ampurdanès S, Llovet JM, et al. Identification of chronic hepatitis C patients without hepatic fibrosis by a simple predictive model. Hepatology 2002; 36: 986-92. [ Links ]
21. Wai CT, Greeson JK, Fontana RJ, Kalbfleisch JD, Marrero JA, Conjeevaram HS, et al. A simple non-invasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology 2003; 38: 518-26. [ Links ]
22. Stuart KA, Riordan SM, Lidder S, Crostella L, Willians R, Skouteris GG. Hepatocyte growth factor/scatter factor induced intracellular signalling. Int J Exp Pathol 2000; 81: 17-30. [ Links ]
23. Friedman SL, Roll FJ, Boyles J, Bissell DM. Hepatic lipocytes: the principal collagen-producing cells of normal rat liver. Proc Natl Acad Sci USA 1985; 82: 8681-5. [ Links ]
24. Matsuda Y, Matsumoto K, Yamada A, Ichida T, Asakura H, Komoriya Y, et al. Preventive and therapeutic effects in rats of hepatocyte growth factor infusión on liver fibrosis/cirrhosis. Hepatology 1997; 26: 81-9. [ Links ]
25. Yasuda H, Imai E, Shiota A, Fujise N, Morinaga T, Higashio K. Antifibrogenic effect of a deletion variant of hepatocyte growth factor on liver fibrosis in rats. Hepatology 1996; 24: 636-42. [ Links ]
26. Sato M, Kakubari M, Kawamura M, Sugimoto J, Matsumoto K, Ishii T. The decrease in total collagen fibers in the liver by hepatocyte growth factor after formation of cirrhosis induced by thioacetamide. Biochem Pharmacol 2000; 59: 681-90. [ Links ]
27. Osaki I, Zhao G, Mizuta T, Ogawa Y, Hara T, Kajihara S, et al. Hepatocyte growth factor induces collagenase (matrix metalloproteinase-1) via the transcription factor Ets-1 in human hepatic stellate cell line. J Hepatol 2002; 36: 169-78. [ Links ]
28. Chang XM, Chang Y, Jia A. Effects of interferon alpha on expression of hepatic stellate cell and transforming growth factor-b1 and a-smooth muscle actin in rats with hepatic fibrosis. World J Gastroenterol 2005; 11: 2634-6. [ Links ]
29. Shiratori Y, Imazeki F, Moriyama M, Yano M, Arakawa Y, Yokosuka O, et al. Histologic improvement of fibrosis in patients with hepatitis C who have sustained response to interferon therapy. Ann Intern Med 2000; 132: 512-24. [ Links ]
30. Poynard T, McHutchison J, Manns M, Trepo C, Lindsay K, Goodman Z, et al. Impact of pegylated interferon alfa-2b and ribavirin on liver fibrosis in patients with chronic hepatitis C. Gastroenterology 2002; 122: 1303-13. [ Links ]
31. Moriyama M, Matsumura H, Watanabe A, Oshiro S, Aoki H, Shimizo T, et al. Evaluation of serum concentrations of human hepatocyte growth factor during interferon therapy for chronic hepatitis C. Intervirology 2005; 48: 223-9. [ Links ]











 text in
text in