Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.105 no.4 Madrid abr. 2013
https://dx.doi.org/10.4321/S1130-01082013000400003
Influencia de la edad avanzada en la morbimortalidad del cáncer gástrico tras la cirugía con intención curativa
The influence of advanced age on the morbi-mortality of gastric cancer after curative surgery
Araceli Mayol-Oltra, Roberto Martí-Obiol, Fernando López-Mozos, Gloria Báguena-Requena y Joaquín Ortega-Serrano
Unidad de Cirugía Esofagogástrica. Servicio de Cirugía General y del Aparato Digestivo. Hospital Clínico Universitario. Valencia
Dirección para correspondencia
RESUMEN
Introducción: el cáncer gástrico (CG) es la cuarta causa de muerte en ambos sexos por cáncer en España tras los tumores de pulmón, colorrectal, mama y próstata. La cirugía continúa siendo el único tratamiento potencialmente curativo en el cáncer gástrico localizado.
Objetivo: evaluar y comparar los aspectos clínicos, quirúrgicos, el desarrollo de complicaciones postoperatorias y la evolución de los pacientes mayores de 75 años comparados con los pacientes menores de 75 años intervenidos en nuestro centro.
Material y métodos: estudio comparativo retrospectivo desde marzo de 2003 a junio de 2011. Se diagnosticaron 166 casos de CG, de ellos, 109 (65 %) fueron intervenidos con intención curativa, estableciéndose dos grupos: grupo M: ≥ 75 años (41 pacientes) y grupo m: < 75 años (68 pacientes). Se analizaron edad, sexo, comorbilidades, localización tumoral, estadio clínico, administración de quimioterapia perioperatoria, técnica quirúrgica, complicaciones postoperatorias, recidiva y mortalidad por la neoplasia.
Resultados: como diferencias estadísticamente significativas entre ambos grupos de edad fueron una mayor presencia de comorbilidades cardiovasculares en el grupo M, así como mayor mortalidad postoperatoria por causa médica. Asimismo, una menor proporción de pacientes del grupo M recibieron quimioterapia preoperatoria y se les realizó linfadenectomía D1. Sin embargo, la tasa de recidivas, local y sistémica, y la supervivencia global fueron similares en ambos grupos.
Conclusiones: la edad no debe ser considerada como contraindicación para realizar cirugía curativa del CG, sino que debe ser el estado general y las comorbilidades las que sienten la contraindicación quirúrgica.
Palabras clave: Cáncer. Estómago. Anciano. Cirugía. Linfadenectomía. Tratamiento.
ABSTRACT
Introduction: gastric cancer (GC) is the fourth leading cause of cancer death in Spain after lung, colorectal, breast and prostate tumours. Surgery remains the only potentially curative treatment in localized gastric cancer.
Objective: the aim of our study is to evaluate and compare the clinical and surgical aspects, development of postoperative complications and outcomes of patients over 75 years old compared with younger patients in our centre.
Material and methods: comparative retrospective study, from March 2003 to June 2011. We diagnosed 166 cases of GC, 109 (65 %) underwent curative surgery. Two groups were settled: group M: ≥ 75 years (41 patients) and group m: < 75 years (68 patients). We analyzed age, sex, comorbidities, tumour location, clinical stage, perioperative chemotherapy, surgical technique, postoperative complications, recurrence and mortality from cancer.
Results: a more frequent presence of cardiovascular comorbidities and a greater postoperative mortality by medical causes were the only significant differences between both groups. Also, a lower proportion of patients in group M received preoperative chemotherapy and underwent D1 lymphadenectomy. However, the rate of local and systemic recurrence and overall survival were similar in both groups.
Conclusions: age should not be considered a contraindication for curative surgery on GC. The general condition and comorbidities are more important to contraindicate surgical treatment.
Key words: Cancer. Stomach. Elderly. Surgery. Lymphadenectomy. Treatment
Introducción
El cáncer gástrico (CG) es la cuarta causa de muerte por cáncer en ambos sexos en España tras los tumores de pulmón, colorrectal, mama y próstata (1). El CG se presenta con mayor frecuencia a partir de los 60 años y su incidencia aumenta con la edad (2,3). En las últimas décadas ha aumentado la proporción de pacientes mayores de 80 años con CG pasando de un 3 a un 17 % en Japón y de un 5 a un 25 % en Occidente (4).
La cirugía continúa siendo el único tratamiento potencialmente curativo en el cáncer gástrico localizado (1,5-8). Según Matsushita y cols. (9) en los casos de CG avanzado en pacientes mayores de 80 años, la tasa de supervivencia a los 3 años es del 36 % en los casos en los que se realiza cirugía y nula en los casos que no reciben tratamiento quirúrgico. Este hecho avala que la cirugía debe ser empleada en pacientes ancianos, aunque tradicionalmente se ha considerado que la morbilidad postoperatoria tras cirugía mayor es más elevada en estos pacientes, quizá debido a la mayor existencia de comorbilidades en ellos (10).
Últimamente se ha observado un aumento en la incidencia de cánceres gástricos proximales y un descenso de los de la porción distal, con lo que se plantea la necesidad de realizar una cirugía cada vez más agresiva, como es la gastrectomía total, en pacientes cada vez más mayores (1,2,11,12).
El objetivo de nuestro estudio es evaluar o comparar los aspectos clínicos, quirúrgicos, el desarrollo de complicaciones postoperatorias y la evolución en cuanto a recidiva y supervivencia de los pacientes mayores de 75 años comparados con los pacientes menores de 75 años intervenidos en nuestro centro.
Material y métodos
Desde marzo de 2003 a junio de 2011 se diagnosticaron 166 casos de CG en nuestro hospital. De ellos, 109 (65 %) fueron intervenidos con intención curativa y cirugía R0 siendo estos los pacientes analizados en el presente estudio. Los 57 casos restantes fueron tratados de forma paliativa. Los datos de estos pacientes son recogidos de forma prospectiva en una base de datos.
Se establecieron dos grupos en función de la edad: grupo M: ≥ 75 años y grupo m: < 75 años. La elección de la edad de corte en 75 años fue en base a los artículos revisados para dicho estudio.
El diagnóstico se realizó mediante endoscopia y biopsia y el estudio de extensión mediante TC toraco-abdomino-pélvica en todos los casos. En caso de dudas de afectación metastásica se utilizó la RM o la PET. Para el estudio de la afectación de la pared gástrica utilizamos desde 2007 la ecoendoscopia, realizándose en 34 pacientes.
La quimioterapia perioperatoria se inició de forma reglada desde 2004 y se indicó en aquellos pacientes con estadio clínico T ≥ 3 y/o N+. La QT utilizada se basa en el esquema Cunningham (13) de QT perioperatoria. El régimen administrado fue mayoritariamente XELOX® (oxaliplatino 130 mg/m2 1 dosis seguido de capecitabina 2000 mg/m2/día durante 15 días) 3 ciclos preoperatorios. Transcurridas 4 semanas desde la finalización de la quimioterapia, los pacientes fueron intervenidos. Los pacientes que tras la cirugía presentaban una buena adaptación a la gastrectomía recibieron 3 ciclos de quimioterapia postoperatoria según el esquema citado. En pacientes mayores de 80 años no se administró QT perioperatoria.
La localización del tumor en el estómago determina la extensión de la gastrectomía. En los tumores localizados en el tercio distal se realizó gastrectomía parcial y se realizó gastrectomía total en aquellos casos en los que no era posible obtener un margen de resección de 5-7 cm. Salvo en los casos de estadios precoces (early) se realizó linfadenectomía D2 modificada según la localización tumoral. Realizamos esplenectomía y linfadenectomía de la arteria esplénica en casos de tumores de cuerpo con afectación evidente o sospecha de infiltración del bazo.
Se consideraron complicaciones postoperatorias las desarrolladas durante los 30 primeros días tras la intervención. La mortalidad postoperatoria se definió como la ocurrida durante los 30 primeros días postoperatorios o antes del alta del paciente. Además, se recogieron los datos de estancia media hospitalaria en cada grupo.
La clasificación clínica y patológica de TNM utilizada fue la clasificación TNM de la 6.a edición (2002) (14).
El seguimiento se llevó a cabo mediante valoración clínica, analítica y TC semestral durante los dos primeros años y anual a partir del tercer año. En caso de gastrectomía parcial se realizó endoscopia anual los dos primeros años y a partir del tercer año únicamente en caso de presentar síntomas. Se definió como recidiva local el crecimiento tumoral en la anastomosis, el lecho de la gastrectomía, las adenopatías locorregionales o la carcinomatosis y recidiva a distancia, como el crecimiento tumoral en hígado o cualquier órgano extraperitoneal.
Se analizaron de forma retrospectiva los datos referentes a edad, sexo, clínica al diagnóstico, presencia de comorbilidades y tipo de las mismas. También se evaluaron la localización tumoral, estadio clínico, administración de QT perioperatoria, técnica quirúrgica realizada, necesidad transfusional durante el perioperatorio, aparición de complicaciones postoperatorias tanto médicas como quirúrgicas, así como su grado según la clasificación Clavien-Dindo (15), recidiva y mortalidad por la neoplasia.
El análisis estadístico se realizó con las pruebas de Chi cuadrado para variables cualitativas y U de Mann-Whitney para variables cuantitativas. Para el análisis de recidiva y supervivencia se utilizó el método de Kaplan y Meier con el test de rangos logarítmicos para analizar la diferencia entre grupos. Se estableció como significativo un valor de p < 0,05.
Resultados
Dividimos a los 109 pacientes intervenidos por cáncer gástrico con intención curativa en el periodo de estudio, en dos grupos: M: ≥ 75 años con 41 pacientes (38 %), y m: < 75 años con 68 pacientes (62 %).
Los datos referentes al sexo, presentación clínica, antecedentes, localización tumoral y empleo de QT perioperatoria se muestran en la tabla I. Las únicas diferencias encontradas al comparar ambos grupos fueron un mayor porcentaje de enfermos con cardiopatía en el grupo de mayores y una menor proporción de pacientes tratados con QT en el mismo grupo. Las tablas II y III recogen los datos relativos al tratamiento quirúrgico empleado y los resultados del mismo (complicaciones médicas, quirúrgicas y mortalidad postoperatoria). Destacamos que al analizar el tipo de linfadenectomía realizada, se aprecia una menor proporción de linfadenectomías D2 en el grupo M.
Al analizar las complicaciones quirúrgicas no se aprecian diferencias significativas entre ambos grupos. Se aprecia un mayor número de exitus en el postoperatorio en el grupo M, pero a expensas de una mayor proporción de complicaciones médicas. En el grupo de pacientes ancianos, dos casos se debieron a complicaciones médicas (neumonía, neumonía por aspiración), un caso fue tras una fuga de muñón duodenal y otro tras dehiscencia de sutura de anastomosis esófago-yeyunal. En el grupo m se produjo tras una dehiscencia de sutura esófago-yeyunal.
Los estadios patológicos y seguimiento (presencia de recidivas y mortalidad por causa oncológica) se muestran en la tabla IV.
La mediana de seguimiento fue de 21 meses (2-81 meses). Durante el periodo de seguimiento no hubo diferencias ni en la aparición de recidivas local y/o sistémica, ni en la mortalidad relacionada con la neoplasia (29 % en el grupo M vs. 22 % en el grupo m).
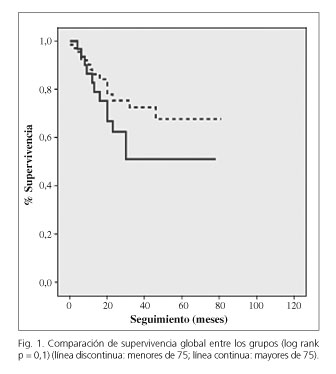
En cuanto a la supervivencia global (Fig. 1) a los 5 años no apreciamos diferencias significativas (p = 0,12), teniendo una supervivencia media en el grupo M de 40,6 ± 5 meses (IC 95 % 29,8-51,4), y en el grupo m de 48,5 ± 3 meses (IC 95 % 42,1-54,7).
Discusión
La incidencia del CG aumenta con la edad, diagnosticándose más frecuentemente alrededor de los 60 años (2,3) e incluso se ha comunicado un aumento en la últimas décadas de la proporción de personas mayores de 80 años con cáncer gástrico, pasando de un 3 a un 17 % en Japón y de un 5 a un 25 % en Occidente (4).
Algunos autores han señalado diferencias significativas entre las características clínicas, quirúrgicas y pronósticas en los pacientes ancianos con cáncer gástrico al compararlo con grupos de pacientes jóvenes (2,11,12). Al analizar los síntomas de presentación del CG no encontramos diferencias entre ambos grupos, siendo la hemorragia digestiva alta o el síndrome anémico la forma de presentación más frecuente. También se han señalado diferencias en la localización tumoral (1,2,11,12) hecho no constatado por nosotros, siendo la localización más frecuente en ambos grupos el tercio distal gástrico.
Tradicionalmente se ha considerado que la morbilidad postoperatoria tras cirugía mayor es más elevada en los pacientes ancianos quizá debido a la mayor existencia de comorbilidades en estos pacientes (10,12,16). Un concepto también a tener en cuenta es el de frailty que hace referencia a la vulnerabilidad o reserva fisiológica del paciente, independientemente de su edad, pero que sí depende en parte de la presencia de determinadas comorbilidades y cómo estas afectan al paciente (17). En nuestro estudio, la presencia de comorbilidades fue significativamente mayor en el grupo de ancianos, concretamente la presencia de enfermedades cardiovasculares. En este grupo de pacientes es donde debemos tener en cuenta tanto la presencia de comorbilidades como la reserva fisiológica (frailty), a la hora de tomar una decisión terapéutica (16,18-20).
La técnica quirúrgica más empleada fue la gastrectomía parcial al tener en nuestro estudio una mayor proporción de cánceres gástricos distales. La linfadenectomía D1 se realizó en mayor proporción en el grupo de ≥ 75 años, siendo esta diferencia estadísticamente significativa, esto también se ha reportado en otros estudios como el estudio inglés de Lamb y cols. (21) donde a los pacientes ancianos con factores de riesgo se les realizaba linfadenectomía D1. En cuanto a la extensión de la linfadenectomía, existen datos contradictorios, ya que los estudios japoneses muestran una baja mortalidad, alrededor del 1 % tras linfadenectomías extensas (22-25). En los estudios realizados en países occidentales se muestran mortalidades significativamente más altas, entre un 10-13 % (21,26-29). Esto se ha relacionado con las diferencias entre la población asiática y occidental, donde los pacientes son mayores, con más patologías concomitantes, mayor riesgo tromboembólico y tumores más proximales que conllevan cirugías más agresivas, por lo que muchos autores defienden la postura de realizar linfadenectomías D1 en pacientes ancianos con enfermedades concomitantes (4,18,30,31). Aunque algunos centros europeos especializados refieren un 2-5 % de mortalidad tras cirugía gástrica radical y linfadenectomía D2 (32,33). En el estudio desarrollado por el British Cooperative Group que comparó la linfadenectomía D2 sobre la D1, la supervivencia a los cinco años fue similar (33 vs. 31 %) apreciándose una mayor morbimortalidad en el grupo sobre el que se realizó linfadenectomía D2 (34,35). Resultados similares fueron publicados por otros grupos (34,36-39). De entre todos ellos destaca el estudio desarrollado por el Dutch Gastric Cancer Group, que comparaba la linfadenectomía D2 respecto a la D1, mostrando una mayor morbilidad (43 vs. 25 %) y mortalidad postoperatoria (10 vs. 4 %) en el grupo con linfadenectomía D2, sin apreciarse diferencias en supervivencia acumulada a los cinco años (35 vs. 30 %) (34,37). Sin embargo, en el análisis del seguimiento de dicho estudio a los 15 años, se halló una menor tasa de recurrencia local y de mortalidad por la enfermedad en el grupo con linfadenectomía D2 comparado con D1, destacando la diferencia observada en los pacientes con enfermedad ganglionar N2 (19 vs. 0 %) (34,39). Los factores relacionados con una mayor morbilidad en el grupo D2 fueron: la edad mayor de 65 años, el sexo masculino, el tipo de gastrectomía, así como la realización de esplenectomía y/o pancreatectomía. En nuestro estudio existe un sesgo a la hora de analizar la mortalidad postoperatoria ya que realizamos más linfadenectomía D1 en el grupo de ancianos, lo cual podría estar asociado a una menor mortalidad postoperatoria que si hiciéramos en este grupo una linfadenectomía D2 (34,40).
En cuanto a las complicaciones postoperatorias, hubo una mayor tasa de complicaciones médicas en el grupo de ancianos frente a los menores de 75 años siendo esta diferencia estadísticamente significativa, como en el estudio de Bittner y cols. (12). Sin embargo, en otros estudios (4,22) no se evidencia mayor tasa de complicaciones ni médicas ni quirúrgicas en los ancianos. En nuestro estudio no hubo diferencias en las complicaciones quirúrgicas ni en la necesidad de reintervenciones, aunque sí evidenciamos diferencias entre ambos grupos de edad al analizar la mortalidad postoperatoria, siendo mayor en el grupo de ancianos a expensas de las complicaciones médicas. Esto puede ser explicado por ser pacientes con mayor proporción de comorbilidades. Este hecho concuerda con los datos de Butte y cols. (2) que explica el aumento de la mortalidad con la presencia de factores de riesgo en los pacientes.
No evidenciamos diferencias entre los estadios tumorales de los pacientes de ambos grupos como en otros estudios (1,12). Aunque otros autores relacionan a los pacientes ancianos con estadios tumorales más avanzados y, por tanto, con peor pronóstico (22,41).
Durante el seguimiento, la tasa de recidiva y de supervivencia fue similar en ambos grupos de edad, como se manifiesta en otros estudios, dependiendo esta principalmente del estadio tumoral (4,16,18,42). En las series con diferencias en la supervivencia entre pacientes jóvenes y ancianos los tumores de estos pacientes fueron más avanzados que los de los pacientes jóvenes (4,16,22,31).
Así podemos concluir diciendo que cuando es posible realizar un tratamiento quirúrgico con intención curativa, la supervivencia libre de enfermedad y global son equiparables en pacientes ancianos y jóvenes. Por tanto, la edad no debe ser considerada como contraindicación para realizar cirugía curativa del CG, sino que debe ser el estado general, la reserva fisiológica o vulnerabilidad del paciente (frailty) y las comorbilidades las que sienten la contraindicación quirúrgica.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Araceli Mayol Oltra
Servicio de Cirugía General y del Aparato Digestivo
Hospital Clínico Universitario
Avda. Blasco Ibáñez, 17
46010 Valencia
e-mail: aracelimayol@gmail.com
Recibido: 17-09-2012
Aceptado: 18-02-2013
Bibliografía
1. García Marcilla JA, Parrilla P, Piñero A. Cáncer Gástrico: epidemiología y factores de riesgo. En: Parrilla Paricio P, Martínez de Haro L, Ortiz Escandell A (eds.). Guía Clínica de Cirugía Esofagogástrica AEC. Madrid: Arán Ediciones; 2001. p. 437-51. [ Links ]
2. Butte JM, Duarte I, Crovari F, Guzmán S, Llanos O. Cáncer gástrico en pacientes de 75 años. Tratamiento quirúrgico y supervivencia a largo plazo. Cir Esp 2007;82:341-5. [ Links ]
3. Hohenberger P. Gastric Cancer. Lancet 2003;362:305-15. [ Links ]
4. Coniglio A, Tiberio GAM, Busti M, Gaverino G, Baiocchi L, Piardi T, et al. Surgical treatment for gastric carcinoma in the elderly. J Surg Oncol 2004;88:201-5. [ Links ]
5. Katai H, Sasako M, Sano T, Maruyama K. The outcome of surgical treatment for gastric carcinoma in the elderly. Jpn J Clin Oncol 1998;28:112-5. [ Links ]
6. Wanebo HJ, Kennedy BJ, Chmiel J, Steele G, Winchester D, Osteen R. Cancer of the stomach: A patient care study by the American College of Surgeons. Ann Surg 1993;218:583-92. [ Links ]
7. Damhuis RA, Tilanus HW. The influence of age on resection rates and postoperative mortality in 2773 patients with gastric cancer. Eur J Cancer 1995;31A:928-31. [ Links ]
8. Kranenbarg K, Van de Velde JH. Gastric cancer in the elderly. Eur J Surg Oncol 1998;24:384-90. [ Links ]
9. Matsushita I, Hanai H, Kajimura M, Tamakoshi K, Nakajima T, Matsubayashi Y, et al. Should gastric cancer patients more than 80 years of age undergo surgery? Comparison with patients not treated surgically concerning prognosis and quality of life. J Clin Gastroenterol 2002; 35:29-34. [ Links ]
10. Kitamura K, Yamaguchi T, Taniguchi H, Hagiwara A, Yamane T, Sawai K, et al. Clinicopathological characteristics of gastric cancer in the elderly. Br J Cancer 1996;73:798-802. [ Links ]
11. Gong DJ, Miao CF, Bao Q, Jiang M, Zhang LF, Tong XT, et al. Risk factors for operative morbidity and mortality in gastric patients undergoing total gastrectomy. World J Gastroenterol 2008;14:6560-3. [ Links ]
12. Bittner R, Butters M, Ulrich M, Uppenbrink S, Beger HG. Total gastrectomy. Updated operative mortality and long-term survival with particular reference to patients older than 70 years of age. Ann Surg 1996;224:37-42. [ Links ]
13. Cunningham D, Allum WH, Stenning SP, Thompson JN, Van de Velde CJ, Nicolson M, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006;355:11-20. [ Links ]
14. AJCC. AJCC Cancer Staging Manual. 6th ed. New York, NY: Springer; 2002. p. 99-106. [ Links ]
15. Dindo D, Demartines N, Clavien PA. Classification of surgical complications, A new proposal with evaluation in a cohort of 6,336 patients and results of a survey. Ann Surg 2004; 244:931-7. [ Links ]
16. Eguchi T, Fujii M, Takayama T. Mortality for gastric cancer in elderly patients. J Surg Oncol 2003;84:132-6. [ Links ]
17. Bergman H, Ferrucci L, Guralnik J, Hogan DB, Hummel S, Karunananthan S, et al. An emerging research and clinical paradigm-Issues and controversies. J Gerontol A Biol Sci Med Sci 2007;62:731-7. [ Links ]
18. Eguchi T, Takahashi Y, Ikarashi M, Kasahara M, Fujii M. Is extended lymph node dissection necessary for gastric cancer in elderly patients? Eur J Surg 2000;166:949-53. [ Links ]
19. Teixeira CR, Haruma K, Teshima H, Yoshihara M, Sunii K, Kajiyama G. Endoscopic therapy for gastric cancer in patients more than 80-years-old. Am J Gastroenterol 1991;86:725-8. [ Links ]
20. Damhuis RA, Tilanus HW. The influence of age on resection rates and postoperative mortality in 2,773 patients with gastric cancer. Eur J Cancer 1995;31A:928-31. [ Links ]
21. Lamb P, Sivasshanmugan T, White M, Irving M, Wayman J, Raimes S. Gastric Cancer surgery - A balance of risk radicality. Ann R Coll Surg Engl 2008;90:235-42. [ Links ]
22. Saito H, Osaki T, Murakami D, Sakamoto T, Kanaji S, Tatebe S, et al. Effect of age on prognosis in patients with gastric cancer. ANZ J Surg 2006;76:458-61. [ Links ]
23. Maehara Y, Oshiro T, Oiwa H, Oda S, Baba H, Akazawa K, et al. Gastric carcinoma in patients over 70 years of age. Br J Surg 1995;82:102-5. [ Links ]
24. Takeda J, Tanaka T, Koufuji K, Kodama I, Tsuji Y, Kakegawa T. Gastric cancer surgery in patients aged at least 80 years old. Hepatogastroenterology 1994;41:516-20. [ Links ]
25. Moriguchi S, Kamakura T, Odaka T. Clinical features of the differentiated and undifferentiated types of advanced gastric carcinoma: Univariate and multivariate analyses. J Surg Oncol 1991;48:202-6. [ Links ]
26. Cuschieri A, Fayers P, Fielding J, Craven J, Bancewicz J, Joypaul V, et al. Postoperative morbidity and mortality after D1 and D2 resections for gastric cancer: Preliminary results of the MRC randomised controlled surgical trial. The Surgical Co-operative Group. Lancet 1996; 347:995-9. [ Links ]
27. Bonenkamp JJ, Songun A, Hermans J, Sasako M, Welvaart K, Plukker JTM, et al. Randomised comparison of morbidity after D1 and D2 dissection for gastric cancer in 996 Dutch patients. Lancet 1995;345:745-8. [ Links ]
28. McCulloch P, Ward J, Tekkis PP. Mortality and morbidity in gastro-oesophageal cancer surgery: Initial results of ASCOT multicentre prospective cohort study. BMJ 2003;327:1192-7. [ Links ]
29. Pye JK, Crumplin MK, Charles J, Kerwat R, Foster ME, Biffin A. One-year survey of carcinoma of the oesophagus and stomach in Wales. Br J Surg 2001;88:278-85. [ Links ]
30. Yamamoto A, Kouno H, Funakoshi M, et al. Comparison of surgical therapy and nonsurgical therapy for the prognosis of gastric cancer in the elderly. J Jpn Soc Clin Surg. 1998;59:1984-8. [ Links ]
31. Sasako M. Risk factors for surgical treatment in the Dutch Gastric Cancer Trial. Br J Surg 1997;84:1567-71. [ Links ]
32. Roukos DH, Lorenz M, Encke A. Evidence of survival benefit of extended (D2) lymphadenectomy in western patients with gastric cancer based on a new concept: A prospective long-term follow-up study. Surgery 1998;123:573-8. [ Links ]
33. Roviello F, Marrelli D, Morgagni P, de Manzoni G, Di Leo A, Vindigni C, et al. Survival benefit of extended D2 lymphadenectomy in gastric cancer with involvement of second level lymph nodes: A longitudinal multicentre study. Ann Surg Oncol 2002;9:894-900. [ Links ]
34. Viudez-Berral A, Miranda-Murua C, Arias-de-la-Vega F, Hernández-García I, Artajona-Rosino A, Díaz-de-Liaño Á, Vera-García R, et al. Current management of gastric cancer. Rev Esp Enferm Dig 2012; 104:134-41. [ Links ]
35. Cuschieri A, Weeden S, Fielding J, Bancewicz J, Craven J, Joypaul V, et al. Patient survival after D1 and D2 resections for gastric cancer: Long-term results of the MRC randomized surgical trial. Surgical Cooperative Group. Br J Cancer 1999;79:1522-30. [ Links ]
36. Dent DM, Madden MV, Price SK. Randomized comparison of R1 and R2 gastrectomy for gastric carcinoma. Br J Surg 1988;75:110-2. [ Links ]
37. Hartgrink HH, van de Velde CJ, Putter H, Bonenkamp JJ, Klein Kranenbarg E, Songun I, et al. Extended lymph node dissection for gastric cancer: Who may benefit? Final results of the randomized Dutch gastric cancer group trial. J Clin Oncol 2004;22:2069-77. [ Links ]
38. Robertson CS, Chung SC, Woods SD, Griffin SM, Raimes SA, Lau JT, et al. A prospective randomized trial comparing R1 subtotal gastrectomy with R3 total gastrectomy for antral cancer. Ann Surg 1994;220:176-82. [ Links ]
39. Degiuli M, Sasako M, Calgaro M, Garino M, Rebecchi F, Mineccia M, et al. Morbidity and mortality after D1 and D2 gastrectomy for cancer: Interim analysis of the Italian Gastric Cancer Study Group (IGCSG) randomized surgical trial. Eur J Surg Oncol 2004;30:303-8. [ Links ]
40. Songun I, Putter H, Kranenbarg EM, Sasako M, van de Velde CJ. Surgical treatment of gastric cancer: 15 years follow-up results of the randomized nationwide Dutch D1D2 trial. Lancet Oncol 2010;11:439-49. [ Links ]
41. Kubota H, Cotoh T, Dhar D. Gastric resection in the aged (>= 80 years) with gastric carcinoma: Multivariate analysis of prognostic factors. Aust N Z J Surg 2000;70:254-7. [ Links ]
42. Katai H, Sasako M, Sano T, Fukagawa T. The outcome of surgical treatment for gastric carcinoma in the elderly. Jpn J Clin Oncol 1998;28:112-5. [ Links ]











 texto en
texto en