Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.106 no.1 Madrid ene. 2014
https://dx.doi.org/10.4321/S1130-01082014000100006
Indicaciones de la cápsula endoscópica en la enfermedad de Crohn
Indications of capsule endoscopy in Crohn's disease
Marisol Luján-Sanchis, Laura Sanchis-Artero, Patricia Suárez-Callol y Enrique Medina-Chulia
Servicio de Medicina Digestiva. Consorcio Hospital General Universitario de Valencia. Valencia
Dirección para correspondencia
RESUMEN
Actualmente la cápsula endoscópica tiene un papel relevante en la enfermedad de Crohn. Este manuscrito pretende dar a conocer las indicaciones y aplicaciones prácticas actuales de la cápsula endoscópica en esta enfermedad. Se trata de una técnica no invasiva que ha supuesto un importante avance en el diagnóstico endoscópico de las enfermedades del intestino delgado. Estas circunstancias, junto a su rendimiento diagnóstico y su excelente tolerancia, le confieren una considerable aceptación por parte del paciente y del médico. Este artículo expone la evidencia actual acerca las circunstancias específicas en las que se puede establecer la indicación de la cápsula endoscópica en tres escenarios concretos: en la sospecha de la enfermedad de Crohn, en las colitis sin clasificar y su extenso papel en la enfermedad de Crohn ya establecida. Así mismo, se revisan el impacto y la implicación de los resultados de la cápsula endoscópica en el seguimiento de esta enfermedad. Estas recomendaciones deben ser interpretadas y aplicadas en el contexto de un manejo integral e individual de estos pacientes. El conocimiento de su correcto uso en la práctica clínica diaria y el análisis de sus resultados podrían dar lugar a la definición de sistemas de puntuación endoscópica que evalúen la actividad y curación mucosa de esta enfermedad. El papel actual de la cápsula endoscópica en la enfermedad de Crohn es objeto de continua revisión y su adecuado uso le dota de nuevas aplicaciones, que podrían en un futuro dar lugar a cambios relevantes en el manejo de estos pacientes.
Palabras clave: Enfermedad de Crohn. Cápsula endoscópica. Enfermedad inflamatoria intestinal.
ABSTRACT
Capsule endoscopy currently plays a relevant role for Crohn's disease. This manuscript will discuss the current indications and practical uses of capsule endoscopy in this disease. It is a non-invasive technique that represents a significant advance in the endoscopic diagnosis of small bowel conditions. These circumstances, together with its diagnostic yield and excellent tolerability, make it considerably acceptable by both patients and physicians. This paper discusses the current evidence on the specific circumstances where capsule endoscopy may be indicated for three specific scenarios: Suspected Crohn's disease, indeterminate colitis, and established Crohn's disease, where it plays an extensive role. Furthermore, the impact and implications of capsule endoscopy results for follow-up are reviewed. These recommendations must be interpreted and applied in the setting of the integral, individual management of these patients. Understanding its appropriate use in daily clinical practice and an analysis of results may define endoscopic scoring systems to assess activity and mucosal healing in this condition. The present role of capsule endoscopy for Crohn's disease is subject to ongoing review, and appropriate usage uncovers novel applications likely to result in relevant changes for the future management of these patients.
Key words: Crohn's disease. Capsule endoscopy. Inflammatory bowel disease.
Introducción
El diagnóstico precoz de la enfermedad inflamatoria intestinal (EII) sigue siendo un reto actualmente dado que la progresión de la actividad inflamatoria da lugar a un daño irreversible (1-4). Actualmente no existe una prueba de referencia para el diagnóstico de la enfermedad de Crohn (EC) (5,6), por lo que las técnicas utilizadas deben ser interpretadas en un contexto adecuado (7). Hasta hace una década, la visualización endoscópica de la mucosa del intestino delgado (ID) se realizaba mediante el alcance limitado del enteroscopio de pulsión o la invasividad de la enteroscopia intraoperatoria. Desde su aprobación por la FDA en 2001, el uso de la cápsula endoscópica (CE) ha mejorado el diagnóstico por la imagen de las enfermedades del ID. Se trata de un pequeño dispositivo que realiza cientos de fotografías mientras avanza de forma natural con los movimientos intestinales, permitiendo la visualización directa y no invasiva de la mucosa. Esta revisión expone sus principales indicaciones en la EC en base a la evidencia disponible hasta la actualidad (8-12). Estas publicaciones, destacan su valor en la identificación de lesiones superficiales que pasan desapercibidas por otras técnicas endoscópicas y radiológicas (7,9,12-15), y la definen como la técnica de referencia para la evaluación del ID cuando no presenta estenosis ni fístulas (12,16). Actualmente, tras la hemorragia de origen incierto, la EC es la segunda indicación más importante de la CE (17). Esta revisión expone su papel en tres escenarios: la sospecha de EC, la colitis sin clasificar y la EC conocida.
Criterios diagnósticos de la ec mediante cápsula endoscópica
Al igual que cualquier técnica endoscópica, la descripción de las lesiones compatibles con la EC sigue una terminología normalizada (18): estenosis, úlceras, erosiones, aftas, pseudopólipos y fístulas (Fig. 1). Ante estas lesiones, se deben descartar otras enfermedades (infecciones, isquemia, vasculitis, iatrogenia, tumores, linfoma y enfermedad de Behçet, entre otras). Otras lesiones como la denudación, eritema o petequias se consideran inespecíficas. La mayoría de los estudios han utilizado el criterio diagnóstico definido en 2004 por Mow y cols. (19): existencia de ulceraciones difusas o múltiples en número mayor a 3, en ausencia de toma de antiinflamatorios. Este criterio le confiere una sensibilidad (S) del 77 %, especificidad (E) del 89 %, valor predictivo positivo (VPP) del 55 % y un valor predictivo negativo (VPN) del 96 % en relación a los hallazgos clínicos, endoscópicos, radiológicos y de la histología, por lo que su valor es muy relevante para excluir la enfermedad.
De igual modo, y aunque menos específico, la presencia de múltiples lesiones aftosas o erosivas (> 10) (como las que se muestran en la figura 2), ya sea distribuidas de forma continua o por segmentos, también ha sido descrito como criterio de diagnóstico de EC por otros autores (20). En 2008, Gal y cols. (21) publicaron el índice de actividad de la EC por cápsula endoscópica (índice de Niv o CECDAI), que define el tamaño de las úlceras, la extensión y las estenosis en los segmentos proximal y distal del ID, y que ha sido validado prospectivamente recientemente (22) (Tabla I). Tal y como ocurre con la colonoscopia, la actividad en el ID no muestra correlación con la clínica. Así, ante un paciente sintomático, la CE detectará lesiones en la mitad de las ocasiones (23,24) y viceversa, cuando el paciente está en remisión clínica (CDAI < 150), la CE mostrará lesiones en el 62 % (25).
Indicaciones de la CE en la enfermedad de Crohn
El papel de la cápsula en la EC varía en función de la precocidad de la sospecha, y de la extensión, actividad y distribución de la enfermedad (26,27).
- Sospecha de la enfermedad de Crohn. La sospecha de la EC se basa en la existencia de síntomas asociados o no a manifestaciones extraintestinales, alteraciones analíticas y/o radiológicas compatibles (7). En estos casos se realizará una ileocolonoscopia con biopsias, e independientemente de su resultado, es recomendable valorar la extensión proximal gástrica y/o intestinal (5,12,28). Por ello, esta es la segunda indicación más importante de la CE en adultos (17), y la primera en niños de 10 a 18 años (29). Su rentabilidad es mayor cuando los síntomas se acompañan de anemia, trombocitosis, marcadores de inflamación y/o fecales (30-33). Así mismo, es la técnica de primera línea cuando la endoscopia y la radiología son negativas o no concluyentes, ya que detecta cambios inflamatorios muy sutiles que pasan desapercibidos por las técnicas radiológicas (Fig. 2). Así, dos importantes metaanálisis (34,35) muestran que su rendimiento es superior al de la ileocolonoscopia, el tránsito baritado del intestino delgado (TID) y la tomografía computarizada (TAC) en un 22 %, 37 % y 42 % respectivamente. Hay que destacar que los estudios que comparan todas las técnicas utilizadas para el diagnóstico de la EC, obtendrán resultados muy diferentes en función de la que sea considerada como técnica de referencia. Así, cuando la prueba de referencia es la ileoscopia, la CE tiene un valor superior a la enterografía por tomografía computarizada (ETC) o la enterografía por resonancia magnética (ERM) (36). Por el contrario, cuando la prueba de referencia es la enteroscopia junto a la valoración clínica por expertos, la ERM es algo superior a la CE (37).
- Colitis inclasificable. Los estudios poblacionales han mostrado que en el 4-10 % de los pacientes con EII y afectación exclusiva de colon, es difícil distinguir entre EC y colitis ulcerosa. Esta entidad se denomina colitis sin clasificar o inclasificable (CI) (38-40). En estos casos, la CE puede identificar en un 17-70 % de los casos lesiones en ID compatibles con EC (40), siendo mejor que el TID o la enteroclisis. No existen datos comparativos con la enterotomografía (ETC) ni la enterorresonancia (ERM). Así mismo, cuando la CE es normal, no se excluye un diagnóstico futuro (12) y se puede recomendar su repetición a medio plazo (8).
- Enfermedad de Crohn conocida. La realización de la CE se debe considerar fundamentalmente cuando se prevea un cambio en el manejo de esta enfermedad (6,8,9,28). Así mismo, se ha visto que dado su alto rendimiento diagnóstico en la enfermedad establecida (85,7 %), sus hallazgos pueden influir en el cambio del manejo y seguimiento clínico en el 64 % de este grupo de pacientes (41). Por ello, ante síntomas o signos que el médico no pueda explicar por el resultado normal o no concluyente de la radiología y/o la colonoscopia, la CE puede detectar lesiones que justifiquen la clínica más allá del duodeno y el íleon terminal, inaccesibles a la endoscopia convencional (12,42). Además, será recomendable cuando la ileocolonoscopia sea imposible o normal (28). Para estas indicaciones, la identificación de las lesiones mucosas es superior al TID (78 vs. 32 %) y puede ser mejor que la ETC (68 vs. 38 %) o ERM (93 vs. 79 %), aunque significación clínica de estas diferencias no está definida.
Estudio de extensión de la enfermedad de Crohn
Tras la accesibilidad a todo el ID mediante la CE, se vio que su afectación podía coexistir con la ileal y la colónica. Por este motivo, la clasificación de Viena se sustituyó por la de Montreal en 2005, añadiendo la localización intestinal (L4) al resto de localizaciones, cuando se detecta afectación del tracto digestivo alto hasta el íleon proximal (43). La mitad de los pacientes con EC sintomática ileal y/o colónica, presentan además afectación en ID proximal, siendo la distribución más frecuente en íleon proximal (67 %) seguida del yeyuno (53 %) y/o duodenal (32 %) (23,44). Actualmente, al diagnóstico inicial es recomendable valorar la extensión a lo largo de todo el tubo digestivo (12,45). Además, estudios muy recientes muestran que la afectación proximal se asocia con edades más jóvenes, no fumadores, coexistencia con afectación ileal y patrón estenosante. En concreto, la afectación yeyunal se asocia con patrones estenosantes que requieren más cirugía (46,47). Estos datos son similares en la EC con afectación ileal, que evoluciona con mayor frecuencia hacia patrones estenosantes y penetrantes que la EC colónica (48). La asociación de comportamiento estenosante con la localización de EC en yeyuno e íleon podría ser tan solo la consecuencia de la respuesta inflamatoria en el segmento de menor calibre intestinal. En este sentido, parece lógica la diferencia de frecuencias de complicaciones estenosantes en la EC de intestino delgado y la de colon.
Enfermedad de Crohn localizada en el intestino delgado
El diagnóstico de la EC aislada del ID es un verdadero desafío y puede ocurrir hasta en un tercio de los pacientes (49-51). Los síntomas suelen ser inespecíficos y, como ocurre con la afectación colónica, no se correlacionan con la actividad endoscópica. Las técnicas para su detección se consideran actualmente complementarias y su elección dependerá de la experiencia de cada centro (52):
La CE diagnóstica precozmente las lesiones mucosas y dirige la necesidad de otras endoscopias (indicación, biopsia, terapéutica y vía de abordaje). Sus principales ventajas son la ausencia de invasividad e irradiación, el estudio directo de la mucosa de todo el ID y la valoración de la actividad en ID cuando la ileocolonoscopia es normal. Ante la presencia de estenosis la CE está contraindicada. Dada la baja sensibilidad del TID para la detección de las mismas, es controvertida su realización (53). Así, se ha visto que en la mayoría de los casos de retención de la cápsula en la EC, la radiología no fue adecuada para sospechar el riesgo de la misma (54). Por ello, ante la sospecha de estenosis algunos autores recomiendan la realización previa de una cápsula degradable que permite valorar la contraindicación de la CE (como se expone en el apartado de complicaciones).
La calprotectina fecal (CF) muestra de forma no invasiva e indirecta la actividad o recurrencia y dirige la necesidad de otras pruebas. Presenta buena correlación con los resultados de la CE con una S 83 %, E 100 %, VPP 100 % y VPN 80 % (24). Por ello, en pacientes con sospecha clínica de EC con ileocolonoscopia normal, una CF en torno a 200 µg/g se asocia con un alto rendimiento diagnóstico de la CE (65 %) (55).
La ETC y ERM evalúan la progresión del daño transmural y las complicaciones (extensión transmural, abscesos, fístulas, estenosis y colecciones), por lo que precederán o completarán el estudio con CE, cuando interese identificar las mismas (8). La detección de las lesiones mucosas mediante las técnicas radiológicas es limitada (56), aunque algunas series que comparan la ERM con la CE les confieren una sensibilidad similar (75 % vs. 77,8 % respectivamente) (57).
Valoración de la actividad y severidad
La CE permite la evaluación de la extensión en el ID y su actividad. Se realizará ante anemia, trombocitosis, pérdida de peso y marcadores inflamatorios fecales que no se justifiquen por los hallazgos de la ileocolonoscopia ni las pruebas radiológicas (26,28). La gravedad de las lesiones se evalúa objetivamente mediante sistemas de puntuación reproducibles como el CECDAI (22) o el índice de Lewis (58). El CECDAI no tiene un umbral específico, aunque el aumento de sus niveles indica mayor gravedad de inflamación de la mucosa. El índice de Lewis por su parte, puntúa el edema velloso, las úlceras y las estenosis (Tabla II), y presenta un VPP 82,6 %, VPN 87,9 %, S 82,6 % y E 87,9 % para el diagnóstico de la EC con respecto a la evaluación clínica, analítica, radiológica, endoscópica y/o histológica (59). Ambos índices mantienen una buena correlación, siendo los niveles de CECDAI de 3,8 y 5,8 correspondientes a un umbral del índice de Lewis de 135 y 790 respectivamente, siendo los primeros valores relativos a una actividad leve y los últimos moderada-severa (60). Recientemente, otros autores han identificado un umbral más alto de 23,5 de CECDAI para la inflamación severa que puede ser más útil para guiar el manejo clínico (61). Estos índices fueron desarrollados inicialmente para estandarizar los informes cápsula, pero su uso como herramienta clínica necesita de estudios prospectivos de validación para evaluar los sistemas de clasificación de lesiones por cápsula en EC (12). Por ello, las pruebas no invasivas como la radiología, la CF y la CE deben considerarse complementarias (52).
En general, cuantos más criterios de sospecha existan (clínicos, analíticos, radiológicos, endoscópicos), más probable será encontrar lesiones compatibles en la CE. Así, con 1 criterio de sospecha, la CE muestra actividad leve y se confirmará el diagnóstico en el 20 % de los casos, sin embargo con 3 criterios de sospecha la actividad será severa y el diagnóstico se confirmará en torno al 80 % (59). En pacientes sanos (sin toma de antiinflamatorios no esteroideos, resección intestinal, espondilitis anquilosante ni síntomas digestivos), sólo un 9 % pueden presentar lesiones mucosas similares a la EC, sin embargo, en todos ellos la puntuación de Lewis indicaría una actividad leve (62). Estos índices han mostrado una buena correlación con la CF, de manera que cuando esta es ≤ 100 µg/g el índice de Lewis es normal (60). Por ello, ante la sospecha de EC con endoscopia normal una CF > 100 mg/g selecciona la indicación de la CE (55), ya que la elevación de CF es similar ante inflamación de ID como en colon (63).
Valoración de la recurrencia postquirúrgica
Actualmente la técnica de referencia para esta indicación es la ileoscopia, mediante el índice de Rutgeerts (64). La CE puede identificar lesiones proximales no alcanzables por la ileoscopia (28,42,65), y se pueden clasificar mediante el índice de actividad de Buchmann (66). El manejo de la recurrencia (seguimiento endoscópico y tratamiento) viene determinado por los factores de riesgo entre los que destaca la extensión en el ID (67). Se recomienda realizarla a los 6 meses-1 año de la cirugía en función de la asociación con otros factores de riesgo (68). Aunque no se ha estudiado la relevancia clínica de sus hallazgos, la CE muestra una S del 62-76 % y E del 100 % con respecto a la ileoscopia (8). Estará indicada cuando la endoscopia está contraindicada o sea insatisfactoria (28), y será de elección ante anastomosis de difícil acceso o cuando sea preferida por el paciente (8).
Curación mucosa
Conseguir la remisión profunda (clínica, biológica y curación mucosa) (3) mejora el pronóstico de esta enfermedad. La curación mucosa es el evento inicial de la supresión de la inflamación de las capas más profundas de la pared intestinal (69). En concreto, la curación mucosa del ID ha sido muy poco estudiada debido a la falta de herramientas adecuadas de investigación. El uso de la CE en la EC (no fistulizante ni penetrante), ha mostrado una mejoría de las úlceras un mes después del tratamiento (70). Al igual que sucede con las lesiones colónicas, esta curación no se correlaciona con la clínica (71).
Enfermedad perianal
Los pacientes con enfermedad perianal que tienen una ileocolonoscopia normal, la CE detecta afectación del ID en el 24 % de los casos, dando lugar a un cambio en el manejo en todos ellos. El resultado positivo de la CE no se asocia con las alteraciones analíticas, antecedente familiar de EII, ni la edad (72).
Diagnóstico diferencial con otras enfermedades intestinales
Otras indicaciones de la CE son la sospecha de tumores intestinales, que en la EII tienen un riesgo relativo superior a la población general (73,74), y los síndromes de malabsorción como la enfermedad celiaca y sus complicaciones (17). En los casos dudosos de celiaquía (anticuerpos negativos y atrofia en la biopsia duodenal), la CE ha mostrado lesiones compatibles con la EC en un 6 % de los casos (75).
Impacto de la cápsula en la enfermedad de Crohn
Los cambios en el manejo a los que dan lugar los hallazgos de la CE, se relacionan con el comienzo de un nuevo tratamiento, el cambio o suspensión del mismo, o bien la indicación de la cirugía (41,76,77). A nivel práctico, este impacto en el manejo de la enfermedad dependerá del motivo por el que se indica la CE. En general, el rendimiento de la CE para el diagnóstico de la EC en las publicaciones actuales es del 60-85 % (41,78). Así mismo, los resultados de la CE darán lugar al cambio en la toma de decisiones en el 90 % de los pacientes cuando la CE se solicita por sospecha de EC, en el 88 % de las colitis inclasificables y en el 73 % de la EC conocida.
Este impacto es especialmente relevante en la edad pediátrica ya que la CE reclasifica como EC el 50 % de las colitis ulcerosas y CI, en el 50 % detecta lesiones proximales no detectadas por otras técnicas y en el 78 % se produce un cambio en la decisión terapéutica (76).
En el caso de la EC establecida se modificará el manejo terapéutico en el 64 % de los pacientes (41). En estudios con más de 900 pacientes con EC (77), el 61,6 % tenían un cambio en la medicación en los 3 meses después de la CE y en el 39,5 % se iniciaba un nuevo tratamiento. Los hallazgos patológicos de la CE en comparación con ninguno o mínimos hallazgos, dio lugar a diferencias significativas en los cambios del tratamiento (73,2 % frente a 51,1 %, p = 0,04), la adición de medicamentos (58,5 % frente a 22,2 %, p < 0,01), y la indicación de cirugía (21,9 % frente al 4,4 %, p = 0,01). Por otra parte, en estos pacientes se ha cambiado el tratamiento (en los porcentajes referidos) cuando la indicación de la CE es la anemia (60 %) y cuando se quiere evaluar la extensión completa en ID de la enfermedad (58 %). Sin embargo, cuando la CE se solicita porque existen discrepancias entre la clínica y otras pruebas (endoscópicas, radiológicas) sólo variará nuestra actitud en el 20 % de los casos (27,78).
Complicaciones
La complicación más relevante de la CE, y casi la única, es la retención siendo muy poco frecuente en esta enfermedad ya que se consigue explorar todo el ID en el 85,4 % (79-90,8 %) de los casos (79). En los pacientes con sospecha de EC el riesgo de retención es comparable al de otras indicaciones como la hemorragia oculta (1,6 %), y en la EC establecida es algo mayor (1,8-13 %), sobre todo si existe estenosis intestinal conocida. Ante sospecha de estenosis intestinal, la CE debe ser precedida de test de permeabilidad intestinal con la cápsula degradable Patency (CP) (Given Imaging, Yoqneam, Israel), aprobada por la FDA en 2006 para este fin, o bien de la radiología en función de la disponibilidad local y la experiencia del centro (12,80-82). En pacientes pediátricos, se elegirá entre CP o ERM por la inocuidad de ambas exploraciones en estas edades.
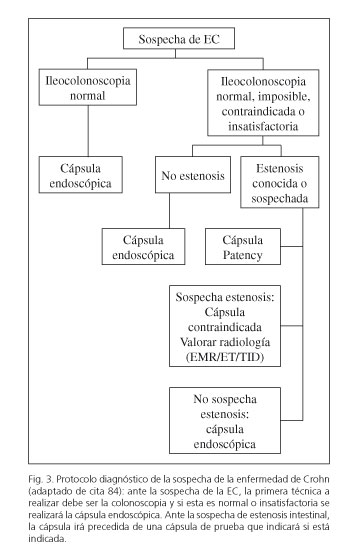
Para algunos autores se trata de una complicación "terapéutica" porque diagnostica estenosis que han pasado desapercibidas por otras técnicas y da lugar a un cambio en el manejo del paciente (83). Por este motivo, ante la existencia de una estenosis se puede administrar la CP previamente y si se expulsa con normalidad no estaría contraindicada la CE. Además es relevante destacar que la radiología normal no excluye completamente la posibilidad de retención, por lo que ante la sospecha clínica de estenosis se recomienda la CP tanto si la radiología está alterada como si es normal. Por otra parte, ante una estenosis radiológica (TID/TAC) la retención de la CE ocurrirá sólo en el 21 % de los casos, por ello se propone evitar la radiología (sobre todo en pacientes jóvenes), a menos que el test de permeabilidad sea anormal (84) (Fig. 3). El tratamiento de la retención dependerá del diámetro y la naturaleza de la estenosis (85) y contempla la actitud expectante con vigilancia de su expulsión, el tratamiento médico o bien endoscópico si no hay obstrucción completa, en cuyo caso estará indicada la cirugía. El tratamiento médico incluye la administración de laxantes o bien corticoides en función de la etiología de la retención. La enteroscopia se indicará si procede recuperar la CE, biopsiar la estenosis y/o tratarla con dilatación. Conclusiones En resumen, la CE es una técnica no invasiva que tiene un amplio papel en la EC. Su utilidad principal está bien definida en el diagnóstico precoz de las lesiones mucosas ante la sospecha de esta enfermedad, la valoración de su extensión y el estudio de la colitis inclasificable, sobre todo si implican cambios en el manejo del paciente. Existen sistemas de puntuación endoscópica que indican la actividad de la enfermedad en el ID, aunque su uso debería extenderse en estudios prospectivos futuros para definir los criterios de actividad y curación mucosa que puedan suponer una guía del tratamiento. Al igual que sucede con otras pruebas diagnósticas y los tratamientos actuales, está por definir la implicación de todas estas aplicaciones de la CE en la modificación de la historia natural de esta enfermedad. Recibido: 12-07-2013 Bibliografía 1. Cosnes J, Cattan S, Blain A, Beaugerie L, Carbonnel F, Parc R, et al. Long-term evolution of disease behavior of Crohn's disease. Inflamm Bowel Dis 2002;8:244-50. [ Links ] 2. Pariente B, Cosnes J, Danese S, Sandborn WJ, Lewin M, Fletcher JG, et al. Development of the Crohn's disease digestive damage score, the Lémann score. Inflamm Bowel Dis 2011;17:1415-22. [ Links ] 3. Panaccione R, Hibi T, Peyrin-Biroulet L, Schreiber S. Implementing changes in clinical practice to improve the management of Crohn's disease. J Crohn's Colitis 2012;6:S235-42. [ Links ] 4. Peyrin-Biroulet L, Loftus EV, Colombel JF, Sandborn WJ. Early Crohn disease: A proposed definition for use in disease-modification trials. Gut 2010;59:141-7. [ Links ] 5. Strange EF, Travis SPL, Vermeire S, Reinisch K, Geboes A, Barakauskiene A, et al. European evidence-based Consensus on the diagnosis and management of ulcerative colitis: Definitions and diagnosis. J Crohn's Colitis 2008;2:1-23. [ Links ] 6. Van Assche G, Dignass A, Panes J, Beaugerie L, Karagiannis J, Allez M, et al. The second European evidence based consensus on the diagnosis and management of Crohn's disease: Definitions and diagnosis. J Crohn'sColitis 2010;4:7-27. [ Links ] 7. Mergener K, Ponchon T, Gralnek I, Pennazio M, de Franchis R, Seidman E, et al. Literature review and recommendations for clinical application of small-bowel capsule endoscopy, based on a panel discussion by international experts: Consensus statements for small-bowel capsule endoscopy, 2006/2007. Endoscopy 2007;39:895-909. [ Links ] 8. Bourreille A, Ignjatovic A, Aabakken L, Loftus EV, Eliaquim R, Pennazio M, et al. Role of small-bowel endoscopy in the management of patients with inflammatory bowel disease: An international OMED-ECCO consensus. Endoscopy 2009;41:618-37. [ Links ] 9. Ladas SD, Triantafyllou K, Spada C, Riccioni ME, Rey JF, Niv Y, et al. European Society of Gastrointestinal Endoscopy (ESGE): Recommendations (2009) on clinical use of video capsule endoscopy to investigate small-bowel, esophageal and colonic diseases. Endoscopy 2010;42:220-7. [ Links ] 10. Doherty GA, Moss AC, Cheifetz AS. Capsule endoscopy for small-bowel evaluation in Crohn's disease. Gastrointest Endosc 2011;74:167-75. [ Links ] 11. Lucendo AJ, Guagnozzi D. Small bowel video capsule endoscopy in Crohn's disease: What have we learned in the last ten years? World J Gastrointest Endosc 2011;3:23-9. [ Links ] 12. Annese V , Daperno M, Rutter MD, Amiot A , Bossuyt P , Oriente J, et al. European evidence based consensus for endoscopy in inflammatory bowel disease. J Crohns Colitis 2013;7(12):982-1018. [ Links ] 13. Leighton JA, Shen B, Baron TH, Adler DG, Davila R, Egan JV, et al. Standards of Practice Committee. American Society for Gastrointestinal Endoscopy. ASGE guideline: Endoscopy in the diagnosis and treatment of inflammatory bowel disease. Gastrointest Endosc 2006;63:558-65. [ Links ] 14. Rey JF, Ladas S, Alhassani A, Kuznetsov K. European Society of gastrointestinal Endoscopy (ESGE). Video capsule endoscopy: update to guidelines (May 2006). Endoscopy 2006;38:1047-53. [ Links ] 15. Sidhu R, Sanders DS, Morris AJ, McAlindon ME. Guidelines on small bowel enteroscopy and capsule endoscopy in adults. Gut 2008;57:125-36. [ Links ] 16. Pohl J, Delvaux M, Ell C, Gay G, May A, Mulder CJJ, et al. European Society of Gastrointestinal Endoscopy (ESGE) Guidelines: Flexible enteroscopy for diagnosis and treatment of small-bowel diseases. Endoscopy 2008;40:609-61. [ Links ] 17. Early DS, Ben-Menachem T, Decker GA. Appropriate use of GI endoscopy. Gastrointest Endosc 2012;75:1127-3. [ Links ] 18. Delvaux M, Friedman S, Keuchel M, Hagenmüller F, Weinstein M, Cave D, et al. Structured terminology for capsule endoscopy: results of retrospective testing and validation in 766 small-bowel investigations. Endoscopy 2005;37:945-50. [ Links ] 19. Mow WS, Lo SK, Targan SR, Dubinsky MC, Treyzon L, Abreu-Martin MT, et al. Initial experience with wireless capsule enteroscopy in the diagnosis and management of inflammatory bowel disease. Clin Gastroenterol Hepatol 2004;2:31-40. [ Links ] 20. Voderholzer WA, Beinhoelzl J, Rogalla P, Murrer S, Schachschal G, Lochs H, et al. Small bowel involvement in Crohn's disease: A prospective comparison of wireless capsule endoscopy and computed tomography enteroclysis. Gut 2005;54:369-73. [ Links ] 21. Gal E, Geller A, Fraser G, Levi Z, Niv Y. Assessment and validation of the new capsule endoscopy Crohn's disease activity index (CECDAI). Dig Dis Sci 2008;53:1933-7. [ Links ] 22. Niv Y, Ilani S , Levi Z, Hershkowitz M, Niv E, Fireman Z, et al. Validation of the capsule endoscopy Crohn's disease activity index (CECDAI or Niv score): A multicenter prospective study. Endoscopy 2012;44:21-6. [ Links ] 23. Mehdizadeh S, Chen GC, Barkodar L, Enayati PJ, Pirouz S, Yadegari M, et al. Capsule endoscopy in patients with Crohn's disease: diagnostic yield and safety. Gastrointest Endosc 2010;71:121-7. [ Links ] 24. De Cruz P, Kamm MA, Prideaux L, Allen PB, Moore G. Mucosal healing in Crohn's disease: A systematic review. Inflamm Bowel Dis 2013;19:429-44. [ Links ] 25. Aggarwal V, Day SD, Connor SJ, Leach ST, Brown GJ, Singh R, et al. Multicenter capsule endoscopy study of small bowel Crohn's disease patients in clinical remission: Long-term follow-up and correlation with faecal biomarkers and clinical outcome. Gastroenterology 2012;142(Supl. 1):169. [ Links ] 26. De Melo SW, Di Palma JA. The role of capsule endoscopy in evaluating inflammatory bowel disease. Gastroenterol Clin N Am 2012;41:315-23. [ Links ] 27. Dussault C, Gower-Rousseau C, Salleron J, Vernier-Massouille G, Branche J, Colombel JF, et al. Small bowel capsule endoscopy for management of Crohn's disease: A retrospective tertiary care centre experience. Dig Liver Dis 2013;45:558-61. [ Links ] 28. Papay P, Ignjatovic A, Karmiris K, Amarante H, Milheller P, Feagan B, et al. Optimising monitoring in the management of Crohn's disease: A physician's perspective. J Crohns Colitis 2013;7(8):653-69. [ Links ] 29. Fritscher-Ravens A, Scherbakov P, Bufler P, Torroni F, Ruuska T, Nuutinen H, et al. The feasibility of wireless capsule endoscopy in detecting small intestinal pathology in children under the age of 8 years: A multicentre European study. Gut 2009;58:1467-72. [ Links ] 30. De Bona M, Bellumat A, Cian E, Valiante F, Moschini A, De Boni M, et al. Capsule endoscopy findings in patients with suspected Crohn's disease and biochemical markers of inflammation. Dig Liver Dis 2006;38:331-5. [ Links ] 31. Valle J, Alcántara M, Pérez-Grueso MJ, Navajas J, Munoz-Rosas C, Legaz ML, et al. Clinical features of patients with negative results from traditional diagnostic work-up and Crohn's disease findings from capsule endoscopy. J Clin Gastroenterol 2006;40:692-6. [ Links ] 32. Fidder HH, Nadler M, Lahat A, Lahav M, Bardan E, Avidan B, et al. The utility of capsule endoscopy in the diagnosis of Crohn's disease based on patient's symptoms. J Clin Gastroenterol 2007;41:384-7. [ Links ] 33. Shim K-N, Kim Y-S, Kim K-J, Kim YH, Kim TI, Do JH, et al. Abdominal pain accompanied by weight loss may increase the diagnostic yield of capsule endoscopy: A Korean multicenter study. Scand J Gastroenterol 2006;41:983-8. [ Links ] 34. Triester SL, Leighton JA, Leontiadis GI, Gurudu SR , Fleischer DE, Hara AK , et al. A meta-analysis of the yield of capsule endoscopy compared to other diagnostic modalities in patients with non-stricturing small bowel Crohn's disease. Am J Gastroenterol 2006;101:954-96. [ Links ] 35. Dionisio PM, Gurudu SR, Leighton JA, Leontiadis GI, Fleischer DE, Hara AK, et al. Capsule endoscopy has a significantly higher diagnostic yield in patients with suspected and established small bowel Crohn's disease: A meta-analysis. Am J Gastroenterol 2010;105:1240-8. [ Links ] 36. Jensen MJ, Nathan T, Rafaelsen SR, Kjeldsen J. Diagnostic accuracy of capsule endoscopy for small bowel Crohn's disease is superior to that of MR enterography or CT enterography. Clin Gastroenterol Hepatol 2011;9:124-29. [ Links ] 37. Wiarda BM, Mensink PB, Heine DG, Stolk MD, Hazenberg H, Stoker J, et al. Small bowel Crohn's disease: MR enteroclysis and capsule endoscopy compared to balloon-assisted enteroscopy. Abdominal Imaging 2012;37:397-403. [ Links ] 38. Vind I, Riis L, Jess T, Knudsen E, Pedersen N, Elkjaer M, et al. Increasing incidences of inflammatory bowel disease and decreasing surgery rates in Copenhagen City and County, 2003-2005: A population-based study from the Danish Crohn colitis database. Am J Gastroenterol 2006;101:1274-82. [ Links ] 39. Stewenius J, Adnerhill I, EkelundG, Florén CH, Fork FT, Janzon L, et al. Ulcerative colitis and indeterminate colitis in the city of Malmo, Sweden. A 25-year incidence study. Scand J Gastroenterol 1995;30:38-43. [ Links ] 40. Mehdizadeh S, Chen G, Enayati PJ, Cheng DW, Han NJ, Shaye OA, et al. Diagnostic yield of capsule endoscopy in ulcerative colitis and inflammatory bowel disease of unclassified type (IBDU). Endoscopy 2008;40:30-3. [ Links ] 41. Lorenzo-Zúñiga V, de Vega VM, Domènech E, Cabré E, Mañosa M, Boix J. Impact of capsule endoscopy findings in the management of Crohn's disease. Dig Dis Sci 2010;55:411-4. [ Links ] 42. Bourreille A, Jarry M, D'Halluin PN, Ben-Soussan E, Maunoury V, Bulois P, et al. Wireless capsule endoscopy versus ileocolonoscopy for the diagnosis of postoperative recurrence of Crohn's disease: A prospective study. Gut 2006;55:978-8. [ Links ] 43. Silverberg MS, Satsangi J, Ahmad T, ArnottI D, Bernstein CN, Bant SR, et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: Report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol 2005;19(Supl. A):5-36. [ Links ] 44. Petruzziello C. Wireless capsule endoscopy and proximal small bowel lesions in Crohn's disease. World J Gastroenterol 2010;16:3299-304. [ Links ] 45. Baumgart D, Sandborn WI. Crohn's disease. The Lancet 2012;380:1590-605. [ Links ] 46. Lazarev M, Huang Ch, Bitton A, Cho JH, Duerr RH, McGovern DP, et al. Relationship between proximal Crohn's disease location and disease behavior and surgery: A cross-sectional study of the IBD genetics consortium. Am J Gastroenterol 2013;108:106-12. [ Links ] 47. Flamant M, Trang C, Maillard O, Sacher-Huvelin S, Le Rhun M, Galmiche JP, et al. The prevalence and outcome of jejunal lesions visualized by small bowel capsule endoscopy in Crohn's disease. Inflamm Bowel Dis 2013;19(7):1390-6. [ Links ] 48. Cosnes J. Epidemiology and natural history of inflammatory bowel diseases. Gastroenterology 2011;140:1785-94. [ Links ] 49. Molinie F, Gower-Rousseau C, Yzet T, Merle V, Grandbastien B, Marti R, et al. Opposite evolution in incidence of Crohn's disease and ulcerative colitis in Northern France (1988-1999). Gut 2004;53:843-8. [ Links ] 50. Lashner B. Clinical features, laboratory findings, and course of Crohn's disease. In: Kirsner JV, editor. Inflamm Bowel Dis. 5th ed. Philadelphia: Saunders; 2000. p. 305-14. [ Links ] 51. Rameshshanker R, Arebi N. Endoscopy in inflammatory bowel disease when and why. WJ Gastrointest Endosc 2012;4:201-11. [ Links ] 52. Gurudu SR, Leighton JA. Correlation of two capsule endoscopy scoring systems with fecal calprotectin: does it really matter? Dig Dis Sci 2012;57:827-9. [ Links ] 53. Cave D, Legnani P, de Franchis R, Lewis BS. ICCE consensus for capsule retention. Endoscopy 2005;37:1065-7. [ Links ] 54. Rondonotti E, Herrerias JM, Pennazio M, Caunedo A, Mascarenhas-Saravia M, de Franchis R. Complications, limitations and failures of capsule endoscopy: A review of 733 cases. Gastrointest Endosc 2005;62:712-6. [ Links ] 55. Koulaouzidis A, Douglas S, Rogers MA, Arnott ID, Plevris JN. Fecal calprotectin: A selection tool for small bowel capsule endoscopy in suspected IBD with prior negative bi-directional endoscopy. Scand J Gastroenterol 2011;46:561-6. [ Links ] 56. Costamagna G, Shah S, Riccioni M, Foschia F, Mutignani M, Perri V, et al. A prospective trial comparing small bowel radiographs and video capsule endoscopy for suspected small bowel disease. Gastroenterology 2002;123:999-1005. [ Links ] 57. Kovanlikaya A, Watson E, Hayward J. Beneck D, Sockolow R, Solomon A, et al. Magnetic resonance enterography and wireless capsule endoscopy in the evaluation of patients with inflammatory bowel disease. Clin Imaging 2013;37:77-82. [ Links ] 58. Gralnek IM, Defranchis R, Seidman E, Leighton JA, Legnani P, Lewis BS, et al. Development of a capsule endoscopy scoring index for small bowel mucosal inflammatory change. Aliment Pharmacol Ther 2008;27:146-54. [ Links ] 59. Rosa B, Moreira MJ, Rebelo A, Cotter J. Lewis score: A useful clinical tool for patients for suspected disease submitted to capsule endoscopy. J Crohn's Colitis 2012;6:692-7. [ Links ] 60. Koulaouzidis A, Douglas S, Plevris JN. lewis score correlates more closely with fecal calprotectin than capsule endoscopy Crohn's disease activity index. Dig Dis Sci 2012;57:987-93. [ Links ] 61. Holleran G, Hall B, Hussey M, Thornton O, Dobson M, McNamara D. How accurate are capsule endoscopy scoring systems in Crohn's disease? 8th Congress ECCO. 14-16 Feb 2013. Vienna Austria, Abstract P233. [ Links ] 62. Lewis JR, Pashinsky Y, Tindley A, Lewis BS. Capsule endoscopy in healthy individuals. Gastroenterology 2012;142:52-3. [ Links ] 63. Jensen MD, Kjeldsen J, Nathan T. Fecal calprotectin is equally sensitive in Crohn's disease affecting the small bowel and colon. Scand J Gastroenterol 2011;46:694-700. [ Links ] 64. Rutgeerts P, Geboes K, Vantrappen G,Beyls J, Kerremans R, Hiele M, et al. Predictability of the postoperative course of Crohn's disease. Gastroenterology 1990;99:956-63. [ Links ] 65. Pons V, Nos P, Bastida G, Beltrán B, Argüello L, Aguas M, et al. Evaluation of postsurgical recurrence in Crohn's disease: A new indication for capsule endoscopy? Gastrointest Endosc 2007;66:533-40. [ Links ] 66. Buchman AL, Miller FH, Wallin A, Chowdhry AA, Ahn C. Videocapsule endoscopy versus barium contrast studies for the diagnosis of Crohn's. Am J Gastroenterology 2004;99:2171-7. [ Links ] 67. Buisson A, Chavauex JB, Bommelaer G, Peyrin-Biroulet L. Diagnosis, prevention and treatment of postoperative Crohn's disease recurrence. Dig Liver Dis 2012;44:453-60. [ Links ] 68. De Cruz P, Kamm MA, Prideaux L, Allen PB, Desmond PV. Postoperative recurrent luminal Crohn's disease: A systematic review. Inflamm Bowel Dis 2012;18:758-77. [ Links ] 69. Neurath MF, Travis SPL. Mucosal healing in inflammatory bowel diseases: A systematic review. Gut 2012;61:1619-35. [ Links ] 70. Tsibouris P, Periklis A, Chrissostomos K, Antonios Z, Panagiota M, Erasmia V, et al. When Crohn's disease is in remission, more patients complete capsule endoscopy study but less lesions are identifiedSaudi J Gastroenterol 2013;19(2):63-8. [ Links ] 71. Efthymiou A. Does clinical response correlate with mucosal healing in patients with Crohn's disease of the small bowel? A prospective, case-series study using wireless capsule endoscopy. Inflamm Bowel Dis 2008;14:1542-7. [ Links ] 72. Adler SN, Yoav M, Eitan S, Yehuda C, EliaKim R. Does capsule endoscopy have an added value in patients with perianal disease and a negative work up for Crohn's disease? World J Gastrointest Endosc 2012;4:185-8. [ Links ] 73. Jess T. Increased risk of intestinal cancer in Crohn's disease: A meta-analysis of population-based cohort studies. Am J Gastroenterol 2005;100:2724-9. [ Links ] 74. Canavan C. Meta-analysis: Colorectal and small bowel cancer risck in patients whit crohn's disease. Alimen Pharmacol Ther 2006;23:1097-104. [ Links ] 75. Kurien M, Evans KE, Aziz I, Sidhu R, Drew K, Rogers TL, et al. Capsule endoscopy in adult celiac disease: a potential role in equivocal cases of celiac disease? Gastrointest Endosc 2013;77:227-32. [ Links ] 76. Gralnek IM, Cohen SA, Ephrath H, Napier A, Gobin T, Sherrod O, et al. Small bowel capsule endoscopy impacts diagnosis and management of pediatric inflammatory bowel disease: A prospective study. Dig Dis Sci 2012;57:465-71. [ Links ] 77. Long MD, Barnes E, Isaacs K, Morgan D, Herfarth HH. Impact of capsule endoscopy on management of inflammatory bowel disease: A single tertiary care center experience. Inflamm Bowel Dis 2011;17:1855-6. [ Links ] 78. Kalla R, McAlindon ME, Drew K, Sidhu R. Impact of capsule endoscopy on management in patients with established Crohn's disease - experience from a single tertiary centre. Gut 2011;60:A216-17. [ Links ] 79. Liao Z, Gao R, Xu C, Li ZS. Indications and detection, completion, and retention rates of small-bowel capsule endoscopy: A systematic review. Gastrointest Endosc 2010;71:280-6. [ Links ] 80. Herrerías JM, Leighton JA, Costamagna G, Infantolino A, Eliakim R, Fischer D, et al. Agile patency system eliminates risk of capsule retention in patients with known intestinal strictures who undergo capsule endoscopy. Gastrointest Endosc 2008;67:902-9. [ Links ] 81. Saurin JC, Maunoury V, Lapalus MG, Cellier C, Delvaux M, Favre O, et al. International consensus in Paris, 2006, on the indications and use of the endoscopic videocapsule test. Report of the SFED capsule commission. Gastroenterol Clin Biol 2007;31:798-805. [ Links ] 82. Postgate AJ, Burling D, Gupta A, Fitzpatrick A, Fraser C. Safety, reliability and limitations of the given patency capsule in patients at risk of capsule retention: A 3-year technical review. Dig Dis Sci 2008;53:2732-8. [ Links ] 83. Cheifetz AS, Lewis BS. Capsule endoscopy retention: Is it a complication? J Clin Gastroenterol 2006;40:688-91. [ Links ] 84. Leighton JA, Legnani P, Seidman EG. Role of capsule endoscopy in inflammatory bowel disease: Where we are and where we are going. Inflamm Bowel Dis 2007;13:331-7. [ Links ] 85. Cheon JH, Kim YS, Lee IS, Chang DK, Ryu JK, Lee KJ, et al. Can we predict spontaneous capsule passage after retention? A nationwide study to evaluate the incidence and clinical outcomes of capsule retention. Endoscopy 2007;39:1046-52. [ Links ] ![]() Dirección para correspondencia:
Dirección para correspondencia:
Marisol Luján Sanchis
Servicio de Patología Digestiva
Hospital General Universitario de Valencia
Avda. Tres Cruces, 2
46014 Valencia
e-mail: marisol.lujan@hotmail.es
Aceptado: 16-09-2013











 texto en
texto en