Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.108 no.5 Madrid may. 2016
Fallo hepático posthepatectomía y fístula biliar: manejo multidisciplinar a propósito de un caso
Liver failure posthepatectomy and biliary fistula: multidisciplinar treatment. Case report
Javier Calleja Kempin1, Arturo Colón Rodríguez1, Pedro Machado Liendo1, Agustín Acevedo2, Jorge Martín Gil3, Teresa Sánchez Rodríguez3 y Laura Zorrilla Matilla1
1 Servicio de Cirugía General. Hospital San Francisco de Asís. Madrid.
2 Servicio de Anatomía Patológica. Hospital Quirón. Madrid.
3 Servicio de Cirugía General. Hospital Quirón San José. Madrid
Dirección para correspondencia
Caso Clínico
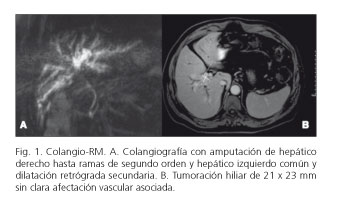
Paciente de 59 años con buen estado general, sin factores de riesgo asociados, que presentaba prurito con bilirrubina 2,5 mg/dl; GGT 400 U/l; FA 350 U/l; CA 19,9 437 y CEA 5. Colangio-RM: tumor en la confluencia biliar de 21 x 23 mm con obstrucción completa del conducto hepático derecho hasta ramas de segundo orden y del origen del conducto hepático izquierdo en íntima relación con la arteria hepática derecha y vena porta derecha (Fig. 1). El estudio volumétrico mostró un remanente hepático futuro del 40% (737 cc, representando un índice > 0,8 ajustado al peso y superficie corporal del paciente), por lo que no se consideró necesario realizar embolización portal preoperatoria, tampoco se decidió drenaje de la vía biliar por presentar en el momento previo a la intervención unas cifras de colemia relativamente bajas (2,5 mg/dl).
Con el diagnóstico de colangiocarcinoma hiliar Bistmuth IV se intervino quirúrgicamente, realizando hepatectomía derecha con ampliación a segmento I+IVb en bloque, seccionando arteria hepática derecha y vena porta derecha en su origen y del conducto hepático izquierdo por encima de la zona infiltrada, con estudio microscópico intraoperatorio libre de infiltración neoplásica. A su vez, se realizó disección de la vía biliar principal con sección de colédoco suprapancreático y linfadenectomía de hilio hepático y arteria hepática hasta tronco celiaco. Reconstrucción biliar mediante hepático-yeyunostomía término-lateral en "Y" de Roux. Intraoperatoriamente se transfundieron dos unidades de concentrados de hematíes. Para la transección del parénquima se empleó bisturí de aspiración ultrasónico (CUSA). No se realizó maniobra de Pringle (clampaje intermitente para isquemia del ligamento hepatoduodenal).
La anatomía patológica definitiva fue informada como colangiocarcinoma hiliar de conducto biliar moderadamente diferenciado (gr2) de patrón en masa (no periductal), que respetaba márgenes quirúrgicos, sin evidencia de infiltración vascular o perineural y con todos los ganglios negativos (0/17; T3N0).
Tras la intervención, el paciente fue trasladado a la UCI, siendo extubado a las 10 horas de la intervención. En la primera analítica postoperatoria presentó actividad de protrombina 35%, bilirrubina 6,6 mg/dl, AST 839 U/l, CPK 1118 U/l, lactato normal y glucemia normal. Los drenajes produjeron 2,5 litros de ascitis moderadamente hemática, con diuresis de 1,1 l en las primeras 24 h.
Considerando un posible inicio de FHPH/SFSS, se comenzó tratamiento con somatostatina en dosis inicial de 50 µg/8 horas con incremento gradual hasta 250 µg cada 8 h en días posteriores, asociando vitamina K i.v. (1 ampolla/12 h) e introduciendo propanolol en dosis de 100 mg/12 h, así como tratamiento preventivo de la encefalopatía (dieta de protección hepática baja en sal y enemas con lactulosa), observando a pesar del tratamiento médico un incremento progresivo en las cifras de colemia, ascitis de difícil control con diuréticos, aunque sin encefalopatía y con fallo renal moderado, además, en el líquido del drenaje se puso de manifiesto la presencia de una fístula biliar.
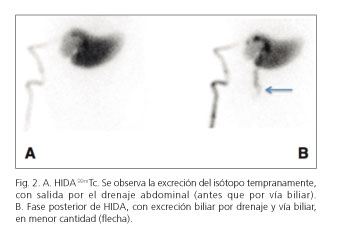
En el 17o día postoperatorio, ante una respuesta insuficiente al tratamiento médico y con diagnóstico establecido de FHPH con bilirrubina de 15 mg, se decidió llevar a cabo una embolización de la arteria esplénica mediante radiología intervencionista, con el objetivo de reducir el flujo y la presión portal. Tras el procedimiento, las cifras de bilirrubina descendieron a 8 mg/dl de forma inmediata, manteniéndose un deterioro de la función sintética del hígado (actividad de protrombina < 50%) y ascitis refractaria con necesidad de paracentesis de repetición. En el 25o día postoperatorio el paciente presentó disnea, hipotensión, fallo renal con mantenimiento de coagulopatía, por lo que ingresó en la UCI realizándose una TC en la que se objetivó la presencia de colecciones con biloma no drenable percutáneamente, por lo que se decidió reintervención para evacuar las colecciones y el biloma secundario a fistula biliar, sin poder encontrar un orifico fistuloso patente por existir gran inflamación local asociada. En esta intervención se midió de forma intraoperatoria la presión en vena la ileocólica que objetivó datos de hipertensión portal (18 mm de Hg). El paciente presentó buena respuesta posterior, con mejoría de todos los parámetros de función hepática, renal y respiratoria. Los cultivos del líquido de drenaje evidenciaron infección por Staphilococo epididermidis y faecium, por lo que se instauró tratamiento y profilaxis con linezolid, daptomicina, meropenem y fluconazol. Tras esta última cirugía quedó establecida una fístula con salida de bilis por el drenaje subfrénico derecho objetivada mediante HIDA99mTc, que fue recogida en su mayoría por el drenaje Jackson-Pratt, y con escasa excrección de bilis por anastomosis hepatoyeyunal (Fig. 2).
En el 31o día postoperatorio se produjo nuevo empeoramiento clínico por sepsis, realizándose TC en la que se observó un infarto parcial del bazo con áreas de necrosis, decidiéndose nueva intervención en la que se evacuó ascitis con tinte biliar, se realizó lavado de la cavidad, esplenectomía, sutura de pequeña fuga en la cara anterior de anastomosis biliar con colocación de drenaje externo multiperforado transanastomótico en asa yeyunal, así como biopsia hepática informada como colestasis crónica con esteatosis hepática microvesicular y focos de hemorragia parenquimatosa, hallazgos compatibles con los descritos en el SFSS (1) (Fig. 3). Tras esta intervención, el paciente experimentó mejoría progresiva y quedó establecida una fístula biliar con débito en ascenso progresivo a través del drenaje abdominal. Se decidió reinfundir el contenido biliar del drenaje hacia el intestino a través del drenaje enterobiliar multiperforado, permitiendo de esta manera el restablecimiento de la circulación enterohepática. Este hecho fue clave para mejorar la situación nutricional del paciente y se asoció con una mejoría constante de los parámetros analíticos, con normalización de las cifras de bilirrubina y de coagulación. El paciente fue dado de alta el 80o día postoperatorio, tras negativización de cultivos, con buena situación clínica, tolerancia oral y normalización analítica. La medicación oral al alta fue propanolol 50 mg/12 h y furosemida 40 mg cada 12 h. La bilis obtenida por el drenaje (hasta 700 cc) le fue reinfundida en su domicilio a través del drenaje multiperforado mediante bomba de infusión nocturna.
Tras 6 meses de la primera intervención, con la regeneración hepática completada y menor actividad inflamatoria en la cavidad abdominal, se realizó nueva cirugía para reparación de la fístula biliar, objetivándose un orificio fistuloso en la zona posterior de la superficie de sección hepática, utilizando el mismo asa de la anastomosis hepáticoyeyunal previa, se realizó una nueva anastomosis al orificio fistuloso. El alta se llevó a cabo con buen estado general, función hepática normal y siendo independiente desde el punto de vista funcional. La RM demostró una hipertrofia compensadora con recuperación del volumen hepático similar al inicial (Fig. 4).
Discusión
Actualmente la morbimortalidad tras resecciones hepáticas mayores ha disminuido de forma importante gracias a una mejor evaluación preoperatoria y una mejor técnica quirúrgica y anestésica. Sin embargo, bien por resecciones extensas o por alteraciones en la capacidad de regeneración hepática, los pacientes pueden desarrollar tanto el llamado síndrome del hígado pequeño para su tamaño -Small for Size Syndrome (SSFS)-, término acuñado por Edmond y cols. para hacer referencia al fallo hepático que se producía tras un trasplante hepático de donante vivo (2) caracterizado por colestasis, coagulopatía, encefalopatía y ascitis refractaria al tratamiento como el llamado fallo hepático posthepatectomía (FHPH), definido como el deterioro de la función hepática tras una resección mayor de forma semejante al SSFS, presente desde los primeros días de postoperatorio (3). Tanto el SFSS como el FHPH son entidades que comparten el mismo origen fisiopatológico, siendo el principal mecanismo implicado el hiperaflujo portal con volumen hepático reducido (2,3), por lo que se produce una dilatación sinusoidal con necrosis centrolobulillar y colestasis asociada, que deriva en una alteración de la función sintética del hígado con inhibición de la regeneración celular (1). En el caso presentado, el diagnóstico de FHPH fue puesto de manifiesto desde los primeros días postoperatorios de acuerdo con la clínica del paciente y confirmados a lo largo de la evolución por los hallazgos anatomopatológicos obtenidos en la biopsia.
Desde el punto de vista profiláctico, existen múltiples formas de minimizar el riesgo de FHPH de manera preoperatoria, basándonos en pruebas capaces de medir tanto la "calidad" del parénquima -biopsia o test de reserva funcional (por ejemplo aclaramiento de verde de indocianina) (4)- como la "cantidad" de parénquima hepático -test de volumen medidos por TC y ajustados al peso y superficie corporal del paciente (5)-. De forma global, se considera suficiente un remanente del 25% en parénquima sano y del 40% en hígados con un cierto grado de daño por hepatopatía. En nuestro caso el paciente tenía un cálculo de volumetría con un remante hepático funcional del 40%, sin existencia de factores de riesgo como edad avanzada (> 65 años) o diabetes, por lo que, en estas condiciones, no se consideró necesario realizar embolización portal preoperatoria para aumentar el volumen hepático remanente (6). Uno de los factores que pudo contribuir en el desarrollo del FHPH pudo ser la presencia de colestasis (Bt 2,5 mg/dl) en el momento de la intervención quirúrgica. No existe evidencia que demuestre que realizar hepatectomías mayores en pacientes con hiperbilirrubinemia se asocie con cifras mayores de morbimortalidad. Cherqui y cols. comunicaron una serie de 20 pacientes con ictericia obstructiva a los que se les realizó una hepatectomía mayor sin drenaje biliar preoperatorio y no se observaron diferencias en necesidad de transfusión, fallo hepático o mortalidad. La morbilidad global fue superior en el grupo de pacientes a los que se realizó drenaje preoperatorio (50% vs. 15%) en forma de colecciones subfrénicas o fístula biliar (7). En un metaanálisis del año 2002, Sewnath y cols. comunicaron la no utilidad del empleo de drenaje percutáneo antes de la cirugía en pacientes con obstrucción biliar, tanto en cirugía pancreática como en cirugía hepática, demostrando un incremento tanto en la morbilidad como en la estancia hospitalaria, sin asociar una reducción en la mortalidad (8). En nuestro caso valoramos la opción de drenaje biliar preoperatorio; sin embargo, debido a que todos los datos de función hepática eran normales, antepusimos la realización de cirugía priorizada sobre la demora y las complicaciones asociadas que el drenaje biliar pudiera producir.
El principal mecanismo etiopatogénico implicado en el desarrollo del SFSS/FHPH es el hiperaflujo portal y la alteración asociada que se produce en el llamado reflejo buffer portoarterial. En condiciones normales existe una intima relación entre el flujo portal y arterial hepático, de forma que la reducción de flujo portal se acompaña de un incremento compensatorio del flujo arterial, mecanismo que no se produce al contrario. Tras una hepatectomía mayor (> 60%), el hígado remanente recibe un incremento de volumen sanguíneo a través de la vena porta, mientras que el flujo arterial, lejos de incrementarse, se ve reducido de forma proporcional, siendo este hecho responsable en parte del daño hepático y la pérdida de capacidad regenerativa (9). Diferentes estudios han demostrado que una presión portal postoperatoria > 20 mmHg se asocia a colestasis con coagulopatía, con incremento de los niveles de factor de crecimiento hepatocitario (HGF) y reducción de los niveles del factor de crecimiento vascular endotelial (VEGF) (10). Básicamente, el tratamiento del FHPH debe ir dirigido a combatir el daño hepático producido por el hiperaflujo portal, de forma que la modulación (farmacológica o quirúrgica) de la circulación esplácnica representa la primera vía terapéutica. De esta forma, cualquier medida encaminada a reducir el flujo portal produce a través del reflejo buffer portoarterial un aumento del aporte arterial que contribuye al desarrollo del mecanismo regenerativo.
Acorde a la definición de FHPH descrita por el grupo internacional de estudio de cirugía hepática, nuestro paciente tenía un grado C de fallo hepático que obligó a realizar varias medidas intervencionistas más allá del simple tratamiento médico (2). La somatostatina es un péptido empleado en clínica para el tratamiento de la hemorragia por varices esofágicas que ejerce su acción reduciendo de forma selectiva el flujo de la circulación esplácnica y por tanto la presión portal, sin producir grandes cambios hemodinámicos; además es capaz de minimizar el daño que el hiperaflujo portal produce en el sinusoide de forma directa por estímulo sobre la endotelina 1 (11). El paciente fue tratado durante todo el proceso con somatostatina, con incremento progresivo de las dosis, hasta su estabilización. Otro tratamiento potencial para modular a la baja el flujo esplácnico en el FHPH es la terlipresina, capaz de reducir la presión venosa portal ayudando a la regeneración hepática (12). Por otro lado, técnicas como la embolización de la arteria esplénica o la esplenectomía han sido descritas como procedimientos para la reducción de la presión y flujo portales, tanto en SSFS tras trasplante como en FHTH, con resultados satisfactorios, con incremento de supervivencia asociado (13,14). Sin embargo, la esplenectomía se puede considerar como superior a la hora de aumentar el balance leucocitario y el recuento de plaquetas, aunque pueda facilitar complicaciones infecciosas, hecho observado en el curso clínico de nuestro paciente. Por otra parte, el fallo hepático puede verse agravado si existen infecciones asociadas como ocurrió en el caso presentado, encontrando hasta en el 80% de los pacientes con FHPH infecciones bacterianas y fúngicas (15). De hecho, un ensayo clínico ha demostrado que el empleo de antibióticos profilácticos reduce el riesgo de FHPH y de complicaciones infecciosas (16).
En el manejo de la coagulopatía puede administrarse vitamina K, trasfusiones de plasma y plaquetas, así como factor VII recombinante, en este caso la vitamina K se mantuvo a lo largo de todo el ingreso, dejándose el resto para tratamiento en momentos puntuales en los que se realizó cirugía u otros procedimientos invasivos.
En el seguimiento del FHPH los parámetros analíticos más fiables para detectar su gravedad son la bilirrubina y la actividad de protrombina o INR. Cuando la bilirrubina alcanza valores > 7 mg/dl se asocia con un importante incremento de la mortalidad postoperatoria (17). Los datos clínicos más relevantes del FHPH son la ascitis y la encefalopatía, esta última se presenta en estadios terminales. Una vez instaurado el cuadro, se establecen patrones de fallo de orgánico: fallo cardiovascular con disminución de las resistencias vasculares periféricas, fallo respiratorio por edema y fallo renal, que se agravan por sepsis de cualquier origen. En el caso presentado se objetivaron todos estos datos de forma progresiva sin llegar a producirse encefalopatía hepática, y solo una terapia multidisciplinar agresiva basada en tratamiento médico, intervencionismo por imagen y cirugías repetidas fue capaz de controlar el cuadro.
Un hecho relevante en este caso clínico fue la presencia de fístula biliar bien drenada al exterior, que permitió una medida exacta de la cantidad de bilis producida por el hígado en su evolución, sirviendo como marcador de la función hepática así como de su regeneración, con incremento del débito de forma gradual acorde con la mejoría clínica y analítica. La reinfusión biliar a la luz intestinal fue clave en la mejoría nutricional, manteniendo la circulación enterohepática biliar, permitiendo finalmente realizar la última intervención de reconstrucción a los 6 meses de la resección, con una regeneración hepática prácticamente completa.
Tanto el FHPH como el SFSS representan las principales causas de mortalidad tras una cirugía hepática mayor o trasplante hepático de donante vivo. Su manejo terapéutico debe ser agresivo y de inicio lo más precoz posible, implicando un manejo multidisciplinar con la participación de diferentes especialistas, aunando de forma conjunta tratamientos farmacológicos, técnicas de radiología intervencionista y cirugía capaces de provocar una reducción del flujo y presión portales.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Javier Calleja Kempin.
Servicio de Cirugía General.
C/ Joaquín Costa, 28.
28002, Madrid
e-mail: jcallejakempin@msn.com
Recibido: 25-02-2015
Aceptado: 07-04-2015
Bibliografía
1. Demetris AJ, Kelly DM, Eghtesad B, et al. Pathophysiologic observations and histopathologic recognition of the portal hyperperfusion or small-for-size syndrome. Am J Surg Pathol 2006;30:986-93. DOI: 10.1097/00000478-200608000-00009. [ Links ]
2. Emond JC, Renz JF, Ferrell LD, et al. Functional analysis of grafts from living donors. Implications for the treatment of older recipients. Ann Surg 1996;224:544-52-discussion 552-4. DOI: 10.1097/00000658-199610000-00012. [ Links ]
3. Rahbari NN, Garden OJ, Padbury R, et al. Posthepatectomy liver failure: A definition and grading by the International Study Group of Liver Surgery (ISGLS). Surgery 2011;149:713-24. DOI: 10.1016/j.surg.2010.10.001. [ Links ]
4. Imamura H, Sano K, Sugawara Y, et al. Assessment of hepatic reserve for indication of hepatic resection: decision tree incorporating indocyanine green test. J Hepatobiliary Pancreat Surg 2005;12:16-22. DOI: 10.1007/s00534-004-0965-9. [ Links ]
5. Vauthey J. Body surface area and body weight predict total liver volume in Western adults. Liver Transplantation 2002;8:233-40. DOI: 10.1053/jlts.2002.31654. [ Links ]
6. Hammond JS, Guha IN, Beckingham IJ, et al. Prediction, prevention and management of postresection liver failure. Br J Surg 2011;98:1188-200. DOI: 10.1002/bjs.7630. [ Links ]
7. Cherqui D, Benoist S, Malassagne B, et al. Major liver resection for carcinoma in jaundiced patients without preoperative biliary drainage. Arch Surg 2000;135:302-8. DOI: 10.1001/archsurg.135.3.302. [ Links ]
8. Sewnath ME, Karsten TM, Prins MH, et al. A meta-analysis on the efficacy of preoperative biliary drainage for tumors causing obstructive jaundice. Ann Surg 2002;236:17-27. DOI: 10.1097/00000658-200207000-00005. [ Links ]
9. Eipel C. Regulation of hepatic blood flow: The hepatic arterial buffer response revisited. WJG 2010;16:6046. DOI: 10.3748/wjg.v16.i48.6046. [ Links ]
10. Yagi S, Iida T, Hori T, Taniguchi K, et al. Optimal portal venous circulation for liver graft function after living-donor liver transplantation. Transplantation 2006;81:373-8. DOI: 10.1097/01.tp.0000198122.15235.a7. [ Links ]
11. Xu X, Man K, Zheng SS, et al. Attenuation of acute phase shear stress by somatostatin improves small-for-size liver graft survival. Liver Transpl 2006;12:621-7. DOI: 10.1002/lt.20630. [ Links ]
12. Fahrner R, Patsenker E, de Gottardi A, et al. Elevated liver regeneration in response to pharmacological reduction of elevated portal venous pressure by terlipressin after partial hepatectomy. Transplantation 2014;97:892-900. DOI: 10.1097/TP.0000000000000045. [ Links ]
13. Yoshizumi T, Taketomi A, Soejima Y, et al. The beneficial role of simultaneous splenectomy in living donor liver transplantation in patients with small-for-size graft. Transpl Int 2008;21:833-42. DOI: 10.1111/j.1432-2277.2008.00678.x. [ Links ]
14. Umeda Y, Yagi T, Sadamori H, et al. Preoperative proximal splenic artery embolization: A safe and efficacious portal decompression technique that improves the outcome of live donor liver transplantation. Transpl Int 2007;20:947-55. DOI: 10.1111/j.1432-2277.2007.00513.x. [ Links ]
15. Schindl MJ. The value of residual liver volume as a predictor of hepatic dysfunction and infection after major liver resection. Gut 2005;54:289-96. DOI: 10.1136/gut.2004.046524. [ Links ]
16. Wu CC, Yeh DC, Lin MC, et al. Prospective randomized trial of systemic antibiotics in patients undergoing liver resection. Br J Surg 1998;85:489-93. DOI: 10.1046/j.1365-2168.1998.00606.x. [ Links ]
17. Mullen JT, Ribero D, Reddy SK, et al. Hepatic insufficiency and mortality in 1,059 noncirrhotic patients undergoing major hepatectomy. ACS 2007;204:854-62-discussion 862-4. DOI: 10.1016/j.jamcollsurg.2006.12.032. [ Links ]











 texto en
texto en