Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Española de Enfermedades Digestivas
versão impressa ISSN 1130-0108
Rev. esp. enferm. dig. vol.108 no.8 Madrid Ago. 2016
https://dx.doi.org/10.17235/reed.2015.4012/2015
Nuevos retos en la investigación clínica del carcinoma hepatocelular
New challenges in clinical research on hepatocellular carcinoma
Álvaro Díaz-González1, Alejandro Forner1,2, Carlos Rodríguez de Lope3 y María Varela4
1 Unidad de Oncología Hepática (BCLC). Servicio de Hepatología. Hospital Clínic Barcelona. IDIBAPS. Universidad de Barcelona. Barcelona.
2 Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (Ciberehd).
3 Servicio de Aparato Digestivo. Hospital Universitario Marqués de Valdecilla. IDIVAL. Santander.
4 Sección de Hepatología. Servicio de Aparato Digestivo. Hospital Universitario Central de Asturias (HUCA). Universidad de Oviedo. Oviedo
Dirección para correspondencia
RESUMEN
Esta es una revisión actualizada de los distintos aspectos de cribado, diagnóstico precoz y tratamiento del carcinoma hepatocelular destacando especialmente los cambios sucedidos en los últimos dos años y las áreas de mejora que requieren trabajos de investigación clínica.
El carcinoma hepatocelular (CHC) constituye actualmente el sexto cáncer más frecuente, con más de 740.000 casos diagnosticados anualmente, y la tercera causa de muerte por neoplasia a nivel mundial (1). Esta neoplasia aparece frecuentemente asociada a la presencia de una enfermedad hepática, siendo una de las principales causas de muerte en los pacientes afectos de cirrosis hepática (2,3). En los últimos años han aparecido novedades importantes en el diagnóstico, estadiaje y tratamiento del CHC que han permitido una mejora en el manejo de esta enfermedad (4-7). A pesar de que estos avances han cambiado completamente la historia natural del CHC, existen aún muchas áreas en las que se precisan avances para poder mejorar. El objetivo de este documento es discutir algunos aspectos controvertidos que a nuestro juicio constituyen retos en la investigación clínica del CHC.
Palabras clave: Carcinoma hepatocelular. Oncología hepática. Sorafenib. Quimioembolización transarterial. AFP.
ABSTRACT
This is an updated review of screening, early diagnosis and treatment of hepatocellular carcinoma, focusing on the advancements occurred in the last years and highlighting the challenges in clinical research.
Hepatocellular carcinoma (HCC) is nowadays the sixth most frequent cancer worldwide with up to 740,000 new cases diagnosed each year, and it is the third most prevalent cause of cancer-related-death worldwide (1). This neoplasm usually appears linked to an underlying liver disease, being one of the most relevant causes of death in patients diagnosed of liver cirrhosis (2,3). In the last years, important advancements in terms of diagnosis, staging and treatment of HCC, improving the management and outcome of the disease, have been made (4-7). Despite the fact that these improvements have absolutely changed natural history of HCC, there are several areas that still need further advancements.
The aim of this document is to discuss some controversial aspects, which in our opinion constitute real challenges in clinical research of HCC.
Key words: Hepatocellular carcinoma. Hepatic oncology. Sorafenib. Transarterial chemoembolization. AFP.
Mejorar el diagnóstico precoz
Teniendo en cuenta que la única posibilidad de aplicar tratamientos con intención curativa es diagnosticando la enfermedad en una fase asintomática y, dado que esta opción es únicamente factible si se efectúa cribado de la población en riesgo, se recomienda explorar periódicamente a los pacientes con cirrosis mediante ecografía (US) abdominal. A pesar de la aceptación del cribado de CHC por parte de las guías de práctica clínica españolas (4), un estudio de registro realizado en España e incluyendo 62 centros y 705 pacientes diagnosticados de CHC durante un periodo de 4 meses mostró que sólo un 47% de los CHC se diagnosticaron a través de programa de cribado y que menos de la mitad se diagnosticaron en estadio inicial (8). Estos datos demuestran que el diagnóstico precoz, aspecto fundamental para poder disminuir significativamente la mortalidad del CHC, es una de las áreas que merecen concentrar los esfuerzos de la comunidad científica. Con el objetivo de evaluar cuáles fueron las principales causas del fracaso del programa de cribado en Estados Unidos, Singal y cols. evaluaron una cohorte de 1.005 pacientes incluidos en el estudio HALT-C. Un tercio de los pacientes no se adhirieron a un programa adecuado de cribado y en el 70% de los casos en los que el CHC se diagnosticó en estadios avanzados, la causa fue la ausencia de detección de la lesión mediante la US (9). Con objeto de mejorar la tasa de detección, es fundamental establecer programas de formación para certificar la capacitación para llevar a término esta actividad y es preciso usar ecógrafos modernos con las prestaciones adecuadas para poder efectuar correctamente la exploración. El uso de marcadores tumorales podría ayudar a superar las teóricas limitaciones de la US: su evaluación es objetiva, no operador dependiente y reproducible, y su determinación es relativamente barata y fácilmente disponible en áreas con bajos recursos económicos. Lamentablemente, los diferentes marcadores tumorales evaluados para el diagnóstico precoz del CHC han mostrado un bajo rendimiento para el diagnóstico precoz del CHC (10-13) y su asociación con la US no mejora el rendimiento y aumenta el coste del cribado (14). Un estudio reciente ha propuesto un panel de microRNA detectados en plasma para el diagnóstico precoz, pero es preciso validar externamente su eficacia (15).
Otro aspecto relevante es elegir aquella población en la cual la aplicación de un programa de cribado es coste-eficaz. La decisión para entrar en un programa de cribado está basada en el riesgo de desarrollar CHC, en la esperanza de vida y en el coste que se esté dispuesto a asumir. Hace más de 30 años (y basado en pacientes con enfermedad renal crónica en los cuales era preciso decidir si entraban en un programa de diálisis), se determinó que una intervención era coste-eficaz si permitía incrementar la supervivencia 100 días con un coste de 50.000$/año de vida ganado (16). Estas consideraciones se han quedado obsoletas: la expectativa de vida de un paciente afecto de cirrosis hepática es difícil de predecir con exactitud, particularmente ahora que se dispone de tratamiento eficaz para la infección por el virus de la hepatitis C (VHC), el coste asumido no está actualizado y, lo más importante, el coste asociado a un programa de cribado es muy difícil de determinar. Además de los costes de las técnicas de cribado y de las pruebas necesarias para confirmar el diagnóstico, es preciso considerar el impacto social que supone la implementación de un programa de cribado (por ejemplo, los días de absentismo laboral), así como el impacto económico y emocional de los resultados falsos positivos y de las potenciales complicaciones de las técnicas de cribado/confirmación diagnóstica (17). Basado en las asunciones anteriormente discutidas, el cribado se considera coste-eficaz si la incidencia estimada de desarrollo de CHC en pacientes con cirrosis es superior al 1,5% y mayor del 0,2% en pacientes con hepatopatía crónica sin cirrosis. De acuerdo con estas premisas, se recomienda cribado en todos los pacientes con cirrosis independientemente de la etiología, en pacientes con hepatopatía crónica activa por VHC con fibrosis grado 3 y en aquellos pacientes con infección crónica por el VHB que presenten riesgo aumentado de CHC (la incidencia de CHC en adultos asiáticos o africanos con infección activa por virus de la hepatitis B [VHB], con o sin historia familiar de CHC, excede claramente este punto de corte) (18). Sin embargo, en los últimos años múltiples autores han demostrado que el riesgo de desarrollo de CHC no es homogéneo en todos los pacientes y se han sugerido diferentes herramientas para predecirlo. En el caso de pacientes con infección crónica por VHC, la elastografía hepática parece ser una herramienta útil para estratificar pacientes con diferente riesgo de CHC (19,20). Merece la pena destacar que en los casos con cirrosis por VHC la obtención de respuesta viral sostenida no elimina el riesgo de desarrollar CHC tras el tratamiento (21) y, por tanto, deberían mantenerse en programas de cribado. En aquellos pacientes con infección crónica por VHB, la edad, el sexo masculino, una rigidez hepática aumentada, el consumo concomitante de alcohol y una carga viral elevada se asocian a un mayor riesgo de CHC (18,22-24). Entre los pacientes con cirrosis hepática alcohólica, tienen mayor riesgo aquellos con plaquetopenia y edad superior a 55 años (25). Por último, respecto al riesgo de CHC en pacientes afectos de enfermedad hepática por depósito de grasa, en el momento actual existe escasa información, particularmente en aquellos que aún no han desarrollado cirrosis. Además, el cribado en estos pacientes está dificultado por la obesidad y la aplicación de tratamientos potencialmente curativos puede verse limitada por las comorbilidades frecuentemente asociadas. Por tanto, actualmente no es posible realizar ninguna recomendación de cribado en este grupo de pacientes.
El diagnóstico no invasivo mediante técnicas de imagen se ha ido refinando progresivamente, permitiendo realizar el diagnóstico concluyente de CHC sin necesidad de obtener una biopsia en un gran número de pacientes. Sin embargo, en nódulos menores de 2 cm, la sensibilidad de las técnicas de imagen es de 50-60% (26-28), por lo que en el 40-50% de estos es necesaria la realización de una biopsia. Recientemente se han evaluado diferentes estrategias para tratar de incrementar la sensibilidad del criterio no invasivo. Se ha analizado la utilidad de la detección de otros parámetros de imagen como la presencia de grasa intralesional, hipointensidad en fases venosas o la presencia de pseudocápsula. Por desgracia, estos parámetros no aumentan significativamente el rendimiento diagnóstico de la RM (29). Las secuencias de difusión han mostrado potencial utilidad para el diagnóstico de CHC, pero hasta la fecha no existen estudios prospectivos que demuestren un claro aumento del rendimiento diagnóstico (30,31). También se ha investigado la utilidad de los contrastes órgano-específicos para el diagnóstico del CHC (32). Aunque estudios retrospectivos han descrito resultados prometedores (33,34), hasta la fecha no existen publicados estudios prospectivos que hayan demostrado superioridad respecto al contraste convencional.
Refinamiento de la evaluación pronóstica y decisión terapéutica
Una vez obtenido el diagnóstico, la evaluación pronóstica es un paso fundamental en el manejo del CHC. Teniendo en cuenta que el CHC aparece en la mayoría de los casos asociado a una cirrosis hepática, y que el grado de alteración de la función hepática determina las opciones terapéuticas y la supervivencia independientemente de la presencia del CHC, es imprescindible considerar conjuntamente el grado de disfunción hepática y la extensión tumoral. Además, la presencia de síntomas relacionados con cáncer evaluados adecuadamente mediante escalas validadas como la clasificación ECOG performance status (35) ha mostrado un gran valor pronóstico y, al igual que el grado de reserva funcional hepática, determina la aplicabilidad de los diferentes tratamientos disponibles. El éxito de cualquier sistema de estadiaje se basa en su capacidad para vincular el estadio de la enfermedad con una recomendación terapéutica. Durante los últimos 30 años se han sugerido múltiples sistemas de estadiaje; la mayoría de ellos no tienen en cuenta la presencia de síntomas o evalúan la extensión tumoral de forma imprecisa (36). De todos los sistemas propuestos hasta la fecha, el que ha presentado más éxito ha sido el sistema Barcelona-Clinic-Liver-Cancer (BCLC). Desde su publicación original en 1999 (37), el BCLC se ha ido refinando hasta su última versión en 2014 (38), ha sido validado externamente (39-42) y por su reconocida capacidad predictiva y su utilidad en el proceso de decisión de tratamiento ha sido el sistema recomendado por las principales sociedades científicas (5,6,43,44). Recientemente se ha publicado un nuevo sistema de estadiaje (clasificación Hong Kong Liver Cancer [HKLC]) derivado a partir de una cohorte de 3.856 pacientes tratados en Hong Kong (45). La principal peculiaridad de esta propuesta es la aceptación de resección quirúrgica en un subgrupo de pacientes con estadio intermedio/avanzado. Sin embargo, la clasificación HKLC presenta importantes limitaciones (46). Una de las más relevantes es el hecho de que está construida de forma retrospectiva y, por tanto, aquellos pacientes seleccionados para resección quirúrgica en vez de TACE presentan ciertas características que determinan un buen pronóstico, mientras que aquellos pacientes tratados con TACE no presentan dichas características, introduciendo un sesgo a favor de la resección (47).
El estadio intermedio del BCLC engloba un grupo heterogéneo de pacientes. Con la intención de refinar la evaluación pronóstica del estadio BCLC-B, Bolondi y cols. han propuesto una sub-clasificación del estadio B en 4 subgrupos de acuerdo al estadio tumoral, presencia de síntomas y el grado de disfunción hepática (48). Esta subclasificación incluye pacientes con disfunción hepática severa. Estos pacientes, como queda claramente definido en la clasificación BCLC, deberían evaluarse para trasplante hepático y en ellos, la presencia de un CHC constituye únicamente una contraindicación en caso de que la extensión tumoral exceda los criterios para poder ofrecer esta opción. Además, sugiere no distinguir entre pacientes asintomáticos (PS 0) y con mínimos síntomas (PS 1) cuando estudios de los mismos autores demuestran la importancia pronóstica de tener PS 1 en pacientes tratados mediante quimioembolización (49). Otro inconveniente es que, mientras que según el BCLC los tumores únicos sin afectación de PS y sin diseminación se deben considerar BCLC A, la propuesta de Bolondi los clasifica como BCLC B. Por último, esta subclasificación no ha demostrado capacidad pronóstica discriminatoria en estudios realizados en Europa (50).
A pesar de las virtudes del sistema BCLC, es preciso refinar la evaluación pronóstica. En este sentido, en los últimos años se han publicado diferentes patrones de expresión genética con posible significación pronóstica (51-57). Sin embargo, hasta la fecha no se ha demostrado que la presencia de un patrón molecular determinado permita una decisión terapéutica específica. Además, el uso de la información genética está limitado por la heterogeneidad tumoral marcada del CHC (58,59). De forma similar, aunque algunos marcadores tumorales (especialmente la AFP) han demostrado un indiscutible valor pronóstico (60-64), muchos de ellos no presentan un valor de corte aceptado como patológico, no tienen capacidad para evaluar a los pacientes de forma individual y no implican una modificación en la decisión terapéutica (7). Por tanto, uno de los retos actuales en investigación clínica es tratar de integrar los datos de expresión génica en los actuales sistemas de evaluación y basar la predicción de supervivencia e indicación de tratamiento en el perfil molecular del paciente.
Mejoras en el tratamiento del CHC intermedio-avanzado
Estos estadios de la enfermedad (BCLC-B y BCLC-C) son los que han experimentado más cambios en los últimos años y es, sin lugar a dudas, el área donde la investigación clínica es más activa. Como es bien conocido, el tratamiento estándar del CHC en estadio intermedio de acuerdo a los resultados de dos ensayos clínicos y un posterior meta-análisis es la quimioembolización (TACE) (65-67). Sin embargo, este tratamiento ha evolucionado en los últimos años y aún existen muchos aspectos a investigar (68). Por ejemplo, no se conoce cuál es el mejor agente quimioterápico y/o embolizante. Uno de los mayores avances en este campo ha sido el desarrollo de esferas de alcohol polivinilo cargadas de adriamicina; estas esferas liberan lentamente y selectivamente la quimioterapia a nivel intratumoral, minimizando los efectos secundarios asociados a la exposición sistémica de la quimioterapia (69) y permitiendo una embolización homogénea y calibrada. A pesar de que estudios preliminares han demostrado una excelente respuesta radiológica (70) y unas supervivencias prometedoras (71,72), los estudios randomizados publicados hasta la fecha no han sido capaces de confirmar con rotundidad las ventajas en respuesta radiológica y supervivencia del uso de estas esferas comparadas con la TACE convencional con quimioterapia embebida en lipiodol (73,74). Otros aspectos relevantes son evaluar cuál es el mejor esquema terapéutico (pauta fija o a demanda en función de la persistencia o no de tejido tumoral vascularizado o cuando se detecta revascularización de las lesiones o progresión), cómo se tiene que evaluar la respuesta o, lo más importante, cuándo considerar que la TACE ha fracasado y han de evaluarse otras opciones terapéuticas. Recientemente se ha sugerido el concepto de progresión intratable, definida como aquella progresión asociada a excesiva carga tumoral, una progresión menor pero asociada a una disfunción hepática, empeoramiento del estado general o una contraindicación a la técnica angiorradiológica (75,76). Basado en este concepto de progresión intratable, recientemente se han generado diferentes índices que nos permitirían, de forma objetiva, decidir cuándo finalizar el tratamiento por considerarlo inservible o insuficiente. La mayoría de estos índices consideran la respuesta radiológica y el empeoramiento de la función hepática como los principales parámetros para catalogar la TACE como ineficaz (77-79). Lamentablemente, estos índices no han sido validados externamente y muchos de ellos derivan de cohortes de pacientes que inicialmente eran malos candidatos para TACE. El principal inconveniente de la TACE es que la mayoría de los pacientes experimentan progresión de su enfermedad a pesar de una respuesta inicial. Por último, se ha evaluado la asociación de TACE con agentes moleculares con acción antiangiogénica como sorafenib o brivanib, pero desafortunadamente esta estrategia no ha demostrado mejoría en la tasa de respuesta, el tiempo a progresión o la supervivencia (80,81).
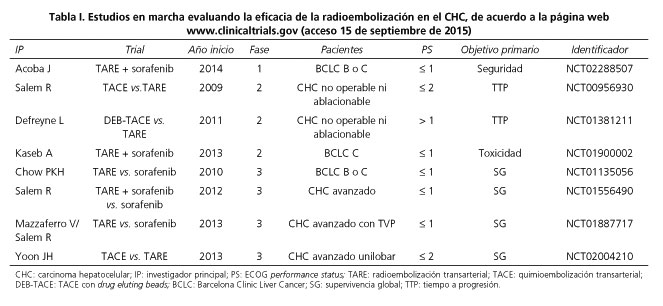
Uno de los tratamientos más prometedores es la radioembolización mediante esferas de Itrio-90 (82). Múltiples estudios prospectivos con pacientes en diferentes estadios de la enfermedad han demostrado seguridad y respuesta radiológica, con una supervivencia aparentemente comparable a la que se obtiene en pacientes tratados mediante TACE o con sorafenib (83-87). Estos datos han dado la base racional para el desarrollo de ensayos clínicos aleatorizados comparando la radioembolización asociada o no con sorafenib versus sorafenib. La tabla I describe los principales estudios en marcha que evalúan la eficacia de la radioembolización en el CHC.
Sin lugar a dudas, en el área donde ha habido mayores progresos ha sido en el tratamiento sistémico. Los progresos en el conocimiento de las alteraciones moleculares que condicionan la progresión tumoral (88-90) han permitido el desarrollo de múltiples agentes que actúan de forma específica a nivel de las vías moleculares alteradas. Se han estudiado múltiples terapias moleculares, siendo el sorafenib el único fármaco que, por el momento, ha demostrado eficacia en términos de supervivencia y retraso de la progresión radiológica en dos ensayos clínicos fase 3 (91,92). Estos resultados han sido confirmados en diferentes ensayos clínicos en los que sorafenib era el tratamiento del brazo control (93-97) y en múltiples estudios prospectivos en la práctica clínica habitual (98-100). Además, el sorafenib mantiene su eficacia independientemente de la etiología de la cirrosis, el estadio basal del tumor, la presencia de síntomas y de los tratamientos previos (101).
A pesar del éxito indiscutible del sorafenib en el CHC avanzado, existen aún muchos aspectos que precisan ser aclarados. Una de las cuestiones más relevantes es identificar en qué pacientes el sorafenib no es eficaz, evitando exponer al paciente a una toxicidad innecesaria. Existe en el momento actual información suficiente para desaconsejar el uso de sorafenib en pacientes Child-Pugh C (99,102,103). En pacientes Child-Pugh B, el perfil farmacocinético no se ve modificado significativamente y no se ha reportado un aumento llamativo de los efectos secundarios, pero es posible que el impacto sobre la progresión tumoral no mejore la supervivencia del paciente en relación al deterioro de la función hepática (99,104), por lo que el uso del sorafenib en esta población debe ser evaluado de forma individualizada (105). Además, se han sugerido diversos marcadores biológicos y clínicos capaces de predecir la respuesta al sorafenib e identificar la ausencia de eficacia en condiciones basales o durante el tratamiento. Biomarcadores como la AFP, factor de crecimiento del endotelio vascular (VEGF), angiopoyetina-2 (Ang-2), factor de crecimiento hepatocitario (HGF) o c-Kit han mostrado capacidad pronóstica en pacientes con CHC avanzado (63). Como se ha expuesto anteriormente, no existe un punto de corte validado que defina qué valor es patológico y, por tanto, el uso de estos biomarcadores no contribuye a la decisión de tratamiento. Mucho más interesante es la identificación de algunos efectos secundarios como predictores de respuesta favorable. En este sentido, el desarrollo de diarrea (106), hipertensión arterial (HTA) (107) o alteraciones dermatológicas (108-110) se asocia a una mejor supervivencia. Por ejemplo, en una cohorte prospectiva recientemente publicada, los pacientes que desarrollaron efectos adversos dermatológicos en los primeros 60 días de tratamiento con sorafenib presentaron una supervivencia mediana significativamente superior que aquellos que no los presentaron (18,2 versus 10,1 meses, respectivamente; p < 0,009) y la aparición de efectos adversos dermatológicos se identificó como uno de los factores pronósticos independientes de supervivencia en el estudio multivariado con análisis de variables tiempo-dependiente. Esta asociación indica la necesidad de un seguimiento cuidadoso de los pacientes con objeto de ajustar la dosis si se detectan efectos secundarios, y así evitar interrupciones innecesarias del tratamiento que llevan a perder eficacia. En cuanto al sustrato sobre el que se producen estos efectos secundarios, se conoce el impacto de los polimorfismos genéticos del factor de necrosis tumoral alfa (TNF-α), interleucina-6 (IL-6) y proteína de unión 3 a nucleótido-Guanina (GNB3) en los síndromes inflamatorios/inmunitarios. Por ejemplo, G308A TNF-α se asocia con HTA, riesgo elevado de enfermedad coronaria y predisposición a la trombosis; C857T de TNF-α se asocia con la artritis psoriásica, IL-6 y los polimorfismos GNB3 C825T también juegan un rol en el desarrollo de HTA. Por otra parte, se conoce que la hipoxia inducida por el tratamiento puede inducir un estímulo compensatorio proangiogénico. Por ello, diferentes estudios se están centrando en la identificación de potenciales polimorfismos en los genes asociados con la respuesta angiogénica (VEGFA, ANGPT2 y PLA2G12A) para de esta manera tratar de identificar los diferentes perfiles de los pacientes, de cara al ajuste de tratamiento (111-113).
Para terminar, en aquellos pacientes con CHC en estadio intermedio/avanzado tratados con sorafenib, el tipo de progresión radiológica determina, de forma estadísticamente significativa y como predictor independiente, la supervivencia post-progresión (100,114). El desarrollo de un nuevo foco extrahepático o de invasión vascular tumoral es el tipo de progresión radiológica asociado a peor supervivencia.
Los resultados positivos del sorafenib fueron la demostración de que las terapias moleculares pueden ser útiles en el tratamiento del CHC y abrieron el camino para evaluar el bloqueo de múltiples vías de señalización de la misma forma que ya se lleva haciendo desde hace años en otras neoplasias. De momento, ningún otro agente evaluado en ensayos clínicos fase 3 en solitario en primera (sunitinib, linifanib, brivanib) (93,94,115) o segunda línea (brivanib, everolimus, ramucirumab) (116-118), o asociado a sorafenib en primera línea (erlotinib) (95), ha conseguido demostrar beneficio respecto a sorafenib.
El resultado negativo de todos estos ensayos clínicos nos obliga a especular por qué todos estos agentes, eficaces en otras indicaciones, han fracasado en el CHC. La primera lección que hemos aprendido es que muchos de estos agentes son excesivamente tóxicos en pacientes con cirrosis. Por tanto, antes de plantear estudios fase 2-3, es preciso realizar estudios fase 1 específicamente en pacientes cirróticos para poder seleccionar la máxima dosis tolerada en esta población. Otra lección aprendida es que algunos resultados clínicos obtenidos en estudios fase 1-2 no son suficientemente informativos para poder predecir eficacia en términos de supervivencia. Sirvan como ejemplos el ensayo clínico de combinación de quimioterapia (PIAF) que presentó respuesta objetiva pero sin impacto en supervivencia (119) o los ensayos clínicos con sorafenib en los que, a pesar de ausencia de respuesta objetiva, se demostró mejoría de supervivencia (91,92), o más recientemente, los ensayos clínicos con linifanib (115) o con brivanib (116), en los que a pesar de objetivarse una mejoría en el tiempo a progresión radiológica no se demostró mejoría en la supervivencia. Además, estos estudios han sufrido sesgos de selección/inclusión de pacientes, en particular aquellos ensayos clínicos evaluando agentes en segunda línea. A la hora de diseñar estos estudios y definir la población diana, es fundamental registrar aquellos eventos acontecidos durante el tratamiento con sorafenib. Como hemos discutido anteriormente, el tipo de progresión radiológica determina de forma estadísticamente significativa la supervivencia post-progresión (100,114). Además, los ensayos en segunda línea reclutan pacientes que, a pesar del fracaso al sorafenib, mantienen una función hepática y estado general conservados (PS 0-1) y han presentado en muchos casos efectos adversos que se asocian con especial buen pronóstico (110). Por tanto, esta población indudablemente presenta una enfermedad con una evolución menos maligna. Por último, algunos estudios han mostrado potencial eficacia en una población específica de acuerdo a un perfil molecular determinado (120) y por tanto, con estos datos preliminares, está justificado enriquecer los estudios con aquellos pacientes que presenten dicho perfil molecular.
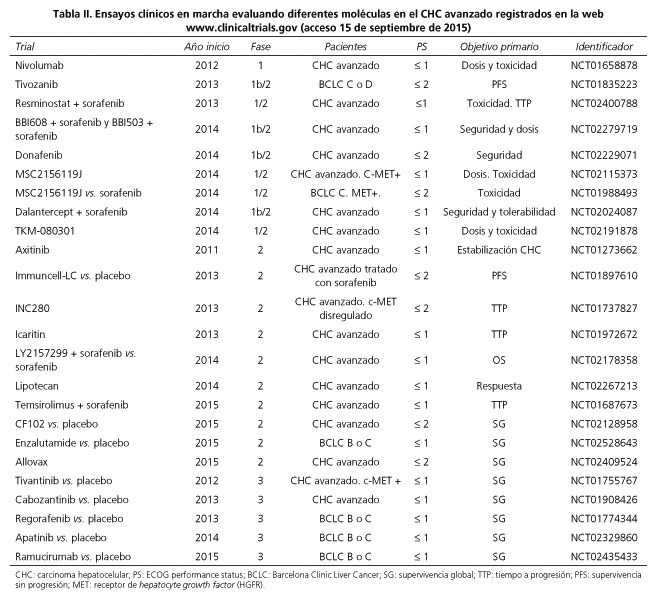
A pesar de los resultados desesperanzadores de los últimos cinco años, en el momento actual existen ensayos clínicos en marcha evaluando diferentes moléculas que en estudios preliminares han mostrado resultados prometedores (Tabla II). Entre los diferentes abordajes cabe destacar el uso de inmunoterapia, con la que se ha descrito repuesta radiológica objetiva y un perfil de seguridad aceptable, y cuyo beneficio deberá ser evaluado en estudios prospectivos aleatorizados más amplios (121,122). Todos estos esfuerzos permitirán, en un futuro inmediato, aumentar las opciones terapéuticas de nuestros pacientes afectos de CHC en estadio avanzado.
![]() Dirección para correspondencia:
Dirección para correspondencia:
María Varela.
Sección de Hepatología.
Servicio de Aparato Digestivo.
Hospital Universitario Central de Asturias.
Avda. de Roma, s/n.
33011 Oviedo
e-mail: maria.varela.calvo@gmail.com
Recibido: 21-09-2015
Aceptado: 24-10-2015
Referencias
1. Fact Sheets by Population-Globocan-IARC (Internet). Available from: http://globocan.iarc.fr/Pages/fact_sheets_population.aspx. [ Links ]
2. Sangiovanni A, Del Ninno E, Fasani P, et al. Increased survival of cirrhotic patients with a hepatocellular carcinoma detected during surveillance. Gastroenterology 2004;126:1005-014. DOI: 10.1053/j.gastro.2003.12.049. [ Links ]
3. Trinchet J-C, Bourcier V, Chaffaut C, et al. Complications and competing risks of death in compensated viral cirrhosis (ANRS CO12 Cir-Vir prospective cohort). Hepatology.2015;62:737-50. DOI: 10.1002/hep.27743. [ Links ]
4. Forner A, Ayuso C, Isabel Real M, et al. Diagnosis and treatment of hepatocellular carcinoma. Med Clin (Barc) 2009;132:272-87. DOI: 10.1016/j.medcli.2008.11.024. [ Links ]
5. Bruix J, Sherman M. Management of hepatocellular carcinoma: An update. Hepatology 2011;53:1020-2. DOI: 10.1002/hep.24199. [ Links ]
6. EASL-EORTC Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol 2012;56:908-43. DOI: 10.1016/j.jhep.2011.12.001. [ Links ]
7. Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma. Lancet 2012;379:1245-55. DOI: 10.1016/S0140-6736(11)61347-0. [ Links ]
8. Varela M, Reig M, De la Mata M, et al. Treatment approach of hepatocellular carcinoma in Spain. Analysis of 705 patients from 62 centers. Med Clin 2010;134:569-76. DOI: 10.1016/j.medcli.2009. 10.042. [ Links ]
9. Singal AG, Nehra M, Adams-Huet B, et al. Detection of hepatocellular carcinoma at advanced stages among patients in the HALT-C trial: Where did surveillance fail? Am J Gastroenterol 2013;108:425-32. [ Links ]
10. Trevisani F, D'Intino PE, Morselli-Labate AM, et al. Serum alpha-fetoprotein for diagnosis of hepatocellular carcinoma in patients with chronic liver disease: Influence of HBsAg and anti-HCV status. J Hepatol 2001;34:570-5. DOI: 10.1016/S0168-8278(00)00053-2. [ Links ]
11. Marrero JA, Feng Z, Wang Y, et al. Alpha-fetoprotein, des-gamma carboxyprothrombin, and lectin-bound alpha-fetoprotein in early hepatocellular carcinoma. Gastroenterology 2009;137:110-8. DOI: 10.1053/j.gastro.2009.04.005. [ Links ]
12. Lok AS, Sterling RK, Everhart JE, et al. Des-gamma-carboxy prothrombin and alpha-fetoprotein as biomarkers for the early detection of hepatocellular carcinoma. Gastroenterology 2010;138:493-502. DOI: 10.1053/j.gastro.2009.10.031. [ Links ]
13. Shen Q, Fan J, Yang XR, et al. Serum DKK1 as a protein biomarker for the diagnosis of hepatocellular carcinoma: a large-scale, multicentre study. Lancet Oncol 2012;13:817-26. DOI: 10.1016/S1470-2045(12)70233-4. [ Links ]
14. Zhang B, Yang B. Combined alpha fetoprotein testing and ultrasonography as a screening test for primary liver cancer. J Med Screen 1999;6:108-10. DOI: 10.1136/jms.6.2.108. [ Links ]
15. Lin XJ, Chong Y, Guo ZW, et al. A serum-microRNA classifier for the early detection of hepatocellular carcinoma: A multicenter and retrospective longitudinal repository study. Lancet Oncol 2015;16:804-15. DOI: 10.1016/S1470-2045(15)00048-0. [ Links ]
16. Neumann PJ, Cohen JT, Weinstein MC. Updating Cost-Effectiveness - The Curious Resilience of the $50,000-per-QALY Threshold. N Engl J Med 2014;371:796-7. [ Links ]
17. Croswell JM, Ransohoff DF, Kramer BS. Principles of cancer screening: Lessons from history and study design issues. Semin Oncol 2010;37:202-15. DOI: 10.1053/j.seminoncol.2010.05.006. [ Links ]
18. Yang HI, Yuen MF, Chan HL, et al. Risk estimation for hepatocellular carcinoma in chronic hepatitis B (REACH-B): Development and validation of a predictive score. Lancet Oncol 2011;12:568-74. DOI: 10.1016/S1470-2045(11)70077-8. [ Links ]
19. Masuzaki R, Tateishi R, Yoshida H, et al. Prospective risk assessment for hepatocellular carcinoma development in patients with chronic hepatitis C by transient elastography. Hepatology 2009;49:1954-61. DOI: 10.1002/hep.22870. [ Links ]
20. Singh S, Fujii LL, Murad MH, et al. Liver stiffness is associated with risk of decompensation, liver cancer, and death in patients with chronic liver diseases: A systematic review and meta-analysis. Clin Gastroenterol Hepatol 2013;11:1573-84.e1-2; quiz e88-89. DOI: 10.1016/j.cgh.2013.07.034. [ Links ]
21. Morgan RL, Baack B, Smith BD, et al. Eradication of hepatitis C virus infection and the development of hepatocellular carcinoma: A meta-analysis of observational studies. Ann Intern Med 2013;158:329-37. [ Links ]
22. Jung KS, Kim SU, Ahn SH, et al. Risk assessment of hepatitis B virus-related hepatocellular carcinoma development using liver stiffness measurement (FibroScan). Hepatology 2011;53:88594. DOI: 10.1002/hep.24121. [ Links ]
23. Wong GL-H, Chan HL-Y, Wong CK-Y, et al. Liver stiffness-based optimization of hepatocellular carcinoma risk score in patients with chronic hepatitis B. J Hepatol 2014;60:339-45. [ Links ]
24. Kim MN, Kim SU, Kim BK, et al. Increased risk of hepatocellular carcinoma in chronic hepatitis B patients with transient elastography-defined subclinical cirrhosis. Hepatology 2015;61:1851-9. DOI: 10.1002/hep.27735. [ Links ]
25. Mancebo A, Gonzalez-Dieguez ML, Cadahia V, et al. Annual incidence of hepatocellular carcinoma among patients with alcoholic cirrhosis and identification of risk groups. Clin Gastroenterol Hepatol 2012;11:95-101. DOI: 10.1016/j.cgh.2012.09.007. [ Links ]
26. Forner A, Vilana R, Ayuso C, et al. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: Prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma. Hepatology 2008;47:97-104. DOI: 10.1002/hep.21966. [ Links ]
27. Sangiovanni A, Manini MA, Iavarone M, et al. The diagnostic and economic impact of contrast imaging technique in the diagnosis of small hepatocellular carcinoma in cirrhosis. Gut 2010;59:638-44. DOI: 10.1136/gut.2009.187286. [ Links ]
28. Khalili KT, Kim TK, Jang HJ, et al. Optimization of imaging diagnosis of 1-2 cm hepatocellular carcinoma: An analysis of diagnostic performance and resource utilization. J Hepatol 2011;54:723-8. DOI: 10.1016/j.jhep.2010.07.025. [ Links ]
29. Rimola J, Forner A, Tremosini S, et al. Non-invasive diagnosis of hepatocellular carcinoma ≤ 2 cm in cirrhosis. Diagnostic accuracy assessing fat, capsule and signal intensity at dynamic MRI. J Hepatol 2012;56:1317-23. DOI: 10.1016/j.jhep.2012.01.004. [ Links ]
30. Piana G, Trinquart L, Meskine N, et al. New MR imaging criteria with a diffusion-weighted sequence for the diagnosis of hepatocellular carcinoma in chronic liver diseases. J Hepatol 2011;55:126-32. DOI: 10.1016/j.jhep.2010.10.023. [ Links ]
31. Vandecaveye V, De Keyzer F, Verslype C, et al. Diffusion-weighted MRI provides additional value to conventional dynamic contrast-enhanced MRI for detection of hepatocellular carcinoma. Eur Radiol 2009;19:2456-66. DOI: 10.1007/s00330-009-1431-5. [ Links ]
32. Van Beers BE, Pastor CM, Hussain HK. Primovist, Eovist: What to expect? J Hepatol 2012;57:421-9. [ Links ]
33. Granito A, Galassi M, Piscaglia F, et al. Impact of gadoxetic acid (Gd-EOB-DTPA)-enhanced magnetic resonance on the non-invasive diagnosis of small hepatocellular carcinoma: A prospective study. Aliment Pharmacol Ther 2013;37:355-63. [ Links ]
34. Golfieri R, Renzulli M, Lucidi V, et al. Contribution of the hepatobiliary phase of Gd-EOB-DTPA-enhanced MRI to Dynamic MRI in the detection of hypovascular small (≤ 2 cm) HCC in cirrhosis. Eur Radiol 2011;21:1233-42. [ Links ]
35. Sorensen JB, Klee M, Palshof T, et al. Performance status assessment in cancer patients. An inter-observer variability study. Br J Cancer 1993;67:773-5. DOI: 10.1038/bjc.1993.140. [ Links ]
36. Forner A, Reig ME, de Lope CR, et al. Current strategy for staging and treatment: The BCLC update and future prospects. Semin Liver Dis 2010;30:61-74. DOI: 10.1055/s-0030-1247133. [ Links ]
37. Llovet JM, Bru C, Bruix J. Prognosis of hepatocellular carcinoma: The BCLC staging classification. Semin Liver Dis 1999;19:329-38. [ Links ]
38. Reig M, Darnell A, Forner A, et al. Systemic therapy for hepatocellular carcinoma: The issue of treatment stage migration and registration of progression using the BCLC-refined RECIST. Semin Liver Dis 2014;34:444-55. DOI: 10.1055/s-0034-1394143. [ Links ]
39. Cillo U, Bassanello M, Vitale A, et al. The critical issue of hepatocellular carcinoma prognostic classification: which is the best tool available? J Hepatol 2004;40:124-31. [ Links ]
40. Grieco A, Pompili M, Caminiti G, et al. Prognostic factors for survival in patients with early-intermediate hepatocellular carcinoma undergoing non-surgical therapy: Comparison of Okuda, CLIP, and BCLC staging systems in a single Italian centre. Gut 2005;54:411-8. DOI: 10.1136/gut.2004.048124. [ Links ]
41. Marrero JA, Fontana RJ, Barrat A, et al. Prognosis of hepatocellular carcinoma: Comparison of 7 staging systems in an American cohort. Hepatology 2005;41:707-716. DOI: 10.1002/hep.20636. [ Links ]
42. Cabibbo G, Enea M, Attanasio M, et al. A meta-analysis of survival rates of untreated patients in randomized clinical trials of hepatocellular carcinoma. Hepatology 2010;51:1274-83. DOI: 10.1002/hep.23485. [ Links ]
43. Ferenci P, Fried M, Labrecque D, et al. Hepatocellular carcinoma (HCC): A global perspective. J Clin Gastroenterol 2010;44:239-45. DOI: 10.1097/MCG.0b013e3181d46ef2. [ Links ]
44. Verslype C, Rosmorduc O, Rougier P. Hepatocellular carcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012;23Suppl7:vii41-8. DOI: 10.1093/annonc/mds225. [ Links ]
45. Yau T, Tang VY, Yao T-J, et al. Development of Hong Kong liver cancer staging system with treatment stratification for patients with hepatocellular carcinoma. Gastroenterology 2014;146:1691-700. DOI: 10.1053/j.gastro.2014.02.032. [ Links ]
46. Sherman M. Staging for hepatocellular carcinoma: Complex and confusing. Gastroenterology 2014;146:1599-602. DOI: 10.1053/j.gastro.2014.04.026. [ Links ]
47. Forner A, Díaz-González A, Liccioni A, et al. Prognosis prediction and staging. Best Pract Res Clin Gastroenterol 2014;28:855-65. [ Links ]
48. Bolondi L, Burroughs A, Dufour J-F, et al. Heterogeneity of patients with intermediate (BCLC B) hepatocellular carcinoma: Proposal for a subclassification to facilitate treatment decisions. Semin Liver Dis 2012;32:348-59. [ Links ]
49. Golfieri R, Giampalma E, Renzulli M, et al. Randomised controlled trial of doxorubicin-eluting beads vs. conventional chemoembolisation for hepatocellular carcinoma. Br J Cancer 2014;111:255-64. DOI: 10.1038/bjc.2014.199. [ Links ]
50. Weinmann A, Koch S, Sprinzl M, et al. Survival analysis of proposed BCLC-B subgroups in hepatocellular carcinoma patients. Liver Int 2015;35:591-600. DOI: 10.1111/liv.12696. [ Links ]
51. Chiang DY, Villanueva A, Hoshida Y, et al. Focal gains of VEGFA and molecular classification of hepatocellular carcinoma. Cancer Res 2008;68:6779-88. DOI: 10.1158/0008-5472.CAN-08-0742. [ Links ]
52. Hoshida Y, Villanueva A, Kobayashi M, et al. Gene expression in fixed tissues and outcome in hepatocellular carcinoma. N Engl J Med 2008;359:1995-2004. DOI: 10.1056/NEJMoa0804525. [ Links ]
53. Hoshida Y, Nijman SM, Kobayashi M, et al. Integrative transcriptome analysis reveals common molecular subclasses of human hepatocellular carcinoma. Cancer Res 2009;69:7385-92. DOI: 10.1158/0008-5472.CAN-09-1089. [ Links ]
54. Lee JS, Chu IS, Heo J, et al. Classification and prediction of survival in hepatocellular carcinoma by gene expression profiling. Hepatology 2004;40:667-76. DOI: 10.1002/hep.20375. [ Links ]
55. Boyault S, Rickman DS, de Reynies A, et al. Transcriptome classification of HCC is related to gene alterations and to new therapeutic targets. Hepatology 2007;45:42-52. DOI: 10.1002/hep.21467. [ Links ]
56. Nault J-C, De Reyniès A, Villanueva A, et al. A hepatocellular carcinoma 5-gene score associated with survival of patients after liver resection. Gastroenterology 2013;145:176-87. DOI: 10.1053/j.gastro.2013.03.051. [ Links ]
57. Hoshida Y, Villanueva A, Sangiovanni A, et al. Prognostic gene expression signature for patients with hepatitis C-related early-stage cirrhosis. Gastroenterology 2013;144:1024-30. DOI: 10.1053/j.gastro.2013.01.021. [ Links ]
58. Gerlinger M, Rowan AJ, Horswell S, et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. N Engl J Med 2012;366:883-92. DOI: 10.1056/NEJMoa1113205. [ Links ]
59. Fox EJ, Loeb LA. Cancer: One cell at a time. Nature 2014;512:143-4. DOI: 10.1038/nature13650. [ Links ]
60. Imamura H, Matsuyama Y, Tanaka E, et al. Risk factors contributing to early and late phase intrahepatic recurrence of hepatocellular carcinoma after hepatectomy. J Hepatol 2003;38:200-7. DOI: 10.1016/S0168-8278(02)00360-4. [ Links ]
61. Sala M, Llovet JM, Vilana R, et al. Initial response to percutaneous ablation predicts survival in patients with hepatocellular carcinoma. Hepatology 2004;40:1352-60. DOI: 10.1002/hep.20465. [ Links ]
62. Merani S, Majno P, Kneteman NM, et al. The impact of waiting list alpha-fetoprotein changes on the outcome of liver transplant for hepatocellular carcinoma. J Hepatol 2011;55:814-9. DOI: 10.1016/j.jhep.2010.12.040. [ Links ]
63. Llovet JM, Peña CEA, Lathia CD, et al. Plasma biomarkers as predictors of outcome in patients with advanced hepatocellular carcinoma. Clin Cancer Res 2012;18:2290-300. [ Links ]
64. Duvoux C, Roudot-Thoraval F, Decaens T, et al. Liver transplantation for hepatocellular carcinoma: A model including alpha-fetoprotein improves the performance of Milan criteria. Gastroenterology 2012;143:985-6. DOI: 10.1053/j.gastro.2012.05.052. [ Links ]
65. Llovet JM, Real MI, Montana X, et al. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: A randomised controlled trial. Lancet 2002;359:1734-9. DOI: 10.1016/S0140-6736(02)08649-X. [ Links ]
66. Lo CM, Ngan H, Tso WK, et al. Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology 2002;35:1164-71. DOI: 10.1053/jhep.2002.33156. [ Links ]
67. Llovet JM, Bruix J. Systematic review of randomized trials for unresectable hepatocellular carcinoma: Chemoembolization improves survival. Hepatology 2003;37:429-42. DOI: 10.1053/jhep.2003.50047. [ Links ]
68. Forner A, Gilabert M, Bruix J, et al. Treatment of intermediate-stage hepatocellular carcinoma. Nat Rev Clin Oncol 2014;11:525-35. [ Links ]
69. Forner A, Real MI, Varela M, et al. Transarterial chemoembolization for patients with hepatocellular carcinoma. Hepatol Res 2007;37Suppl2:S230-7. DOI: 10.1111/j.1872-034X.2007.00190.x. [ Links ]
70. Varela M, Real MI, Burrel M, et al. Chemoembolization of hepatocellular carcinoma with drug eluting beads: Efficacy and doxorubicin pharmacokinetics. J Hepatol 2007;46:474-81. DOI: 10.1016/j.jhep.2006.10.020. [ Links ]
71. Burrel M, Llovet JM, Reig M, et al. Survival of patients with hepatocellular carcinoma treated by transarterial chemoembolisation (TACE) using Drug Eluting Beads. Implications for clinical practice and trial design. J Hepatol 2012;56:1330-5. DOI: 10.1016/j.jhep.2012.01.008. [ Links ]
72. Malagari K, Pomoni M, Moschouris H, et al. Chemoembolization with doxorubicin-eluting beads for unresectable hepatocellular carcinoma: Five-year survival analysis. Cardiovasc Interv Radiol 2012;35:1119-28. [ Links ]
73. Lammer J, Malagari K, Vogl T, Pilleul F, et al. Prospective randomized study of doxorubicin-eluting-bead embolization in the treatment of hepatocellular carcinoma: Results of the PRECISION V study. Cardiovasc Interv Radiol 2010;33:41-52. [ Links ]
74. Golfieri R, Giampalma E, Renzulli M, et al. Randomised controlled trial of doxorubicin-eluting beads vs. conventional chemoembolisation for hepatocellular carcinoma. Br J Cancer 2014;111:255-64. DOI: 10.1038/bjc.2014.199. [ Links ]
75. Raoul J, Sangro B, Forner A, et al. Evolving strategies for the management of intermediate-stage hepatocellular carcinoma: Available evidence and expert opinion on the use of transarterial chemoembolization. Cancer Treat Rev 2011;37:212-20. DOI: 10.1016/j.ctrv.2010.07.006. [ Links ]
76. Bruix J, Reig M, Rimola J, et al. Clinical decision making and research in hepatocellular carcinoma: Pivotal role of imaging techniques. Hepatology 2011;54:2238-44. DOI: 10.1002/hep.24670. [ Links ]
77. Hucke F, Sieghart W, Pinter M, et al. The ART-strategy: Sequential assessment of the ART score predicts outcome of patients with hepatocellular carcinoma re-treated with TACE. J Hepatol 2014;60:118-26. DOI: 10.1016/j.jhep.2013.08.022. [ Links ]
78. Hucke F, Pinter M, Graziadei I, et al. How to STATE suitability and START transarterial chemoembolization in patients with intermediate stage hepatocellular carcinoma. J Hepatol 2014;61:1287-96. DOI: 10.1016/j.jhep.2014.07.002. [ Links ]
79. Adhoute X, Penaranda G, Naude S, et al. Retreatment with TACE: The ABCR SCORE, an aid to the decision-making process. J Hepatol 2015;62:855-62. DOI: 10.1016/j.jhep.2014.11.014. [ Links ]
80. Lencioni R, LLovet J, Han G, et al. Sorafenib or placebo in combination with transarterial chemoembolization (TACE) with doxorubicin-eluting beads (DEBDOX) for intermediate-stage hepatocellular carcinoma (HCC): Phase II, randomized, double-blind SPACE trial. J Clin Oncol 2012;30:abstrLBA154. [ Links ]
81. Kudo M, Han G, Finn RS, et al. Brivanib as adjuvant therapy to transarterial chemoembolization in patients with hepatocellular carcinoma: A randomized phase III trial. Hepatology 2014;60:1697-1707. DOI: 10.1002/hep.27290. [ Links ]
82. Sangro B, Inarrairaegui M, Bilbao JI. Radioembolization for hepatocellular carcinoma. J Hepatol 2012;56:464-73. DOI: 10.1016/j.jhep.2011.07.012. [ Links ]
83. Kulik LM, Carr BI, Mulcahy MF, et al. Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology 2008;47:71-81. DOI: 10.1002/hep.21980. [ Links ]
84. Hilgard P, Hamami M, Fouly A El, et al. Radioembolization with yttrium-90 glass microspheres in hepatocellular carcinoma: European experience on safety and long-term survival. Hepatology 2010;52:1741-9. DOI: 10.1002/hep.23944. [ Links ]
85. Salem R, Lewandowski RJ, Mulcahy MF, et al. Radioembolization for hepatocellular carcinoma using Yttrium-90 microspheres: A comprehensive report of long-term outcomes. Gastroenterology 2010;138:52-64. DOI: 10.1053/j.gastro.2009.09.006. [ Links ]
86. Sangro B, Carpanese L, Cianni R, et al. Survival after yttrium-90 resin microsphere radioembolization of hepatocellular carcinoma across Barcelona clinic liver cancer stages: A European evaluation. Hepatology 2011;54:868-78. DOI: 10.1002/hep.24451. [ Links ]
87. Mazzaferro V, Sposito C, Bhoori S, et al. Yttrium-90 radioembolization for intermediate-advanced hepatocellular carcinoma: A phase 2 study. Hepatology 2013;57:1826-37. DOI: 10.1002/hep.26014. [ Links ]
88. Villanueva A, Newell P, Chiang DY, et al. Genomics and signaling pathways in hepatocellular carcinoma. Semin Liver Dis 2007;27:55-76. DOI: 10.1055/s-2006-960171. [ Links ]
89. Hanahan D, Weinberg A. Hallmarks of cancer: The next generation. Cell 2011;144:646-74. DOI: 10.1016/j.cell.2011.02.013. [ Links ]
90. Vogelstein B, Papadopoulos N, Velculescu VE, et al. Cancer genome landscapes. Science 2013;339:1546-58. DOI: 10.1126/science.1235122. [ Links ]
91. Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008;359:378-90. [ Links ]
92. Cheng AL, Kang YK, Chen Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: A phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol 2009;10:25-34. DOI: 10.1016/S1470-2045(08)70285-7. [ Links ]
93. Cheng AL, Kang YK, Lin DY, et al. Sunitinib versus sorafenib in advanced hepatocellular cancer: Results of a randomized phase III trial. J Clin Oncol 2013;31:4067-75. DOI: 10.1200/JCO.2012.45.8372. [ Links ]
94. Johnson PJ, Qin S, Park JW, et al. Brivanib versus sorafenib as first-line therapy in patients with unresectable, advanced hepatocellular carcinoma: Results from the randomized phase III BRISK-FL study. J Clin Oncol 2013;31:3517-24. DOI: 10.1200/JCO.2012.48.4410. [ Links ]
95. Zhu AX, Rosmorduc O, Evans J, et al. SEARCH: A phase III, randomized, double-blind, placebo-controlled trial of sorafenib plus erlotinib in patients with hepatocellular carcinoma (HCC). Ann Oncol 2012;23(Suppl9):abstract LBA2. [ Links ]
96. Qin S, Bai Y, Lim HY, et al. Randomized, multicenter, open-label study of oxaliplatin plus fluorouracil/leucovorin versus doxorubicin as palliative chemotherapy in patients with advanced hepatocellular carcinoma from Asia. J Clin Oncol 2013;31:3501-8. [ Links ]
97. Cainap C, Qin S, Huang W, et al. Phase III trial of linifanib versus sorafenib in patients with advanced hepatocellular carcinoma (HCC). J Clin Oncol 2013;30(Suppl 34):abstr249. [ Links ]
98. Iavarone M, Cabibbo G, Piscaglia F, et al. Field-practice study of sorafenib therapy for hepatocellular carcinoma: A prospective multicenter study in Italy. Hepatology 2011;54:2055-63. DOI: 10.1002/hep.24644. [ Links ]
99. Lencioni R, Kudo M, Ye S-L, et al. GIDEON (Global Investigation of therapeutic Decisions in hepatocellular carcinoma and Of its treatment with sorafeNib): Second interim analysis. Int J Clin Pract 2014;68:609-17. [ Links ]
100. Reig M, Rimola J, Torres F, et al. Post-progression survival of patients with advanced hepatocellular carcinoma. Rationale for second line trial design. Hepatology 2013;58:2023-31. DOI: 10.1002/hep.26586. [ Links ]
101. Bruix J, Raoul JL, Sherman M, et al. Efficacy and safety of sorafenib in patients with advanced hepatocellular carcinoma: Subanalyses of a phase III trial. J Hepatol 2012;57:821-9. DOI: 10.1016/j.jhep.2012.06.014. [ Links ]
102. Worns MA, Weinmann A, Pfingst K, et al. Safety and efficacy of sorafenib in patients with advanced hepatocellular carcinoma in consideration of concomitant stage of liver cirrhosis. J Clin Gastroenterol 2009;43:489-95. DOI: 10.1097/MCG.0b013e31818ddfc6. [ Links ]
103. Pinter M, Sieghart W, Graziadei I, et al. Sorafenib in unresectable hepatocellular carcinoma from mild to advanced stage liver cirrhosis. Oncologist 2009;14:70-6. DOI: 10.1634/theoncologist.2008-0191. [ Links ]
104. Abou-Alfa G, Amadori D, Santoro A, et al. Is sorafenib (S) safe and effective in patients (pts) with hepatocellular carcinoma (HCC) and Child-Pugh B (CPB) cirrhosis? J Clin Oncol 2008;26:Abstract4518. [ Links ]
105. Reig M, Matilla A, Bustamante J, et al. Recommendations for the management of sorafenib in patients with hepatocellular carcinoma. Gastroenterol Hepatol 2010;33:741-52. DOI: 10.1016/j.gastrohep.2010.05.007. [ Links ]
106. Koschny R, Gotthardt D, Koehler C, et al. Diarrhea is a positive outcome predictor for sorafenib treatment of advanced hepatocellular carcinoma. Oncology 2013;84:613. DOI: 10.1159/000342425. [ Links ]
107. Estfan B, Byrne M, Kim R. Sorafenib in advanced hepatocellular carcinoma: Hypertension as a potential surrogate marker for efficacy. Am J Clin Oncol 2013;36:319-24. [ Links ]
108. Vincenzi B, Santini D, Russo A, et al. Early skin toxicity as a predictive factor for tumor control in hepatocellular carcinoma patients treated with sorafenib. Oncologist 2010;15:85-92. DOI: 10.1634/theoncologist.2009-0143. [ Links ]
109. Otsuka T, Eguchi Y, Kawazoe S, et al. Skin toxicities and survival in advanced hepatocellular carcinoma patients treated with sorafenib. Hepatol Res 2012;42:879-86. [ Links ]
110. Reig M, Torres F, Rodríguez-Lope C, et al. Early dermatologic adverse events predict better outcome in HCC patients treated with sorafenib. J Hepatol 2014;61:318-24. DOI: 10.1016/j.jhep.2014.03.030. [ Links ]
111. Pietrowski D, Tempfer C, Bettendorf H, et al. Angiopoietin-2 polymorphism in women with idiopathic recurrent miscarriage. Fertil Steril 2003;80:1026-9. DOI: 10.1016/S0015-0282(03)01011-2. [ Links ]
112. Samli H, Demir B, Ozgoz A, et al. Vascular endothelial growth factor gene 1154 G/A, 2578 C/A, 460 C/T, 936 C/T polymorphisms and association with recurrent pregnancy losses. Genet Mol Res 2012;11:4739-45. DOI: 10.4238/2012.December.17.6. [ Links ]
113. Wang V, Rosen R, Meyerle C, et al. Suggestive association between PLA2G12A singlenucleotide polymorphism rs2285714 and response to anti-vascular endothelial growth factor therapy in patients with exudative age related macular degeneration. Mol Vis 2012;18: 2578-85. [ Links ]
114. Iavarone M, Cabibbo G, Biolato M, et al. Predictors of survival of patients with advanced hepatocellular carcinoma who permanently discontinued sorafenib. Hepatology 2015;62:784-91. DOI: 10.1002/hep.27729. [ Links ]
115. Cainap C, Qin S, Huang W-T, et al. Linifanib versus sorafenib in patients with advanced hepatocellular carcinoma: results of a randomized phase III trial. J Clin Oncol 2015;33:172-9. [ Links ]
116. Llovet JM, Decaens T, Raoul JL, et al. Brivanib in patients with advanced hepatocellular carcinoma who were intolerant to sorafenib or for whom sorafenib failed: Results from the randomized phase III BRISK-PS study. J Clin Oncol 2013;31:3509-16. DOI: 10.1200/JCO.2012.47.3009. [ Links ]
117. Zhu AX, Kudo M, Assenat E, et al. EVOLVE-1: Phase 3 study of everolimus for advanced HCC that progressed during or after sorafenib. J Clin Oncol 2014;32:abstr172. [ Links ]
118. Zhu AX, Park JO, Ryoo B-Y, et al. Ramucirumab versus placebo as second-line treatment in patients with advanced hepatocellular carcinoma following first-line therapy with sorafenib (REACH): A randomised, double-blind, multicentre, phase 3 trial. Lancet Oncol 2015;16:859-70. DOI: 10.1016/S1470-2045(15)00050-9. [ Links ]
119. Yeo W, Mok TS, Zee B, et al. A randomized phase III study of doxorubicin versus cisplatin/interferon alpha-2b/doxorubicin/fluorouracil (PIAF) combination chemotherapy for unresectable hepatocellular carcinoma. J Natl Cancer Inst 2005;97:1532-8. DOI: 10.1093/jnci/dji315. [ Links ]
120. Santoro A, Rimassa L, Borbath I, et al. Tivantinib for second-line treatment of advanced hepatocellular carcinoma: A randomised, placebo-controlled phase 2 study. Lancet Oncol 2013;14:55-63. [ Links ]
121. Sangro B, Gomez-Martin C, de la Mata M, et al. A clinical trial of CTLA-4 blockade with tremelimumab in patients with hepatocellular carcinoma and chronic hepatitis C. J Hepatol 2013;59:81-8. DOI: 10.1016/j.jhep.2013.02.022. [ Links ]
122. Palmer DH, Midgley RS, Mirza N, et al. A phase II study of adoptive immunotherapy using dendritic cells pulsed with tumor lysate in patients with hepatocellular carcinoma. Hepatology 2009;49:124-32. DOI: 10.1002/hep.22626. [ Links ]











 texto em
texto em