Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.108 no.10 Madrid oct. 2016
https://dx.doi.org/10.17235/reed.2016.3671/2015
Manejo de las estenosis esofágicas refractarias en edad pediátrica
Management of refractory esophageal stenosis in the pediatric age
Fernando Alberca de las Parras1, María Navalón Rubio2 y Juan Egea Valenzuela1
1Unidad de Gestión Clínica de Digestivo. Unidad de Endoscopias
2Servicio de Pediatría. Gastroenterología Pediátrica. Hospital Clínico Universitario Virgen de la Arrixaca. Murcia
Dirección para correspondencia
RESUMEN
Introducción: las estenosis esofágicas refractarias (EER) a las dilataciones suponen un importante problema de salud en la pediatría. Se han descrito técnicas alternativas como la colocación de prótesis y el uso de mitomicina C (MC). Presentamos nuestra experiencia en una serie consecutiva con ambas técnicas, en nuestro caso con prótesis biodegradables (PB) y a veces ambas técnicas asociadas.
Material y métodos: se incluyeron 6 pacientes, dos con fístula postquirúrgica en atresias esofágicas tipo 1 operadas, otro con atresia operada sin fístula y otros tres con estenosis caústicas. Se colocaron 5 PB en 4 niños, 3 en atresias operadas (en un paciente 2 prótesis) y 1 en estenosis. Dos de los niños con atresia tenían fístula asociada.
Se utilizó MC en 5 casos, en dos de forma primaria y en tres tras recidiva al fracasar la prótesis.
Resultados: las PB colocadas en las fístulas fueron recubiertas y en un caso solucionaron la fístula y en otro no. En las estenosis fueron efectivas en solo una (con la fístula no resuelta), recidivando en 2. La MC solucionó uno de estos casos, debiendo ponerse una segunda prótesis en el otro paciente. En los otros dos (una atresia y otra por caústicos), la MC fue efectiva, solucionando las estenosis tras 1 y 2 sesiones respectivamente. En el cómputo total hemos solucionado las estenosis en 5 de 6 estenosis refractarias (83,3%) y en 1 de 2 fístulas (50%).
Conclusiones: la asociación de prótesis biodegradables y mitomicina ha sido efectiva en el rescate de algunos casos de estenosis esofágicas refractarias en niños, teniendo un papel secundario en la resolución de fístulas.
Palabras clave: Estenosis esofágica. Pediatría. Prótesis biodegradables. Mitomicina.
ABSTRACT
Introduction: Refractory esophageal stenosis (RES) is a major health problem in the pediatric population. Several techniques such as stent placement or C-mitomycin (CM) have been described as alternative treatments. We present our experience with both techniques, in our case with biodegradable stents (BS) and sometimes the association with stents and CM.
Material and methods: Six patients have been included: 2 post-operative fistulas in patients with type I esophageal atresia; 1 operated atresia without fistula; and 3 caustic strictures. 5 BS were placed in 4 children: 3 of them in cases of atresia (2 prosthesis in one case) and the other one in a case of stricture. CM was used in 5 cases: in 2 of them from the beginning, and in the other 3 cases after failure of the stent.
Results: When placed in fistulas, BS were fully covered. One of them successfully treated the fistula, but the other one was not effective. One stenosis was successfully treated with SB (in the case of persistent fistula), but recurrence was observed in the other 2 cases. One of these was solved with CM, and the other one needed a second stent. In the remaining 2 cases (one atresia and one caustic stricture) CM was effective after 1 and 2 sessions respectively. Overall, 5 out of 6 stenosis have been successfully treated (83.3%), and 1 out of 2 fistulas (50%).
Conclusions: Association of BS and CM has been effective in the management of RES in children.
Key words: Esophageal stenosis. Pediatrics. Biodegradable stent. Mitomycin.
Introducción
El manejo de las estenosis esofágicas refractarias (EER) en pediatría es un campo abierto en el que la dilatación endoscópica es la técnica de referencia. No existen estudios amplios aleatorizados sobre alternativas terapéuticas y las diferentes técnicas que se han aplicado lo han hecho basándose en casos publicados y en estudios descriptivos de series de casos, derivado además de la experiencia en adultos. Existen además problemas éticos para el desarrollo de nuevas terapias, lo que lleva habitualmente a manejar a estos pacientes con una tendencia a las actitudes expectantes y conservadoras.
No se ha definido de forma absoluta el concepto de resistencia o refractariedad al tratamiento dilatador, si bien se suele manejar el número de tres dilataciones como la base para definirlo (1).
Tampoco está claro si existen diferencias entre estenosis postcaústicos y estenosis postquirúrgicas.
Se han utilizado prótesis metálicas (acero o nitinol) (2), incluso biliares (3) o traqueobronquiales (4), así como de silicona (5), plástico (Polyflex) (1), politetrafluoroetieno (6) o de material biodegradable (polidioxanona) (7) en casos de estenosis postquirúrgicas y tras cáusticos en niños, con resultados muy variables ya que se han mostrado porcentajes de migraciones inaceptables.
Las prótesis biodegradables (PB) aportan la ventaja en el paciente pediátrico de evitar su retirada, situación que obliga a una nueva anestesia y no está exenta de complicaciones (incluida la dificultad para la extracción en las metálicas). No obstante, en un trabajo con ocho niños no tuvieron problemas en conseguir su retirada sin complicaciones (2).
Existe la posibilidad de diseñar las prótesis a la medida del caso que estamos tratando (customización) (5), lo que permite individualizar su uso. Las prótesis aportan, frente a las dilataciones, la ventaja de mantener la presión radial durante más tiempo y teóricamente podrían permitir solucionar el problema o distanciar la necesidad de dilataciones (8).
Actualmente solo se ha publicado el uso de PB en niños en una publicación y se trata de la descripción de un caso (7).
Por otro lado se ha publicado la efectividad de la mitomicina C (MC) por vía depot inyectada o extendida sobre el área estenótica en paciente pediátricos refractarios (9,10). La MC es una antraciclina derivada del Streptomyces caespitosus, con propiedades antineoplásicas y antiproliferativas; las antineoplásicas son similares a los agentes alquilantes, que causan la reticulación del ADN y que inhiben la síntesis proteica y del ARN. El mecanismo exacto de su actividad antifibroblástica es incierto, posiblemente por inhibición de la actividad de los fibroblastos, suprimiendo la formación de fibrosis y cicatrización por la apoptosis. Se ha usado en oftalmología y otorrinolaringología en la resolución de estenosis (9,11,12).
Presentamos seis casos de EER tratadas con PB y/o MC que pueden aportar un nuevo enfoque dentro de una población sometida a múltiples exploraciones intervencionistas.
Metodología
Se incluyeron 6 pacientes entre febrero de 2010 y diciembre de 2013.
Todos los procedimientos se realizaron en quirófano programado con anestesia general e intubación. En varios casos hemos utilizado el apoyo de radiología para asegurar posición de las guías e identificar las estenosis con contraste.
De forma habitual utilizamos endoscopios pediátricos (Pentax EG-1580K de 5,1 mm y Olympus GIF-XP160, de 5,9 mm), aunque en niños mayores de 15 kg utilizamos endoscopios de mayor calibre (Olympus GIF-Q165, de 9,2 mm), lo que acortaba tiempos anestésicos y facilitaba el procedimiento.
En cuatro niños colocamos una gastrostomía endoscópica, sirviendo en uno de ellos de puerto de acceso inferior para poder canalizar una estenosis y así como de punto de tracción para poder pasar el introductor de una PB.
Procedimiento para la colocación de prótesis
En tres casos colocamos prótesis customizadas biodegradables SX ELLA-BD (ELLA-CS, Hradec Kralove, Czech Republic) tras haber medido la longitud de la estenosis, el esófago sano por encima y debajo de la misma y el calibre del esófago, principalmente proximal. Analizando estos datos solicitamos prótesis que se adaptasen a estas medidas, teniendo que diseñarse además introductores especialmente pequeños, sobre todo en la niña de 8 meses, ya que el introductor estándar mide 28F. En este caso la prótesis fue recta sin copas por falta de espacio en el introductor. En otros dos casos, por tratarse de esófagos dilatados se usaron PB comercializadas.
Antes de la colocación de la prótesis realizamos una dilatación con un máximo de 10 mm a 2 atm de presión (balón de dilatación Hercules de Cook-Winston Salem USA), lo suficiente para poder pasar el introductor pero no excesivamente enérgica para disminuir el riesgo de migración precoz. Las prótesis se deben montar al comienzo del procedimiento, existiendo sistemas de tope de oliva o de balón.
En todos los casos se utilizó tratamiento del reflujo ácido gastroesofágico mediante inhibidores de la bomba de protones a altas dosis, habiéndose realizado cirugía antirreflujo en dos pacientes.
Protocolo de mitomicina C (Fig. 1)
Es preferible usar endoscopios de canal de trabajo mayor de 2,8 mm pues se puede hacer en un solo paso toda la técnica sin hacer recambios.
Se dilata el área estenótica con balones de 10-12 mm (1a y 2a). Se aplica MC: la dilución la realiza previamente para asegurar su estabilidad (máximo 72 h) y se guarda en frigorífico.
La técnica a emplear va a depender de la longitud de la estenosis (Fig. 1):
Para estenosis puntiformes (hasta 1 cm): se utiliza la técnica de punción con aguja de esclerosis de la MC a dosis de 1,6 ml (0,75 mg) inyectado en dosis divididas, 0,4 ml en cada uno de los cuatro cuadrantes (en una preparación de 0,4 mg/ml) (1b) (13).
Para estenosis largas (mayores de 1 cm) realizamos una adaptación del sistema descrito por Broto y cols. (14):
- Se posiciona una guía y se retira el gastroscopio.
- A través de la misma, y como innovación técnica que aportamos, se coloca un balón de extracción biliar de 15 mm hinchado distal a la estenosis, colapsando el esófago, para evitar que la MC migre a esófago distal y estómago y pueda lesionar tejido sano (2b).
- Volvemos a introducir el gastroscopio y mediante un cepillo biliar de doble lumen (Cook) se aplicará lentamente y distribuyéndola por toda la estenosis a una dilución de 0,4 mg/ml. (2c) La cantidad dependerá del tamaño del niño: en menores de 12,5 kg se usan 2,5 ml y en mayores de 12,5 kg se usan 5 ml.
- Posteriormente se pasa un balón de dilatación de 8 mm y se hincha a baja presión (2 atm) durante 5 minutos para facilitar el contacto íntimo de la MC con la pared esofágico (2d).
- Al acabar la aplicación se realiza un lavado del producto utilizando el sistema de bomba de inyección de agua y la aspiración por el endoscopio (2e).
En niños menores de 2 años (o de 10 kg) no será factible el uso de un cepillo biliar en caso de que tenga una estenosis larga; en esta situación se utilizará exclusivamente una aguja de esclerosis para inyectar la MC sobre la estenosis, pasando posteriormente un cepillo infantil para su extensión en la zona estenosada.
El criterio que seguimos para el uso inicial de PB o MC dependía de la evolución previa de la estenosis y de su longitud. En estenosis cortas sin complicaciones previas optamos por la mitomicina. Ante pacientes con fístula asociada, perforación o complicación previa o estenosis largas, optamos por PB.
Resultados
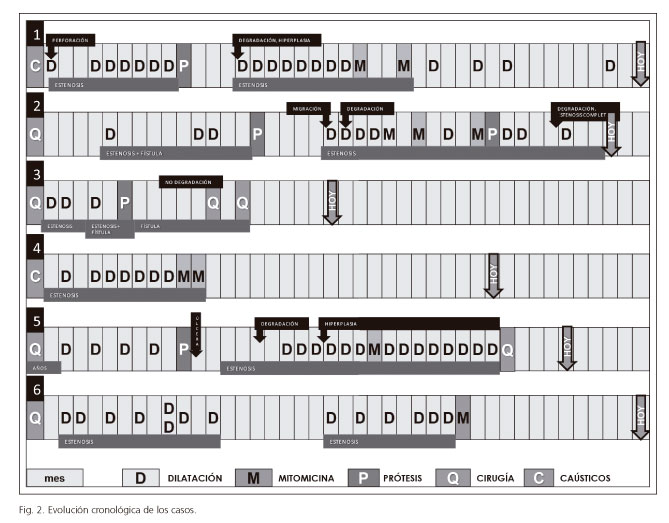
Presentamos el análisis descriptivo de una serie prospectiva de casos de niños catalogados como resistentes a las dilataciones esofágicas y que han sido tratados con medidas alternativas, como PB esofágicas y MC.
Serie completa
Caso 1
Niña de 6 años de edad que presentó una esofagitis y gastritis graves tras ingesta de cáusticos (lavavajillas industrial). En un mes presentó una estenosis grave esofágica, con perforación puntiforme ante la dilatación que se manejó de forma conservadora. A los 4 meses de la ingesta se reiniciaron dilataciones esofágicas y antrales por estenosis puntiforme, consiguiéndose la resolución de la estenosis gástrica tras 6 dilataciones pero persistiendo la esofágica tras 9 intentos. Se colocó una gastrostomía endoscópica percutánea (PEG). A los 10 meses de la ingesta se colocó una prótesis biodegradable ELLA de 16 mm de diámetro x 6 cm de longitud (encargada a medida). No hubo problemas técnicos en la colocación de la prótesis.
En el seguimiento presentó dolor torácico durante los primeros 4 meses que mejoró con aumento de la dosis de inhibidores de la bomba de protones y analgésicos. Así mismo se produjo una estenosis por crecimiento de tejido hiperplásico proximal que se dilató en tres ocasiones resolviéndose de forma completa. La estenosis distal recidivó a los 4 meses (tiempo que tardó en degradarse a prótesis) requiriendo de nuevo dilataciones. A los nueve meses de la colocación de la prótesis se colocó mitomicina en dos sesiones, siendo muy efectiva, pues tras 18 meses permanece con ingesta oral sólida y sin estenosis evidente en las gastroscopias. La mitomicina C consiguió aumentar el periodo interdilatación de 3-4 semanas a 24 semanas actualmente.
Caso 2
Niño de 3 años con síndrome de VACTERL (atresia esofágica y anorrectal), con múltiples cirugías reconstructivas y fístula esofágica a nivel de la esofagoileocoloplastia (fístula esofago-cutánea de origen iatrogénico).
Se iniciaron dilataciones por estenosis de la anastomosis que se suspendieron por salida del hilo guía por pared abdominal y abscesos cérvico-torácicos mensuales. Un año después, ante el fracaso de las dilataciones y la persistencia de la fístula, se decidió colocar una prótesis biodegradable ELLA completamente recubierta de 18 mm de diámetro x 6 cm de longitud (encargada a medida). Desde el punto de vista técnico presentó una gran dificultad para paso del introductor por la rotación y acodadura del esófago proximal (que achacamos a la cirugía de la fístula) y que se solucionó mediante la tracción del hilo usando la gastrostomía para aumentar la tensión.
En el seguimiento presentó un absceso cervical debido al desplazamiento distal de la prótesis, desapareciendo con antibióticos y con la recolocación de la misma. A los 8 meses se produjo reestenosis que ha obligó a reiniciar las dilataciones, incluyéndolo en un protocolo prospectivo con el uso de mitomicina C. Ante el fracaso del mismo por reestenosis se decidió la colocación de una segunda prótesis, en este caso no recubierta (por la resolución de la fístula), que se colocó a los 16 meses de haber puesto la primera. 4 meses después el niño volvió a presentar disfagia absoluta para líquidos, sin poder objetivarse paso de contraste a tramos distales (estenosis completa que está pendiente de nueva solución quirúrgica).
Tiempos de degradación de las prótesis fueron de 5 meses para la primera y 4 meses para la segunda.
Caso 3
Niña de 8 meses de edad con atresia esofágica tipo I long-gap manejada al nacimiento con sonda de aspiración continua (replogue) y realización de gastrostomía para inicio de nutrición enteral. A los 2 meses de vida se programa para cirugía correctora con anastomosis término-terminal de ambos cabos. En el estudio baritado al mes de la intervención se objetiva estenosis crítica a nivel de la zona de anastomosis. Por ello, con 3,5 meses de edad se decidió realizar una primera dilatación endoscópica. Respuesta inicial favorable con reestenosis precoz que precisó nueva dilatación a las 4 semanas de la previa. Nueva recidiva a las 4 semanas, por lo que se vuelve a programar dilatación. Previo a esta tercera dilatación se detecta paso accidental de la guía a mediastino, lo que obliga a no realizar la dilatación e ingreso en UCIP para monitorización. Se detectó zona de mediastinitis posterior derecha con probable absceso asociado. Evolución posterior tórpida desde el punto de vista respiratorio, con múltiples ingresos por neumonías de probable origen aspirativo. Tras cuadro respiratorio grave y con la sospecha previa de reflujo gastroesofágico moderado-grave, se realiza cirugía antirreflujo. Por otro lado, a los 7 meses de vida se programa para revisión endoscópica constatando probable orificio fistuloso con emisión de moco, con sospecha de fístula bronco-esofágica que se confirma por estudio baritado y fibrobroncoscopia (fístula a bronquio segmentario de LID). Se decide en sesión multidisciplinar abordaje de fístula esófago-bronquial con prótesis esofágica colocada mediante endoscopia. Con 8 meses se colocó una prótesis biodegradable parcialmente recubierta de 6 x 1,5 x 4 cm. No se planteó ningún problema técnico salvo la necesidad de un diseño muy específico, sin copas anchas, para poder colocar un introductor apropiado al tamaño de la niña (5 kg).
Posteriormente y de forma progresiva se introduce nutrición oral. No se constata disfagia ni sialorrea y presenta buena tolerancia digestiva. Sin embargo presenta persistencia de cuadros respiratorios intercurrentes de repetición. Se solicita estudio baritado (2 meses tras la colocación de la prótesis) que no muestra fugas de contraste ni estenosis esofágica por lo que se mantiene nutrición oral. Sin embargo persisten las exacerbaciones respiratorias de forma reiterada, por lo que se vuelve a solicitar nuevo tránsito esofágico así como dos estudios endoscópicos donde no se constata la evidencia de recidiva de la fístula ni estenosis. Sin embargo, en revisión endoscópica a los 7 meses de la colocación de la prótesis se objetiva desaparición de los restos de la prótesis esofágica, ausencia de estenosis y se visualiza en proximidad a cardias un orificio fistuloso de 4-5 mm de diámetro. Se realizó cierre quirúrgico de la fístula, aunque por reapertura a los 2 meses se realizó una esofagostomía cervical y posteriormente ascenso gástrico con esofagogastroplastia. Buena evolución clínica actual desde el punto de vista respiratorio y digestivo.
Caso 4
Niña de 2 años de edad con estenosis esofágica secundaria a ingesta de caústicos que no respondió tras 7 dilataciones consecutivas realizadas con balón de dilatación esofágico. La estenosis tenía 1 cm de longitud y un calibre inicial de 2 mm. Se realizaron 2 sesiones de inyección intralesional de mitomicina C (1,6 ml en cada ocasión) y dilatación con balones de 10-11-12 mm con 40 días de separación entre sesiones, obteniendo la resolución completa del cuadro. Han transcurrido 2 años y 5 meses desde la ingesta y no ha precisado nuevas dilataciones esofágicas en los últimos 19 meses.
Caso 5
Niño de 13 años con atresia de esófago tipo 1 intervenida realizándose esofagogastroplastia tipo Sharli tras el nacimiento. En una endoscopia digestiva alta realizada por disfagia crónica se objetivó una boca de Killian de aspecto fibroso, al igual que los primeros tramos de esófago proximal que mostraba así mismo un trayecto tortuoso y un área anastomótica con estenosis. El paciente refería que tras las comidas se atragantaba y tenía que girar el cuello hacia la izquierda y presionarse entre los planos musculares con la mano para facilitar el paso del bolo. Las 2 primeras dilataciones (separadas por 2 meses) fueron infructuosas por el plegamiento del esófago, recidivando la clínica en pocos días. Se decidió la colocación de una prótesis biodegradable no recubierta y dada la edad y peso del niño, se utilizó una prótesis comercializada de 23/18/23 x 8. Como el esófago proximal estaba muy acodado y tortuoso, y con la intención de corregir su posición, se decidió colocarla muy alta, justo bajo la boca de Killian. Las 2 semanas el paciente consulta de manera urgente por dolor cervical (postura antiálgica con elevación de hombros, inmovilidad del cuello y contractura de musculatura paravertebral cervical), por lo que se realizó una gastroscopia apreciando una gran úlcera de fondo necrótico en el borde superior de la prótesis. El TAC no demostró perforación ni afectación extraluminal y se manejó de forma conservadora con analgesia y nutrición enteral. Se objetivó la cicatrización en 15 días, aunque la estenosis persistió, precisando nuevas dilataciones (la siguiente a las 7 semanas de la colocación de la prótesis), incluso con una periodicidad mayor que la seguida previa a colocar la prótesis (ahora pasó a precisar cada semana o cada 2 semanas). Ha presentado abundante tejido de hiperplásico que no ha supuesto problema de paso hasta las últimas endoscopias en que ha habido que realizar dilataciones específicas.
La prótesis se reabsorbió a los 5 meses de su colocación. Tras un total de 6 dilataciones se decidió ensayar una sesión de inyección de mitomicina, sin respuesta aparente. Se intervino al año de la colocación de la prótesis.
Caso 6
Niña de 2 años y 6 meses intervenida a los 2 meses de vida de una atresia esofágica tipo 1 long-gap, con realización de gastrostomía en el mismo acto quirúrgico. A los 2 meses de la intervención (4 meses de vida) requiere dilatación esofágica con balón hidroneumático por estenosis de la zona anastomótica. Tras una buena respuesta inicial se produjo una reestenosis a las 4 semanas motivo por el que se procedió a una segunda dilatación. Desde ese momento se hicieron dilataciones sucesivas con una periodicidad que oscila entre 4 y 8 semanas (excepto en una ocasión que precisó dilatación a las 2 semanas de la previa y otra ocasión en que no precisó dilataciones por ausencia de reestenosis en un periodo de 7 meses). Además la paciente presentaba desde el nacimiento una marcada traqueomalacia asociada, lo que condicionaba una intubación nasotraqueal compleja y ciertos problemas en la extubación tras cada proceso de dilatación esofágica.
Tras un total de 14 dilataciones hidroneumáticas decidió realizar una sesión de MC (con 2 años y 6 meses de vida). Se produjo una respuesta muy favorable pues tras una sesión, no ha precisado nuevas dilataciones en los últimos 19 meses ni ha mostrado ningún tipo de clínica digestiva ni respiratoria en este periodo.
Análisis de la serie
En total se han puesto 5 prótesis en 4 pacientes (en 1 caso se han usado 2 prótesis). Se ha conseguido el objetivo de solucionar la estenosis en 2 casos, ha habido respuesta parcial temporal en 3 casos y en un paciente un empeoramiento clínico (por presentar una úlcera esofágica). Tres han sido customizadas y 2 comercializadas (todas del menor calibre 23/18/23). Tres han sido no recubiertas, una parcialmente cubierta y otra completamente cubierta. De las dos fístulas ha sido efectiva la de prótesis cubierta y falló la parcialmente cubierta.
Al analizar las complicaciones observadas con las PD hemos visto como la más frecuente el dolor significativo (necesidad de analgesia mantenida más de 5 días) en 2 casos (2/5, 40%), hiperplasia grave (que ha requerido dilatación específica en 2 casos (2/5, 40%), hiperplasia leve (no precisa dilatación) en 2 casos (2/5, 40%), migración de la prótesis en 1 caso (1/5, 20%), aunque se pudo recolocar y una úlcera penetrante en el borde superior de la prótesis en un paciente (1/5, 20%). Todas han podido ser resueltas de forma conservadora.
Con respecto a la MC se han hecho 5 terapias en 6 enfermos, con 2 en 4 enfermos y 1 sesión en uno. Se ha solucionado la estenosis de forma definitiva en 3 casos (60%) y en otros dos no ha sido efectiva (40%).
No hemos detectado efectos secundarios al uso de MC.
El tiempo medio dedicado a la técnica de la MC ha sido de 28,7 minutos (16-75).
En cuanto al cómputo total de la serie manejando ambas técnicas, podemos decir que hemos solucionado las estenosis en 5 de 6 casos de EER (83,3%) y en 1 de 2 fístulas (50%); la fístula que fracasó tuvo que reintervenirse. De los dos fracasos uno presenta un cierre completo esofágico que ha obligado a replantear cirugía reparadora y el otro persiste con dieta oral mediante dilataciones quincenales.
El seguimiento de los casos tras la prótesis o mitomicina final (último caso incluido) osciló entre los 8 meses y 2 años.
Discusión
El concepto de refractariedad no está bien establecido. Aunque se ha propuesto un número de 5 sesiones de dilatación para evaluar la respuesta (15), parece que el consenso más aceptado es la persistencia de estenosis tras tres dilataciones endoscópicas (1). Como definición, una EER o recurrente sería una restricción anatómica por compromiso luminal cicatrizal o fibrosis y que condiciona una disfagia en ausencia de evidencia endoscópica de inflamación. Esto puede ocurrir por una incapacidad para conseguir un diámetro de 14 mm en 5 sesiones a intervalos de 2 semanas (refractaria) o por incapacidad para mantener un diámetro luminal satisfactorio en 4 semanas una vez que el diámetro de de 14 mm ha sido alcanzado (recurrente) (16). En cualquier caso es difícil aplicar en niños el criterio clínico exclusivamente pues no es lo mismo mantener estenosis de 3-4 mm en un lactante, en el que quizá se produzcan muy pocos síntomas, que en un escolar de 6 años. Por ello quizá debamos hablar de criterios mixtos clínicos, endoscópicos y radiológicos a la hora de definir las estenosis como refractarias y es lo que nosotros hemos utilizado.
Las dilataciones endoscópicas plantean problemas de recidiva habituales, siendo procedimientos agresivos que requieren sedaciones profundas o anestesias y no están exentas de complicaciones (por las microfisuras de pared que pueden producir con cicatrices secundarias y fibrosis).
Un problema añadido en los niños de nuestra serie es que dos de ellos habían tenido perforaciones, una tras la primera dilatación, y otro de forma espontánea por fugas postquirúrgicas. Este es un factor que complica enormemente la respuesta a cualquier técnica por la fibrosis interna y externa generada.
Hemos tenido dos casos de estenosis postatresia operada con acodaduras del esófago proximal a la estenosis de la anastomosis, hasta el punto de presentar enormes dificultades de acceso al mismo mediante endoscopios pediátricos y que ha obligado a utilizar endoscopios de mayor calibre para dar mayor rigidez al empuje. Hemos detectado que la introducción del endoscopio con la cabeza en supino o ligeramente girada a la derecha facilita la intubación digestiva, lo que nos ha inducido a plantear rotaciones postquirúrgicas por la posición adoptada en el acto operatorio.
Las PB han demostrado su efectividad y seguridad en las estenosis esofágicas benignas en adultos (17). La principal ventaja de las PB es que no hay que retirarlas. En adultos es habitual utilizar prótesis recubiertas o parcialmente recubiertas en patología benigna y luego proceder a su retirada en un plazo de tiempo, teniendo a veces que recurrir a segundas prótesis (18). Se han descrito complicaciones graves en el proceso de retirada, como perforaciones, hemorragias, problemas con la sedación y necesidad de segundas y terceras endoscopias. De ahí nuestra intención al trabajar con material biodegradable que no precisa de su retirada. No se ha relacionado una diferente tendencia a la migración que otras prótesis aunque si las ponemos no cubiertas (es lo habitual, salvo si hay fístulas) lógicamente tenderán a migrar menos que las prótesis plásticas o las metálicas cubiertas. Nosotros tuvimos una migración en una prótesis cubierta que se pudo reubicar. En una serie alemana con 12 niños la tendencia a la migración fue mayor con las prótesis plásticas que con las de silicona o nitinol (19).
Las principales desventajas de las PDB podría ser su degradación precoz, y es bien conocido que el ácido acelera su degradación. Además se degradan más las prótesis en las zonas de mayor presión, como son las estenosis. En nuestro caso hemos visto degradaciones a los 4 a 7 meses, sin poder relacionarlo ni con la respuesta ni con la existencia de antirreflujo previo.
Se han publicado 132 casos de PB en patología esofágica benigna y maligna (Tabla I), pero solo hay un caso de edad pediátrica, en el que no fue efectiva, a consecuencia del reflujo generado al tener colocada la prótesis muy distalmente y migrar parcialmente a estómago (7). Existen otros dos casos colocados en Minsk, pero no han sido publicados (información suministrada por la casa comercial y recogida por Vandenplas) (7). En 2011 se presentó en forma de abstract en la DDW un registro belga con 24 PB en 20 pacientes, sin datos sobre cuáles son esofágicos ni espectro de edades, y con resultados globales a los 6 meses de un 52% de necesidad de nuevas técnicas para solucionar el problema y con un 60% de episodios de dolor (31).
Estas prótesis se han relacionado con mayor posibilidad de hiperplasia, pudiendo en algún caso llegar a ser grave (24,32). Hemos tenido dos casos de hiperplasia importante que han necesitado dilataciones específicas para solucionarlas, hecho ya descrito en la literatura (33). En uno de los casos existía una técnica antirreflujo hecha (se trataba de una esófago-íleo-colo-gastroplastia muy competente) y en otro caso no. La hiperplasia parece ser más importante en nuestra serie que la publicada en adultos (1 caso entre 21 PD) (17). Nos planteamos que quizá la mayor capacidad regenerativa de los tejidos en los niños pueda ser una razón para ello.
En cuanto a nuestros resultados nos parece importante analizar los fracasos y detectar las causas.
En el caso 2 la existencia de varias cirugías previas, con un esófago tortuoso, casi infranqueable y perforaciones previas otorgan una falta de elasticidad que probablemente imposibilita incluso la expansión de los stents. La prótesis recubierta solucionó la fístula, con el breve lapso en que migró, pero hasta ahora ha sido imposible solucionar la estenosis, siendo además un mal candidato a nueva cirugía correctora. En el caso 3 la carencia de copas en la prótesis (por el pequeño calibre del introductor) facilitó el que no hubiese un buen colapso entre el esófago dilatado y la prótesis, acumulándose comida en esa zona que pudo fomentar la falta de respuesta de la fístula. Por ello pensamos que es esencial que las prótesis tengan copas sobre todo en los casos de esófago dilatados por estenosis de larga evolución, para conseguir un buen anclaje. De esta forma podríamos evitar además la migración de los dispositivos. El caso 5 fracasó por una razón semejante al caso 2, ya que se trataba de una estenosis con rotación asociada tras una cirugía de atresia. Además la colocación de una prótesis comercializada, algo más grande, y justo bajo la boca de Killian, condicionó el desarrollo de una úlcera profunda, dolorosa, por decúbito de la prótesis sobre un esófago fibroso y rotado. Los fracasos han estado relacionados con pacientes ya operados de atresia, con complicaciones previas y esófagos fibrosos. En estos casos quizá deberíamos replantear la estrategia y definir nuevos protocolos con prótesis que aporten mayor fuerza radial, si bien trabajos publicados recientemente no encuentran diferencia en este aspecto con las prótesis disponibles actualmente (34). Quizá el planteamiento pase por prótesis metálicas recubiertas mantenidas durante más tiempo en el esófago. Por el contrario se ha publicado recientemente una serie amplia de 59 PB en 21 pacientes adultos con estenosis esofágicas benignas y con una baja tasa de respuesta (25%), por lo que los autores plantean la utilidad de estas prótesis solo como puente para aumentar el tiempo entre dilataciones y no con intención curativa (35).
En cuanto a las fístulas en un caso se ha solucionado y otro ha recidivado, aunque probablemente ha sido debido a un mal colapso del esófago pues se trataba de una niña muy pequeña que un esófago muy dilatado y una fístula amplia. Se ha descrito el tratamiento y resolución de fístulas asociadas a atresia con una prótesis plástica recubierta (36) y nosotros aportamos otro caso, aunque desgraciadamente no se ha conseguido la resolución de la estenosis. En adultos ha sido efectivo el tratamiento con PB recubiertas en 4 de 5 pacientes con fugas anastomóticas, si bien en un caso precisó tres stents y hubo migraciones en 3 ocasiones (28).
La MC ha servido para hacer el rescate de un caso de prótesis tras una ingesta de caústicos, siendo en esta niña la asociación altamente beneficiosa. En otro caso, también por caústicos, su uso inicial ha solucionado una estenosis de forma rápida y en solo 2 sesiones. En el caso 2 se vio un cierto efecto de "taquifilaxia" pues con las 3 primeras dosis se aprecia un claro aumento de los periodos interdilatación (de cada 4 semanas pasa a dilatarse cada 7-10 semanas) pero tras la 4a dosis desaparece tal efecto y vuelve a precisar dilatación igual que basalmente (cada 4 semanas). Es decir es como si la MC le funcionase inicialmente y perdiese efecto con el tiempo: este fenómeno no ha sido comunicado.
En cuanto a la MC se ha visto que una mayor concentración y más tiempo de contacto con el tejido aumenta su efecto, por lo que es importante estar 5 minutos al menos con el contacto mucoso mantenido y con las cantidades apropiadas (37,38).
Se han utilizado varias técnicas para su aplicación, como las compresas o esponjas empapadas, la inyección mucosa, el uso de catéteres spray y la colocación de stents liberadores del fármaco. Se han utilizado endoscopios rígidos y fibroendoscopios. Además se ha descrito su aplicación por medio de un catéter colocado a través del estoma de gastrostomía (39).
No está bien definido pero 5 sesiones de MC podría ser un límite apropiado para su uso mantenido (14) aunque otros autores han llegado a utilizarlo en seis sesiones sin complicaciones (40). Es un fármaco seguro en su aplicación tópica y, aunque es citotóxico y teóricamente es posible que lesione la mucosa sana (41), esto no ha sido descrito en las series digestivas, no encontrando complicaciones destacables.
Se han descrito 42 pacientes pediátricos tratados con mitomicina por estenosis esofágicas (Tabla II). Tan solo se ha publicado dos series. Un estudio multicéntrico con 16 enfermos, obtiene una respuesta completa en un 62,5 % y un 19% de respuesta parcial, con un seguimiento de 5 años (41). Por otro lado en un trabajo prospectivo se analiza su eficacia en 10 casos con un índice de respuesta del 100% (40). El resto se trata de casos puntuales seleccionados en los que se alcanzó éxito clínico.
Ambas técnicas no están exentas de complejidad técnica y la respuesta puede estar relacionada con la experiencia, especialmente en el caso de la MC por ser dependiente de dosis y tiempo de contacto. Por otro lado es clave plantear adecuadamente las medidas de las prótesis, debiendo tender a colocar medidas un punto por encima del esófago superior medido aún con el riesgo de poder desencadenar dolor o producir una úlcera por decúbito. Aunque las PB son procedimientos caros, y más aún si están customizadas, estamos consiguiendo disminuir los costes secundarios a ingresos, anestesia, tiempo de quirófano y recuperación y baja laboral de progenitores si conseguimos que retrasen el periodo entre dilataciones. Además son niños con múltiples procedimientos que agradecerían de forma marcada una disminución de los mismos. Se necesitarían estudios de coste-efectividad que definan su impacto económico.
Con la revisión efectuada y la experiencia recogida planteamos una propuesta de manejo de las estenosis refractarias, siempre en consenso con el equipo quirúrgico de cada centro (Fig. 3). Una vez establecido el concepto de estenosis refractaria a la persistencia de síntomas y/o de estenosis radiológica tras tres dilataciones efectivas, planteamos la posibilidad de realizar tratamiento endoscópico dependiendo de la existencia o no de fístula asociada, entidad inicialmente quirúrgica, aunque en casos seleccionados podría plantearse el uso de prótesis cubiertas. Si no hay fístulas depende de la longitud de la estenosis: en largas (> 1 cm) y fibrosas (como en los cáusticos) probar primero con prótesis recubiertas; en estenosis cortas, realizar sesiones de mitomicina, hasta 5 sesiones. Si no repuesta, cambiaríamos de técnica. El fracaso de ambas llevaría a nueva indicación quirúrgica o a valorar otras prótesis como las plásticas, uso de cortes con esfinterotomos puntiformes... Una posibilidad a explorar sería asociar varias técnicas pues la prótesis podría servir para ayudar al mantenimiento y a la prolongación del efecto de la mitomicina.
Conclusiones
Pensamos que la posibilidad de crear PB a medida (sistema custom) aporta un nuevo enfoque en la patología pediátrica grave al poder diseñar la prótesis necesaria en cada caso.
Las prótesis biodegradables evitan la necesidad de realizar maniobras de retirada que se deben hacer con otro tipo de prótesis. Sin embargo los efectos secundarios apreciados pueden ser un factor limitativo.
Han sido efectivas en la resolución de fístulas, aunque su efectividad ha mostrado limitaciones en el manejo de estenosis postquirúrgicas y caústicas, que han recidivado aunque han permitido alargar los tiempos entre dilataciones.
Se debe intensificar el tratamiento antirreflujo para mantener más tiempo la prótesis y disminuir los efectos secundarios.
La mitomicina C permite rescatar estenosis sin respuesta a las dilataciones con pocos efectos secundarios.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Fernando Alberca de las Parras.
Unidad de Gestión Clínica Digestivo. Unidad de Endoscopias.
Hospital Clínico Universitario Virgen de la Arrixaca.
Ctra. Madrid-Cartagena, s/n.
30120 El Palmar. Murcia.
e-mail: alberca.fernando@gmail.com
Recibido: 14-01-2016
Aceptado: 11-06-2016
Bibliografía
1. Broto J, Asensio M, Vernet JM. Results of a new technique in the threatment of severe esophageal stenosis in children: poliflex stents. J Pediatr Gastroenterol Nutr 2003;37(2):203-6. DOI: 10.1097/00005176-200308000-00024. [ Links ]
2. Zhang C, Yu JM, Fan GP, et al. The use of a retrievable self-expanding stent in treating childhood benign esophageal strictures. J Pediatr Surg 2005r;40(3):501-4. DOI: 10.1016/j.jpedsurg.2004.11.041. [ Links ]
3. Ruthmann O, Richter S, Fischer A. Biliary stenting of an iatrogenic esophageal perforation following corrosive esophagitis in a 5-year-old child. Endoscopy 2009;41(Suppl 2):E325-6. DOI: 10.1055/s-0029-1214939. [ Links ]
4. Best C, Sudel B, Foker JE, et al. Esophageal stenting in children: indications, application, effectiveness and complications. Gastrointest Endosc 2009;70(6):1248-53. DOI: 10.1016/j.gie.2009.07.022. [ Links ]
5. Foschia F, De Angelis P, Torroni F, et al. Custom dynamic stent for esophageal strictures in children. J Pediatr Surg 2011;46(5):848-53. DOI: 10.1016/j.jpedsurg.2011.02.014. [ Links ]
6. Atabek C, Surer I, Demirbag S. Increasing tendency in caustic esophageal burns and long-term polytetrafluorethylene stenting in severe cases: 10 years experience. J Pediatr Surg 2007;42(4):626-40 DOI: 10.1016/j.jpedsurg.2006.12.012. [ Links ]
7. Vandenplas Y, Hauser B, Devreker T. A biodegradable esophageal stent in the treatment of a corrosive esophageal stenosis in a child. J Pediatr Gastroenterol Nutr 2009;49(2):254-7. DOI: 10.1097/MPG.0b013e31819de871. [ Links ]
8. Kramer RE, Quiros JA. Esophageal stents for severe strictures in young children: experience, benefits and risk. Curr Gastroenterol Rep 2010;12(3):203-10. DOI: 10.1007/s11894-010-0105-4. [ Links ]
9. Rahbar R, Jones DT, Nuss RC, et al. The role of mitomycin in the prevention and treatment of scar formation in the pediatric aerodigestive tract: friend or foe? Arch Otolaryngol Head Neck Surg 2002;128:401-6. [ Links ]
10. Afzal NA, Albert D, Thomas AL. A child with oesophageal strictures. Lancet 2002;359(9311):1032. DOI: 10.1016/S0140-6736(02)08095-9. [ Links ]
11. Rahbar R, Shapshay SM, Healy GB. Mitomycin: effects on laryngeal and tracheal stenosis, benefits, and complications. Ann Otol Rhinol Laryngol 2001;110:1-6. DOI: 10.1177/000348940111000101. [ Links ]
12. Kao SCS, Lia CL, Tseng JH, et al. Dacrocystorhinostomy with intraoperative mitomycin-C. Ophthalmology 1997;104:86-91. DOI: 10.1016/S0161-6420(97)30357-1. [ Links ]
13. Spier BJ Sawma VA, Gopal DV. Intralesional mitomycin C: successful treatment for benign recalcitrant esophageal stricture. Gastrointest Endosc 2009;69(1):152-3. DOI: 10.1016/j.gie.2008.05.060. [ Links ]
14. Broto J, Gil-Vernet JM, Royo G. Use of mitomycin C in esophageal stenosis. Cir Pediatr 2007;20:57-8. [ Links ]
15. Antoniou D, Soutis M, Christopoulos-Geroulanos G. Anastomotic strictures following esophageal atresia repair: a 20-year experience with endoscopic ballon dilatation. J Pediatr Gastroenterol Nutr 2010;51(4):464-7. DOI: 10.1097/MPG.0b013e3181d682ac. [ Links ]
16. Kochman ML, McClave, SA, Boyce HW. The refractory and the recurrent esophageal stricture: a definition. Gastrointestinal Endoscopy 2005;62(3):474-5. DOI: 10.1016/j.gie.2005.04.050. [ Links ]
17. Repici A, Vieggaar FP, Hassan C. Efficacy and sefaty of biodegradable stents for refractory benign esophageal strictures: the BEST (Biodegradable Esophageal Stent) study. Gastrointestinal Endoscopy 2010;72(5):927-34. DOI: 10.1016/j.gie.2010.07.031. [ Links ]
18. Hirdes MM, Siersema PD, Houben MH, et al. Stent-in-Stent Technique for Removal of Embedded Esophageal Self-Expanding Metal Stents. Am J Gastroenterol 2011;106:286-93. DOI: 10.1038/ajg.2010.394. [ Links ]
19. Reinshagen K, Kähler G, Manegold BC. Evaluation of stents in treating childhood benign esophageal strictures. Klin Padiatr 2009;221(1):25-30. DOI: 10.1055/s-2007-984377. [ Links ]
20. Goldin E, Fiorini A. Ratan Y. A new biodegradable and self-expandable stent for benign esophageal strictures. Gastrointestinal Endoscopy 1996;43(4):294SW. DOI: 10.1016/S0016-5107(96)80017-4. [ Links ]
21. Fry SW, Fleischer DE. Management of a refractory benign esophageal stricture with a new biodegradable stent. Gastrointest Endosc 1997;45(2):179-82. DOI: 10.1016/S0016-5107(97)70244-X. [ Links ]
22. Tanaka T, Takahashi M, Nitta N. Newly developed biodegradable stents for benign gastrointestinal tract stenoses: a preliminary clinical trial. Digestion 2006;74:199-205 DOI: 10.1159/000100504. [ Links ]
23. Saito Y, Tanaka T, Andoh A. Usefulness of biodegradable stents constructed of poly-l-lactic acid monofilaments in patients with benign esophageal stenosis. World J Gastroenterol 2007;13(29):3977-80. DOI: 10.3748/wjg.v13.i29.3977. [ Links ]
24. Dhar A, Topping JH, Johns E. Biodegradable stents in refractory benign oesophageal strictures. First report of 4 patients from UK. Gastrointest Endosc 2009;M1487. DOI: 10.1016/j.gie.2009.03.655. [ Links ]
25. Orive-Calzada A, Alvarez-Rubio M, Romero-Izquierdo S, et al. Severe epithelial hyperplasia as a complication of a novel biodegradable stent. Endoscopy 2009;41(Suppl 2):E137-E138. DOI: 10.1055/s-0029-1214634. [ Links ]
26. Stivaros SM, Williams LR, Senger C. Woven polydioxanone biodegradable stents: a new treatment option for benign and malignant oesophageal strictures. Eur Radiol 2010;20:1069-72. DOI: 10.1007/s00330-009-1662-5. [ Links ]
27. van Boekel PG, Vieggar FP, Siersema PD. A comparison of temporary self-expanding plastic and biodegradable stents for refactory benign esophagel strictures. Clin Gastroenterol hepatol 2011;9(8):653-9. DOI: 10.1016/j.cgh.2011.04.006. [ Links ]
28. Cerná M, Köcher M, Válek V. Covered biodegradable stent: new therapeutic option for the management of esophageal perforation or anastomotic leak. Cardiovasc Interv Radiol 2011;34:1267-71. DOI: 10.1007/s00270-010-0059-9. [ Links ]
29. van Hooft JE, van Berge Henegouwen MI. Endoscopic treatment of benign anastomotic esophagogastric strictures with a biodegradable stent. Gastrointest Endosc 2011;73:1043-7. DOI: 10.1016/j.gie.2011.01.001. [ Links ]
30. Griffiths EA, Gregory CJ, Pursnani KG. The use of biodegradable (SX-ELLA) oesophageal stents to treat dysphagia due to benign and malignant oesophageal disease. Surg Endosc 2012;26(8):2367-75. DOI: 10.1007/s00464-012-2192-9 . [ Links ]
31. Ibrahim M, Vandermeeren A, Van Maele V. Belgian multicenter experience with the biodegradable ella stent in benign strictures of the digestive tract. Endoscopy 2010;42 (Suppl 1):A259. [ Links ]
32. Güitrón-Cantú A, Adalid-Martínez R, Gutiérrez-Bermúdez JA. Reacción a cuerpo extraño de una prótesis esofágica biodegradable. Informe de un caso Revista de Gastroenterología de México 2010;2:203-7. [ Links ]
33. Hair CS, Devonshire DA. Severe hyperplastic tissue stenosis of a novel biodegradable esophageal stent and subsequent successful management with high-pressure balloon dilation. Endoscopy 2010;42(Suppl 2):E132-E133. DOI: 10.1055/s-0029-1244011. [ Links ]
34. Hirdes MM, Vleggaar FP, de Beule, M. In vitro evaluation of the radial and axial force of self-expanding esophageal stents. Endoscopy 2013;45(12):997-1005. DOI: 10.1055/s-0033-1344985. [ Links ]
35. Hirdes MM, Siersema PD, van Boeckel PG. Single and sequential biodegradable stent placement for refractory benign esophageal strictures: a prospective follow-up study. Endoscopy 2012;44(7):649-54. DOI: 10.1055/s-0032-1309818. [ Links ]
36. Adler DG, Pleskow DK. Closure of a benign tracheoesophageal fistula by using a coated, self-expanding plastic stent in a patient with a history of esophageal atresia. Gastrointest Endosc 2005;61(6):765-8. DOI: 10.1016/S0016-5107(05)00083-0. [ Links ]
37. Khaw PT, Doyle JW, Sherwood MB, et al. Prolonged localized tissue effects from 5-minute exposure to fluorouracil and mitomycin. Arch Ophthalmol 1993;111:263-7. DOI: 10.1001/archopht.1993.01090020117035. [ Links ]
38. Lee DA, Lee TC, Cortes AE. Effects of mithramycin, mitomycin, daunorubicin and bleomycin on human fibroblast attachment and proliferation. Invest Ophthalmol Vis Sci 1990;31:2136-44. [ Links ]
39. Heran MK, Baird R, Blair GK. Topical mitomycin-C for recalcitrant esophageal strictures: a novel endoscopic/fluoroscopic technique for safe endoluminal delivery. J Pediatr Surg 2008;43(5):815-8. DOI: 10.1016/j.jpedsurg.2007.12.017. [ Links ]
40. Kumar A, Bhatnagar V. Topical application of mitomycin-C in corrsive esophageal strictures. J Indian Assoc Pediatr Surg 2005;10:25-7. DOI: 10.4103/0971-9261.16071. [ Links ]
41. Rosseneu S, Afzal N, Yerushalmi B. Topical application of mitomycin-C in oesophageal strictures. J Pediatr Gastroenterol Nutr 2007;44(3):336-41. DOI: 10.1097/MPG.0b013e31802c6e45. [ Links ]
42. Uhlen S, Fayoux P, Vachin F, et al. Mitomycin C: an alternative conservative treatment for refractory esophageal stricture in children? Endoscopy 2006;38(4):404-7. DOI: 10.1055/s-2006-925054. [ Links ]
43. Olutoye OO, Shulman RJ, Cotton RT. Mitomycin C in the management of pediatric caustic esophageal strictures: a case report. J Pediatr Surg 2006;41(5):e1-3. DOI: 10.1016/j.jpedsurg.2005.12.051. [ Links ]
44. Gillespie MB, Day TA, Sharma AK. Role of mitomycin in upper digestive tract stricture. Head Neck 2007;29(1):12-7. DOI: 10.1002/hed.20476. [ Links ]
45. Zur KB, Putnam PE, Rutter MJ. Combined retrograde and anterograde hypopharyngeal puncture and dilatation in a child with complete hypopharyngeal stenosis. Int J Pediatr Otorhinolaryngol 2007;71(1):153-7. DOI: 10.1016/j.ijporl.2006.07.023. [ Links ]
46. Fröhlich T, Greess H, Köhler H. Topical mitomycin C treatment of a benign oesophageal stricture following caustic ingestion in a four-year-old boy. Z Gastroenterol 2007;45:255-8. DOI: 10.1055/s-2006-927153. [ Links ]
47. Daher P, Riachy E, Georges B. Topical application of mitomycin C in the treatment of esophageal and tracheobronchial stricture: a report of 2 cases. J Pediatr Surg 2007;42(9):E9-11. DOI: 10.1016/j.jpedsurg.2007.06.007. [ Links ]
48. Chung J, Connolly B, Langer J. Fluoroscopy-guided topical application of mitomycin-C in a case of refractory esophageal stricture. J Vasc Interv Radiol 2010;21(1):152-5. DOI: 10.1016/j.jvir.2009.09.016. [ Links ]
49. Machida H Tominaga K., Minamino H. Locoregional MMC for refractory esophageal stricture after ESD. Endoscopy 2012;44:622-5. [ Links ]











 texto en
texto en