INTRODUCCIÓN
El síndrome del intestino irritable (SII) es un trastorno gastrointestinal (GI) que afecta a hasta un 15% de la población europea y norteamericana 1,2,3 y que se caracteriza por dolor abdominal, estreñimiento y/o diarrea y sensación de hinchazón 4.
En España, la prevalencia, de acuerdo con los criterios de Roma III 5, era del 8,3% 6.
El SII se ha clasificado, de acuerdo con el hábito intestinal predominante, en diferentes subtipos, incluyendo SII con predominio de estreñimiento (SII-E), SII con predominio de diarrea (SII-D), SII mixto (SII-M) asociado a diarrea y estreñimiento y SII sin subtipo 6,7.
La fisiopatología del SII es compleja y multifactorial e incluye trastornos de la motilidad intestinal, hipersensibilidad visceral, activación del sistema inmune de la mucosa, cambios en la flora intestinal, malabsorción y microinflamación intestinal 8.
En la práctica clínica, el SII-E representa un desafío tanto desde el punto de vista diagnóstico como terapéutico 9, por lo que es necesario establecer directrices clínicas específicas 10.
Actualmente, el manejo terapéutico de este trastorno se basa en una combinación de cambios en el estilo de vida y la administración de ciertos tratamientos sintomáticos no específicos 11.
La linaclotida es un agonista selectivo del receptor de la guanilato ciclasa C (GC-C). El receptor GC-C se expresa en la superficie luminal de las células epiteliales intestinales y su activación conduce a un aumento significativo de las concentraciones intracelulares y extracelulares de guanosin monofosfato cíclico (cGMP). El cGMP está involucrado en una amplia gama de procesos fisiológicos, que incluyen la regulación de la homeostasis de los líquidos intestinales 12,13 y la modulación de la actividad del nervio intestinal aferente, lo que puede estar relacionado con sus efectos analgésicos 14,15.
La eficacia y seguridad de linaclotida en pacientes con SII-E se ha demostrado en dos ensayos clínicos multicéntricos de fase III, aleatorizados, doble ciego, comparados con placebo 16,17, así como en análisis adicionales 18,19.
Recientemente, los resultados de una encuesta realizada en Canadá identificaron la linaclotida como el tratamiento para el SII-E más satisfactorio y los autores recomendaban que podría ser considerado en la primera línea de tratamiento farmacológico 20.
La linaclotida es el primer fármaco y único de su clase aprobado en Europa para el tratamiento del SII-E. Hasta donde nosotros conocemos, desde su aprobación en 2012 no hay ningún trabajo indexado en práctica clínica real.
El objetivo de este estudio es evaluar la efectividad, la seguridad y el grado de satisfacción de linaclotida en pacientes con SII-E en la práctica clínica.
MÉTODOS
Se realizó un estudio prospectivo, abierto, observacional y unicéntrico en pacientes consecutivos con SII-E, según los criterios diagnósticos de Roma III, entre agosto de 2014 y febrero de 2017.
Los pacientes recibieron tratamiento con linaclotida (Constella(r), Allergan Inc., Irvine, CA) 290 mg/24 horas, una cápsula 30 minutos antes del desayuno.
El protocolo del estudio fue aprobado por el Comité Ético del Hospital Universitario de Salamanca. Todos los pacientes fueron informados de los detalles del protocolo del estudio y los pacientes proporcionaron un consentimiento informado por escrito antes de comenzar el estudio. Se siguieron los principios éticos establecidos en la Declaración de Helsinki y la buena práctica clínica.
El estudio incluyó pacientes, hombres o mujeres, de edad igual o superior a 18 años con diagnóstico de SII-E moderado-grave, con menos de tres deposiciones por semana y refractarios a tratamientos previos con laxantes.
Criterios de exclusión
Se excluyeron aquellos pacientes que presentaban alteraciones gastrointestinales estructurales o funcionales que pudieran afectar a la motilidad gastrointestinal, úlcera péptica activa, un historial de diverticulitis o cualquier condición crónica que pudiera estar asociada con dolor abdominal o malestar.
El análisis de eficacia y seguridad excluyó a todas las pacientes que recibieron la medicación del estudio y no acudieron a la primera revisión de control realizada al mes de iniciar el tratamiento.
Se indicó a las pacientes que debían suspender el tratamiento con laxantes una vez comenzaran con la linaclotida, por el riesgo de diarrea asociado y para interferir lo menos posible en cuanto al aumento del número de deposiciones.
En aquellas pacientes en las que la efectividad del fármaco se considerara insuficiente, se permitió el uso de laxantes como tratamiento de rescate (el mismo que hubieran tomado anteriormente).
Además de la visita inicial, se programaron vistas al mes 1, 3 y 6. Las siguientes visitas de seguimiento se realizaron cada seis meses.
Variables del estudio
Las diferentes variables del estudio (número de deposiciones, intensidad del dolor e hinchazón) se recogieron mediante un diario que se entregó al paciente.
La variable primaria fue la variación del número de deposiciones semanales con respecto a la media del número de deposiciones durante dos semanas previas al inicio del tratamiento.
Las variables secundarias incluían cambios en el registro de la frecuencia e intensidad de los síntomas (dolor e hinchazón), medidos mediante una escala visual analógica (EVA) de once niveles (0-10).
El paciente evaluó, de manera subjetiva, el grado de mejoría y de satisfacción con el tratamiento, con tres posibles valoraciones establecidas: a) mejoría total, según el paciente hubiera experimentado una mejoría en los tres parámetros clínicos analizados (número de deposiciones/semana, intensidad del dolor e hinchazón); b) mejoría parcial, si había experimentado mejoría en dos de los parámetros clínicos; y c) no-mejoría, si no había experimentado mejoría en al menos dos parámetros.
El grado de satisfacción de los pacientes se midió mediante la utilización de una EVA de once niveles (0-10).
Además, se registraron la frecuencia y la intensidad de los efectos adversos para valorar la seguridad y la tolerabilidad del tratamiento.
Estadística
Todos los análisis estadísticos se realizaron con el programa informático MedCalc versión 17.6 (MedCalc Software bvba, Ostend, Bélgica).
Antes se comenzar el estudio se calculó que sería necesario incluir 30 pacientes para detectar una diferencia en la media igual o superior a 2,5 unidades en el número de deposiciones/semana, asumiendo una desviación estándar de 4, con un nivel de confianza del 95% y una precisión del 10%. Se ha asumido una pérdida de seguimiento del 10% de los pacientes.
Los datos fueron expresados como número (porcentaje), media (desviación estándar [DE]), media (intervalo de confianza del 95% [IC 95%]) o mediana (IC 95%), según correspondiera.
Se trasladó, para la valorar la efectividad final, la última observación obtenida durante el tratamiento con linaclotida.
Se examinó la distribución de las variables continuas con una prueba de D'Agostino-Pearson. Se realizaron comparaciones entre los valores pre y postratamiento para las siguientes variables: número de deposiciones/semana, intensidad del dolor e hinchazón.
Si las variables cuantitativas seguían una distribución normal, se compararon las medias utilizando la prueba de la t de Student de dos colas para muestras pareadas. En aquellas variables que no presentaban una distribución normal se utilizó bien el test de Wilcoxon o bien el de Mann-Whitney, según correspondiera. Las variables categóricas fueron comparadas mediante la utilización de la prueba de Chi-cuadrado o el test exacto de Fisher, según fuera necesario.
Para analizar la relación entre los cambios en las variables clínicas (número de deposiciones, intensidad del dolor e hinchazón) ocurridos entre la visita de inicio y la última observación válida y el grado de satisfacción del paciente, se realizó un análisis de regresión lineal. Para el análisis de regresión lineal se utilizó el coeficiente de correlación de Pearson. Se consideró como estadísticamente significativo un valor de p < 0,05.
RESULTADOS
De los 110 pacientes que fueron evaluados (seis hombres y 104 mujeres), 30 cumplieron los criterios de inclusión/exclusión y fueron incluidos en el análisis. El 100% (30/30) de las pacientes eran mujeres.
De las 30 pacientes analizadas, cinco (16,7%) requirieron medicación concomitante con laxantes como tratamiento de rescate a lo largo del estudio, cuatro de las cuales suspendieron el tratamiento con linaclotida por presentar una efectividad insuficiente.
La media de edad fue de 50,3 11,3 años. Las principales características clínicas y demográficas se muestran en la Tabla 1.
Tabla 1 Características demográficas y clínicas de la muestra en la población al inicio del estudio
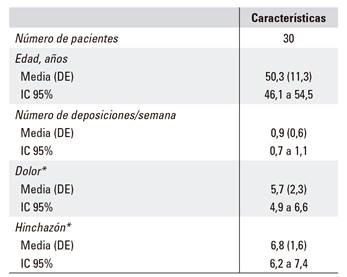
DE: desviación estándar; IC: intervalo de confianza. *Medidos mediante una escala visual analógica (EVA) de 11 niveles (0-10).
A lo largo del estudio, 13 (43,3%) pacientes suspendieron el tratamiento, siete pacientes por no haberse demostrado la efectividad del tratamiento o por presentar una efectividad insuficiente pese al tratamiento de rescate con laxantes (todos ellos abandonaron el estudio en la consulta del mes 1), cuatro por disminución de los efectos del tratamiento a lo largo del estudio (tras tres, cuatro, 12 y 22 meses de tratamiento, respectivamente) y dos por suspensión del tratamiento y no presentar una recaída de la enfermedad durante el seguimiento (a los seis y 12 meses, respectivamente) (Tabla 2).
Tabla 2 Características clínicas y demográficas, al inicio del estudio, de las pacientes en las que se retiró el tratamiento por no haberse demostrado su efectividad o por presentar una efectividad insuficiente pese al tratamiento de rescate con laxantes

M: mujer. *Medidos mediante una escala visual analógica (EVA) de once niveles (0-10).
El análisis final del estudio muestra una tasa de mejoría total del 63,3% (19/30), con una mediana (IC 95%) de tiempo de seguimiento de 18,0 (8,4 a 25,7) meses. De las 30 pacientes evaluadas en el mes 1, 23 (76,7%) mejoraron con el tratamiento de linaclotida, 19 (63,3%) de forma total y cuatro (13,3%) como mejoría parcial (dolor e hinchazón). De las 19 pacientes que realizaron un control de visita a los 12 meses válido, un 52,6% (10/19) fue clasificado como mejoría total, y de las 12 pacientes que realizaron una vista de mes 24 válida, cinco (41,7%) fueron clasificadas como mejoría total (Tabla 3).
Tabla 3 Mejoría clínica de los pacientes a lo largo del seguimiento del estudio
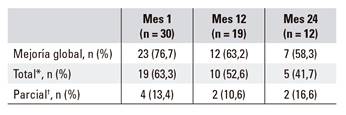
N: número. *Aumento en el número de deposiciones ≥ 1 y reducción de dolor e hinchazón ≥ 30%. †Ha experimentado mejoría en dos de los tres parámetros clínicos (aumento en el número de deposiciones ≥ 1; reducción de dolor ≥ 30%; reducción de hinchazón ≥ 30%).
El número medio de deposiciones por semana aumentó desde 0,9 (0,6) al inicio del estudio hasta 4,7 (3,7) al final del mismo (p < 0,0001). Resultados similares fueron observados, con el dolor (5,7 [2,3] frente a 3,1 [2,8], al inicio y final del estudio, respectivamente, p < 0,0001) y con la hinchazón (6,8 [1,6] frente a 2,9 [2,5], al inicio y final del estudio, respectivamente, p < 0,0001). La Tabla 4 muestra los cambios de las diferentes variables del estudio con respecto a la visita de inicio.
Tabla 4 Visión general de los valores del número de deposiciones/semana, dolor e hinchazón y sus cambios con respecto a la visita de inicio

DE: desviación estándar; IC: intervalo de confianza. *Medidos mediante una escala visual analógica (EVA) de once niveles (0-10). †Test de la t de Student para muestras pareadas.
Un aumento mayor o igual a cuatro deposiciones/semana fue observado en el 56,7% (17/30) de los pacientes. La tasa de éxito global fue significativamente mayor en aquellos pacientes que presentaron una variación en el número de deposiciones ≥ 4 en el mes 1 en comparación con aquellos que presentaron una variación en el número de deposiciones < de cuatro (94,1% frente al 7,7%, respectivamente, p < 0,0001).
Una reducción de tres unidades en la escala del dolor o en la sensación de hinchazón fue referida por el 53,5% (16/30) y el 63,3% (19/30) de las pacientes, respectivamente.
Más del 70% de los pacientes indicó estar satisfecho con el tratamiento al mes 1 en relación a la satisfacción con tratamientos anteriores. El grado de satisfacción del paciente (Fig. 1) se mantuvo a lo largo del estudio, sin mostrar diferencias significativas (6,9 [2,6] frente a 6,1 [2,5], al inicio y final del estudio, respectivamente, p < 0,3865).

Fig. 1 Evolución del grado de satisfacción de los pacientes a lo largo del tiempo (n.s.: no significativo).
El porcentaje mínimo de días de cumplimentación correcta del diario del paciente fue del 60%, con una media del 70,0% (68,8% a 73,3%).
La Figura 2 muestra la relación entre los cambios ocurridos en las variables clínicas y el grado de satisfacción de las pacientes. El grado de satisfacción fue 0,70 (error estándar [EE] 0,10) unidades mayor por cada unidad que aumente el número deposición/semana. Por cada unidad de dolor que se redujo, el grado de satisfacción aumentó en 0,84 (0,19) unidades y por cada unidad que se redujo el grado de hinchazón, el grado de satisfacción aumentó en 0,88 (0,13) unidades.

Fig. 2 Evaluación de los cambios ocurridos en las variables clínicas y el grado de satisfacción del paciente. A. Aumento del número de deposiciones (r = 0,81; IC 95%: 0,64-0,91, p < 0,0001). B. Reducción en la intensidad del dolor (r = 0,63; IC 95%: 0,34-0,11, p = 0,0002). C. Reducción en la sensación de hinchazón (r = 0,78; IC 95%: 0,58-0,89, p < 0,0001).
No se detectaron acontecimientos adversos (AA) graves en el estudio. A lo largo del seguimiento del estudio, once (36,7%) pacientes reportaron, al menos, un AA (diarrea: ocho [26,7%] pacientes; dolor abdominal: tres [10,0%] pacientes). La mayoría de los acontecimientos adversos fueron catalogados como leves (90,1%). Una paciente presentó un episodio de diarrea clasificado como moderado que se resolvió sin necesidad de tratamiento médico.
DISCUSIÓN
Los resultados de este estudio mostraron que la administración de una capsula/día de linaclotida, administrada 30 minutos antes del desayuno, mejoró de forma significativa la sintomatología, tanto abdominal como intestinal, de los pacientes con SII-E.
Como se ha mencionado anteriormente, la eficacia y seguridad de linaclotida en pacientes con SII-E se ha demostrado en dos ensayos clínicos multicéntricos de fase III, aleatorizados, doble ciego, comparados con placebo 16,17, así como en análisis adicionales 18,19).
La proporción de pacientes que obtuvieron un aumento en el número de deposiciones superior o igual a cuatro o una reducción de tres unidades en la escala del dolor o en la sensación de hinchazón parece ser superior a la publicada por los ensayos clínicos de fase III 16,17. Sin embargo, debido a que se han utilizado diferentes criterios de éxito y que las poblaciones pueden diferir, la comparación de los resultados es compleja.
Se ha descrito que las condiciones de definición de respondedor en los ensayos clínicos con linaclotida fueron muy estrictas y más lejos de la definición de respondedor en la práctica clínica real 21.
En un análisis a posteriori de la población de dos ensayos clínicos de fase III 16,17 se registraron, como variables primarias de eficacia, el grado de dolor y el grado de disconfort abdominal en las últimas 24 horas mediante una EVA de once puntos (0 [ninguno] - 10 [muy grave]) 18. Se definió como respondedor a aquel paciente que, durante al menos seis de las 12 semanas de tratamiento, tuviera una mejoría del 30% o más en la puntuación media peor del dolor abdominal o en la puntuación media de incomodidad abdominal para esa semana 18. En los pacientes tratados con linaclotida, la proporción de pacientes que tuvieron una mejoría en dolor/disconfort abdominal, a la semana 12, fue del 54,8% y del 54,1% según el estudio analizado 18. Además, un 39,4% y un 37,0% de los pacientes se mostraron considerablemente o completamente aliviados en al menos la mitad del tiempo de seguimiento del estudio 18.
En este estudio, once pacientes (36,7%) presentaron ausencia o pérdida de respuesta a lo largo del seguimiento del estudio. El número de pacientes que abandonaron el tratamiento por una respuesta insuficiente fue superior al publicado en los ensayos clínicos, exactamente cinco 16 y 15 17. Sin embargo, como se ha mencionado anteriormente, es difícil establecer una comparación con estos estudios.
La información relativa al uso de linaclotida en pacientes con SII-E, en la práctica clínica, es limitada.
En un estudio prospectivo y multicéntrico que incluyó a 375 pacientes con SII-E procedentes de 79 centros en Alemania, se evaluó la eficacia y seguridad de linaclotida en la práctica clínica 22. Los resultados de este estudio, con una mediana de seguimiento de cinco meses, mostraron una variación entre las determinaciones basales y las de la última observación registrada de 4,9 frente a 2,4, 5,3 frente a 2,7 y 2,7 frente a 4,4, en hinchazón, dolor y número de deposiciones, respectivamente, en todas las comparaciones (p < 0,0001) 22.
Los resultados de un estudio multicéntrico que incluyó pacientes que recibieron linaclotida durante un periodo comprendido entre cuatro y 12 semanas mostraron una tasa de respondedores a linaclotida (disminución > 75 puntos en la escala SII-SSS) del 45,4% y del 36,1% a las cuatro y 12 semanas de seguimiento, respectivamente 23.
En un estudio multicéntrico abierto de fase IIIb, realizado en España, en el que se evaluó el efecto de linaclotida en adultos con SII-E moderado o grave, se observó que el 80% de los pacientes en la población por protocolo presentó alguna mejoría en la semana 12 24. De manera similar a lo observado en nuestro estudio, la respuesta al final del seguimiento se asociaba de forma independiente a la observada en la semana 4 24.
Los resultados observados en este estudio están en consonancia con los observados en los estudios alemán 22, inglés 23 y español 24, respectivamente. Cabe destacar que el periodo de seguimiento de este estudio, con una mediana de 18 meses, es superior a los publicados hasta el momento 22,23,24.
Mejores resultados fueron publicados por un grupo español que encontró, en un grupo de 22 pacientes seguidos durante 26 semanas, una disminución del dolor respecto al inicio y un aumento en el número de deposiciones (3-4 por semana) en el 87% y 90% de los pacientes, respectivamente 25. Además, El 85% de los pacientes referían una mejoría global 25.
El grado de satisfacción medio observado en el estudio no declinó a lo largo del tiempo, manteniéndose en cifras entre 5,9 y 6,9 sobre 10. Estos resultados están en línea con los de una encuesta realizada en Canadá, en la que los pacientes identificaron a linaclotida como el tratamiento para el SII-E más satisfactorio 20.
En cuanto a la relación existente entre la mejoría en los parámetros clínicos y el grado de satisfacción, la mejoría de los parámetros clínicos se relacionó, de manera significativa, con el grado de satisfacción de los pacientes, sin que se observaran diferencias significativas entre ellos.
Un 36,7% de los pacientes reportaron, al menos, un AA, ninguno de ellos grave. Esta proporción es similar a la observada en diferentes estudios 16,17,18,19,22,23,24, pero algo mayor a la observada por Mínguez Cortes 25.
Este estudio tiene limitaciones inherentes con respecto a la interpretación de sus resultados, ya que es un estudio abierto, no aleatorizado y no comparativo por diseño. Sin embargo, los resultados obtenidos están en consonancia con los hallazgos de los ensayos clínicos aleatorizados que evaluaron la terapia con linaclotida 16,17,18,19.
En este estudio no se evaluó la consistencia de las heces, por lo que esto podría suponer una limitación a la hora de interpretar los resultados.
Habría que mencionar que en este estudio un 36,7% de los pacientes abandonó el tratamiento por ausencia o pérdida de eficacia a lo largo del estudio, lo que podría suponer una limitación a la hora de generalizar los resultados. Otra limitación del estudio es que la última observación obtenida se trasladó hacia delante para realizar el análisis de efectividad, lo que podría suponer un sesgo 26.
En resumen, el tratamiento con linaclotida en pacientes con SII-E en el entorno de la práctica clínica se ha mostrado eficaz y seguro a largo plazo, reduciendo de forma significativa el dolor y la sensación de hinchazón e incrementando el número de deposiciones espontáneas por semana. Sería interesante realizar estudios multicéntricos que evalúen los posibles factores relacionados con la falta o pérdida de respuesta terapéutica a lo largo del tiempo.











 texto en
texto en 

