Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista Española de Cirugía Oral y Maxilofacial
versión On-line ISSN 2173-9161versión impresa ISSN 1130-0558
Rev Esp Cirug Oral y Maxilofac vol.26 no.6 Madrid nov./dic. 2004
Controversias en Cirugía Oral y Maxilofacial: Parte I
Osteosíntesis maxilofacial con titanio
Maxillofacial osteosynthesis with titanium
S. Martínez-Villalobos Castillo
| Resumen: El Titanio es un elemento cuyas propiedades han posibilitado avances impresionantes en la industria aerospacial y química de nuestros días. Podríamos decir que ya es el metal del futuro. Como biomaterial utilizado en las técnicas de osteosíntesis se ha consolidado como de primera elección frente al acero. Su extraordinaria biocompatibilidad y las posibilidades que la biometalurgia ofrece le están abriendo las puertas en numerosos campos de aplicación médica como por ejemplo la Odontología. Palabras clave: Osteosíntesis maxilofacial; Titanio. Biomateriales; Osteosíntesis facial pediátrica; Placas de titanio; Placas reabsorbibles. | Abstract: Titanium is an element whose properties have made possible impressive advances in the aerospace and chemical industry of our days. We could say that it is already the metal of the future. As biomaterial used in the osteosynthesis techniques one has consolidated like of first choice in front of the steel. Its extraordinary biocompatibility and the possibilities that biometallurgy offers to us are opening the doors in numerous fields of medical application like for example the Odontology. Key words: Maxillofacial osteosynthesis; Titanium. Biomaterials; Paediatric facial osteosynthesis; Titanium plates; Resorbable plates. |
Miembro AO-CFM España. European AO Faculty,
Médico Adjunto Servicio de Cirugía Oral y Maxilofacial.
Hospital Universitario Virgen de las Nieves, Granada, España
Correspondencia:
Sergio Martínez-Villalobos Castillo
Servicio de Cirugía Oral y Maxilofacial
Hospital Universitario Virgen de las Nieves, Granada, España
E-mail: smvillalobos@terra.es
Introducción
El comienzo de la fijación con placas y tornillos para osteosíntesis (reparación activa de huesos fracturados) se remonta a 1886, cuando el alemán Karl Hansmann presenta su experiencia clínica en la que se incluían dos casos de fracturas mandibulares tratadas con este sistema diseñado, no obstante, para el tratamiento de fracturas sobre huesos largos del organismo.
Las dos grandes guerras mundiales, por motivos evidentes, supusieron un gran avance en el desarrollo de técnicas y sistemas de reparación ósea. Sin embargo, en el territorio maxilofacial este avance no fue tan significativo, ya que el empleo de las técnicas de fijación desarrolladas para huesos largos venían acompañadas de un elevado índice de complicaciones y fracasos, por lo que su uso quedó muy limitado, siendo los tratamientos clásicos ortopédicos los empleados rutinariamente. Hasta no hace mucho tiempo, en situaciones especialmente complejas se recurría a una tecnología más evolucionada pero diseñada para la traumatología general en un intento de reparar graves lesiones óseas maxilares, intentos que, casi siempre, resultaban fallidos o cuando menos asociados a una elevada morbilidad (Figs. 1 y 2).
Se necesitaba pues de técnicas y sistemas específicos para el territorio maxilofacial dadas sus peculiaridades anatómicas, fisiológicas y biomecánicas, con un doble objetivo: la reparación anatómica con restauración funcional lo más precoz posible y una disminución drástica de la morbilidad.
Osteosíntesis y biomateriales
Diferentes estudios experimentales en el campo de la biomecánica y fisiopatología de la consolidación ósea así como la investigación y perfeccionamiento de los biomateriales empleados, han resultado en los últimos 25 años en un vertiginoso avance en cuanto a técnicas y sistemas, gracias a los cuales se ha producido una considerable disminución en los índices de complicaciones y fracasos terapéuticos en el manejo de las diferentes técnicas de osteosíntesis craneofacial.
En 1949, el belga Robert Danis enuncia el principio de la compresión axial del foco de fractura. Partiendo de esta idea, el grupo suizo ASIF desarrolló diferentes líneas de investigación que dieron sus frutos a principios de los años 60 para su aplicación clínica en el tratamiento de las fracturas de los huesos largos. En 1968, Luhr diseña una placa de compresión axial para la osteosíntesis mandibular. En 1973 Michelet y en 1975 Champy, describen los principios de la osteosíntesis monocortical, no compresiva, para el territorio maxilofacial. Gracias a estos progresos técnicos, y al desarrollo de la biometalurgia, la consecución de buenos resultados clínicos con la mínima morbilidad asociada comenzaron a ser objetivos alcanzables.
A toda placa de osteosíntesis se le exigen unas propiedades mínimas, fundamentalmente resistencia adecuada (para proporcionar estabilidad), ductilidad suficiente (para permitir un moldeado anatómico) y biocompatibilidad (para no producir efectos adversos locales o sistémicos). Los materiales con los que se fabrican los implantes para osteosíntesis son variados; se usan principalmente acero inoxidable, aleaciones de cobalto-cromo-molibdeno y el titanio, puro o aleado. Durante muchos años, el acero inoxidable fue el material de elección. Consiste en una aleación de los metales hierro, cromo, níquel y molibdeno en proporciones bien definidas (62,5-17,5-14,5 y 2,8% respectivamente) asociados a otros componentes en menor proporción. Su resistencia, compatibilidad y propiedades anticorrosivas (ligadas proporcionalmente a la presencia de cromo) resultan adecuadas, aunque en 1977 Steinemann describe cierta potencialidad autocorrosiva por interacción entre diferentes componentes metálicos del implante fretting corrosion. Esta circunstancia aconseja la sistemática retirada de materiales de acero inoxidable una vez consolidada y mineralizada la fractura, al año aproximadamente de la intervención.
En este desarrollo tecnológico al que hacíamos referencia, el titanio como biomaterial se ha convertido en uno de los protagonistas indiscutibles, dada su extremada pasividad química (y por tanto excelente biocompatibilidad) y por reunir las propiedades físicas adecuadas para un buen comportamiento biomecánico a largo plazo. Su densidad hace que los implantes pesen alrededor de un 45% menos que los implantes de acero y de cobalto, factor importante respecto a la comodidad del paciente sobre todo en fijaciones largas. Su bajo módulo de elasticidad es otra ventaja, ya que minimiza la protección contra la presión y ésta se transfiere al hueso; la relativa importancia de la protección contra la presión se incrementa a medida que aumenta el tamaño del implante. Por todo ello, desde mediados de los 80 los implantes fabricados con titanio puro son de elección para la osteosíntesis en el territorio cráneomaxilofacial.
El titanio
El titanio (Ti) fue descubierto en 1791, asignándosele el nº 22 en la Tabla Periódica de Elementos, y constituye el noveno elemento en abundancia de la corteza terrestre, encontrándose en concentraciones significativas sobre todo en mena de rutilo (en forma de TiO2) y en ilmenita (FeO.TiO2). En la actualidad, su «síntesis» como metal puro se realiza a partir de estos minerales mediante la técnica desarrollada por Kroll en 1937: reducción del tetracloruro de titanio con magnesio en atmósfera de argón para evitar su oxidación.
A mediados de los años 50, los estudios relativos al titanio y sus aleaciones sufrieron un gran impulso, fundamentalmente en EE.UU., dada la gran importancia que sus propiedades físico-químicas le conferían en el desarrollo de tecnología militar y aerospacial sobre todo: baja densidad, bajo módulo de elasticidad, excelente relación resistencia mecánica / densidad, buen comportamiento a altas temperaturas, gran resistencia a la corrosión y magnifica biocompatibilidad. En la siguiente década, sus aplicaciones fueron ampliadas a la industria química y biomédica.
El titanio es considerado como un metal ligero, el único que presenta dimorfismo; en estado puro su microestructura cristalina y estable es hexagonal, pasando a ser cúbica e inestable a partir de 882°C (tª de tránsito). Esta transformación permite realizar combinaciones con diferentes elementos y, consecuentemente, obtener aleaciones con diferentes estructuras cristalográficas y por tanto propiedades físico-químicas. Distinguimos tres tipos:
Aleaciones a son las que presentan una estructura hexagonal a temperatura ambiente, y en ellas el efecto del aleante consiste en aumentar la temperatura de tránsito. El titanio comercialmente puro pertenece a este grupo.
Aleaciones b son las que presentan una estructura cúbica a temperatura ambiente, y en ellas el efecto del aleante es precisamente hacer estable esta microestructura a esta temperatura.
En las aleaciones a/b la microestructura es mixta (globular) y estable; el TAV (aleación de Titanio/6% Aluminio/4% Vanadio) pertenece a este grupo.
El titanio «comercialmente puro» (Ti CP) es simplemente titanio y oxígeno, junto a otras «impurezas». En efecto, el titanio metálico puro reacciona muy rápidamente con el oxígeno, nitrógeno, hidrógeno y carbono de la atmósfera, por lo que en su obtención para fines comerciales presenta estas impurezas en su composición en diferentes proporciones, lo que da lugar hasta a cuatro tipos de combinaciones con diferentes grados de resistencia y ductilidad (Grados 1 a 4 de la Norma ASTM F67) (Tablas 1 y 2).
Los diferentes procedimientos físicos empleados en la obtención y manipulación del Titanio CP (temperatura, velocidad de enfriamiento, etc.) hacen que se puedan obtener hasta tres microestructuras cristalinas diferentes con diferentes propiedades: equiaxial (el titanio de los implantes dentales y para osteosíntesis), martensítica y Widmanstätten (Fig. 3). El proceso de «mecanización» es finalmente un paso fundamental para la obtención de implantes de alta calidad en superficie, características que pueden ser analizadas con microscopía electrónica de barrido y cuyos defectos pueden tener repercusión en las propiedades biomecánicas del implante en servicio (Figs. 4 y 5).
Por otra parte, esta elevada reactividad con el oxígeno hace que se formen espontánea y rápidamente capas de óxido de titanio en su superficie, que varían desde el TiO al Ti7O12, capas que, si bien son muy delgadas, son impermeables; de ahí sus propiedades anticorrosivas con excelente resistencia a la acción de los ácidos inorgánicos y de casi todos los orgánicos (Contzen-1967). Así, no se ha evidenciado corrosión incluso en casos de fracaso de osteosíntesis en los que el tejido circundante se encontraba oscurecido por partículas abrasivas de titanio puro (Pohler, 1988). Es por tanto extremadamente insoluble por lo que su biocompatibilidad es excelente, comportándose como un material químicamente inerte que no interacciona con el organismo (a diferencia del acero). Para Steinemann (1988) existe una saturación fisiológica de titanio en el organismo, por lo que no existe posibilidad de interacción con titanio soluble adicional. No se han descrito reacciones tóxicas ni alérgicas.
El TAN (Titanio/6% Aluminio/7% Niobio) es una aleación relativamente nueva seleccionada por la AO/ASIF para las futuras generaciones de implantes diseñados para la fijación de fracturas. La aleación fue concebida en 1977 por un equipo de investigadores en Sulzer Bros (Winterthur-Suiza) e introducida en 1985 en la práctica clínica (prótesis de reemplazo total de cadera). Las propiedades mecánicas de la aleación TAN son muy similares a la aleación Ti-6Al-4V, utilizada como biomaterial desde hace años. Se ha sustituido el Vanadio por Niobio, metal descubierto por Hatchett en Connecticut en 1801 e inicialmente denominado Columbio, asignándosele el nº 41 en la Tabla Periódica de Elementos.
Su composición queda recogida en la tabla 3, siendo trascendental que los contenidos en hidrógeno sean mínimos para evitar la fractura de la aleación. Su microestructura es mixta a/b globular, muy similar al TAV, por lo que sus propiedades físicas son también muy parecidas (densidad, módulo de elasticidad, sensibilidad a la tensión, fatiga rotacional, corrosión, etc.). Con respecto al Ti CP Grado 4, posee sustanciales ventajas, que podríamos resumir a efectos prácticos en una mejor relación del binomio manejabilidad/ resistencia. Desde el punto de vista de la biocompatibilidad el TAN sigue el principio de utilizar solamente elementos no tóxicos para implantes indicado en la patente USA 4,029,129 asignada al Instituto Straumann (Waldenburg- Suiza).
Numerosos estudios experimentales in vivo e in vitro sustentan la excelente biocompatibilidad de esta aleación y ciertas ventajas (al menos en el campo teórico y experimental) con respecto a los compuestos con Vanadio. Finalmente, el análisis espectroscópico de fotoelectrones ha determinado que la superficie del TAN es una capa mixta de óxido de titanio, óxido de aluminio y óxido de niobio, más estable químicamente que las capas de óxido de titanio formadas en el Ti CP, por lo que la resistencia a la corrosión es si cabe mayor. Tratamientos de superficie como el anonizado de los implantes permiten determinar el espesor de esta capa de óxido mixta, que es el que condiciona el color que presentan los implantes por difracción de la luz en el interior del óxido (típicamente dorado en los implantes AO).
Un ejemplo de estos implantes de última generación lo constituyen en nuestro territorio los tornillos de fijación para los sistemas de bloqueo tipo UNILOCK 2.0.
Osteosíntesis y radioterapia
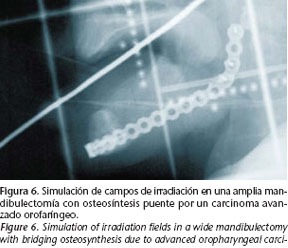
En la actualidad, la osteosíntesis mandibular con placas de titanio tras procedimientos ablativos oncológicos es una técnica rutinaria y perfectamente sistematizada. Usualmente son utilizadas técnicas de fijación en osteotomías de abordaje, para el refuerzo en madibulectomías marginales, en el puenteo de defectos óseos tras mandibulectomías segmentarias y en la fijación de injertos óseos microvascularizados o libres. Según el caso, distintos tipos de fijaciones son empleados, y en su elección, la presencia de radioterapia pre o postoperatoria es un factor determinante. Como norma general, deberá procurarse una fijación rígida, suficientemente estable, sobre aquellas áreas radiadas o que quedarán incluidas en campos de radiación (Fig. 6).
Es bien conocido que la radioterapia condiciona un aumento en el índice de complicaciones locales, incluyendo entre otras fracasos de las osteosíntesis. Sin embargo, no está sólidamente establecida en la bibliografía una relación causal directa y significativa entre la presencia de material de osteosíntesis y la aparición de estas complicaciones, siendo su génesis multifactorial.
Diversos factores locales han sido establecidos como responsables de este fenómeno, entre los que destacan la localización anatómica del defecto mandibular y la presencia o no de una cobertura adecuada de los implantes con colgajos vascularizados. Típicamente, las complicaciones son más frecuentes en ausencia de esta cobertura y en las regiones sinfisaria y del cuerpo mandibular, justo por delante del «estuche» maseterino. Los factores tisulares relacionados con este incremento en la morbilidad son fundamentalmente las alteraciones que la radioterapia ocasiona en la microvascularización ósea y de los tejidos conectivos, que condicionan un retraso en el proceso de cicatrización y regeneración tisular. Finalmente, también se han establecido efectos deletéreos de tipo bioquímico como los que se producen sobre la actividad de la BMP (proteína ósea morfogenética). Consecuentemente, la consolidación de una osteotomía y el proceso de osteointegración entre tornillos y hueso se ven enlentecidos con un aumento en las posibilidades de fracaso, máxime si consideramos que por los mismos motivos locales y tisulares, el riesgo de infección también está incrementado. En estas circunstancias, el empleo de una fijación no suficientemente estable casi garantiza la presentación de complicaciones.
Un segundo aspecto a considerar es la interacción que se produce entre el metal de los implantes y la radiación. Es bien conocido que la distribución de la dosis resulta alterada, produciéndose un incremento de la misma debido a un fenómeno de dispersión por delante del implante y una atenuación por un efecto de absorción distalmente al mismo. Desde el punto de vista experimental, ha quedado establecido que estos cambios son directamente proporcionales al nº atómico del metal interpuesto y a los «perfiles» (en términos de grosor y anchura) del implante, quedando limitados a un área entre 1-5 mm alrededor de la placa, con una media dosimétrica de menos del 3% para el fenómeno de dispersión a los 2 mm y del 4% para el fenómeno de absorción a los 5 mm. Estas variaciones quedan sin embargo «compensadas» cuando se utilizan campos paralelos y opuestos (Ryu-1995). En la práctica clínica, estos fenómenos pudieran tener dos repercusiones importantes: sobre el control oncológico, por atenuación e infradosis, y sobre la radionecrosis tisular por sobredosis.
En el primer caso, y con los datos de que se disponen, parece poco probable que tras la realización de una cirugía oncológica ad hoc con márgenes oncológicos macroscópicos de seguridad y con el eventual empleo de colgajos reconstructivos, la interposición de una placa pudiera interferir sobre la dosis terapéutica que el lecho quirúrgico tumoral hubiese de recibir; no hay evidencia científica de un incremento en la tasa de recidivas locales por este motivo.
En el segundo aspecto, la dispersión sí pudiera tener repercusión clínica, ya que puede producirse más probablemente una osteoradionecrosis focal por sobredosis en la interfase hueso-tornillo, con el consiguiente fracaso del sistema de osteosíntesis aplicado, o una mayor radionecrosis tisular, mucosa o cutánea, con mayor riesgo de exposición de placa intra o extraoral (Fig. 7).
En resumen, y dado que la radioterapia de cabeza y cuello usualmente utiliza campos paralelos y opuestos, las variaciones en la dosis terapéutica por dispersión y absorción se compensan sin tener una repercusión significativa en el control oncológico local e incluso, para la mayoría de los autores, en los fenómenos de radionecrosis focal. En cualquier caso, y en función de su nº atómico, las aleaciones de titanio son también en este aspecto menos interactivas y, por lo tanto, de elección en presencia de radioterapia adyuvante respecto a las de acero.
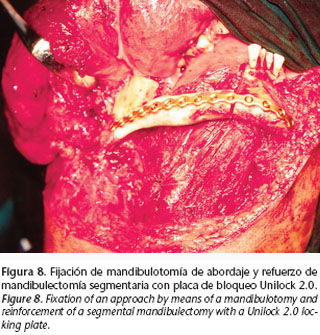
En la práctica clínica, la opción de una Placa de Bloqueo (tipo UNILOCK) sería electiva en todos los casos en los que deba coexistir con la radioterapia, no ya por sus más bajos perfiles sino, sobretodo, por minimizarse al máximo la isquemia que sobre la cortical ósea provoca la compresión de una placa tradicional (Fig. 8).
Finalmente, cabe insistir en que los índices de complicaciones y fracasos achacados al binomio Radioterapia / Osteosíntesis se minimizan en presencia de una cobertura tisular adecuada y mediante la restauración anatómica con injertos óseos microvascularizados de los defectos mandibulares. La opción de la osteosíntesis puente, con el implante adecuado, debería reservarse para defectos muy posteriores o para pacientes con un pronóstico oncológico muy desfavorable.
Retirada de osteosíntesis
Una vez consolidada la fractura u osteotomía los materiales de osteosíntesis pierden su efecto biomecánico de fijación interfragmentaria y se convierten en cuerpos mecánicamente inertes. El hueso subyacente se remodela de forma reactiva al stress vascular que le supone el tener adosada la placa. Este proceso ocurre en los primeros meses del postoperatorio y cursa con una fase inicial de cierta porosis que queda resuelta si la circulación intracortical está indemne, circunstancia que se da cuando la técnica de osteosíntesis ha sido adecuada. En ocasiones, transcurrido el tiempo necesario, el grado de osteointegración es tal que se produce neoformación ósea sobre la placa de osteosíntesis (Fig. 9). En esta situación, transcurrido un año de la cirugía, la decisión de proceder a la retirada del material de osteosíntesis, caso de haber utilizado titanio, resulta comprometida. Supone una nueva intervención quirúrgica, a menudo con anestesia general, no exenta de ciertos riesgos locales y sistémicos. Además, en muchas ocasiones la osteointegración es tal que hay que realizar ostectomías para poder retirar el material, los tornillos pueden descabezarse permaneciendo el vástago en el espesor del hueso, etc. En definitiva, puede darse una situación de agresión local desmesurada, con riesgo de complicaciones, que debe estar justificada. No podemos obviar que en muchas ocasiones, y en algunos países más que en otros, la sistemática retirada de las osteosíntesis obedece más a criterios socio-sanitarios y económicos que a los estrictamente biomédicos.
Las principales indicaciones, casi siempre relativas, para proceder a retirar los materiales de fijación serian:
Intolerancia al frío.
Palpación subcutánea y sensibilidad.
Exposición intra-extraoral.
Interferencia con prótesis.
Interferencia con implantes dentales.
Inestabilidad. Movilidad de la placa y/o aflojamiento de los tornillos, por infección y/o por error técnico.
Reacciones adversas (tóxicas) locales ó generales: hardware de acero inoxidable.
Otra posible desventaja (invocada en la literatura) que podría justificar bien la retirada de material de osteosíntesis metálica, bien el empleo de osteosíntesis reabsorbible, es la interferencia con las pruebas de imagen de la TC durante el seguimiento de procesos oncológicos. Esta cuestión dependerá del territorio craneofacial y del proceso patológico que nos ocupe y adquiere especial relevancia en la patología tumoral de la base craneal. En estos casos, y dado que los requerimientos biomecánicos del área lo permiten sin riesgos añadidos, la fijación con implantes reabsorbibles resultaría electiva. El perfil de los implantes a emplear en el tercio medio facial (miniplacas) minimiza estos efectos, por lo que cabe individualizar nuestra elección en función de las necesidades biomecánicas y funcionales de cada paciente y de la presencia de radioterapia adyuvante. A nivel mandibular, la necesidad de una osteosíntesis durante el procedimiento quirúrgico suele ir asociada a un estadio avanzado de la enfermedad oncológica y por lo tanto a la presencia casi inevitable de la radioterapia. En estas circunstancias se impone una fijación segura, suficientemente estable, habitualmente rígida, que proporcione una rehabilitación funcional lo más precoz posible y minimice la posibilidad de complicaciones; En la actualidad, los implantes reabsorbibles no garantizan estas premisas, por lo que resulta electiva la osteosíntesis con titanio aún asumiendo el inconveniente del posible retraso en el diagnóstico de una recidiva por interferencia con las pruebas de imagen de la TC. Ciertamente, desde la incorporación de la RM a nuestro arsenal diagnóstico rutinario esta desventaja ha quedado obviada, dado que los implantes de titanio no provocan interferencias ni artefactos en este tipo de exploraciones, tan solo una señal de vacío que se limita a la exacta localización y dimensión del implante; y es que las aleaciones de titanio no poseen magnetismo residual y los implantes por tanto pueden ser sometidos de forma rutinaria a Resonancias Magnéticas Nucleares (la permeabilidad magnética, en el caso de materiales poco permeables, puede ser medida con un instrumento denominado Severn Gauge cuya prueba de calibrado más baja es igual a 1.01, habiendo sido registradas permeabilidades menores en la aleación TAN).
El seguimiento de los procesos de consolidación y mineralización de fracturas u osteotomías no plantea ningún inconveniente, ya que las exploraciones TC con ventana ósea no se ven artefactadas por los implantes de titanio, ni por supuesto las exploraciones radiológicas simples o tomográficas.
Persiste la controversia en el caso de pacientes en crecimiento aunque en general, como después veremos, se tiende a retirarlas aunque no estén dando problemas invocando la incertidumbre sobre posibles efectos adversos a muy largo plazo.
Es bien conocido el fenómeno migratorio que acontece durante el crecimiento. Las osteosíntesis metálicas en el territorio craneal, por este motivo, deben de ser retiradas sistemáticamente, debido a su posible penetración endocraneal con la consiguiente interacción meníngea. La indicación de osteosíntesis reabsorbible en estos casos resulta electiva.
Fractura de la placa
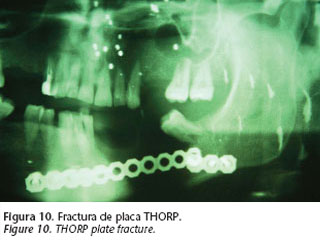
Las placas pueden «fracturarse». La causa es la denominada fatiga metálica (Pohler y Straumann-1975), situación que acontece cuando la placa soporta una carga mecánica excesiva y prolongada, casi siempre por ausencia de reconstrucción ósea subyacente (placas de reconstrucción con puenteo del defecto óseo). Si la placa además ha sido excesivamente manipulada durante el proceso de moldeado, este fenómeno puede verse favorecido (Fig.10).
Pero la causa más frecuente de esta rotura metálica es el error en su elección, es decir, cuando le exigimos a una placa unas prestaciones biomecánicas para las que no está diseñada. En la actualidad, esta situación se presenta frecuentemente en el tratamiento de fracturas en mandíbulas edéntulas con miniplacas, en las que subestimamos las fuerzas funcionales que han de contrarestar.
De otra parte, cuando los defectos en la continuidad ósea no son restaurados, los extremos óseos remanentes tienden a reabsorberse, por lo que a largo plazo pueden producirse aflojamientos y suelta de tornillos, inicialmente estables y osteointegrados, que deberán ser retirados.
Osteosíntesis con titanio en niños
Afortunadamente, la gran mayoría de las fracturas de los maxilares que acontecen en la edad pediátrica son subsidiarias de tratamiento conservador, entendiéndose como tal desde la abstinencia terapéutica a la fijación intermaxilar. La elección de una u otra alternativa depende de las características intrínsecas de la fractura y de la edad del paciente, sobre todo en lo que se refiere a la etapa de dentición que presenta. En otras ocasiones es precisa una cirugía abierta para la reducción de la fractura, aunque finalmente no sea imprescindible la fijación interfragmentaria. En estos casos el exquisito manejo quirúrgico de los tejidos blandos es imperativo para minimizar el daño vascular y la posible repercusión que sobre el crecimiento é pudiera tener.
En general, se tenderá a ser más conservador a menor edad del enfermo, pero se presentan casos en la práctica clínica que no lo permiten. Hay situaciones en las que una reducción abierta con fijación activa de los focos resulta necesaria para una adecuada curación de las fracturas, fundamentalmente en los casos con un importante grado de desplazamiento, en presencia de focos múltiples y/o de fracturas de ambos maxilares y con independencia del grupo etario del paciente (Fig. 11). Clásicamente se ha utilizado la osteosíntesis alámbrica (acero inoxidable) para solventar la mayoría de estas situaciones, asociada o no a fijación intermaxilar. La evolución en el diseño de miniplacas y microplacas de titanio, con perfiles muy bajos (1-1,5 mm) y tornillos muy cortos y autoroscantes, ha generalizado su uso en estas situaciones desplazando casi totalmente a la fijación alámbrica, ya que la estabilidad primaria que posibilita es muy superior, por lo que en muchas ocasiones se puede obviar la fijación intermaxilar, situación nada despreciable tratándose de niños (Fig. 12).
En el caso de las fracturas mandibulares el objetivo final del tratamiento es similar al de la población adulta, esto es, obtención de una reducción anatómica y de una estabilización del foco que permita una correcta e inmediata reparación, tanto anatómica como funcional. Partiendo de esta premisa, es evidente que la mandíbula de estos pacientes esta sometida a una serie de particularidades, en gran parte comunes al resto del esqueleto facial, que condicionan la solución terapéutica: hueso en crecimiento, crecimiento combinado máxilo-mandibular, presencia de gérmenes dentarios (distintas fases de dentición) y posición basal del nervio dentario inferior. La dinámica del crecimiento conduce por lo tanto a encontrarnos con diferentes situaciones clínicas en el tratamiento quirúrgico de las fracturas mandibulares en niños. Esta heterogeneidad, unida a la baja incidencia de fracturas faciales en la infancia, justifica la inexistencia de un tratamiento consensuado. Como principios básicos, el grado de desplazamiento va a condicionar la necesidad de osteosíntesis, la fase de la dentición determinará las técnicas de inmovilización y de osteosíntesis a emplear y la localización de la fractura la duración de la inmovilización (Hardt-Gottsauner-1993).
Las ventajas de la cirugía abierta con fijación no sólo se fundamentan en la obtención de una reducción precisa de los focos de fractura. Con este tipo de actuación se posibilita que la vía aérea permanezca permeable, saliendo al paso de potenciales complicaciones graves como la aspiración de vómito (nada infrecuente en niños), y consiguiéndose un rápido retorno a la dieta habitual del niño, con mantenimiento del funcionalismo máxilo-mandibular y cráneo-mandibular (ATM) de forma precoz; esta fisioterapia pasiva es beneficiosa para todo el sistema estomatognático en crecimiento (Fig. 13).
Los inconvenientes descritos en la literatura incluyen el posible daño de los gérmenes dentarios, la interrupción del potencial osteogénico del periostio al exponer la mandíbula con la consiguiente alteración del patrón de crecimiento, aparición de cicatrices hipertróficas, fundamentalmente en adolescentes, y la posible interferencia del material de osteosíntesis en el crecimiento mandibular a la que nos referiremos más tarde. Hay que destacar que todos estos inconvenientes, salvo el último, son comunes para los sistemas de osteosíntesis reabsorbible, e incluso podría pensarse que algo más acentuados debido a los mayores perfiles de sus placas y tornillos. (Champy-1992)
Las indicaciones para la cirugía abierta con fijación semirígida en las fracturas mandibulares de la infancia son, en nuestra opinión y en concordancia con otros autores las siguientes:
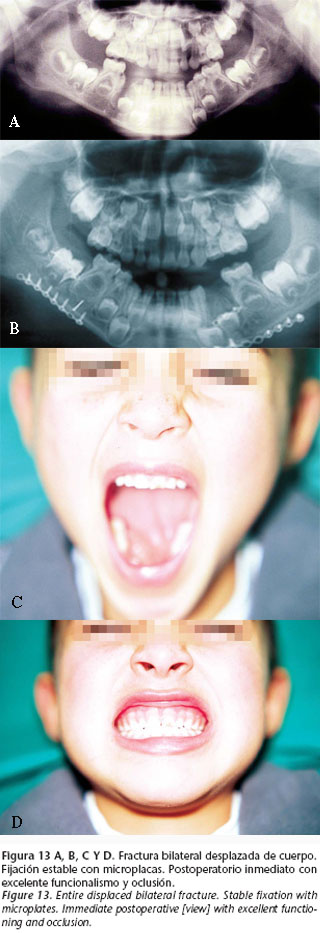
1. Traumatismos de elevada energía, que originan fracturas mandibulares múltiples, especialmente si se acompañan de fracturas del tercio medio facial. Dentro de este apartado se incluyen las fracturas abiertas (Fig. 14). La energía liberada origina frecuentemente la conminución de los fragmentos; la fijación con miniplacas permite recuperar la arquitectura de la mandíbula minimizando el daño funcional y estético.
2. Deficiente fijación de las férulas metálicas del bloqueo intermaxilar. Durante los dos primeros años de vida los dientes deciduos no aportan la suficiente estabilidad. Posteriormente, la dentición mixta dificulta en ocasiones la obtención de una adecuada inmovilización. La reducción abierta en fracturas mandibulares, únicas pero con importante desplazamiento, permite evitar una fijación intermaxilar precaria.
3. Asociación de fracturas de cóndilo y del cuerpo mandibular. Fundamentalmente antes de los 12 años, el cóndilo constituye la localización más frecuente de las fracturas mandibulares. El tratamiento conservador, basado en dieta blanda y movilización precoz, se ve entorpecido en ocasiones por la existencia de otro foco de fractura, fundamentalmente en el cuerpo mandibular contralateral. La fijación con material de osteosíntesis permite la apertura oral precoz, minimizando el riesgo de anquilosis en la articulación dañada (Fig. 15).
4. Situaciones en que las consecuencias del traumatismo no se limiten a las fracturas faciales. En las primeras etapas de la infancia resulta desgraciadamente habitual la presencia de lesiones intracraneales o tóraco-abdominales. En estas situaciones, resulta aconsejable recurrir al tratamiento abierto de las fracturas mandibulares, que permite reducir y estabilizar adecuadamente la fractura, manteniendo libre la vía aérea, lo que facilita el trabajo en las unidades de cuidados intensivos pediátricas y evita la indeseable traqueotomía (Fig. 16).
En el caso de fracturas orbitomalares desplazadas, mucho más infrecuentes, se aconseja un abordaje intraoral y fijación mediante miniplaca de titanio en el arbotante máxilo-malar. Si se precisa un abordaje del reborde infraorbitario o del suelo de la órbita se puede utilizar una vía subtarsal o transconjuntival. El reborde infraorbitario puede estabilizarse mediante osteosíntesis alámbrica o mediante microplacas de titanio. El suelo de la órbita puede restaurarse mediante reducción pura del fragmento desplazado, o mediante injertos autólogos sin ningún tipo de fijación. Por último, si se precisa un abordaje en cola de ceja para realizar una osteosíntesis fronto-malar, se pueden emplear mini-microplacas de titanio o bien osteosíntesis alámbrica si es que el arbotante máxilo-malar ha sido convenientemente fijado. En las fracturas tipo Lefort, a pesar de su infrecuencia, la mayor parte de los casos (80%) precisan de cirugía abierta y fijación semirígida. Sólo aquellos casos con mínimo desplazamiento son subsidiarios de una abstención terapéutica (dieta blanda y control) o de la aplicación de un bloqueo intermaxilar durante 3 semanas. En el resto de los casos se procederá a la estabilización de los arbotantes naso-maxilares y máxilo-malares mediante miniplacas.
En la actualidad, tanto para las fracturas orbitomalares como para las de tercio medio, la indicación de osteosíntesis reabsorbible puede resultar electiva, ya que sus resultados son equiparables a la osteosíntesis con titanio y se obvia la posibilidad de una futura retirada. La decisión creemos depende, sobre todo, de la experiencia del cirujano con uno y otro sistemas. Con respecto a las fracturas órbito-naso-etmoidales, hay que considerar que el crecimiento del tercio medio facial está condicionado por el desarrollo de la fosa craneal anterior, órbita y septo. Las fracturas de esta región, aunque infrecuentes, tienen por un lado un alto potencial de alterar el desarrollo facial, pero por otro pueden acompañarse de importantes secuelas estéticas ante una reducción inapropiada. Por ello, a pesar de la importante desperiostización que conlleva su tratamiento, la mayor parte de los autores mantienen la idea de realizar una reducción anatómica de todas las fracturas desplazadas mediante abordaje coronal en ausencia de heridas faciales que permitan un abordaje directo. La fijación semirrígida se hará preferentemente con miniplacas reabsorbibles (si es que las condiciones de los tejidos blandos lo permiten) con alambres de acero, con microplacas de titanio o si la estabilidad de la fractura lo permite, con pegamentos biológicos (cianoacrilato). La utilización de placas metálicas en este territorio conlleva cierto riesgo de migración intracraneal, y requiere de un seguimiento estrecho hasta finalizado el crecimiento y si es necesario de un segundo abordaje para su retirada (Fig. 17).
Conclusiones
Se ha invocado de forma reiterada en la literatura la interferencia de la osteosíntesis de titanio en el crecimiento de los huesos faciales.Como ya apuntábamos, es difícil discriminar entre los efectos deletéreos que sobre el crecimiento se derivan de la propia fractura, del traumatismo indirecto sobre la ATM, de las lesiones sobre tejidos blandos, traumáticas o quirúrgicas (matriz de crecimiento de Moss y Rankow) y los consecuentes a la aplicación de miniplacas de titanio para la osteosíntesis.
La fijación con miniplacas y microplacas de titanio, excluido el territorio pericraneal, plantea pues la controversia derivada de la necesidad de una segunda intervención para su retirada, necesidad que se argumenta para indicar la fijación con sistemas reabsorbibles. Los autores que mantienen tal postura suelen proceder a su retirada a los 2-3 meses de su aplicación. Cuando los abordajes son intraorales las consecuencias de una segunda cirugía pueden considerarse como asumibles, pero en abordajes extraorales (p.e. coronal o submandibular) estas consecuencias no pueden ser desdeñadas. De otra parte, algunos cirujanos postulan que el nuevo abordaje quirúrgico repercute sobre el crecimiento facial de manera similar al tratamiento primario de la fractura, por lo que teniendo en cuenta la reconocida biocompatibilidad de las placas de titanio recomiendan su mantenimiento, sobre todo en pacientes mayores de 13 años, salvo que produzcan alguna alteración objetiva. Hay que tener en cuenta, como ya hemos dicho, que las osteosíntesis se manifiestan biomecánicamente activas hasta que la fractura ha consolidado; a partir de este momento se comportan como cuerpos inertes sobre los cuales, y en ausencia de complicaciones, se produce remodelado óseo y osteointegración, pudiendo evidenciarse como el material «acompaña» a la mandíbula en su crecimiento (Fig. 18).
Siguiendo los postulados de Medicina Basada en la Evidencia, no existe en la literatura evidencia científica contrastada que establezca una relación causal directa entre la presencia de un implante de titanio y una alteración del crecimiento sobre un hueso facial. La experiencia clínica de muchos cirujanos, entre los que nos encontramos, habla en contra de esta posibilidad, por lo que una vez realizada la pertinente valoración crítica en términos de validez y utilidad, podemos concluir que esta hipótesis no justifica la no utilización de estos implantes en niños cuando sea necesario, ni la sistemática retirada de los mismos cuando no lo sea (Fig.19).
En cualquier caso, un seguimiento prolongado es imprescindible en estos pacientes sobre los que se individualizará la decisión.
Bibliografía
1. Allal AS, Richter M, Russo M, Rouzaud M, Dulguerov P, Kurtz JM. Dose variation at bone/titanium interfaces using titanium hollow screw osseointegrating reconstruction plates. Int J Radiation Oncology Biol Phys 1998;40:215-9. [ Links ]
2. Amaratunga NA. Mandibular fractures in children. A study of clinical aspects, treatment needs, and complications. J Oral Maxillofac Surg 1988;46:637- 40. [ Links ]
3. Alpert B. Discussion. Paediatric facial fractures: Evolving patterns of treatment. J Oral Maxillofac Surg 1993;51:844-5. [ Links ]
4. Bahr W, Stricker A, Gutwald R, Wellens E. Biodegradable osteosynthesis material for stabilization of maxillary fractures: experimental investigation in sheep. J Craniomaxillofac Surg 1999;27:51-7. [ Links ]
5. Bartlett SP, DeLozier JB. Controversies in the management of paediatric facial fractures. Clin Plast Surg 1992;19:245-58. [ Links ]
6. Blakey GH, Ruiz RL. Management of facial fractures in the growing patient. En: Fonseca. Oral and Maxillofacial Trauma, 2ª ed. [ Links ]
7. Boyd JB. Use of reconstruction plates in conjunction with soft-tissue free flaps for oromandibular reconstruction. Clin Plast Surg 1994;21:69-77. [ Links ]
8. Champy M, Blez P, Kahn JL. Osteosynthesis using resorbable plates in maxillofacial surgery: hopes and disappointments. Chirurgie 1992;118:596-600. [ Links ]
9. Cordeiro P, Hidalgo D. Soft tissue coverage of mandibular reconstruction plates. Head Neck 1994;16:112-5. [ Links ]
10. Coustal B, Michelet V, Pinsolle J, Siberchicot F, Caix P, Michelet FX. Résultats de l´utilisation des plaques de reconstruction mandibulaire en titane. Rev Stomatol Chir Maxillofac 1994;95:274-7. [ Links ]
11. Davidson J, Birt BD, Gruss J. A-O plate mandibular reconstruction: a complicaction critique. J Otolaryngol 1991;20:104-7. [ Links ]
12. Davidson J, Freeman J, Gullane P, Rotstein L, Birt D. Mandibulotomy and radical radiotherapy: compatible or not? J Otolaryngol 1988;17:279-81. [ Links ]
13. Dean A, Alamillos F. Osteosíntesis y Radioterapia. En: Martínez-Villalobos: Osteosíntesis Craneomaxilofacial. Ergon, Madrid 2002, 247-58 [ Links ]
14. Delacroix S, Rymel J, Smith P, Clubb B. The effects of steel and titanium mandibular reconstruction plates on photon and electron beams. Br J Radiol 1990;63:642-5. [ Links ]
15. Demianczuk AN, Verchere C, Phillips JH. The effect on facial growth of paediatric mandibular fractures. J Craniofac Surg 1999;10:323-8. [ Links ]
16. Flynn TR. Oral and Maxillofacial Infections. Atlas of the Oral and Maxillofacial Surgery Clinics of North America 2000;8(1). [ Links ]
17. Fortunato MA, Fielding AF, Guernsey LH. Facial bone fractures in children. Oral Surg Oral Med Oral Pathol 1982;53:225-30. [ Links ]
18. Freitag V, Berthold B, Fischer H. Experience with AO reconstruction plates after partial mandibular resection involving its continuity. J Craniomaxillofac Surg 1991;19:191-8. [ Links ]
19. Futran ND, Urken ML, Buchbinder D, Moscoso JF, Biller HF. Rigid fixation of vascularized bone grafts in mandibular reconstruction. Arch Otolaryngol Head Neck Surg 1995;121:70-6. [ Links ]
20. Gosain AK, Song L, Corrao MA, Pintar FA. Biomechanical evaluation of titanium, biodegradable plate and screw, and cyanoacrylate glue fixation systems in craniofacial surgery. Plast Reconstr Surg 1998;101:582-91. [ Links ]
21. Greenberg AM. Craniomaxillofacial Fractures. Principles of Internal Fixation Using the AO/ASIF Technique. Springer-Verlag, New York, Inc 1993. [ Links ]
22. Gullane PJ. Primary mandibular reconstruction: analysis of 64 cases and evaluation of interface radiation dosimetry on bridging plates. Laryngoscope 1991;101:1-24. [ Links ]
23. Hardt N., Gottsauner A. The treatment of mandibular fractures in children. J Craniomaxillofac Surg 1993;21:214-219. [ Links ]
24. Iizuka T, Thorén H, Annino DJ, Hallikainen D, Lindqvist Ch. Midfacial fractures in paediatric patients. Frequency, characteristics, and causes. Arch Otolaryngol Head Neck Surg 1995;121:1366-71. [ Links ]
25. Imola MJ, Hamlar DD, Shao W, Chowdhury K, Tatum S. Resorbable plate fixation in paediatric craniofacial surgery: long-term outcome. Arch Facial Plast Surg 2001;2:79-90. [ Links ]
26. Junquera LM, Martínez-Villalobos S. Osteosíntesis en pacientes pediátricos. En: Martínez- Villalobos. Osteosíntesis Craneomaxilofacial. Ergon, Madrid 2002;223-233. [ Links ]
27. Kaban LB, Mulliken JB, Murray JE. Facial fractures in children. An analysis of 122 fractures in 109 patients. Plast Reconstr Surg 1977;59:15-20. [ Links ]
28. Kaban LB. Diagnosis and treatment of fractures of the facial bones in children 1943-1993. J Oral Maxillofac Surg 1993;51:722-29. [ Links ]
29. Klotch DW, Ganey T, Greenburg H, Slater-Haase A. Effects of radiation therapy on reconstruction of mandibular defects with titanium reconstruction plate. Otolaryngol Head Neck Surg 1996;114:620-7. [ Links ]
30. Klotch DW, Gump J, Kuhn L. Reconstruction of mandibular defects in irradiated patients. Am J Surg 1990;160:396-8. [ Links ]
31. Martínez-Villalobos S. Fracaso de osteosíntesis. En: Martínez-Villalobos. Osteosíntesis Craneomaxilofacial. Ergon, Madrid 2002;209-21. [ Links ]
32. McCann KJ, Irish JC, Gullane PJ, Holmes H, Brown DH, Rotsein L. Complications associated with rigid fixation of mandibulotomies. J Otolaryngol 1994;23:210-15. [ Links ]
33. Melian E, Fatyga M, Lam P, Steinberg M, Reddy SP, Petruzzelli GJ, Glasgow GP. Effect of metal reconstruction plates on cobalt-60 dose distribution: a predictive formula and clinical implications. Int J Radiat Oncol Biol Phys 1999;44:725-30. [ Links ]
34. Pinsolle J, Demeaux H, Phan E, Coustal B, Siberchicot F, Michelet FX. Plaques de reconstruction mandibulaire en titane et radiothérapie. Ann Chir Plast Esthet 1993;38:163-6. [ Links ]
35. Planell Estany JA. Estudio comparativo para Synthes Hispania de diferentes materiales de osteosíntesis para aplicación médica. Universidad Politécnica de Cataluña. Barcelona, 1995 [ Links ]
36. Postlethwaite KR, Philips JG, Booth S, Shaw J, Slater A. The effect of small plate osteosynthesis on postoperative radiotherapy. Br J Oral Maxillofac Surg 1989;27:375-8. [ Links ]
37. Posnick JC, Wells M, Pron GE. Paediatric facial fractures: Evolving patterns of treatment. J Oral Maxillofac Surg 1993;51:836-44. [ Links ]
38. Precious DS, Delaire J, Hoffman CD. The effects of nasomaxillary injury on future facial growth. Oral Surg Oral Med Oral Pathol 1988;66:525-30. [ Links ]
39. Prein J. Manual of Internal Fixation in the Cranio-Facial Skeleton. Springer-Verlag, Berlin Heidelberg 1998. [ Links ]
40. Raveh Y, Stitch H, Sutter F. The use of titanium-coated hollow screw and reconstruction plate system in bridging of lower jaw defects. J Oral Maxillofac Surg 1984;42:281-94. [ Links ]
41. Rodríguez Rius D. El titanio y sus propiedades. Impladent magazine nº2, Marzo 2002. [ Links ]
42. Rohrich RJ. Advances in Craniomaxillofacial Fracture Management. Clinics in Plastic Surgery 1992;19(1). [ Links ]
43. Ryu JK, Stern RL, Robinson MG, Bowers MK, Kubo HD, Donald PJ, Rosenthal SA, Fu KK. Mandibular reconstruction using titanium plate: the impact of radiation therapy on plate preservation. Int J Radiat Oncol Biol Phys 1995;32:627-34. [ Links ]
44. Schusterman MA, Reece GP, Kroll SS, Weldon ME. Use of the AO plate for immediate mandibular reconstruction in cancer patients. Plast Reconstr Surg 1991;88:588-93. [ Links ]
45. Schweinfurth JM, Koltai PJ. Pediatric mandibular fractures. Facial Plast Surg 1998; 14:31-44. [ Links ]
46. Sherick DG, Buchman SR, Patel PP. Pediatric facial fractures. Analysis of differences in subspecialty care. Plast Reconstr Surg 1998;102:28-31. [ Links ]
47. Spencer KR, Sixeland A, Taylor GI, Wiesenfeld D. The use of titanium mandibular reconstruction plates in patients with oral cancer. Int J Oral Maxillofac Surg 1999;28:288-90. [ Links ]
48. Spiessl B, Rahn B. Internal Fixation of the Mandible. A Manual of AO/ASIF Principles. Springer-Verlag, Berlin Heidelberg 1989. [ Links ]
49. Stoll P, Wachter R, Bahr W. Bridging lower jaw defects with AO plates: comparison of THORP and 3-DBRP systems. J Craniomaxillofac Surg 1992;20:87-90. [ Links ]
50. Tanaka N, Uchide N, Suzuki K y cols. Maxillofacial fractures in children. J Craniomaxillofac Surg 1993;21:289-93. [ Links ]
51. Tatcher M, Kuten A, Helman J. Laufer D. Perturbation of cobalt 60 radiation doses by metal objects implanted during oral and maxillofacial surgery. J Oral Maxillofac Surg 1984;42:108-110. [ Links ]
52. Thaler SR, Huang V. Midfacial fractures in the paediatric population. Ann Plast Surg 1992;29:348-52. [ Links ]
53. Vuillemin T, Raveh J, Sutter F. Mandibular reconstruction with the titanium hollow screw reconstruction plate (THORP) system: Evaluation on 62 cases. Plast Reconstr Surg 1988;82:804-814. [ Links ]
54. Weber WD, Chotkowski GC. Mandibular Fractures. Atlas of the Oral and Maxillofacial Surgery Clinics of North America 1997;5(1). [ Links ]
55. Winzenburg SM, Imola MJ. Internal fixation in pediatric maxillofacial fractures. Facial Plast Surg 1998;14:45-8. [ Links ]
56. Worrall SF. Avoiding and managing complications in minor oral surgery. En: Ward Booth P, Schendel SA y Hausamen JE (eds.): Maxillofacial Surgery. Churchill- Livingstone, Edinburgh 1999;1608-1609. [ Links ]











 texto en
texto en