Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Cirugía Oral y Maxilofacial
versión On-line ISSN 2173-9161versión impresa ISSN 1130-0558
Rev Esp Cirug Oral y Maxilofac vol.30 no.1 Madrid ene./feb. 2008
¿Cuál sería su diagnóstico y su manejo terapéutico?
What should the diagnosis and treatment be?
Presentamos el caso de un varón de 35 años sin antecedentes personales de interés intervenido 8 años antes en el Hospital Universitario del Valle Calí (Colombia) de un meningioma frontal, desconociéndose datos quirúrgicos y radiológicos de la cirugía de exéresis tumoral. En el primer año tras la cirugía el paciente refiere crisis comiciales. Posteriormente recibió tratamiento complementario con radioterapia, retirada del colgajo óseo frontal y reconstrucción frontal con malla de titanio. Tras sufrir repetidos cuadros de celulitis frontal es remitido a nuestro servicio desde su Hospital de referencia para tratamiento quirúrgico definitivo y reconstrucción frontal.
En la exploración física se aprecia el relieve que produce la malla de titanio y la supuración crónica a nivel frontal (Fig. 1). Al paciente se le realizó un CT craneal en el que se observa la malla de titanio colocada entre la piel y la duramadre cubriendo el defecto óseo frontal (Fig. 2).
Ante una situación como ésta ¿cuál sería su plan terapéutico?
Posibilidades reconstructivas en cirugía de base-bóveda craneal frontal. A propósito de 1 caso
Reconstructive possibilities in surgery of the frontal skull base and cavity. A case report
I. Heras Rincón1, I. Zubillaga Rodríguez2, G. Sánchez-Aniceto2, R. Gutiérrez Díaz2, J.J. Montalvo Moreno3
1 Médico Residente.
2 Médico Adjunto.
3 Jefe del Servicio de Cirugía Oral y Maxilofacial.
Hospital Universitario 12 de octubre. Madrid, España
Dirección para correspondencia
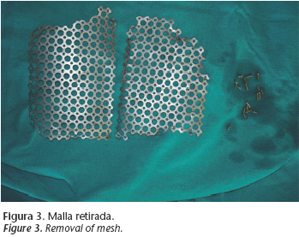
Dada la situación del paciente se plantea un tratamiento quirúrgico y reconstructivo frontal. Tras realizar un CT craneal y de macizo facial previo se decidió optar por el siguiente procedimiento quirúrgico bajo anestesia general e intubación orotraqueal: reapertura de abordaje coronal sobre cicatriz previa y retirada de malla de titanio frontal (Fig. 3) observándose la impronta dejada por el material de ostesíntesis en laduramadre (Fig. 4), disección de vasos temporales superficiales, obtención de colgajo libre microvascularizado de epiplon (Fig. 5) y colocación del mismo en fosa craneal anterior obliterando el espacio muerto (Fig. 6) con microanastomosis termino-terminal de arteria y vena temporal superficial a vasos epiploicos (Fig. 7). Al mismo tiempo se coloca parche de Tutopatch para reparar un defecto dural.
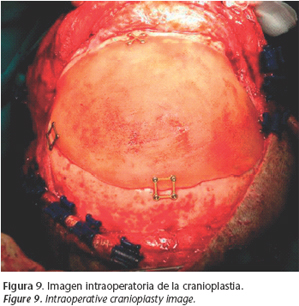
El paciente fue dado de alta debido a la buena evolución clínica (Fig. 8) y se decide esperar para realizarle una cranioplastia. Como veremos más adelante el problema fundamental, llegados a este punto, es la elección del biomaterial a utilizar ya que aunque existe bastante bibliografía al respecto no existe un consenso entre autores. Ocho meses después se decide intervenir al paciente para tratamiento reconstructivo de su defecto óseo frontal. De nuevo bajo anestesia general e intubación orotraqueal se realiza reapertura del abordaje coronal, legrado de la mucosa del seno frontal y obturación del mismo con colgajo libre remanente de epiplon y colocación de implante preformado de acrílico (Fig. 9) (Synthes®) fijado con 4 placas 1,3 mm (Synthes®). Finalmente el paciente es dado de alta con CT de control realizado en su centro de referencia con el excelente resultado estético y funcional que se muestra 6 meses después de realizar la cranioplastia (Figs. 10 y 11).
Discusión
Planteamos un caso de un paciente complicado no sólo técnicamente sino también en la actitud terapéutica a tomar que plantea un reto por varios motivos. En primer lugar el intentar solucionar una secuela de una resección neuroquirúrgica sin conocer datos de la exéresis tumoral ni aportar ningún informe ni de la cirugía, ni de anatomía patológica ni de la radioterapia recibida. En segundo lugar se plantea la necesidad de aislar el lecho quirúrgico (fosa craneal anterior) de un ambiente contaminado, como son los senos paranasales. En tercer lugar hay que cerrar el defecto dural derivado de la resección tumoral y en cuarto y último lugar es necesario reconstruir el defecto óseo frontal. Sin olvidar finalmente que se trata de un paciente radiado, hecho que empeora considerablemente la vascularización local y que limita nuestras posibilidades reconstructivas.
La cirugía de base de cráneo se ha visto sometida a una revolución en las dos últimas dècadas debido al desarrollo de nuevos abordajes a éste complejo área anatómico. Los neurocirujanos, en concierto con los nuevos cirujanos de cabeza y cuello, han cambiado los parámetros de aquello considerado hasta ahora como "no resecable"1 creando cada vez defectos mayores en la base craneal. Sin embargo dicha revolución no hubiese sido posible sin nuevas técnicas de reconstrucción. Los recientes avances en radiología, técnica microquirúrgica y de reconstrucción han permitido que la cirugía craneofacial se haya convertido en el tratamiento de elección de la patología tumoral en la fosa craneal anterior.2-6
Cualquier defecto en la base craneal que ponga en comunicación el contenido intracraneal con la cavidad nasal o senos paranasales tiene que ser reconstruido. Clásicamente dicho defecto era cubierto con capas de tejido no vascularizado (fascia lata o materiales sintéticos ). Esto puede producir necrosis, fístula de LCR e infección que puede tener fatales consecuencias en forma de meningitis o absceso cerebral. El uso de tejidos vascularizados como colgajos locales o libres vascularizados ha disminuido considerablemente la morbilidad y mortalidad asociadas.7
Los colgajos locales, como la galeapericráneo o el músculo temporal, pueden ser utilizados con éxito en los defectos craneales de pequeño tamaño en la fosa craneal anterior. Defectos moderados y mayores requieren el uso de un colgajo libre que además de aportar una vascularización fiable y un mayor volumen, tiene una adaptabilidad y flexibilidad mayor que permite obliterar mejor el espacio muerto y conseguir un mejor resultado estético. Ante un paciente radiado previamente, es imperativo el uso de un colgajo libre debido al estado deficiente de la vascularización local.
La cirugía de la base craneal requiere el esfuerzo de un equipo multidisciplinar. Tras la resección es fundamental aislar adecuadamente el Sistema Nervioso Central. Dicho aislamiento comienza por la duramadre. Si existe un desgarro dural debe ser suturado si es posible, si no lo es o existe un defecto dural secundario a la resección debe ser reparado con un injerto de fascia lata del propio paciente o parches heterólogos. A continuación el tejido dural debe ser cubierto con una capa de tejido bien vascularizado. Una reparación con éxito del defecto dural no parece depender necesariamente del material que se utilice sino de que aporte de verdad un sellado eficaz (watertight-seal).8,9 La elección del colgajo libre a utilizar depende de varios factores como son el tamaño del defecto, la longitud del pedículo que se necesita, y las preferencias del cirujano. Los vasos receptores locales de elección suelen ser ramas de la arteria carótida externa (especialmente la arteria occipital) y la venas yugular externa, yugular interna o alguna de sus ramas. La monitorización post-quirúrgica del colgajo puede hacerse por eco-doppler o con un tutor que comunique con el exterior. El colgajo libre de elección para muchos continúa siendo el recto anterior del abdomen debido a su alta vascularización y el gran volumen que aporta y la longitud y tamaño de su pedículo, aunque se han descrito innumerables colgajos. En nuestro paciente nos decidimos por un colgajo libre de epiplon que tiene una mayor adaptabilidad y nos permite obliterar mejor el espacio muerto. De ese modo evitaremos la formación de colecciones que pueden sobreinfectarse y hacer fracasar nuestro plan terapéutico. Independientemente del colgajo libre utilizado hay una menor tasa de complicaciones que cuando se utilizan colgajos locales y ello se traduce en una mejor cicatrización, menor tasa de fístula de LCR y de meningitis y una menor estancia hospitalaria. 10
Una vez hemos conseguido separar adecuadamente la fosa craneal anterior de los senos paranasales debemos reconstruir el defecto óseo frontal por debajo del colgajo libre que utilicemos.
Las indicaciones fundamentales para realizar una cranioplatia son la protección frente al trauma y mejorar el aspecto estético.11 Actualmente defectos mayores de 16 cm2 deben ser reconstruidos, defectos menores a nivel fronto- orbitario pueden ser reconstruidos con una finalidad estética. A nivel frontal, el problema no lo plantea la indicación de la reconstrucción sino el material a utilizar. En un CT realizado antes de la cranioplastia puede apreciarse el defecto frontal que presenta nuestro paciente (Fig. 12).
Desde la antigüedad muchos han sido los materiales a utilizar y hasta hoy en día no existe ninguno que sea de clara elección. El hueso antólogo tiene varios inconvenientes que limitan su uso como son la morbilidad de la zona donante, la limitada cantidad de hueso y que se ve sometido a una reabsorción variable. A pesar de ello para muchos autores continúa siendo el biomaterial de elección para defectos de poco tamaño. El Metilmetacrilato es una buena opción por su relativo bajo coste, gran disponibilidad y alta resistencia a la infección (Manson et al. publicaron que era el biomaterial de elección en adultos con partes blandas de buena calidad sin historia previa de infección)12 aunque no deja de ser una sustancia inerte que no se adapta al hueso cambiante (lo cual limita su uso en población pediátrica) ni promueve regeneración ósea alguna. Hard Tissue Replacement (HTR) tiene la gran ventaja de que puede ser fabricado a medida del paciente por medio de modelos estereolitográficos por ordenador. Además su porosidad y sus características hidrofílicas promueven crecimiento vascular en él. Pastas de Hidroxiapatita pueden ser utilizadas, tanto en forma de cerámicas (no reabsorbibles) como en forma de cemento (que sí que son reabsorbibles). Aunque suponen un excelente biomaterial no existe evidencia histológica hasta el momento de que en pastas de cemento de hidroxiapatita se produzca crecimiento óseo significativo (sólo se ha descrito invasión ósea en la periferia del implante)13 o reabsorción en humanos en un periodo de seguimiento de hasta tres años. Tampoco se ha visto crecimiento óseo significativo en estudios en animales tas tres años de seguimiento.14 Pueden ser utilizadas tanto en adultos como en niños y su punto débil es su fragilidad que las predisponen a infección por fracturarse ante mínimos traumatismos. Es ésta fragilidad lo que ha llevado a combinarlas con mallas de titanio, fijadas con osteosíntesis al hueso circundante, que actúen como andamiaje por debajo de las mismas en defectos craneales de espesor total.
Las características ideales de éste material incluirían: biocompatibilidad, ausencia de respuesta inflamatoria o a cuerpo extraño, radiolúcido, fácilmente moldeable, no reabsorbible, osteoactivo y fácilmente disponible.
Como ocurre en nuestro paciente, en muchas ocasiones el defecto craneal es consecuencia de una resección tumoral. Se podría pensar que es mejor para el paciente una cranioplastia en el primer acto quirúrgico sin embargo esto no es así por varios motivos. En la resección pueden darse circunstancias que desaconsejen una reconstrucción primaria como defectos durales y comunicación con cavidades contaminadas como los senos paranasales. Introducir un cuerpo extraño eleva considerablemente el riesgo de sufrir una infección local que además de poner en riesgo la vida del paciente puede estropear cualquier procedimiento reconstructivo previo en la zona y obliga a retirar el implante. Además el cierre del defecto frontal puede contribuir junto con el edema cerebral del post-operatorio inmediato a una elevación de la presión intracraneal. Infecciones locales son una contraindicación para realizar una cranioplastia. Se recomienda esperar como mínimo menos seis meses y después de un tratamiento antibiótico adecuado, para asegurar la cranioplastia. Del mismo modo se recomienda esperar al menos seis meses para reabrir un abordaje coronal.
Por lo mencionado anteriormente, en nuestro paciente se esperó ocho meses después de la colocación del colgajo libre de epiplon para colocar un implante preformado de acrílico fabricado a medida del paciente con modelos estereolitográficos por ordenador y fijado con microplacas de titanio.
Bibliografía
1. Theodoros Teknos N, Jonathan Smith C, Terry Day A, James Netterville L, Brian Burkey B. Microvascular Free Tissue Transfer in Reconstructing Skull Base Defects: Lessons Learned. Laryngoscope 2002;112:1871-6. [ Links ]
2. Torres A, Acebes JJ, López L, Marnov A, Viñals J, Serra JM, Maños M, Monner A. Complicaciones de la cirugía craneofacial en tumores de base craneal anterior. Neurocirugía 2005;16:492-8. [ Links ]
3. Días FL, Sa GM, Kligernan J, et al. Complication of craneofacial resection. Head Neck 1999;21:12-20. [ Links ]
4. Gutierrez Díaz R, Sánchez Aniceto G, Romance A, Lobato R, Cabrera A, Alday R. Resección craneofacial anterior. Neurocirugía 1999;10:277-83. [ Links ]
5. Nelly MBH, Waterhouse D, Slade E, et al. A 5-year review of 71 consecutive anterior skull base tumors. Br J Plastic Surg 1999;53:184-90. [ Links ]
6. Patel SG, Singh B, Polluri A, Bridger PG, et al. Craniofacial surgery for malignant skull base tumors. Report of an international Collaborative study. Cancer 2003;98:1179-87. [ Links ]
7. Georgantopoulou A, Hodkingson PD, Gerber CJ. Cranial-base surgery: a reconstructive algorithm. Br J Plastic Surg 2003;56:10-3. [ Links ]
8. West CA, Towns G, Bachelor AG, Liddington MI. Reconstruction of skull base and dura using rectus abominis muscle combined with a vascularised fascial perforator flap. Journal of Plastic, Reconstructive and Aesthetic Surgery 2006;59:631-5. [ Links ]
9. Chang DW, Langstein HN, Gupta A, De monte F, Do KA, Wang X, Robb G. Reconstructive Management of Cranial Base Defects after Tumor Ablation. Plast Reconstr Surg 2001;107:1346-55. [ Links ]
10. Neligan PC, Mulholland S, Irish J, y cols. Flap selection in cranial base reconstruction. Plast Reconstr Surg 1996;98:1159-08. [ Links ]
11. Gladstone HB, McDermott MW, FRCSC, Cooke DD. Implants For Cranioplasty. Otolaryngologic Clinics of North América April 1995;28:2:381-400. [ Links ]
12. Manson PN, Crawley WA, Hoopes JE. Frontal Cranioplasty: Risk factors and choice of cranial vault reconstruction. Plast Reconstr Surg 1986;77:888-904. [ Links ]
13. Gosain AK. Biomaterials for reconstruction of the cranial vault. Plast Reconstr Surg 2005;116:663-6. [ Links ]
14. Gosain AK, Riordan PA, Song L, Amarante MT, Kalantarian B, Nagy PG, Wilson CR, Toth JM, McIntyre BL. A 1-year study of osteoinduction in hydroxyapatite-derived biomaterials in an adult sheep model: part II. Bioengineering implants to optimize bone replacement in reconstruction of cranial defects. Plast Reconstr Surg 2004;114:1155-63;discussion 1164-5. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Ignacio Heras Rincón
Servicio de Cirugía Oral y Maxilofacial.
Hospital Universitario 12 de octubre.
Avenida de Córdoba s/n, 28041 Madrid, España
Email: nachohr1@hotmail.com











 texto en
texto en