Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Española de Cirugía Oral y Maxilofacial
versão On-line ISSN 2173-9161versão impressa ISSN 1130-0558
Rev Esp Cirug Oral y Maxilofac vol.30 no.2 Madrid Mar./Abr. 2008
Histiocitoma fibroso maligno de orofaringe. Resección y reconstrucción con colgajo fasciocutáneo radial
Malignant oropharyngeal fibrous histiocytoma. Resection and radial reconstruction with fasciocutaneous flap
L. García Monleón1, J. Acero Sanz2, Á. del Amo Fernández de Velasco1, S. Ochandiano Caicoya2, J. López de Atalaya2, C. Navarro Vila3.
1 Médico Residente.
2 Médico Adjunto.
3 Jefe de Servicio.
Servicio de Cirugía Oral y Maxilofacial. Hospital General Universitario Gregorio Marañón. Madrid, España
Dirección para correspondencia
RESUMEN
El histiocitoma fibroso maligno se reconoce como el sarcoma de tejidos blandos más frecuente de la edad adulta, aunque su localización en faringe no es usual habiéndose recogido en la literatura científica tan solo 6 casos en esta localización. Presentamos el caso de un paciente con un histiocitoma fibroso maligno en orofaringe de gran tamaño, al que se le realizó una resección con amplios márgenes y la reconstrucción del defecto con un colgajo fasciocutáneo radial. Discutiremos a raíz del caso la epidemiología, manifestaciones clínicas, incidencia de metástasis, histopatología, factores pronósticos y tratamiento de este tipo de tumores.
Palabras clave: Histiocitoma fibroso maligno; Maxilofacial; Cabeza y cuello; Orofaringe; Reconstrucción; Colgajo radial.
ABSTRACT
Malignant fibrous histiocytoma is recognized as the most common soft-tissue sarcoma in adults, although its location in the pharynx is unusual. Only 6 cases of the pharynx have been reported in the scientific literature. We report the case of a patient with a large malignant fibrous histiocytoma in the oropharynx. The tumor was resected with generous margins and the defect was reconstructed with a radial fasciocutaneous flap. The epidemiology, clinical manifestations, incidence of metastases, histopathology, prognostic factors and treatment of malignant fibrous histiocytoma are discussed in relation to this case.
Key words: Malignant fibrous histiocytoma; Maxillofacial; Head and neck; Oropharynx; Reconstruction; Radial flap.
Introducción
El fibrohistiocitoma maligno fue descrito por OBrien y Stout en 1964,1 y desde entonces es reconocido como el sarcoma de tejidos blandos más frecuente en la edad adulta. Es una neoplasia definida histopatológicamente por una proliferación mesenquimal de células histiocitarias y de fibroblastos que siguen varios patrones de crecimiento. El HFM debe ser diferenciado de otras neoplasias que también exhiben un importante pleomorfismo como el liposarcoma pleomórfico, rabdomiosarcoma pleomórfico, carcinoma pleomórfico y leiomiosarcoma.2,3
Se localiza más frecuentemente en las extremidades, retroperitoneo y cavidad abdominal, siendo su localización en cabeza y cuello tan solo el 1-7% de los casos.2,4-6 Raramente se localiza en los tejidos blandos de la cavidad oral y en muy pocos casos se observa su localización en orofaringe, como en el caso que nos ocupa. Presentamos, debido a la rareza de su localización e implicaciones de la misma, un nuevo caso de histiocitoma fibroso maligno afectando el paladar blando y pared lateral del orofaringe. Revisamos la literatura a propósito de este caso.
Caso clínico
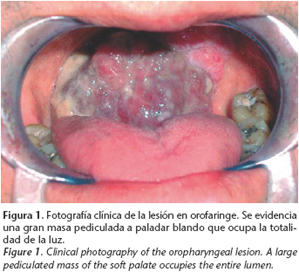
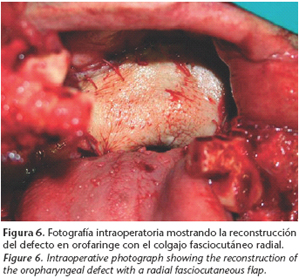
Presentamos el caso de un varón de 54 años que acude a nuestra consulta por disfagia, dislalia y sensación de cuerpo extraño en cavidad oral de 2 meses de evolución. El paciente era fumador habitual. A la exploración intraoral se observaba una gran masa exofítica de 7 cm de diámetro máximo, carnosa, que parecía pediculada a paladar blando y ocupaba la luz de la orofaringe (Fig. 1). No se palpaban adenopatías cervicales. La TC cervicofacial objetivaba una lesión de partes blandas de gran tamaño y bordes bien definidos que parecía originarse en el paladar blando, creciendo exofíticamente y ocupando la luz de la orofaringe (Fig. 2). No se objetivaron adenopatías de características patológicas. El resto de la exploración física y la TC toracoabdominal no objetivaron otras lesiones a distancia. Se realizó una biopsia incisional que reveló una neoplasia fusocelular constituida por una población de células de hábito fibrohistiocitario con un patrón de crecimiento tipo estoriforme, compatible con fibrohistiocitoma maligno (Fig. 3). Dada la obstrucción rápidamente progresiva de la vía aérea superior, el paciente requirió la realización de una traqueostomía previamente a la cirugía definitiva. El paciente fue sometido a cirugía realizándose un abordaje mediante labiomandibulotomía media, exéresis de la lesión con márgenes de seguridad -lo que supuso la resección de la totalidad del paladar blando, pilares amigdalinos y la pared de orofaringe izquierda- y la reconstrucción inmediata con un colgajo fasciocutáneo radial del lado izquierdo (Figs. 4-7). El estudio anatomopatológico de la pieza reveló una neoplasia fusocelular constituida por una población de células de hábito fibrohistiocitario, de núcleos ovalados, pleomórficos y citoplasmas fusiformes, que alternaba con otras de hábito epitelioide, dispuestas formando haces entrecruzados y adoptando en zonas un patrón de crecimiento tipo estoriforme, confirmando así el diagnóstico inicial. Se identificaron frecuentes figuras de mitosis, algunas de ellas atípicas. Las tinciones para vimentina y proteina CD68 fueron positivas. La neoplasia respetaba ampliamente los márgenes de resección quirúrgicos. Dado el gran tamaño de la lesión, fue administrado tratamiento radioterápico complementario. El paciente ha permanecido libre de recidiva local o a distancia hasta el momento actual y presenta un excelente resultado estético y funcional, con deglución y fonación normales.
Discusión
A raíz de la descripción por OBrien y Stout del histiocitoma fibroso maligno (HFM) como un tipo histológico independiente de los sarcomas de tejidos blandos, se han publicado grandes series de HFM y se acepta hoy como el sarcoma de tejidos blandos más frecuente de la edad adulta, 2,4-9 siendo también uno de los más frecuentes en el territorio maxilofacial.10, 11
El fibrohistiocitoma maligno puede presentarse a cualquier edad, aunque es realmente infrecuente antes de los cuarenta años y extremadamente raro en la infancia. Se observa un pico de mayor incidencia en la séptima década y es más frecuente en hombres que en mujeres.2,5-7 Puede localizarse en tejidos blandos y de forma primaria intraósea. Sus localizaciones más frecuentes son la extremidades (60%) y el retroperitoneo o cavidad abdominal (20%), siendo menos frecuente en el área maxilofacial.2,4-7,12,13 El tracto nasosinusal es su localización craneofacial más común, siendo otras el esqueleto facial, la laringe, tejidos blandos del cuello y las glándulas salivares mayores.3,14 Si su localización en cavidad oral es poco frecuente,12,14-18 menos aún lo es en la faringe, habiéndose recogido en la literatura científica tan solo 6 casos en esta localización.19-24
Macroscópicamente el tumor tiene una apariencia multilobulada, carnosa, grisácea y aunque parece circunscrito, en la mayoría de los casos se encuentran extensiones microscópicas al tejido adyacente. 2 Microscópicamente, las células neoplásicas adoptan morfologías muy variables, en ocasiones similares a histiocitos y en otras la apariencia es de fibroblastos. El patrón histológico también es altamente variable de unas zonas a otras y entre distintos tumores, habiéndose clasificado en función de su apariencia y la población celular predominante en distintos subtipos: estoriformepleomorfo, mixoide, de células gigantes, inflamatorio y angiomatoide. La forma pleomórfica-estoriforme es la más frecuente y se caracteriza por contener grupos de células neoplásicas fusocelulares en un patrón estoriforme alrededor de vasos, además de células redondeadas similares a histiocitos, frecuentemente exhibiendo cierto grado de pleomorfismo (Fig.3). Este tipo tiende a ser pobremente diferenciado, más frecuentemente grado 2 ó 3. En la variante mixoide se observan células mesenquimales en un estroma mixoide rico en mucopolisacáridos, también existe cierto grado de pleomorfismo celular, pero en mucho menor grado que en el subtipo anterior; tiene menos tendencia a metastatizar a distancia, observándose un mejor pronóstico. En el subtipo de células gigantes lo peculiar es la presencia de una mezcla de células multinucleadas malignas y benignas y en particular de células gigantes de tipo osteoclástico, asociadas con células estromales que asemejan histiocitos mononucleares con grados variables de anaplasia. La variante inflamatoria se caracteriza por la presencia de abundantes neutrófilos, células plasmáticas, linfocitos y, en ocasiones, células espumosas, en un estroma pobremente colagenizado. El tipo angiomatoide predomina en sujetos menores de 40 años, suele ser de bajo grado y en él se observan áreas de hemorragia con depósito de hemosiderina junto con una población fibrohistiocítica pleomórfica y elevada actividad mitótica.2,6,7 Nuestro caso corresponde a la variante estoriforme.
Como para otros tipos de sarcomas, se han observado casos de fibrohistiocitomas malignos radioinducidos tras un periodo de latencia variable entre 5 y 45 años.6,25-28 En 1999 Patel y cols.,25 estudiaron una serie de 10 pacientes con sarcomas de cabeza y cuello radioinducidos, observando que el HFM era el subtipo más frecuente (4/10). En este mismo artículo, realizan una revisión de los sarcomas de cabeza y cuello radioinducidos publicados en la literatura científica hasta ese momento, encontrándose que el diagnóstico más frecuente también fue de HFM (36%). Pero en lo que respecta a nuestro caso, no se identificó este antecedente.
Este tumor habitualmente se presenta como una masa indolora de crecimiento progresivo, habitualmente de menos de seis meses de evolución. Cuando la tumoración se localiza en cavidades como el abdomen o retroperitoneo, el paciente puede presentar sintomatología de distensión abdominal progresiva, como progresivo aumento del perímetro abdominal, aparición de hernias y varicocele. En los casos intraabdominales y retroperitoneales también se puede observar la presentación conjunta de un síndrome constitucional, aunque en el resto de localizaciones no es una clínica habitual.2,7 La peculiar localización del caso que presentamos, condicionó una rápida y profusiva obstrucción de la vía aérea, lo que determinó la realización de una traqueostomía previa a la cirugía definitiva.
La extensión metastásica a distancia no es un fenómeno infrecuente, habiéndose cifrado en torno al 40% de los casos y siendo su localización más típica la pulmonar (80-90%), seguida de la ósea y hepática. En función de las series, se encontraron extensión a ganglios linfáticos regionales en un 10-32%.2,3,5,6,29 Respecto al riesgo de metástasis, Le Doussal y cols.,6 encontraron un aumento de éste en pacientes con grado histológico 3 y un tamaño tumoral mayor de 8 cm. Otros autores hallaron además la profundidad del tumor correlacionada directamente con el porcentaje de metástasis, mientras que el porcentaje de células inflamatorias presentes en la lesión parecía tener un efecto protector frente a éstas.2 En nuestro caso el estudio de extensión no mostró metástasis regionales ni a distancia y dado que en general no se considera un tumor con alta linfofilia no se consideró indicada la realización de un vaciamiento cervical profiláctico.
La recurrencia local tiene un gran impacto en la supervivencia. Estudios previos han observado un porcentaje de recidiva del HFM variable entre el 26 y el 51%.2,5-7,14,29 En un reciente estudio, Sabesan y cols.,3 encontraron que el porcentaje de recidivas se hallaba directamente relacionado con la amplitud de la resección realizada, siendo para HFM de cabeza y cuello, de un 86% en el caso de resecciones marginales (con menos de 3 cm de margen quirúrgico) frente a un 27% de aquellos donde se había realizado una resección radical. Este estudio apoya los resultados obtenidos por otros autores para HFM en otras localizaciones, como Shinozaki y cols. que observaron una recurrencia local del 100%, 72%, 17% y 0% para resecciones intralesionales, marginales, amplias o amputación, respectivamente.30
Existen múltiples factores que parecen influir en la evolución del fibrohistiocitoma maligno. En un estudio sobre 227 casos de HFM, Pezzi y cols.,5 encontraron que el tamaño de la lesión y su grado histológico fueron los factores pronósticos más importantes. En este trabajo se observó una supervivencia media a los 5 años para tumores menores de 5 cm de diámetro y de grado intermedio de malignidad del 93%, mientras que para aquellos mayores de 10 cm y de alto grado de malignidad, tan solo fue del 41%. En su estudio sobre factores pronósticos para pacientes con HFM localizado, Le Doussal y cols.6 encontraron que la supervivencia específica de la enfermedad se hallaba relacionada inversamente y de forma significativa con el estadio, la presencia de enfermedad residual, la profundidad del tumor y la histología no mixoide. También observaron que la radioterapia postoperatoria y los márgenes quirúrgicos libres de infiltración tumoral parecían aumentar el control local de la enfermedad. Sin embargo, otros autores como Kearney y cols.,7 en un estudio sobre 167 HFM, coinciden en que la profundidad del tumor y su localización parecen afectar a la supervivencia, pero no consideran el tamaño tumoral ni el subtipo histológico como factores de riesgo independientes. También Roser y cols.9 encontraron factores como la profundidad del tumor, el grado histológico, el tamaño de la lesión y los subtipos estoriforme-pleomórfico indicativos de peor pronóstico.
Dentro de los sarcomas de cabeza y cuello, el HFM presenta una supervivencia mayor que otros tumores de este mismo grupo, siendo ésta a los 5 años de 50 a 74% en función de las series.3,5,6,9,29,31 Wanebo y cols., en un estudio sobre 214 sarcomas de cabeza y cuello, encontraron que la supervivencia media del HFM a los 5 años era de un 72%, por encima de la supervivencia para otros tipos de sarcomas más agresivos como el angiosarcoma, osteosarcoma y rabdomiosarcoma.31
En cuanto al pronóstico de los HFM en cabeza y cuello comparado con aquellos localizados en extremidades y tronco, resulta interesante el estudio de Sabesan y cols., del 2004 sobre 131 pacientes con HFM, 54 en cabeza y cuello y 77 en otras localizaciones.3 Estos autores observaron una mayor supervivencia a los 5 años para aquellos HFM localizados en extremidades y tronco (77% de pacientes vivos a los 5 años y 65% libres de enfermedad, frente a un 48% y 41% respectivamente para aquellos HFM de cabeza y cuello). Por otra parte esto podría explicarse por dos factores: el mayor porcentaje de tumores de alto grado en cabeza y cuello observado en esta serie (78% frente al 55%) y el mayor porcentaje de resecciones amplias y radicales realizadas en extremidades y tronco.
El tratamiento de elección es la resección con amplios márgenes, ya que en estos tumores se observa una elevada tendencia a la recidiva local, que parece directamente relacionada con la extensión de la resección,3, 30 y la presencia o ausencia de enfermedad residual.6 Dado que no se considera un tumor con gran linfofilia, el vaciamiento cervical profiláctico no está indicado, realizándose disección cervical solo en caso de presencia de adenopatías metastásicas clínica o radiológicamente positivas. Aunque el papel de la radioterapia no ha sido bien establecido, existen estudios como el de Hsu y cols.,29 sobre 76 pacientes con HFM localizado, donde analizan distintos factores pronósticos (edad, sexo, localización tumoral, estadio, tamaño, profundidad, márgenes quirúrgicos positivos, radioterapia y dosis administrada), encontrando que la administración de radioterapia postoperatoria era el único factor que mejoraba el control local de la enfermedad, aunque sin aumentar el tiempo medio de supervivencia (control local a los 5 años de 85% para pacientes que habían recibido radioterapia, frente al 44% de los que no la habían recibido). El papel de la quimioterapia está bien establecido para algunos tipos de sarcomas de partes blandas como el rabdomiosarcoma, osteosarcoma y sarcoma de Ewing, pero permanece controvertido para otro tipo de sarcomas del adulto, como en el caso del HFM. En cuanto a este punto, cabe destacar un metaanálisis publicado por la SMAC (Sarcoma Meta-analysis Collaboration) basado en datos individuales de 1568 pacientes tratados con regímenes quimioterápicos basados en la doxorrubicina.32 Encontraron que el tratamiento quimioterápico parecía influir significativamente en las recidivas locales y a distancia, así como aumentar la supervivencia libre de enfermedad en pacientes con sarcomas localizados de tejidos blandos. Por lo tanto hasta ahora no existe consenso en cuanto a la indicación de administrar tratamiento complementario a la cirugía en el HFM. Serían necesarios estudios prospectivos, aleatorizados y randomizados, pero dada la baja incidencia de este tipo de tumores, parecen muy difíciles de llevar a cabo.
Conclusiones
El fibrohistiocitoma maligno de cabeza y cuello es un tumor agresivo, donde una resección inadecuada se relaciona con un mayor porcentaje de recidivas locales y un peor pronóstico. Por ello, el tratamiento primario de este tipo de tumores debería ser la resección, tan amplia como fuera posible. En caso de aquellos tumores en que su localización o gran tamaño no permitan unos adecuados márgenes, la radioterapia postoperatoria podría permitir un mayor control local de la enfermedad.
El colgajo fasciocutáneo radial ofrece excelentes resultados en la reconstrucción de grandes defectos de la orofaringe, incluyendo el paladar blando.
Bibliografía
1. OBrien JE, Stout AP. Malignant fibrous xantomas. Cancer 1964;17:1445-555. [ Links ]
2. Weiss SW, Enzinger FM. Malignant fibrous histiocytoma. An analysis of 200 cases. Cancer 1978;41:2250-66. [ Links ]
3. Sabesan T, Xuexi W. Malignant fibrous histiocytoma: outcome of tumours in the head and neck compared with those in the trunk and extremities. Br J Oral Maxillofac Surg 2006;44:209-12. [ Links ]
4. Gibbs JF, Huang PP, Lee RJ, y cols. Malignant fibrous histiocytoma: an institucional review. Cancer Invest 2001;19:23-7. [ Links ]
5. Pezzi ME, Rawling MS, Esgro JJ, y cols. Prognostic factors in 227 patients with malignant fibrous histiocytoma. Cancer 1992;69:2098. [ Links ]
6. Le Doussal V, Coindre J-M, Leroux A, y cols: Prognostic factors for patients with localized primary malignant fibrous histiocytoma. A multicenter study of 216 patients with multivariate analysis. Cancer 1996;77:1823. [ Links ]
7. Kearney MM, Soule EH, Ivins JC. Malignant fibrous histiocytoma. A retrospective study of 167 cases. Cancer 1980;45:167. [ Links ]
8. Markhede G, Angervall L, Sterner B. A multivariate analysis of the prognosis after surgical treatment of malignant soft tissue tumours. Cancer 1982;49:1721-33. [ Links ]
9. Rööser B, Willen H, Gustafson P, y cols. Malignant fibrous histiocytoma of soft tissues. A population-based epidemiologic and prognostic study of 137 patients. Cancer 1991;67:499-505. [ Links ]
10. Huber GF, Matthews TW, Dort JC. Soft-tissue sarcomas of the head and neck: a retrospective analysis of the Alberta experience 1974 to 1999. Laryngoscope 2006;116:780-5. [ Links ]
11. Sturgis EM, Potter BO. Sarcomas of the head and neck region. Curr Opin Oncol 2003;15:239-52. [ Links ]
12. Rapidis AD, Andressakis DD, Lagogiannis GA, Douzinas EE. Malignant fibrous histiocytoma of the tongue: review of the literature and report of a case. J Oral Maxillofac Surg 2005;63:546-50. [ Links ]
13. Kanazawa H, Watanabe T, Kasamatsu A. Primary malignant fibrous histiocytoma of the mandible: review of literature and report of a case. J Oral Maxillofac Surg 2003;61:1224-7. [ Links ]
14. Barnes L, Kanbour A. Malignant fibrous histiocytoma of the head and neck: a report of 12 cases. Arch Otolaryngol Head Surg Neck 1988;114:1149-56. [ Links ]
15. Bras J, Batsakis JG, Luna MA. Malignant fibrous histiocytoma of the oral tissues. Oral Surg 1987;64;57. [ Links ]
16. Chen YK, Lin LM, Lin CC. Malignant fibrous histiocytoma of the tongue. J Laryngol Otol 2001;115:763-5. [ Links ]
17. McMillan MD, Smillie AC, Ferguson JW. Malignant fibrous histiocytoma of the tongue: report of a case and ultraestructural observations. J Oral Pathol 1986;15:255. [ Links ]
18. Manni JJ, Van Den Broek P, Van Haelst UJ, y cols. Malignant fibrous histiocytoma of the tongue. J Maxillofac Surg 1986;14:103. [ Links ]
19. Kinishi M, Amatsu M. Malignant fibrous histiocytoma of the hypopharynx ORL. J Otorhinolaryngol Relat Spec 1990;52:47-50. [ Links ]
20. Murakami M, Akiyama Y, Tei G, Shinomiya T. Malignant Fibrous Histiocytoma in the hypopharynx; A case report. Acta Otalgica (Kyoto) 1995;88:623-8. [ Links ]
21. Bonnin P, Lallemant JG. Malignant histiocytofibroma. A propos of 3 cases of cervicofacial localization. Ann Otolaryngol Chir Cervicofac 1995;112:336-44. [ Links ]
22. Mevio E, Sbrocca M, Malignant fibrous histiocytoma of the pharynx. Acta Otorhinolaryngol Belg 2003;57:79-81. [ Links ]
23. Nakamizo M, Yokoshima K, Malignant fibrous histiocytoma of the hypopharynx: a case report in a young adult. J Nippon Med Sch 2004;71:301-5. [ Links ]
24. Lakhani P, Rubesin SE, Zhang PJ. Malignant fibrous histiocytoma of the pharynx. AJR Am J Roentgenol 2005;184(3 Suppl):S12-3. [ Links ]
25. Patel SG, See AC, Williamson PA, Archer DJ, Evans PH. Radiation induced sarcoma of the head and neck. Head Neck 1999;21:346-54. [ Links ]
26. Wiesmilleer K, Barth TF. Early radiation-induced malignant fibrous histiocytoma of the oral cavity. J Laryngol Otol 2003;117:224-6. [ Links ]
27. Haberal I, Samim E. Radiation-induced malignant fibrous histiocytoma of the neck in a patient with laryngeal carcinoma. Am J Otolaryngol 2001;22:146-9. [ Links ]
28. Guney E, Yigitbasi OG. Postirradiation malignant fibrous histiocytoma of the larynx: a case report. Am J Otolaryngol 2002;23:293-6. [ Links ]
29. Hsu HC, Huang EY, Wang CJ. Treatment results and prognostic factors in patients with malignant fibrous histiocytoma. Acta Oncol 2004;43:530-5. [ Links ]
30. Shinozaki T, Kato K, Watanabe H, Yanagawa T, Ahmed AR, Takagishi K. Discriminant analysis of prognostic factors for malignant fibrous histiocytoma in soft tissue. J Orthop Sci 2001;6:339-42. [ Links ]
31. Wanebo HJ, Koness RJ. Head and neck sarcoma: report of the head and neck sarcoma registry. Society of Head and Neck Surgeons Committee on Research. Head neck 1992;14:1-7. [ Links ]
32. Sarcoma Meta-analysis Collaboration (SMAC) Meta-analysis Group. Adjunvant chemotherapy for localized respectable soft tissue sarcoma in adults. Cochrane Database Syst Rev 2000;4:CD001419. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Laura García Monleón
Calle Antonio Zapata, nº 14, 2º B
28002 Madrid, España
Email: lauragmonleon@gmail.com
Recibido: 29.11.06
Aceptado: 14.01.08











 texto em
texto em