Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Española de Cirugía Oral y Maxilofacial
versão On-line ISSN 2173-9161versão impressa ISSN 1130-0558
Rev Esp Cirug Oral y Maxilofac vol.31 no.3 Madrid Mai./Jun. 2009
La ciclooxigenasa-2 (COX-2) y el factor de crecimiento epidérmico (EFG) en lesiones epiteliales orales premalignas
Cyclooxygenase-2 (COX-2) and epidermal growth factor (EGF) in oral premalignant epithelial lesions
S. Díaz Prado1, A. Gallego Guadalupe2, J.L. López-Cedrún3, J. Ferreras Granado4, L. Antón Aparicio1,5
1 Dra. en Biología. Departamento de Medicina. Universidad de La Coruña. La Coruña. INIBIC.
2 Unidad de Investigación. Estudiante de Biología.
3 Servicio Cirugía Oral y Maxilofacial. Jefe de Servicio, Dr. en Medicina.
4 Servicio Cirugía Oral y Maxilofacial. Médico Especialista, Licenciado en Medicina.
5 Departamento de Medicina. Universidad de La Coruña. La Coruña, España. Servicio Oncología Médica. Jefe de Servicio, Dr. en Medicina. C.H.U. A Coruña. La Coruña, España.
Dirección para correspondencia
RESUMEN
Las lesiones premalignas orales incluyen eritroplasias (manchas rojas) y leucoplasias (manchas blancas), las cuales se desarrollan a lo largo de superficies epiteliales. Estas lesiones son considerados marcadores en la "carcinogénesis de campo" ya que pacientes con lesiones premalignas orales pueden desarrollar carcinoma de células escamosas (CCS) en el sitio de las lesiones, así como en otros lugares de tracto aerodigestivo superior. Se está haciendo un gran esfuerzo para identificar nuevos biomarcadores SEBs (surrogate endpoint biomarkers) para el carcinoma de células escamosas de cabeza y cuello. Los SEBs candidatos para el carcinoma de células escamosas invasivo en el trato aerodigestivo superior deben ser detectables con los cambios moleculares celulares y tisulares que tienen lugar durante la formación del tumor. Entre los diferentes marcadores que se han propuesto hasta la actualidad, la ciclooxigenasa- 2 (COX-2) y el receptor del factor de crecimiento epidérmico (EGFR) parecen ser los más prometedores. COX-2 se sobre expresa durante el proceso tumoral, desde hiperplasia temprana a enfermedad metastásica. EGFR también está anormalmente activado en tumores epiteliales, pues las células de casi todas estas neoplasias expresan altos niveles de este receptor, una característica asociada con un peor pronóstico clínico. En este sentido el tracto aerodigestivo superior proporciona un sistema o modelo único para el estudio de CCS y para la investigación de nuevos candidatos SEBs.
Palabras clave: Factor de crecimiento epidérmico; Ciclooxigenasa-2; Carcinoma de células escamosas de cabeza y cuello; Lesión premaligna oral; Biomarcador; Carcinogénesis de campo.
ABSTRACT
Oral premalignant lesions include leukoplakia (white patch) and erythroplakia (red patch), which develop on epithelial surfaces. These lesions are markers for field cancerization because patients with oral premalignancy can develop squamous cell carcinoma at the site of the lesion(s) and at other sites in the upper aerodigestive tract. An effort is being made to identify surrogate endpoint biomarkers (SEBs) for head and neck squamous cell carcinoma (HNSCC). Candidate SEBs for invasive squamous cell carcinoma (SCC) of the upper aerodigestive tract are detectable molecular, cellular, and tissue changes that take place during tumorigenesis. Among the markers that have been proposed to date, cyclooxygenase-2 (COX-2) and the epidermal growth factor receptor (EGFR) seem to be the most promising. COX-2 is overexpressed during tumor transformation from early hyperplasia to metastasic disease. EGFR is also abnormally activated in epithelial tumors, since cells of almost all these kinds of neoplasm express high levels of this receptor, a characteristic associated with poor clinical outcome. The upper aerodigestive tract provides a unique model for studying the development of squamous cell carcinoma and for investigating candidate SEBs.
Key words: Epidermal growth factor; Cyclooxygenase-2; Head and neck squamous cell carcinoma; Oral premalignant lesion; Biomarker; Field cancerization.
Introducción
La carcinogénesis en el tracto aerodigestivo superior es un proceso que consta de múltiples pasos. Histológicamente este proceso consiste en la transición, a lo largo del tiempo, desde epitelio normal, hiperplasia, displasia hasta CCS. Esta transición histológica consta de múltiples cambios moleculares y celulares, incluyendo cambios en la expresión de genes que codifican para receptores/factores de crecimiento. Durante las últimas décadas se ha empleado el término "carcinogénesis de campo" para describir las anomalías histológicas (Hiperplasia, Displasia y CCS in situ) detectadas en la mayoría de los epitelios normales adyacentes al CCS extirpado. Entre los diferentes SEBs, la ciclooxigenasa- 2 (COX-2) y el receptor para el factor de crecimiento epidérmico (EGFR) están interrelacionados. Existen evidencias indicadoras que la sobre expresión de COX-2 y EGFR constituyen un evento temprano en la carcinogénesis epitelial, postulándose que el aumento en los niveles de COX- 2 y EGFR en lesiones premalignas constituyen un mecanismo de "carcinogénesis de campo". Si estos biomarcadores (COX-2 y EGFR) están sobre expresados en el carcinoma de células escamosas (CCS), puede inducirse que la carcinogénesis, crecimiento y supervivencia de un subconjunto de lesiones premalignas orales pueden depender de una interferencia de los mismos actores en diferentes roles y escenarios (Tabla 1).
Lesiones premalignas de la mucosa oral
Eritroplasia
La eritroplasia es definida como una mancha roja aterciopelada que no puede ser clínica o patológicamente atribuida a ninguna enfermedad específica. Algunos investigadores consideran la eritroplasia como la primera señal de carcinoma de células escamosas asintomático de la cavidad oral. Las lesiones eritroplásicas y leucoplásicas pueden ser consideradas como un continuo, ya que ambas pueden transformarse en lesiones malignas. Una presentación esquemática de una eritroplasia/leucoplasia define los descubrimientos microscópicos que pueden ser vistos en asociación con cambios neoplásicos potenciales de la membrana mucosa oral a medida que el tejido progresa desde hiperqueratosis benigna a través de varias etapas de eritroleucoplasia. Las lesiones eritroplásicas y leucoplásicas a veces son englobadas dentro de la misma categoría como leucoplasia manchada o eritroleucoplasia manchada, ya que en muchos casos no es posible diferenciar ambos tipos de lesiones.
Leucoplasia
La leucoplasia se define como una mancha o placa blanca en la mucosa oral. La leucoplasia ha sido clasificada en varios subtipos diferentes y aproximadamente un 6% de todas las leucoplasias orales se convierten en malignas. En una evaluación de pacientes con leucoplasias sobre los que se les realizó un seguimiento de 3 años, se observó que un 31% de las lesiones desaparecieron, un 25% permanecieron sin cambios y un 30% mejoraron.
Displasia epitelial oral
La displasia epitelial es una condición premaligna caracterizada clínicamente por una alteración en el epitelio que puede provocar que la mucosa oral se vuelva roja, blanca o de otro color. Microscópicamente, la displasia se ha clasificado como leve, moderada o severa. La displasia epitelial puede llegar a ser progresiva en un cierto plazo, aunque en algunos casos, las formas suaves de displasia pueden ser reversibles.
Carcinogénesis de la mucosa oral
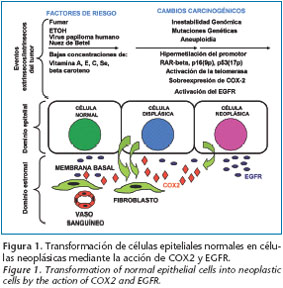
El desarrollo de CCS es un proceso que consta de múltiples pasos que implican cambios relacionados con genes específicos, eventos epigenéticos y transducción de señales dentro de la célula (Fig. 1). Las alteraciones genéticas que están presentes muy tempranamente en el curso de la carcinogénesis son mutaciones o deleciones de 3p y 9p. La activación de la telomerasa también ocurre tempranamente en la carcinogénesis.1 Las mutaciones o deleciones de 17p (implicando el gen supresor de tumores p53), 13q y 18q generalmente tienen lugar más tarde en el proceso de carcinogénesis. Un evento epigenético importante en la progresión del cáncer es el silenciamiento de regiones promotoras de genes a través de la hipermetilación, la cual se ha mostrado que afecta al gen supresor de tumor p16, DAP-quinasa y E-cadherina.2, 3 También el gen que codifica para el receptor del ácido retinoico beta (RAR-beta) está silenciado por metilación de su promotor.4 El humo del tabaco, que contiene agentes que pueden actuar como mutágenos, activa el receptor del factor de crecimiento epidérmico. A su vez esta activación del EGFR provoca un aumento de la producción de prostaglandinas, incluida la PGE2, pudiendo esta actuar como retroalimentador positivo, incrementando la transducción de la señal EGFR.5 La ciclina-D1 está generalmente sobreexpresada en cáncer de cabeza y cuello y la activación del EGF es responsable de la alta actividad de la ciclina-D1.6
Ciclooxigenasa (COX)
La COX es una enzima que limita la tasa de producción de prostaglandinas (PGs) y tromboxanos (TxB) a partir de ácido araquidónico libre. El precursor de PGs es el ácido araquidónico, un ácido graso poliinsaturado de 20 carbonos. El primer paso en la síntesis de PGs es la hidrólisis de fosfolípidos para producir araquidonato libre, una reacción catalizada por la fosfolipasa A2. El oxígeno molecular es añadido al ácido araquidónico en una reacción catalizada por la actividad ciclooxigenasa de COX. Esta reacción produce un producto inestable, PGG2, que es convertido rápidamente a PGH2 por la actividad peroxidasa de COX (Fig. 2). PGH2 es el precursor común para todos los prostanoides (p.ej. prostaglandinas y tromboxanos), en reacciones catalizadas por sintasas específicas y diferentes. La enzima es bifuncional (Fig. 2) y se presenta como dos formas distintas: la enzima COX-1 que se expresa constitutivamente y está presente en la mayoría de las células y tejidos, y la isoenzima COX- 2 que es inducible y se expresa en respuesta a citoquinas, factores de crecimiento, oncogenes, estímulos y carcinógenos del tabaco.7 A pesar de que ambas poseen actividades enzimáticas similares, COX-1 y COX-2 poseen diferentes propiedades y distintos patrones de expresión (Tabla 2). La enzima COX-1 esta constitutivamente expresada con bajos niveles en la mayoría de los tejidos y sintetiza la prostaglandina pertinente para satisfacer las funciones fisiológicas normales. Por el contrario COX-2 no suele estar presente en la mayoría de las células, pero una fuerte regulación le permite ser rápidamente expresada en respuesta a señales relacionadas con el crecimiento. Este rápido incremento en la expresión resulta en un aumento en la síntesis de prostaglandinas asociadas con la inflamación y carcinogénesis, existiendo evidencias tangibles que COX-2 está sobre expresada en células estromales extra e intratumorales y así como en neoplásicas propias del tumor. Hay varios mecanismos que explican la sobre expresión de COX-2 en estos tipos celulares: la expresión de COX-2 está generalmente regulada a nivel transcripcional y post-transcripcional, aunque también puede ser regulada por la tasa de síntesis / degradación de la proteína; el promotor de COX- 2 humano contiene múltiples sitios de unión a factores transcripcionales, incluyendo el elemento de respuesta a cAMP y sitios de unión potenciales para Myb, para factores moleculares interleucina-6 (NF-IL6) y kB (NFkb), y para factores Ets (Fig. 2). De todos estos sitios de unión, los más próximos al inicio de la transcripción son sensibles a varios estímulos. Puesto que COX-2 es una sintetasa de prostaglandinas, la consecuencia más obvia de la sobre expresión de COX-2 es el aumento en la producción de prostaglandinas. El incremento en la síntesis de PG puede contribuir a la carcinogénesis de varias formas, siendo destacable la estimulación del crecimiento celular: PGE2 y PGF2 estimulan la mitogénesis en sinergia con el factor de crecimiento epidérmico (EGF). COX-2, está sobre expresada en una variedad de condiciones premalignas y malignas, incluyendo leucoplasias orales y CCS. Niveles altos de COX-2 pueden contribuir a la carcinogénesis modulando el metabolismo xenobiótico, apoptosis, vigilancia inmune y angiogénesis. Se piensa que las PGs pueden ser importantes en la patogénesis del cáncer debido a efectos en la proliferación celular, angiogénesis, vigilancia inmune y apoptosis.8 Los niveles de COX-2 también están incrementados en la mucosa aparentemente normal adyacente a CCS.9 Existen múltiples evidencias que no sólo demuestran la sobre expresión de COX-2 en CCS sino que también sugieren la relación existente entre COX-2 y desarrollo tumoral.
Mecanismos de COX-2 relacionados con la carcinogénesis
COX-2 puede afectar a múltiples mecanismos importantes en la carcinogénesis. En general, COX-2 se sobre expresa durante el proceso tumoral, desde hiperplasia temprana a enfermedad metastásica (Fig. 3). En este sentido, se han detectado altos niveles de COX-2 en epitelio neoplásico, en células inflamatorias y vasculares intra y adyacente al tumor. Los metabolitos derivados de COX- 2 a partir de células inflamatorias de la infiltración contribuyen también al proceso carcinogénico.
Metabolismo xenobiótico
La COX-2, enzima bifuncional, posee actividad peroxidasa y ciclooxigenasa; la actividad peroxidasa cataliza la conversión de procarcinógenos a carcinógenos. Las reacciones oxidativas son catalizadas principalmente por el citocromo P-450S. Tejidos como los del tracto aerodigestivo superior generalmente poseen bajas concentraciones de P-450S y, por lo tanto, cantidades significativas de xenobioticos pueden ser oxidados a mutágenos por la actividad peroxidasa de COX-2. Además de catalizar la síntesis de mutágenos, COX-2 puede también ser inducida por procarcinógenos: por ejemplo, el benzo [a] pireno (B[a] P), un procarcinógeno del humo del tabaco, estimula la transcripción de COX- 2. En particular, la sobre expresión de COX- 2 puede condicionar un incremento en la producción de mutágenos: el malondialdehido (MDA) puede producirse por isomerización de PGH2 tanto por vía enzimática como por vía no enzimática. Además, existen otro tipo de carcinógenos adicionales que pueden formarse por oxidación de aminas aromáticas, aminas heterocíclicas y derivados dihidrodiol de hidrocarburos policíclicos. De este modo, la sobreexpresión de COX-2 puede conducir a daños en el ADN, contribuyendo de este modo al proceso de carcinogénesis.
Apoptosis
Se ha comprobado que la apoptosis o muerte celular programada disminuye durante la carcinogénesis y la sobreexpresión de COX-2 en células epiteliales conduce a un descenso de la apoptosis. Este efecto ha sido atribuido, al menos en parte, a un aumento en los niveles de la proteína anti-apoptótica Bcl-2. Posiblemente, la sobreexpresión de COX-2 prolonga la supervivencia de células anormales favoreciendo la acumulación secuencial de cambios genéticos que aumentan el riesgo de carcinogénesis.
Inflamación
La inflamación crónica es un factor de riesgo reconocido en la carcinogénesis de los epitelios. La sobreexpresión de COX-2, mediada por citoquinas, contribuye al incremento en la síntesis de PGs en tejidos inflamados, proporcionando la base para una relación causa efecto entre la inflamación crónica y la carcinogénesis por medio de una sobreexpresión de COX-2.
Angiogénesis
Cualquier aumento significativo en la masa tumoral debe ser precedido por un incremento en el suministro vascular con el fin de poder aportar los nutrientes y oxígeno al tumor. Recientemente, se ha encontrado que los niveles de COX-2 están correlacionados con la expresión de VEGF y la vascularización del tumor en CCS.10
Movilidad celular y adhesión
La invasividad promovida por COX-2 está mediada por CD44, un receptor de superficie celular para el hialuronato. La sobreexpresión de COX-2 causa la invasividad celular y también incrementó la expresión de CD44. Los cambios bioquímicos asociados con esta dinámica celular tumoral incluyen un aumento de la expresión y alteración de la metaloproteinasa-2 y disminución de la expresión de la E-cadherina.
Receptor del factor de crecimiento epidermico (EGFR)
El receptor del EGF fue el primer receptor identificado de una familia de receptores conocidos como receptores ErbB; esta familia consta de los siguientes receptores relacionados: EGFR (ErbB1/EGFR/HER1), ErbB2 (HER2/neu), Erb3 (HER3) y ErbB4 (HER4). Bajo condiciones fisiológicas, una variedad de ligandos de la familia EGFR inducen la formación de complejos homo o heterodiméricos entre los cuatros tipos de receptores ErbB, los cuales mantienen la diversificación y ampliación de la señal.11 En las células tumorales estos receptores pueden ser activados por mecanismos adicionales y la sobreexpresión del receptor en el tumor puede conducir a la dimerización del receptor independiente del ligando. En algunos tumores las formas mutantes del EGFR, que acontecen a partir de cambios génicos, provocan un descenso de la expresión constitutiva del receptor dependiente del ligando. Estos fenómenos indican que las células tumorales pueden tener mecanismos de activación del EGFR adicionales aparte de la sobreexpresión del receptor, mutaciones y producción del ligando autocrino.
Estructura, función y transducción de señal
El receptor del factor de crecimiento epidérmico (EGFR), también conocido como HER1 o erbB1 es una glicoproteína ubicua que atraviesa la membrana celular. Está compuesta por una parte extracelular (amino-terminal) de unión al ligando, una región transmembrana hidrofóbica, y una parte citoplásmica que contiene el dominio tirosina quinasa y la región carboxi-terminal con residuos de tirosina críticos y motivos reguladores del receptor. La superficie celular es el lugar donde se producen las interacciones iniciales entre ligando-receptor y receptor-receptor. La unión de un conjunto especifico de ligandos (EGF, TGFa, anfiregulina, betacelulina o epiregulina) al dominio extracelular activa la función catalítica citoplasmática promoviendo la dimerización del EGFR y la autofosforilación del receptor en residuos de tirosina.12 Estas tirosinas fosforiladas sirven como sitios de acoplamiento para un número de moléculas adaptadoras y transductoras de señales que inician múltiples rutas de señalización, resultando en una proliferación celular, diferenciación, migración, adhesión, protección contra apoptosis y transformación entre otros eventos. Las rutas de transducción de señales citoplásmicas que son activadas por el EGFR activo incluyen PLC-gamma-1, Ras-Raf-MEK-MAPKs, fosfatidilinoistol-3 quinasa (PI3K) y Akt, Src, (SAPKs, stress-activated protein kinases), PAK-JNKKJNK, y los transductores de señal y activadores de la transcripción (STATs).13 La mayor ruta de señalización de la familia ErbB es vía la ruta Ras-Raf-Map-quinasa. La activación de Ras inicia una cascada de fosforilaciones en múltiples pasos que conduce a la activación de MAPKs, ERK1 y ERK2 siendo estos reguladores de la transcripción de moléculas relacionadas con la proliferación celular, supervivencia y transformación. Otra ruta importante en la señalización de EGFR es la fosfatidilinositol 3-quinasa (PI3K) y la proteína serina/ treonina quinasa Akt.14 Akt transduce señales que desencadenan una cadena de respuestas desde proliferación y crecimiento celular hasta supervivencia y motilidad.14 Otra ruta de señalización es la vía de la proteína quinasa activada bajo condiciones de estrés, participando la proteína quinasa C y Jak /Start. La activación de estas rutas se traduce en el núcleo en diferentes programas transcripcionales que median una variedad de respuestas celulares, incluyendo división celular, supervivencia (o muerte), movilidad, invasión, adhesión y reparación celular.
Expresión basal de EGF-R y TGF-α en lesiones premalignas
Los niveles de expresión de TGF-a y EGFR son mayores en leucoplasia que en mucosa normal adyacente. Los valores de expresión de TGF-a en mucosa normal adyacente hacia leucoplasia displásica son superiores en promedio a los detectados en mucosa oral de voluntarios sin leucoplasia (Fig. 3). En contraste y determinado mediante immunohistoquímica, en pacientes con CCS la expresión de TGF-α y EGFR está significativamente elevada en CCS y en la mucosa normal adyacente en comparación con mucosa oral de pacientes sin CCS. Los mecanismos por los cuales aumenta la expresión de TGF-α y EGFR en leucoplasia y CCS no se han determinado, pero éstos pueden incluir alteraciones en controles genéticos, en líneas celulares de CCS, el incremento de los niveles en mRNA de TGF-α y EGFR induce inicialmente en un incremento en la tasa de transcripción génica y no un incremento en el número de copias del gen ni alteraciones de la estabilidad del mensajero.
EGFR en cáncer de cabeza y cuello
La evidencia de que TGFa y EGFR participan en la carcinogénesis procede de estudios de transfección y de análisis de RNA y proteínas en experimentos con líneas celulares de tumores humanos incluyendo CCS. En humanos se ha observado que los niveles de TGF-α y EGFR en CCS y en mucosa normal adyacente están elevados. El receptor para el factor de crecimiento epidérmico (EGFR) está anormalmente activado en tumores epiteliales; las células de casi todas estas neoplasias expresan altos niveles de EGFR, una característica asociada con un peor pronóstico clínico. En los tumores analizados se encuentran niveles detectables de EGFR, aunque con marcadas diferencias entre los pacientes. Algunos investigadores no han encontrado diferencias significativas en la expresión de EGFR, ni entre las diferentes localizaciones anatómicas exploradas ni en los diferentes estados de diferenciación tumoral. Tampoco se han encontrado diferencias significativas en la distribución de los niveles de EGFR entre los tumores T1-2 y T3-4. Por el contrario, se ha observado una diferencia significativa en la distribución de los niveles de EGFR entre los estadios tumorales I y II frente a III y IV.
Basados en este valor umbral, la sobreexpresión de EGFR se ha asociado con una tasa libre de recidiva y una tasa de supervivencia global más baja con respecto a pacientes que muestran menores niveles de EGFR. Los análisis de la supervivencia, mediante modo univariante, muestran que el EGFR y el estadio tumoral son variables significativas, siendo el estadio tumoral la variable que asocia la mayor significación. Para la supervivencia libre de recidiva, el EGFR ha sido el único parámetro significativo. En otros estudios, la frecuencia de tumores CCS con altos niveles de EGFR fue generalmente más baja que los datos publicados previamente15,16 y también, la correlación de tumores bien o moderadamente diferenciados y los tumores pequeños es contradictoria con estudios previos. En este sentido, la expresión del EGFR se correlaciona con CCS bien diferenciado y moderadamente diferenciado; el tamaño del tumor se correlaciona con un incremento en los valores de expresión, siendo más frecuente en tumores T1-2. Por el contrario, no se encuentra correlación entre el tamaño del tumor y el grado de diferenciación histológica. Una posible explicación a los resultados contradictorios obtenidos en los diferentes estudios publicados es la falta de consenso para la visualización del receptor y definir los niveles de los puntos de corte; además, la intensidad de la tinción puede ser dependiente de la fijación del tejido. Otras explicaciones posibles para las diferencias observadas podrían estar relacionadas con diferencias en la expresión de EGFR en varios puntos del tumor y la asociación entre la presencia de la infección del virus del papiloma humano y la expresión del receptor.17 Otros trabajos han mostrado que, comparando los niveles en mucosa normal de pacientes sin cáncer, el 80-90% de los CCS sobreexpresa EGFR y su ligando, TGF-α, con un incremento medio de 69 y 5 veces, respectivamente. El estudio posterior realizado por el mismo grupo de investigadores ha revelado que en pacientes con CCS, el mRNA y la proteína de EGFR están también sobreexpresados en lesiones displásicas e incluso en la mucosa normal adyacente. Todas estas observaciones indican que la sobreexpresión de EGFR es un evento temprano en el desarrollo de CCS.
Expresión de otros miembros ErbB
La expresión de Her2 se detecta en un 20% de los casos y su sobreexpresión parece estar asociada con un alto riesgo de metástasis ganglionar y peor supervivencia en pacientes con carcinomas orales. Aproximadamente la mitad de los carcinomas de la cavidad oral expresaron Her3 y, al igual que Her2, su sobreexpresión se asocia con una mayor incidencia de diseminación ganglionar.18 La expresión de Her4 también se ha detectado en la mitad de los carcinomas de la cavidad oral.19
Perspectivas clinicas y direcciónes terapéuticas
Agentes quimioprentivos
La prevención utilizando fármacos, o quimioprevención, han sido estrategias evaluadas y constituyen a día de hoy una débil promesa para disminuir la morbilidad y mortalidad asociada con el cáncer. Se han evaluado diversos agentes como posibles terapias quimiopreventivas. Entre ellas cabe destacar vitaminas (A, E, C) y minerales (Selenio). En cuanto a la búsqueda de nuevas dianas moleculares, otros estudios han incluido los inhibidores de COX-2, e inhibidores de EGFR (Fig. 4) como posibles agentes terapéuticos.
Dianas Moleculares
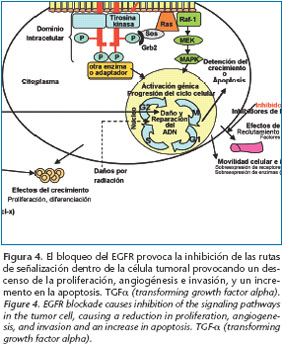
Existen evidencias que demuestran que las prostaglandinas están implicadas en carcinogénesis, siendo la prostaglandina E2 responsable de la activación de EGFR, con la consecuente estimulación de la proliferación celular (Fig. 5). En este sentido, COX-2 puede ser un determinante de la expresión de EGFR en lesiones epiteliales orales premalignas como también en CCS (Fig. 6), por lo que la inhibición de la ruta de COX-2 y/o EGFR proporcionaría una diana ideal para terapia molecular en lesiones premalignas de la cavidad oral. La implicación del EGFR en el carcinoma de células escamosas ha estimulado el uso clínico de varios agentes para bloquear la función de esta proteína. En concreto, ya se han demostrado con probada eficacia dos anticuerpos monoclonales, Cetuximab y Gefitinib como agentes terapéuticos para el carcinoma oral.
Gefitinib detiene la proliferación y el ciclo celular en fase G1 y reduce las metástasis ganglionar regional en ratones con carcinoma de células escamosas oral (CCSO).20 De igual modo, Cetuximab promueve la detención en fase G1 del ciclo celular en células cultivadas de CCSO.21 La exposición al Gefitinib también aumenta la radiosensibilidad de células de CCSO in vitro e in vivo.22 Recientemente se ha desarrollado un ensayo aleatorio del inhibidor EGFR EKB-569 sólo, Celecoxib (400 mg dos veces al día) sólo, la combinación de los dos fármacos o placebo en pacientes que presentaron leucoplasia oral displásica aneuploide.5
Conclusiones
Las lesiones premalignas orales se desarrollan a lo largo de superficies epiteliales del tracto aerodigestivo. Estas lesiones pueden abocar al desarrollo del CCS en la misma zona de la lesión. En este sentido, la carcinogénesis del tracto aerodigestivo implica una transición histológica en múltiples pasos desde epitelio normal hasta CCS. Este proceso implica una serie de cambios no sólo a nivel celular y molecular, sino también cambios en la expresión de genes que codifican para diferentes factores de crecimiento. Es por ello por lo que se está haciendo un gran esfuerzo por identificar nuevos marcadores de las lesiones premalignas de la mucosa del tracto aerodigestivo superior. Entre los diferentes marcadores que se han propuesto hasta la actualidad, la ciclooxigenasa-2 (COX-2) y el receptor del factor de crecimiento epidérmico (EGFR) parecen ser los más prometedores. Las evidencias reales de que COX-2 y EGFR están sobreexpresados en CCS de cabeza y cuello, arrastran el pensamiento hacia la conveniencia de explorar si ambos marcadores pueden ser utilizados como SEBs en lesiones premalignas (tipo leucoplasias) de la mucosa oral.
Agradecimientos
A. Carro Ramos por su ayuda técnica. S. Díaz Prado es beneficiaria de un contrato post-doctoral de investigación dentro del Programa Isidro Parga Pondal por la Xunta de Galicia (La Coruña, Galicia, España).
Bibliografía
1. Mao L, Hong WK, Papadimitrakopoulou VA. Focus on head and neck cancer. Cancer Cell 2004;5:311-6. [ Links ]
2. Hasegawa M, Nelson HH, Peters E, Ringstrom E, Posner M, Kelsey KT. Patterns of gene promoter methylation in squamous cell cancer of the head and neck. Oncogene 2002;21:4231-6. [ Links ]
3. Herman JG, Baylin SB. Gene silencing in cancer in association with promoter hypermethylation. N Engl J Med 2003;349:2042-54. [ Links ]
4. Youssef EM, Lotan D, Issa JP, Wakasa K, Fan YH, Mao L, y cols. Hypermethylation of the retinoic acid receptor-beta(2) gene in head and neck carcinogenesis. Clin Cancer Res 2004;10:1733-42. [ Links ]
5. Dannenberg AJ, Lippman SM, Mann JR, Subbaramaiah K, Dubois RN. Cyclooxygenase- 2 and epidermal growth factor receptor: pharmacologic targets for cheomoprevention. J Clin Oncol 2005;23:254-66. [ Links ]
6. Lippman SM, Sudbo J, Hong WK. Oral cancer prevention and the evolution of molecular targeted drug development. J Clin Oncol 2005;23:346-56. [ Links ]
7. Wiese FW, Thompson PA & Kadlubar FF. Carcinogen substrate specificity of human COX-1 and COX-2. Carcinogenesis 2001;21:5-10. [ Links ]
8. Williams CS, Tsujii M, Reese J, Dey SK, DuBois RN. Host cyclooxygenase-2 modulates carcinoma growth. J Clin Invest 2000;105:1589-94. [ Links ]
9. Chan G, Boyle JO, Yang EK, Zhang F, Sacks PG, Shah JP, et al. Cyclooxygenase- 2 expression is up-regulated in squamous cell carcinoma of the head and neck. Cancer Res 1999;59:991-4. [ Links ]
10. Gallo O, Franchi A, Magnelli L, Sardi I, Vannacci A, Boddi V, y cols. Cyclooxygenase- 2 pathway correlates with VEGF expression in head and neck cancer. Implications for tumor angiogenesis and metastasis. Neoplasia 2001;3:53-61. [ Links ]
11. Schlessinger J. Cell signaling by receptor tyrosine kinase. Cell 2000;103:211- 25. [ Links ]
12. Yarden Y, Sliwkowski M. Untangling the ErbB signaling network. Nat Rev Mol Cell Biol 2001;2:127-37. [ Links ]
13. Olayioye MA, Neve RM, Lane HA, Hynes NE. The ErbB signaling network: Receptor heterodimerization in development and cancer. EMBO J 2000;19:3159-67. [ Links ]
14. Vivanco I, Sawyers CL. The phosphatidylinositol 3-Kinase-Akt pathway in human cancer. Nat Rev Cancer 2002;2:489-501. [ Links ]
15. Gupta AK, McKenna WG, Weber CN, Feldman MD, Goldsmith JD, Mick R, y cols. Local recurrence in head and neck cancer: Relationship to radiation resistance and signal transduction. Clin Cancer Res 2002;8:885-92. [ Links ]
16. Bei R, Pompa G, Vitolo D, Moriconi E, Ciocci L, Quaranta M, et al. Co-localization of multiple ErbB receptors in stratified epithelium of oral squamous cell carcinoma. J Pathol 2001;195:343-8. [ Links ]
17. Almadori G, Cadoni G, Cattani P, Galli J, Bussu F, Fernandina G, et al. Human papillomavirus infection and epidermal growth factor receptor expression in primary laryngeal squamous cell carcinoma. Clin Cancer Res 2001;7:3988-93. [ Links ]
18. Xia W, Lau YK, Zhang HZ, Xiao FY, Johnston DA, Liu AR, y cols. Combination of EGFR, HER-2/neu and HER-3 is a stronger predictor for the outcome of oral squamous cell carcinoma than any individual family members. Clin Cancer Res 1999; 5:4164-74. [ Links ]
19. Ang KK, Andratschke NH, & Milas L. Epidermal growth factor receptor and response of head-and-neck carcinoma to therapy. Int J Radiat Oncol Biol Phys 2004;58:959-65. [ Links ]
20. Shintani S, Li C, Mihara M, Nakashiro K, Hamakawa H. Gefitinib (Iressa), an epidermal growth factor receptor tyrosine kinase inhibitor, mediates the inhibition of lymph node metastasis in oral cancer cells. Cancer Lett 2003;201:149-55. [ Links ]
21. Kiyota A, Shintani S, Mihara M, Nakahara Y, Ueyama Y, Matsumura T, y cols. Anti-epidermal growth factor receptor monoclonal antibody 225 upregulated p27 (KIP1) and p15 (INK 4B) and induces G1 arrest in oral squamous carcinoma cell lines. Oncology 2002;63:92-8. [ Links ]
22. Harari PM, Huang SM. Head and neck cancer as a clinical model for molecular targeting of therapy: combining EGFR blockade with radiation. Int J Radiat Oncol Biol Phys 2001;49:427-33. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
L.M. Antón Aparicio
Servicio Oncología Médica
C.H.U. A Coruña. Hospital Materno Infantil Teresa Herrera
C/ As Xubias S/N
15006 A Coruña. España
E-mail: lantapa@canalejo.org
Recibido: 08.10.08
Aceptado: 02.03.09











 texto em
texto em