Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Cirugía Oral y Maxilofacial
versión On-line ISSN 2173-9161versión impresa ISSN 1130-0558
Rev Esp Cirug Oral y Maxilofac vol.31 no.6 Madrid nov./dic. 2009
¿Cuál es su diagnóstico?
What would your diagnosis be?
Paciente varón de 50 años de edad. No presenta antecedentes médicos ni quirúrgicos de interés. El paciente, cuatro meses antes de acudir a urgencias, debuta con un cuadro de dolor hemifacial izquierdo siendo diagnosticado de una neuralgia del V par (en tratamiento con carbamacepina). Dos meses después comienza con hipoestesia del nervio alveolar inferior ipsilateral y es exodonciado de los cordales izquierdos (quiste periapical). La causa de acudir a urgencias (cuatro meses posterior al diagnóstico de neuralgia del nervio trigémino) es una parálisis facial periférica izquierda asociada a hipoestesia del nervio alveolar inferior derecho.
En la exploración física se evidencia una clara parálisis facial completa izquierda y una tumoración submandibular de alrededor de 2X2 cm. La glándula submaxilar es normal a la palpación con un correcto drenaje de saliva por el conducto de Wharton. A la palpación se comprueba la hipoestesia de ambos nervios alveolares inferiores, siendo, el resto de la exploración neurológica, anodina. El paciente no presenta trismus, disfagia o disnea. No asocia fiebre, celulitis o dolor en posible relación con un foco infeccioso de causa odontogénica. El suelo de la boca no está indurado y los pilares amigdalinos están sin desplazar.
En la analítica no se aprecian alteraciones significativas.
Se realiza una TC multicorte con contraste intravenoso en el que se observa una masa en el lóbulo profundo de la glándula parótida izquierda de aproximadamente 3X 3 X 4 cm. Dicha tumoración presenta bordes mal definidos, atenuación heterogénea y realce periférico. Está en contacto con la rama y el cóndilo mandibular. Ocupa el espacio parafaríngeo y se sitúa en contacto con la vertiente inferior del peñasco (Fig. 1).
Carcinoma ductal sobre adenoma pleomorfo de parótida
Duct carcinoma over the pleomorphic adenoma of the parotid gland
I. Navarro Cuéllar1, J. González Martín-Moro3, J.M. Múñoz Caro2, L. Pingarrón Martín1, J.L. del Castillo Pardo de Vera2, D.M. Benito5, M. Burgueño García4
1 Médico residente. Servicio de Cirugía Oral y Maxilofacial. Hospital Universitario La Paz. Madrid. España
2 Médico adjunto. Servicio de Cirugía Oral y Maxilofacial. Hospital Universitario La Paz. Madrid. España
3 Médico adjunto. Servicio de Cirugía Oral y Maxilofacial. Hospital General de Ciudad Real. España
4 Jefe de Servicio. Servicio de Cirugía Oral y Maxilofacial. Hospital Universitario La Paz. Madrid. España
5 Médico residente. Servicio de Anatomía Patológica. Hospital Universitario La Paz. Madrid. España
Dirección para correspondencia
Los tumores malignos de glándula salivares representan alrededor del 1-3% de todos los cánceres de cabeza y cuello y el 0,3% de todos los tumores malignos del organismo.1 La glándula parótida, al igual que en los tumores benignos de glándulas salivares, representa la localización más frecuente.
Determinados signos clínicos pueden orientarnos hacia un cuadro de malignidad de una tumoración parotídea: una masa de consistencia pétrea, adherida a planos profundos y dolorosa a la palpación (posible afección nerviosa), un crecimiento expansivo de rápida evolución (el tumor de Warthin también lo puede presentar) y una morfología polinodular (también frecuente en las recidivas de adenoma pleomorfo). Sin embargo, la parálisis facial, la presencia de adenopatías cervicales y una propagación cutánea orientan el diagnóstico de una manera más fiable. Las tumoraciones parotídeas de lóbulo profundo muchas veces son diagnosticadas tardíamente por no ser palpables ni presentar otro tipo de sintomatología. De hecho, la afección nerviosa puede ser el debut de tumores malignos condicionando pobremente el pronóstico.
Ante toda tumoración parotídea clínicamente palpable, la punción aspiración con aguja fina (PAAF) sigue siendo, para muchos autores, la primera prueba complementaria necesaria para orientar nuestro diagnóstico. Sin embargo, la PAAF tiene sus limitaciones en comparación con otras técnicas de análisis histológico, como "el frozen section", a la hora de determinar la estirpe histológica, tanto de los tumores malignos como benignos.14
La segunda herramienta diagnóstica ante una sospecha de tumoración maligna de la glándula parótida tiene que ser una prueba de imagen. En general, las masas benignas presentan bordes bien definidos y un realce homogéneo del contraste mientras que en las masas malignas los bordes pueden ser irregulares (también pueden asociarse con el tumor mixto, especialmente si es polinodular) y el realce heterogéneo. La resonancia magnética nuclear (RM) es la prueba de elección. Con ella se consigue un mayor realce de los tejidos blandos permitiéndonos establecer con más exactitud los límites del tumor y la posible infiltración de los mismos. Comparándola con la tomografía axial computerizada (TC), la RM presenta una sensibilidad, para determinar dichos límites, cercana al 80% mientras que la TC nos ofrece un 63%. Si consideramos la sensibilidad para establecer la infiltración local, ésta es de 89% para la RM y del 65% para la TC. Sin embargo, la tomografía sigue siendo un arma diagnóstica fundamental para evaluar la afección ósea.2
El diagnóstico diferencial de las masas de lóbulo profundo de parótida incluye desde lesiones benignas como los quistes linfoepiteliales en pacientes VIH+, síndrome de Sjögren, tumores benignos (adenoma pleomorfo, tumor de Warthin, oncocitoma, etc.), tumores malignos primarios, metástasis, síndromes linfoproliferativos, etc.13
El comportamiento biológico y por extensión el pronóstico de los tumores malignos de parótida varía en función de su estirpe histológica. El carcinoma mucoepidernoide suele ser el más frecuente de todos ellos seguido del carcinoma de células acinares, el adenocarcinoma (en sus distintas variantes), el carcinoma adenoide quístico (cilindroma) y el carcinoma ex adenoma pleomorfo. Sin embargo, en el Reino Unido, el carcinoma ex-adenoma pleomorfo supera en frecuencia, en algunas series, al carcinoma mucoepidermoide.3
El carcinoma ex-tumor mixto es un adenoma pleomorfo en el que, sobre su componente epitelial, se desarrolla una neoplasia maligna. Su origen puede ser un adenoma pleomorfo no tratado y malignizado (el intervalo de malignización puede ser de hasta 20 años) o una malignización de una recurrencia tumoral.3 La tasa de recurrencia del adenoma pleomorfo varía de un 4-45% según la técnica quirúrgica empleada (parotidectomía vs tumorectomía) y su transformación maligna puede llegar a ser de hasta un 12%.4 Para su diagnóstico, y por definición, debe encontrarse un adenoma pleomorfo englobando a un tejido tumoral de características malignas. En aquellos casos de larga evolución, en los que el carcinoma haya sustituido completamente al adenoma, la presencia de hialina es muy característica de una degeneración del adenoma pleomorfo.5
El carcinoma ex adenoma pleomorfo suele afectar a personas situadas alrededor de los 60-70 años sin una clara predilección por hombres o mujeres. Normalmente se presenta como una masa indolora de crecimiento lento y años de evolución que en un momento dado desarrolla una gran expansión local y crecimiento rápido. La lesión maligna suele estar incluida dentro de la benigna (en proporción variable) y presenta unos límites irregulares y un patrón infiltrativo.6
El carcinoma ductal de glándula salivar fue descrito por primera vez en 1968 por Kleinsasser8 asentando más del 80% en la parótida. Histológicamente tiene un componente carcinomatoso intraductal y otro infiltrativo. El intraductal presenta distintos patrones de crecimiento como son el sólido, el cribiforme y el papilar mientras que el componente infiltrativo es un estroma desmoplásico. Hasta un 30% de los pacientes pueden presentar calcificaciones intratumorales. Una sobre-expresión de la oncoproteína c-erbB-2 está asociado a un peor pronóstico (favorece la proliferación, migración e indiferenciación celular)7. La mutación del P53 y la sobre-expresión de la proteína HER-2 también tipifican inmunohistologicamente este tipo de tumor.8 Hay estudios que sugieren que la terapia hormonal con Trastuzumab (bloqueo de los receptores de los factores de crecimiento tumoral) es efectivo en aquellos tumores, como el carcinoma ductal mamario y el salivar, que sobre-expresan la oncoproteína HER2.9
La parálisis facial (40%), el dolor, la invasión perineural (70%), la afección ganglionar cervical (60%) y el desarrollo de metástasis a distancia (35-65%) son hallazgos clínicos frecuentes del carcinoma ductal de la glándula parótida. La tasa de recurrencia local se sitúa alrededor del 40%.10
En este tipo de tumor, la parotidectomía total junto a un vaciamiento cervical, radioterapia, quimioterapia postoperatoria en función de la afección regional y sistémica y terapia hormonal (si precisara) debe ser el plan terapéutico de elección. Ante cuellos N0, el vaciamiento cervical electivo está justificado.
Hay estudios que afirman que la radioterapia postoperatoria para el tratamiento de carcinomas ex adenomas pleomorfo, en pacientes con cuellos pN0, mejora el control local de un 49% a un 75%.11 La radioterapia varía entre 45-71 Gy en función de la propagación cervical de la enfermedad y la supervivencia global varía de un 16% para los N+ a un 67% para los N0.11
Las posibilidades reconstructivas descritas en la literatura son múltiples: colgajos musculares o cutáneos locales, colgajos músculo- cutáneos regionales como son el pectoral mayor y el dorsal ancho y los colgajos libres microvascularizados: colgajo fascio-cutáneo escapular, colgajo de recto abdominal, colgajo lateral de brazo, colgajo anterolateral de muslo, latissimus dorsi.12
En el caso de nuestro paciente, se realizó una PAAF obteniéndose el resultado de carcinoma indiferenciado de células grandes. El estudio de extensión se realizó con una TC torácico-abdominal debido a que la mayor parte de las ocasiones la diseminación a distancia de este tipo de tumor es a pulmón y a mediastino. Dicha TC no reveló imágenes sugerentes de metástasis. En la TC cervico- facial se aprecia la tumoración en el lóbulo profundo de la parótida con las características antes descritas así como una masa submandibular de 3 X 3 cm con atenuación heterogénea y áreas de necrosis en su interior sugerente de adenopatía en rangos patológicos y en íntimo contacto con ambas carótidas, yugular interna y el músculo esternocleidomastoideo (Fig. 2).
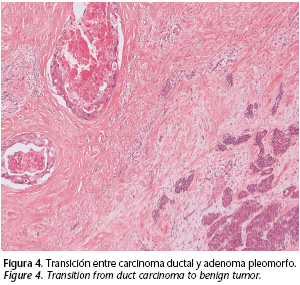
Se decidió intervenir al paciente mediante una parotidectomía radical izquierda asociando un vaciamiento cervical radical ipsilateral. Se mandó una biopsia intraoperatoria del nervio facial en su salida por el orificio estilo-mastoideo con el fin de valorar si había extensión intracraneal vía perineural. El resultado fue "tejido nervioso sin presencia de infiltración tumoral". Considerando el mal pronóstico del paciente, la reconstrucción se realizó con un colgajo muscular de pectoral mayor que aportó volumen y protección a los grandes vasos (Fig. 3). Se completó la intervención con una suspensión del modiolo y una cantopexia para minimizar las secuelas de la parálisis facial. El informe anatomopatológico fue: "Carcinoma ductal ampliamente invasivo sobre adenoma pleomorfo, identificándose la presencia de infiltración neural y vascular. Márgenes libres de afectación tumoral. Vaciamiento cervical radical sin presencia tumoral" (Figs. 4 y 5). La inmunohistoquímica para detectar HER-2 fue negativa. Por tanto, la masa submandibular descrita en el TAC sugerente de adenopatía en rangos patológicos resultó ser el propio tumor extendido al espacio submandibular.
El paciente ha estado en tratamiento por parte del servicio de oncología radioterápica (60 Gy más sobreimpresión con 5 Gy). Meses más tarde, en un estudio de extensión con body-TC se detectó enfermedad diseminada en pulmón, mediastino, cerebro, meninges y ósea (costillas y vértebras). Ha sido tratado por el servicio de oncología médica (cisplatino 60 mg/m2, epirrubicina 60 mg/m2 y ciclofosfamida 600 mg/m2) y se le ha administrado radioterapia paliativa en cerebro, meninges y columna. Ha desarrollado un síndrome de compresión medular con paraparesia y monoplejia de pierna derecha.
Como conclusión, el carcinoma ductal de glándula parótida es un tumor de pronóstico infausto (diseminación linfática y hematógena temprana) en el que el diagnóstico precoz junto al tratamiento multidiscipinar de cirugía, radioterapia y quimioterapia es clave a la hora conseguir mejorar el pronóstico de los pacientes.
Bibliografía
1. Bhattacharyya N, Fried MP. Determinants of Survival in Parotid Gland Carcinoma: a Population Based Study. American Journal of Otolaryngology 2005;26:39-44. [ Links ]
2. Raine C, Saliba K, Chippindale AJ, Mclean NR. Radiological Imaging in Primary Parotid Malignancy. British Journal of Plastic Surgery 2003;56:637-47. [ Links ]
3. Reza Nouarai SA, Hope KL, Nelly CG, Mclein NR, Soames JV. Carcinoma Ex Benign Pleomorphic Adenoma of the Parotid Gland. Plast Reconstr Surg 2005;116: 1206. [ Links ]
4. Zbären P, Tschumi I, Nuyens M, Stauffer E. Recurrent Pleomorphic Adenoma of the Parotid Gland. The American Journal of Surgery 2005;189:203-7. [ Links ]
5. Cawson RA, Gleeson MJ, Everson JW. Pathology and Surgery of the Salivary Glands. Oxford: ISIS Medical Media 1997. [ Links ]
6. Barrios JM, Soler F, Guerra B, Navarro Cuéllar C.Tumores malignos de las glándulas salivares. Tratado de Cirugía Oral y Maxilofacial (vol. II). Navarro C, García-Marín F, Ochandiano S. Ed Arán, 2004. [ Links ]
7. Etges A, Pinto DS, Kowalski LP, Soares FA. Salivary duct carcinoma: immunohistochemical profile of an aggressive salivary gland tumour. J Clin Pathol 2003;56: 914-8. [ Links ]
8. Jaenhe M, Roeser K, Jaekel T, Schepers J, Albert N, Löning T. Clinical and Immunohistologic Typing of Salivary Duct Carcinoma. Cancer 2005;103:2526-33. [ Links ]
9. Nabili V, Tan JW, Bhuta S, Sercarz JA, Head CS. Salivary Duct Carcinoma: A Clinical And Histologic Review With Implications For Trastuzumab Therapy. Head and Neck 2007;29:907-12. [ Links ]
10. Sefik A, Fan C, Barnes L, Myers EN. Salivary Dcut Carcinoma. Otolaryngol Head Neck Surg 2003;129:720-5. [ Links ]
11. Chen AM, García J, Bucci MK, Quivey JM, Eisele DW. The Role of Postoperative Radiation Therapy in Carcinoma Ex Pleomorphic Adenoma of the Parotid Gland. Int J Radiation Oncology Biol Phys 2007;67:138-43. [ Links ]
12. Teknos TN, Nussenbaum B, Bradford CR, Prince ME, El-Kashlan H, Chepeha DB. Reconstruction of Complex Parotidectomy Defects Using the Lateral Arm Free Tissue Transfer. Otolaryngol Head and Neck Surg 2003;129:183-91. [ Links ]
13. Ric Harnsberger H. Parotid Space. Serie radiológia clínica. Los 100 diagnósticos principales en cabeza y cuello. Harnberger, Hudgins, Wiggins, Davidson. Ed Elsevier. [ Links ]
14. Zbären P, Guélat D, Loosli H, Stauffer E. Parotid tumors: Fine needle aspiration and/or frozen section. Otolaryngology, Head and Neck Surgery 2008;139:81-5. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Ignacio Navarro Cuéllar
Servicio de Cirugía Oral y Maxilofacial.
Hospital Universitario La Paz
Paseo de la Castellana 264, 28046 Madrid. España
E-mail: nnavcu@hotmail.com











 texto en
texto en