Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Cirugía Oral y Maxilofacial
versión On-line ISSN 2173-9161versión impresa ISSN 1130-0558
Rev Esp Cirug Oral y Maxilofac vol.34 no.1 Madrid ene./mar. 2012
Plasma rico en plaquetas: fundamentos biológicos y aplicaciones en cirugía maxilofacial y estética facial
Platelet-rich plasma: biology and applications in maxillofacial surgery and facial aesthetics
Jordi Rodríguez Floresa, María Angustias Palomar Gallegob y Jesús Torres García-Dencheb
aServicio de Cirugía Oral y Maxilofacial, Hospital Universitari Sagrat Cor, Barcelona, España
bFacultad de Ciencias de la Salud, Universidad Rey Juan Carlos, Madrid, España
Dirección para correspondencia
RESUMEN
Esta revisión presenta el uso del preparado de plasma rico en plaquetas (PRP) como una herramienta potenciadora de ciertas características histológicas de los tejidos conformados por células con receptores para los factores de crecimiento plaquetarios. Se ha realizado una revisión sobre el plasma rico en plaquetas de la literatura publicada en PubMed. Se describen los fundamentos biológicos del PRP a nivel celular, la técnica de obtención, y sus usos clínicos en la actualidad.
Palabras clave: Plasma rico en plaquetas. Factores de crecimiento. Bioestimulación.
ABSTRACT
This review shows platelet-rich-plasma (PRP) as an enhancer of the histological characteristics of the tissues with platelet-derived growth factor receptors. A review has been made of the literature on the platelet-rich plasma published in PubMed. The article describes the cellular biology of PRP, the technique for obtaining it, and its clinical applications.
Key words: Platelet-rich plasma. Growth Factors. Biostimulation.
Introducción
En el contexto de investigaciones bioquímicas para contrarrestar los procesos celulares del envejecimiento, se empezó a estudiar y a utilizar el plasma rico en plaquetas (y rico a su vez en factores de crecimiento derivados de las plaquetas) por sus propiedades moduladoras y estimuladoras de la proliferación de las células derivadas de células madre de origen mesenquimal (fibroblastos, osteoblastos, células endoteliales, células epiteliales, adipoblastos, miocitos, y condrocitos, principalmente), y como un útil elemento auxiliar para mejorar la regeneración tisular. El PRP fue inicialmente usado en ciertas especialidades quirúrgicas para mejorar la curación de las heridas iatrogénicas y las heridas de evolución recalcitrante. Pero sus aplicaciones actuales se extienden más allá del uso para la reparación de las heridas quirúrgicas y la regeneración de los tejidos perdidos, y el PRP se ha popularizado en otras ramas de la medicina. En el campo de la medicina estética, el PRP se utiliza principalmente por su papel en la bioestimulación del fibroblasto cutáneo, y como biopotenciador de los tratamientos de relleno con tejido adiposo. Se trata de una herramienta estética novedosa, con numerosos estudios realizados al respecto y otros muchos en marcha para acabar de establecer las propiedades y las indicaciones de este preparado capaz de mejorar las características de un gran número de células de nuestro organismo1.
El proceso de regeneración tisular
La regeneración de los tejidos duros y blandos tiene lugar mediante un complejo de eventos a nivel celular y a nivel molecular que son regulados por proteínas de señal, en un proceso biológico que, hoy por hoy, aún no ha sido caracterizado en su totalidad, pero en el que las plaquetas juegan un papel capital y decisivo2,3.
La activación plaquetaria en respuesta al daño tisular y vascular provoca la formación de un tapón plaquetario y un coágulo hemático cuyas funciones son la consecución de la hemostasia, y la secreción de proteínas biológicamente activas involucradas en el proceso de curación tisular. Estas proteínas, los denominados factores de crecimiento, son secretadas básicamente por la estructura plaquetaria, pero no de manera exclusiva, pudiendo ser producidas también por células varias como es el caso del fibroblasto.
En la literatura encontramos descritas numerosas aplicaciones clínicas del plasma rico en plaquetas, principalmente para úlceras, cirugía maxilofacial, y cirugía espinal. En la mayoría de estudios quedan patentes evidencias para fomentar su uso; sin embargo, existen pocos estudios con controles que determinen y cuantifiquen definitivamente la magnitud de los efectos del plasma rico en plaquetas. Además, existe poco consenso sobre el proceso de obtención y caracterización del PRP, cosa que impide que se puedan establecer los estándares que serían necesarios para integrar la vasta literatura sobre el tema de un modo científico2,4.
Conceptos generales sobre la cicatrización de heridas
Hay 3 etapas distintas pero solapadas en el proceso de cicatrización: la inflamatoria, la proliferativa y la de remodelación. La inflamatoria es la respuesta inicial a la lesión tisular, de ahí que el objetivo inicial sea proporcionar una rápida hemostasia y comenzar la cascada de reacciones que lleven a la regeneración del tejido. Cuando la sangre sale de los vasos lesionados, se forma un hematoma llenando el espacio tisular con plaquetas, que juegan un papel clave. Los factores de crecimiento y las citoquinas se liberan principalmente por las plaquetas, pero también por otras células, dando lugar a la migración, proliferación y diferenciación celular, y a la síntesis de la matriz extracelular. La red de fibrina del hematoma funciona como una matriz provisional para mantener un andamiaje del espacio regenerativo y permitir la migración y proliferación celular2.
La segunda fase, o fase de proliferación, es la fase de cicatrización propiamente dicha. El tejido necrótico es eliminado y reemplazado por tejido vivo, que es el específico de cada entorno tisular (hueso, cartílago, tejido fibroso). Las células madre mesenquimales llevan a cabo la diferenciación a osteoblastos, fibroblastos, condrocitos y otros tipos de células en función de los requerimientos del tipo de tejido a regenerar. Los factores locales como el perfil de factores de crecimiento y citoquinas, las hormonas, los nutrientes, el pH, la presión parcial de oxígeno y el entorno eléctrico y mecánico condicionan la diferenciación adecuada2.
La fase final es la de remodelación, y se caracteriza por la reorganización y adaptación del nuevo tejido generado para parecerse lo máximo al tejido original. Los cambios producidos incluyen una reducción de la densidad y vascularidad celular, la eliminación del exceso de matriz reparada y la orientación de las fibras de colágeno de la matriz reparada hacia las líneas de fuerza de máxima tensión. Esta etapa final de la cicatrización puede requerir años para completarse2 (Figura 1).
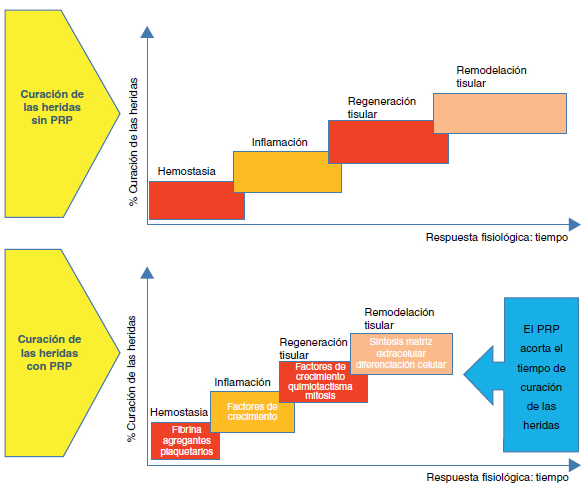
Figura 1. Diagrama esquemático del proceso de curación de las
heridas en condiciones normales y de su aceleración cuando se
aplica el preparado plasmático rico en plaquetas.
Los gránulos α de las plaquetas
Los gránulos α de las plaquetas contienen numerosas proteínas que influyen poderosamente en la cicatrización de las heridas. Entre ellas el factor de crecimiento derivado de las plaquetas (PDGF) (que incluye los isómeros αα, ββ, y αβ), el factor de crecimiento transformante (TGF)-β (que incluye los isómeros β1 y β2), el factor plaquetario 4 (PF4), la interleuquina (IL)-1, el factor angiogénico derivado de las plaquetas (PDAF), el factor de crecimiento endotelial (VEGF), el factor de crecimiento epidérmico (EGF), el factor de crecimiento endotelial derivado de las plaquetas (PDEGF), el factor de crecimiento de células epiteliales (ECGF), el factor de crecimiento insulina-like (IGF), la osteocalcina, la osteoconectina, el fibrinógeno, la vitronectina, la fibronectina y la trombospondina (TSP)-1. Estas proteínas, denominadas proteínas secretoras, componen las familias de los factores de crecimiento, citoquinas y quimioquinas2,5-7.
Las proteínas secretadas por los gránulos α también juegan un papel en la defensa celular ante agentes exógenos en el lugar de la herida, mediante la producción de proteínas de señal que atraen a los macrófagos. Además, el PRP contiene un pequeño número de células leucocitarias que también contribuyen a la defensa celular mediante la síntesis de interleuquinas que intervienen en la respuesta inmune inespecífica.
La activación, también conocida como degranulación, provoca que los gránulos α se fundan con la membrana celular de las plaquetas, donde algunas de las proteínas secretoras (por ejemplo, PDGF y TGF-β) pasan al estado activo al añadírseles histonas y cadenas laterales de carbohidratos. Así, las proteínas son secretadas, permitiendo que se enlacen a los receptores de las células diana (por ejemplo, células madre mesenquimales, osteoblastos, fibroblastos, células endoteliales, o células epidérmicas). Una vez unidas a los receptores transmembrana, se activan las proteínas señalizadoras intracelulares, lo que lleva a la expresión de una secuencia de genes (distintos en cada tipo celular) que dirigen la proliferación celular, la formación de la matriz, la producción osteoide, la síntesis de colágeno, y otras acciones, en función del tipo de célula sobre el que actúen5,8.
Las plaquetas empiezan a secretar activamente estas proteínas en los 10 minutos siguientes a la formación del coágulo, completando la secreción de más del 95% de los factores de crecimiento presintetizados en el plazo de 1 hora. Tras esta salva inicial de proteínas liberadas, las plaquetas sintetizan y secretan proteínas adicionales mientras se mantienen vivas (entre 5 y 10 días). Cuando empieza a disminuir la influencia directa de las plaquetas, los macrófagos que llegan arrastrados por el torrente vascular estimulados por las plaquetas asumen la responsabilidad de la regulación de la cicatrización secretando sus propios factores. De esta forma, las plaquetas, en última instancia, establecen la pauta en el lugar de reparación de la herida5,9.
Las principales proteínas secretadas por las plaquetas activadas influyen en muchos aspectos de la cicatrización3,10:
• PDGF es quimiotáctico para macrófagos;
PDGF, TGF-β e IGF actúan colectivamente en la quimiotaxis y mitogénesis de las células madre y de los osteoblastos, en la angiogénesis de los nuevos capilares, en la formación de la matriz ósea, y en la síntesis del colágeno; PDGF y TGF-β también participan en la mineralización ósea.
• Como grupo, las proteínas adhesivas fibrinógeno, fibronectina, vitronectina y TSP-1 participan en la formación del trombo y algunas también parecen tener propiedades mitogénicas.
Factores de crecimiento
Los factores de crecimiento o GF (growth factors) son un conjunto de sustancias de naturaleza peptídica cuya misión es la comunicación intercelular a nivel molecular. Son capaces de modificar las respuestas biológicas celulares, ya que regulan la migración, proliferación, diferenciación y metabolismo celular, e incluso la apoptosis. La función principal de los factores de crecimiento es la del control externo del ciclo celular, mediante el abandono de la quiescencia celular (G0) y la entrada de la célula en fase G1. Los factores de crecimiento estimulan el aumento del tamaño celular al incrementar la síntesis proteica de las células sobre las que actúan11.
En cuanto a su clasificación, los factores de crecimiento se pueden clasificar según sea su especificidad: amplia o reducida. Los de especificidad amplia como el factor de crecimiento derivado de las plaquetas (PDGF) y el factor de crecimiento epidérmico (EGF) actúan sobre muchas clases de células, entre las cuales tenemos: fibroblastos, fibras musculares lisas, células neurogliales, y el EGF, además, sobre células epiteliales y no epiteliales. Como ejemplo de factor de crecimiento de especificidad reducida tenemos a la eritropoyetina, que solo induce la proliferación de los precursores de los hematíes.
Los factores de crecimiento actúan de manera local. La estimulación celular se realiza bien por un sistema autocrino en el que las células producen y responden al mediador biológico, o por un sistema paracrino en el que la célula que produce el factor se encuentra en las proximidades de las células a las que afecta11.
En general, los factores de crecimiento son sintetizados en forma de precursores, siendo necesario para la liberación del factor en forma «activa» un proceso específico de proteólisis. Su mecanismo de acción siempre comienza al unirse a receptores específicos de membrana. Para cada tipo de factor de crecimiento existe un receptor o conjunto de receptores específicos. Las células responden a un FC solo si disponen de la proteína receptora apropiada. El proceso está mediado por un sistema de segundos mensajeros que activan una cascada de señales que acaba en la activación de uno o varios genes (transducción de señales). Debido a este mecanismo, la acción de los factores en el lugar de la lesión continúa aunque hayan desaparecido los mismos del medio, ya que han activado el sistema de segundos mensajeros11.
Entre los tipos celulares productores de los factores de crecimiento están los fibroblastos, osteoblastos, células endoteliales, leucocitos, monocitos y macrófagos. Además existen lugares de almacenamiento, como son las plaquetas (en los gránulos α) y el hueso (adheridos a la matriz ósea)11.
Factor de crecimiento derivado de las plaquetas (PDGF)
• Tipos: AA, BB, AB
• Promueve indirectamente la angiogénesis a través de los macrófagos, por un mecanismo de quimiotaxis12;
• Activador de macrófagos;
• Mitógeno de células mesenquimales;
• Facilita la formación de colágeno tipo I;
• Promueve la proliferación de las células adiposas y de los fibroblastos dérmicos1.
Factor de crecimiento transformante β (TGF-β)
• Quimiotaxis;
• Proliferación y diferenciación de las células mesenquimales;
• Síntesis de colágeno por los osteoblastos;
• Promueve la proliferación de adipocitos y fibroblastos dérmicos humanos1;
• Pro-angiogénesis;
• Inhibe la formación de osteoclastos;
• Inhibe la proliferación de células epiteliales en presencia de otros factores.
Factor de crecimiento epidérmico (EGF)
• Efectos mitogénicos y quimiotácticos en fibroblastos y células epiteliales;
• Induce la migración celular;
• Los fibroblastos, los proosteoblastos y precondrocitos expresan un alto número de receptores para EGF;
• Estimula la formación de tejido de granulación.
Factor de crecimiento fibroblástico (FGF)
• Estimulación y coordinación de la mitogénesis de células mesenquimales como los fibroblastos, los osteoblastos, condrocitos, células musculares lisas y mioblastos esqueléticos;
• Inhibe los osteoclastos;
• Promueve la proliferación de los fibroblastos e induce la secreción de fibronectina por estos;
• Pro-angiogénesis por acción quimiotáctica sobre células endoteliales.
Factor de crecimiento insulina-like (IGF)
• Promueve la proliferación y diferenciación de células mesenquimales y de revestimiento;
• Estimula la síntesis de osteocalcina, fosfatasa alcalina y colágeno tipo I por los osteoblastos13;
• Actúa como agente quimiotáctico para las células vasculares endoteliales.
Factor de crecimiento vascular endotelial (VEGF)
• Induce la quimiotaxis y proliferación de las células endoteliales;
• Provoca una hiperpermeabilidad de los vasos sanguíneos;
• Mitógeno, proapoptótico, promotor de la quimiotaxis y la diferenciación de células epiteliales, renales, gliales y fibroblastos.
Aplicaciones del prp sobre los tejidos mesenquimales
La biología del plasma rico en factores de crecimiento ha conducido al uso de este preparado autólogo en múltiples ramas de la biología, la medicina, la odontología, la cirugía, y ciencias afines. Los factores de crecimiento actúan a nivel de los receptores citoplásmicos de muchos tipos celulares, sobre todo en las células de estirpe mesenquimal, aunque no de manera exclusiva sobre estas, ya que también se le han atribuido efectos proliferativos sobre otras series celulares como son las células gliales y renales. Así, los estudios científicos de caracterización celular presentan a las células mesenquimales como las células con mayor número de receptores para los factores de crecimiento secretados por los gránulos α de las plaquetas y por ciertas células12.
El tejido mesenquimal procede del mesodermo (la lámina intermedia del disco embrionario trilaminar) durante el desarrollo embrionario. El mesénquima es el tejido primitivo mesodérmico del que derivan gran parte de los tejidos orgánicos. El mesénquima en conjunto es un tipo de tejido conectivo laxo, de consistencia viscosa, rico en colágeno y fibroblastos. El mesénquima dará lugar, por el proceso de diferenciación tisular, a vasos sanguíneos y órganos cardiovasculares, músculo liso, mesotelio, al sistema linfático y al tejido conectivo propiamente dicho. El tejido mesenquimal también está conformado por una sustancia fundamental (muy tenue, con apenas fibras y fibroblastos activados). El mesénquima hace referencia también a los tejidos de sostén o de relleno que conforman los órganos, en contraposición al parénquima o tejido principal de un órgano.
Aunque al tejido conectivo se le atribuyen muchas funciones, las principales son:
• Proporcionar soporte estructural;
• Servir como un medio de intercambio de sustancias;
• Ayudar en la defensa y protección del organismo;
• Establecer un lugar para el depósito de grasa.
El tejido mesenquimal posee células madre pluripotenciales cuya diferenciación y especialización origina diferentes tipos de tejidos: los tejidos conectivos en general y todos sus tipos; los tejidos musculares, y algunos tejidos epiteliales (formados con doble origen en endotelio y mesotelio)23.
Dentro del tejido mesenquimal no especializado encontramos los tejidos que podríamos englobar con el nombre genérico de «tejido conectivo». Existen dos tipos de tejido conjuntivo: el tejido conectivo laxo, y el tejido conectivo denso. El tejido conectivo laxo se encarga del sostén de los órganos y epitelios en su lugar, y posee una gran variedad de proteínas que conforman sus fibras, incluyendo colágeno y elastina; el tejido conectivo laxo forma el estroma o relleno de los órganos, sobre el que asientan el parénquima o las células que realizan la función característica de cada órgano. El tejido conectivo denso posee abundantes fibras colágenas, es menos flexible que el laxo, pero más resistente a las tracciones. Dentro del tejido conectivo denso, encontramos dos subtipos: el modelado o regular, y el no modelado o irregular. El tejido conectivo denso modelado o regular tiene todas sus fibras de colágeno orientadas en una misma dirección; es el tejido que encontramos en estructuras como son los tendones y los ligamentos. El tejido conectivo denso no modelado o irregular presenta una multidireccionalidad de las fibras colágenas; lo encontramos en la dermis profunda, en el periostio, y en el pericondrio.
Existen tejidos mesenquimales especializados como el tejido adiposo, el tejido cartilaginoso, el tejido óseo, el tejido hematopoyético, y el tejido muscular.
Plasma rico en plaquetas
El estudio de los factores de crecimiento junto con el descubrimiento de su liberación por parte de las plaquetas ha conducido al desarrollo de un concentrado de plaquetas autólogo, útil para estimular la proliferación y la diferenciación celular en aquellos tejidos donde esto es requerido, tal y como sucede en las heridas y procesos de regeneración de los tejidos, o para luchar contra la involución celular que tiene lugar con el envejecimiento14.
El PRP se define como una fracción de plasma obtenido de sangre autóloga que tiene una concentración de plaquetas superior a la del plasma en condiciones basales. El PRP contiene no solo un alto nivel de plaquetas, sino también de los factores de crecimiento que son secretados activamente por las plaquetas. Además, el PRP también es rico en proteínas que actúan a nivel de la adhesión celular (fibrina, fibronectina, y vitronectina), por lo que proporciona el soporte estructural necesario para la migración celular, y para la proliferación y crecimiento tridimensional de los tejidos sobre los que actúa. El PRP tiene efectos no solo directamente sobre las células diana para los factores de crecimiento, sino también como matriz extracelular para la estimulación de la reparación y/o regeneración del tejido de un modo global5,15.
Concentración de plaquetas necesaria
Es probable que el efecto del PRP sobre la cicatrización de una herida sea función de muchas variables, entre ellas la concentración de plaquetas, el volumen añadido de PRP, la extensión y el tipo de la lesión y la condición médica global del paciente. El gran número de variables y su potencial interacción es la razón por la que no existe una recomendación única sobre el nivel de aumento de plaquetas que debe producir el PRP sobre la línea base para ofrecer sus efectos de la manera más óptima.
Algunos investigadores han sugerido que el PRP debería alcanzar una concentración en plaquetas de 3 a 5 veces superior al nivel normal, aunque la relación entre el número de plaquetas añadido y el beneficio clínico obtenido es uno de los parámetros que permanecen pendientes de determinar con exactitud. Se han publicado niveles de concentración que van desde menos de 2 hasta 8,5 veces el nivel normal, o, incluso, que cada individuo necesita una concentración diferente de plaquetas para obtener un mismo beneficio clínico5,16.
Aunque es imposible predeterminar la magnitud del efecto estimulador del proceso de curación de las heridas mediante el empleo de PRP por la gran variabilidad interindividual y la influencia de factores propios de cada caso y de cada herida en particular, lo que sí está científicamente demostrado es la correlación estadísticamente positiva entre la aplicación del mismo y el acortamiento temporal del proceso, gracias a su riqueza en factores de crecimiento, y a sus propiedades mitogénicas y quimiotácticas. El PRP contiene una alta concentración de plaquetas, y consiguientemente es rico en factores de crecimiento y de la coagulación17-19.
Técnica de procesado
Cuando se realiza una cirugía, la sangre fluye en el lugar de la incisión y las plaquetas inician la formación del coágulo y la cicatrización, lo que provoca una reducción del nivel de plaquetas en sangre. Por lo tanto, la sangre siempre debe extraerse antes de la cirugía (si se utiliza el PRP con el fin de mejorar la curación de una herida quirúrgica), ya que de lo contrario podría producirse la activación de las plaquetas, lo que interferiría con su preparación4.
Cuando se centrifuga la sangre anticoagulada, se forman 3 capas en función de la densidad: la capa inferior (densidad 1,09), compuesta por glóbulos rojos; la capa media (densidad 1,06), compuesta por glóbulos blancos y plaquetas, y la capa superior (densidad 1,03), compuesta por plasma. La fase plasmática, a su vez, puede subdividirse en 3 fracciones en función de la cantidad de plaquetas presentes, que de superior a inferior son: una fracción pobre en plaquetas, la fracción intermedia con una concentración media de plaquetas, y la fracción rica en plaquetas7 (Figura 2 y Figura 3).
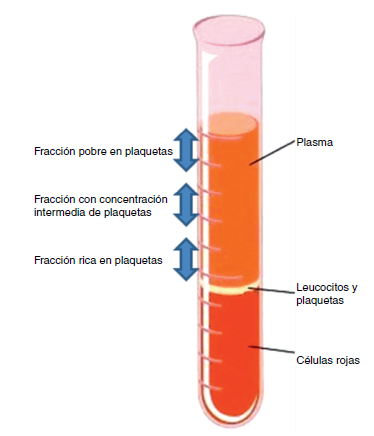
Figura 2. Fases obtenidas tras la centrifugación
de sangre anticoagulada.
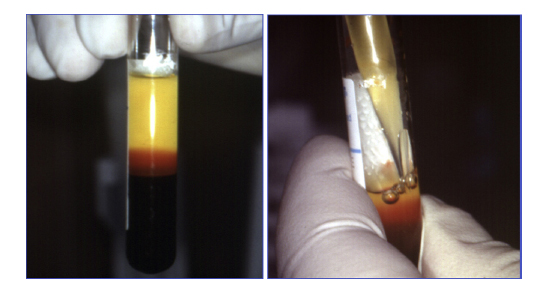
Figura 3. Pipeteado de la fracción correspondiente
al plasma rico en plaquetas.
La centrifugación es el procedimiento básico para obtener PRP, con un rendimiento aproximado del 10% sobre la sangre extraída. Debe evitarse la fragmentación de las plaquetas durante el proceso, ya que a consecuencia de ella se produciría su activación precoz, y, con ello, algunas proteínas secretoras adquirirían su estructura terciaria definitiva bioactiva. La liberación indebida por fragmentación de altos niveles de proteínas podría comprometer la bioactividad de las mismas. Puede mantenerse la integridad de la membrana plaquetaria usando como anticoagulante citrato ácido de dextrosa (el citrato secuestra el calcio y bloquea la cascada de la coagulación, y la dextrosa proporciona los nutrientes que hacen viables a las plaquetas), y velocidades lentas de centrifugación (son parámetros estándar de centrifugado: 1.400 RPM durante 7 minutos)20.
Es posible utilizar centrífugas convencionales de laboratorio para obtener el PRP, aunque el proceso es tedioso, o al menos requiere cierta pulcritud en la manipulación. Todo ello hace difícil mantener la esterilidad, por lo que es imprescindible tener protocolizado el procedimiento y ser muy cuidadosos. Además, estas técnicas pueden no optimizar el rendimiento en cuanto a la concentración de plaquetas o de proteínas secretoras5,20.
Dependiendo de la cantidad de PRP que se necesite, se pueden utilizar diferentes tecnologías que combinan la velocidad de centrifugación con dispositivos concentradores de plaquetas. A pesar de coincidir en el fundamento de la técnica, los rendimientos varían en cuanto a viabilidad (30-85%) y concentración de plaquetas (2 a 8 veces sobre el nivel normal)5,7,20.
Existen diferentes protocolos para la obtención del concentrado plaquetario, de acuerdo a cada sistema e incluso a cada autor. Así, algunos presentan dos centrifugados, otros simplemente uno, y existe una amplia variación en cuanto a los tiempos de centrifugado (Tabla 1).
Atendiendo a la lógica de proporciones, cabría esperar que la concentración de proteínas secretoras fuera proporcional a la concentración de plaquetas. Aunque dicha proporcionalidad se cumple en PDGF, TGF-β y EGF, no se cumple en VEGF ni IGF. Eppley et al.21 y Weibrich et al.16 no encontraron utilidad al uso de la concentración de plaquetas para predecir los niveles resultantes de proteínas secretoras en el PRP resultante. En cualquier caso, los niveles de proteínas siempre fueron inferiores a los esperables, lo que podría deberse a una activación parcial de las plaquetas o a que parte de dichas proteínas se quedaran fijadas al coágulo.
Weibrich et al evaluaron la capacidad de concentrar plaquetas y factores de crecimiento con diversos sistemas de producción de PRP. Se evaluaron la plasmaféresis de banco de sangre (Blook Bank), Curasan Kit, Smart PreP, Friadent, PCCS, y PRGF (Tabla 2).
En una primera suposición, podríamos pensar que los niveles de factores de crecimiento son directamente proporcionales al número de plaquetas concentradas. Sin embargo, los datos publicados por Weibrich et al no demuestran una correlación estadísticamente significativa entre la concentración plaquetaria y los niveles de factores de crecimiento. Este hecho probablemente se deba a la gran variabilidad celular en cuanto a la producción y almacenamiento de factores de crecimiento, lo que significa que diferentes individuos necesitarán diferentes concentraciones de plaquetas para conseguir un mismo efecto biológico. Sin embargo, no se encontraron diferencias en los niveles de factores de crecimiento en función del sexo y la edad.
Activación del PRP
Después de su preparación, el PRP es estable en condiciones de anticoagulación durante 8 horas o más. El PRP debe activarse para que los gránulos α liberen sus contenidos. El coágulo que se forma sirve de vehículo para contener las proteínas secretoras y mantenerlas en el lugar de la herida. Distintos autores proponen diferentes métodos de activación de PRP. Hay quien mezcla a priori los componentes: desde la simple mezcla de cloruro cálcico y trombina con PRP, hasta la mezcla cuantificada de PRP, cloruro cálcico/trombina, aire y variables tiempos de agitación22.
Algunos autores proponen que la mezcla del PRP y la solución activadora se produzca in situ sobre la herida. Para ello utilizan un dispositivo que aúna 2 jeringas con diferente tamaño de émbolo, una con PRP y otra con la solución activadora. La activación se produce al mezclarse ambas soluciones inmediatamente antes de dispensarlas sobre la herida, es decir, las plaquetas ya se aplican activadas3.
Sea cual fuere el método utilizado para la activación del PRP, la mezcla activada debe aplicarse antes de 10 minutos para evitar que se retraiga el coágulo y que secuestre en su superficie las proteínas secretoras.
Discusión
Los factores de crecimiento activados se enlazan a los receptores de sus células diana: células madre mesenquimales, osteoblastos, adipoblastos, condroblastos, fibroblastos, células endoteliales, células epidérmicas, mioblastos5,24.
La gran popularización del PRP tuvo sus orígenes en los campos de la cirugía oral y la odontología por los efectos estimulantes de este preparado sobre los fibroblastos de la estructura periodontal y la mucosa oral, y sobre los osteblastos del hueso alveolar. Estudios clínicos han evidenciado una mejora en la curación alveolar cuando se usa PRP, tanto a nivel de la regeneración ósea subyacente como del recubrimiento de partes blandas. Anitua et al son considerados unos de los grandes propulsores del preparado de PRP, y fueron quienes establecieron la técnica más sencilla y más popular para la preparación del mismo. Anitua et al publican un gran número de estudios, la mayoría de ellos en el campo de la implantología dental, en los que demuestra mejores resultados de regeneración ósea, osteointegración y ganancia de partes blandas cuando se usa el preparado de PRP de manera aislada y/o combinado con otras sustancias como los sustitutos óseos25-29.
Okuda y Kawase et al demuestran un incremento en la síntesis del ADN durante el proceso de regeneración periodontal en los pacientes tratados con PRP, evaluando la actividad mitógena mediante la incorporación de 5-bromodeoxiuridina, observando un contaje celular significativamente superior en el periodonto de los pacientes tratados con PRP respecto al grupo control. Otros estudios de Kawase y Okuda et al observan las propiedades potenciadoras de la regeneración de los fibroblastos gingivales y de las células del ligamento periodontal, así como de su capacidad reguladora de la síntesis de colágeno en la matriz extracelular. Las propiedades del PRP también han sido utilizadas en el manejo de defectos de recesión gingival, aisladamente o en combinación con diferentes técnicas de regeneración ósea guiada y distintos biomateriales30-33.
Sus efectos proregeneradores del tejido óseo también se han usado ampliamente en el campo de la cirugía maxilofacial. A principios de los años 80, Matras describió las cualidades y aplicaciones del gel rico en plaquetas en la cirugía maxilofacial como sellante de tejidos, agente hemostático en defectos de tejidos blandos, y potenciador de la consolidación fracturaria y de la fijación de injertos cutáneos. Los estudios de Fennis et al en cabras y en humanos sobre el empleo del PRP en cirugía maxilofacial son los que aportan una mayor evidencia científica dentro de la literatura sobre el papel del PRP en la regeneración ósea, constatando mejorías en la curación ósea. Los exámenes de Fennis et al evidencian, a nivel histomorfométrico, una menor encapsulación fibrosa de los injertos óseos de córtico-esponjosa particulados usados en la reconstrucción de defectos óseos mandibulares, y un recuento más elevado del número de capilares neoformados; y, a nivel clínico-radiológico, observan una mejor unión ósea de los injertos óseos al hueso mandibular, una mayor formación de callo óseo, y una mayor densidad ósea. Asimismo, el grupo de Fennis et al ha presentado estudios en los que se han demostrado los efectos regeneradores del PRP sobre el hueso en situaciones tan adversas para la adecuada regeneración ósea como son: usando córtico-esponjosa de cresta inguinal anterior previamente irradiada, o usando injertos de ácido poliláctico, y demostrando en ambos casos una regeneración ósea mandibular lo suficientemente aceptable como para conseguir el soporte estructural suficiente para sustentar el emplazamiento de implantes dentales. En el mismo orden de investigaciones, Kim efectuó un estudio controlado colocando implantes dentales de titanio en perros utilizando polvo de hueso desmineralizado asociado o no a PRP, observando a nivel histológico una osteointegración significativamente superior de los implantes dentales cuando el polvo óseo se combinaba con PRP respecto al grupo control34-38.
Una de las aplicaciones en las que existe unanimidad general sobre las ventajas de aplicar el preparado de PRP es en aquellos casos en los que se busca su efecto como adhesivo biológico. Se ha utilizado para cohesionar injertos óseos o biomateriales particulados, como membrana biológica o en forma de spray para aumentar la adhesividad de colgajos cutáneos o mucosos al lecho receptor. Por sus efectos sobre los tejidos blandos, el PRP se ha usado en cirugía plástica y dermatológica para favorecer y modular la curación en los colgajos cutáneos repuestos, ofreciendo una mejor regeneración tisular, un mejor sellado y una mejor hemostasia de todos los procedimientos quirúrgicos que llevan implícito el levantamiento de un colgajo. Se ha utilizado en ritidectomías, mamoplastias, blefaroplastias y en otras cirugías de colgajo, así como tras el «laser resurfacing» y en quemaduras. Los autores atribuyen al uso de PRP en los colgajos quirúrgicos ventajas como: una mejor curación de las heridas, con un resultante menor tiempo de recuperación para el paciente; la eliminación de espacios muertos; la hemostasia sobre el sangrado capilar; una disminución de la necesidad de usar drenajes; una menor necesidad de vendajes compresivos; un menor edema postoperatorio en las primeras 72 horas, que a su vez conduce a un menor dolor en el postoperatorio inmediato.
En traumatología, medicina deportiva y cirugía artroscópica también se ha aplicado PRP en un intento de mejorar la curación de lesiones musculares, cartilaginosas, tendinosas u óseas, existiendo estudios al respecto muy prometedores. Un estudio animal en conejos realizado por el grupo de Reinholz et al39 revela que el plasma rico en factores de crecimiento inyectado en el periostio de articulaciones añosas es capaz de inducir un cambio de celularidad y una producción de colágeno comparable a las articulaciones de los conejos jóvenes, es decir, produce un rejuvenecimiento del periostio envejecido.
En neurocirugía también se ha utilizado el PRP para mejorar el proceso de fusión espinal o la regeneración de nervios periféricos. Análogamente al uso del PRP para el tratamiento del envejecimiento facial, en neurocirugía también encontramos indicaciones de este preparado en patologías neurodegenerativas como el Alzheimer, y aplicaciones prometedoras como la regeneración del tejido dañado tras la isquemia cerebral40,41.
El PRP es también muy eficaz en el tratamiento de úlceras crónicas de piel y tejidos blandos, ya que estimula notablemente la curación y cierre de las heridas ulcerosas, a menudo difíciles de curar y de tórpida evolución, sobre todo en los pacientes diabéticos. Cervelli et al también evalúan los efectos del PRP para la curación de úlceras crónicas con resultados muy satisfactorios42.
La más novedosa aplicación del PRP y la que actualmente genera un mayor número de estudios de investigación y artículos al respecto es la que se le ha venido dando en los últimos años en el campo de la ingeniería tisular. Los factores de crecimiento que son secretados por las plaquetas actúan promoviendo la proliferación y el crecimiento de las células, y algunos de ellos, sobre todo el factor de crecimiento insulínico (IGF) y el TGF-β, promoviendo también el proceso de diferenciación tisular de las células madre y de las células inmaduras sobre las que actúan mediante señalización intercelular. La aplicabilidad para la creación tisular asistida por ingeniería se ha difundido prácticamente a todas las anteriores aplicaciones ya descritas previamente para el PRP, redescribiendo de este modo el papel del plasma rico en factores de crecimiento como una herramienta biológica capaz de potenciar la creación de células maduras a partir de sus precursores en su línea de diferenciación celular, además de mantener el estímulo proliferativo y revitalizante necesario para el estado óptimo de las células maduras sobre las que actúa43.
Plasma rico en plaquetas y estética facial
El PRP es una de las herramientas médicas regenerativas más novedosas en la medicina anti-aging, y son patentes sus efectos beneficiosos sobre el rejuvenecimiento cutáneo; aunque el mecanismo de acción de los factores de crecimiento es un terreno en el que aún queda mucho por investigar. En el ámbito de la medicina cosmética y estética tenemos varias formas de utilizar los efectos del plasma rico en factores de crecimiento.
Primeramente, el PRP se puede usar de manera tópica por sus efectos estimuladores sobre el fibroblasto dérmico, en forma de coágulo a modo de mascarilla, o, más frecuentemente, mediante pulverización del mismo. Se suele usar como terapia tópica tras las exfoliaciones químicas o físicas o tras el «laser resurfacing», a modo de bioestimulador de la regeneración cutánea. También usamos el plasma rico en factores de crecimiento en forma de coágulo para rellenar cicatrices, arrugas, o surcos como el de la cuenca orbitaria («tear through»).
Existen en el mercado dermocosmético diversos preparados tópicos comercializados que incluyen en su composición factores de crecimiento y proteínas solubles de matriz secretadas por fibroblastos dérmicos humanos. La aplicación tópica de factores de crecimiento humanos en múltiples estudios clínicos ha demostrado reducir los signos y síntomas del envejecimiento cutáneo, incluyendo una reducción en las arrugas y la elastosis, y un incremento en la síntesis de colágeno dérmico estadísticamente significativos. A nivel histológico, se ha evidenciado que producen un incremento en el grosor de la epidermis y un aumento en la densidad de fibroblastos en la dermis superficial.
También con el objetivo de realizar una bioestimulación cutánea, podemos utilizar el PRP a nivel intradérmico, a modo de mesoterapia, para el tratamiento de arrugas, elastosis o discromías. La administración intradérmica de plasma rico en plaquetas se ha manifestado como un estímulo para la producción de colágeno tipo I por parte de la célula fibroblástica. La inyección intradérmica de factores de crecimiento produce cambios clínicos notables sobre la piel envejecida: restaura la vitalidad cutánea, aumenta el grosor de la piel, recupera la consistencia elástica, mejora la afluencia vascular, estimula las secreciones, y mejora la tersura y apariencia de la piel. Los factores de crecimiento regulan la remodelación de la epidermis y de la dermis, y tienen una gran influencia sobre la apariencia y textura de la piel.
Otra aplicación novedosa del PRP es la destinada a mejorar la calidad celular de las infiltraciones de tejido graso libre lipoaspirado en la lipoescultura42,44. El grupo de Cervelli et al ha publicado los más destacados estudios sobre los efectos del PRP mezclado con injertos de grasa libre usados para el rejuvenecimiento cutáneo, evidenciando, a nivel clínico, un mayor porcentaje de mantenimiento en el tiempo del contorno restaurado y de la tridimensionalidad estereológica cuando el injerto graso es mezclado con PRP, que cuando se aplica de manera aislada; e, in vitro, un significante incremento de las células adipocitarias.
Conclusiones
El grado de reacción inflamatoria disminuye significativamente cuando se añade plasma rico en plaquetas al tejido mesenquimal en proceso de curación.
El PRP promueve la biointegración y la supervivencia de las células mesenquimales sobre las que actúa44.
Bibliografía
1. Kakudo N, Minakata T, Mitsui T, Kushida S, Notodihardjo FZ, Kusumoto K. Proliferation-promoting effect of platelet-rich plasma on human adipose-derived stem cells and human dermal fibroblasts. Plast Reconstr Surg. 2008; 122:1352-60. [ Links ]
2. Bhanot S, Alex JC. Current aplications of platelet gels in facial plastic surgery. Facial Plast Surg. 2002; 18:27-33. [ Links ]
3. Anitua E, Andía I, Ardanza B, Nurden P, Nurden AT. Autologous platelets as a source of proteins for healing and tissue regeneration. Thromb Haemost. 2004; 91:4-15. [ Links ]
4. Man D, Plosker H, Windland-Brown JE. The use of autologous platelet-rich plasma (platelet gel) and autologous platelet-poor plasma (fibrin glue) in cosmetic surgery. Plast Reconstr Surg. 2001; 107:229-37. [ Links ]
5. Marx RE. Platelet-rich plasma: Evidence to support its use. J Oral Maxillofac Surg. 2004; 62:489-96. [ Links ]
6. George JN. Platelets. Lancet. 2000; 355:1531-9. [ Links ]
7. Welsh WJ. Autologous platelet gel: clinical function and usage in plastic surgery. Cosmetic Derm. 2000; 11:13. [ Links ]
8. Lucarelli E, Beccheroni A, Donati D, Sangiorgi L, Cenacchi A, Del Vento AM, et al. Platelet-derived growth factors enhance proliferation of human stomal stem cells. Biomaterials. 2003; 24:3095-100. [ Links ]
9. Zimmermann R, Arnold D, Strasser E, Ringwald J, Schlegel A, Wiltfang J, et al. Sample preparation technique and white cell content influence the detectable levels of growth factors in platelet concentrates. Vox Sang. 2003; 85:283-9. [ Links ]
10. Robiony M, Polini F, Costa F, Politi M. Osteogenesis distraction and platelet-rich plasma for bone restoration of the severly atrophic mandible: preliminary results. J Oral Maxillofac Surg. 2002; 60:630-5. [ Links ]
11. Peñarrocha M, Sanchís JM, Martínez JM. Factores de crecimiento y proteínas que influyen en el crecimiento óseo: aplicaciones en implantología oral. Periodoncia. 2001; 11:205-16. [ Links ]
12. Beca T, Hernández G, Morante S, Bascones A. Plasma rico en plaquetas. Una revisón bibliográfica. Av Periodon Implantol. 2007; 19:39-52. [ Links ]
13. Meinel L, Zoidis E, Zapf J, Hassa P, Httiger MO, Auer JÁ, et al. Localized insulin-like growth factor 1 delivery to enhance new bone formation. Bone. 2003; 33:660-72. [ Links ]
14. Tam WL, Ang YS, Lim B. The molecular basis of ageing in stem cells. Mech Ageing Dev. 2007; 128:137-48. [ Links ]
15. Mehta S, Watson JT. Platelet rich concentrate: basic science and current clinical applications. J Orthop Trauma. 2008; 22:432-8. [ Links ]
16. Weibrich G, Kleis WK, Hafner G, Hitzler WE. Growth factor levels in platelet-rich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg. 2002; 30:97-102. [ Links ]
17. Arora NS, Ramanayake T, Ren YF, Romanos GE. Platelet-rich plasma: a literature review. Implant Dent. 2009; 18:303-10. [ Links ]
18. Bashutski JD, Wang HL. Role of platelet-rich plasma in soft tissue root-coverage: a review. Quintessence Int. 2008; 39:473-83. [ Links ]
19. Nikolidakis D, Jansen JA. The biology of platelet-rich plasma and its application in oral surgery: literature review. Tissue Eng Part B Rev. 2008; 14:249-58. [ Links ]
20. Marx RE. Platelet-rich plasma (PRP): what is PRP and what is not PRP?. Implant Dent. 2001; 10:225-8. [ Links ]
21. Eppley BL, Woodell JE, Higgins J. Platelet quantification and growth factor analysis from platelet-rich plasma: implications for wound healing. Plast Reconstr Surg. 2004; 114:1502-8. [ Links ]
22. Eppley BL, Pietrzak WS, Blanton M. Platelet-rich plasma: A review of biology and applications in plastic surgery. Plast Reconstr Surg. 2006; 118:147e-59e. [ Links ]
23. Solé M. Curació de les lesions tissulars. En: Ordi J, editor. Anatomia patològica general, 16. Barcelona: Edicions Universitat de Barcelona; 1998. p. 7–76. [ Links ]
24. Gregoire FM, Smas CM, Sul HS. Understanding adipocyte differentiation. Physiol Rev. 1998; 78:783-809. [ Links ]
25. Anitua E. Enhancement of osseointegration by generating a dynamic implant surface. JJ Oral Implantol. 2006; 32:72-6. [ Links ]
26. Sánchez M, Anitua E, Azofra J, Andía I, Padilla S, Mujika I. Comparison of surgically repaired Achilles tendon tears using platelet-rich fibrin matrices. Am J Sports Med. 2007; 35:245-51. [ Links ]
27. Anitua E, Sánchez M, Nurden AT, Zalduendo M, De la Fuente M, Azofra J, et al. Reciprocal actions of platelet-secreted TGF-beta1 on the production of VEGF and HGF by human tendon cells. Plast Reconstr Surg. 2007; 119:950-9. [ Links ]
28. Anitua E, Aguirre JJ, Algorta J, Ayerdi E, Cabezas AI, Orive G, et al. Effectiveness of autologous preparation rich in growth factors for the treatment of chronic cutaneous ulcers. J Biomed Mater Res B Appl Biomater. 2008; 84:415-21. [ Links ]
29. Anitua E, Sánchez M, Orive G, Andía I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials. 2007; 28:4551-60. [ Links ]
30. Okuda K, Kawase T, Momose M, Murata M, Saito Y, Suzuki H, et al. Platelet rich plasma contains high levels of platelet derived growth factors and transforming growth factor beta and modulates the proliferation of periodontal related cells in vitro. J Periodontal. 2003; 74:858-64. [ Links ]
31. González Lagunas J. Plasma rico en plaquetas. Rev Esp Cir Oral y Maxilofac. 2006; 2:89-99. [ Links ]
32. Kawase T, Okuda K, Wolff LF, Yoshie H. Platelet rich plasma derived fibrin clot formation stimulates collagen synthesis in periodontal ligament and osteoblastic cells in vitro. J Periodontol. 2003; 74:858-64. [ Links ]
33. Kawase T, Okuda K, Saito Y, Amizuka N, Suzuki H, Yoshie H. Platelet-rich plasma provides nucleus for mineralization in cultures of partially differentiated periodontal ligament cells. In Vitro Cell Dev Biol Anim. 2005; 41:171-6. [ Links ]
34. Fennis JP, Stoelinga PJ, Jansen JA. Mandibular reconstruction: a clinical and radiographic animal study on the use of autogenous scaffolds and platelet-rich plasma. Int J Oral Maxillofac Surg. 2002; 31:281-6. [ Links ]
35. Fennis JP, Stoelinga PJ, Jansen JA. Mandibular reconstruction: a histological and histomorphometric study on the use of autogenous scaffolds, particulate cortico-cancellous bone grafts and platelet-rich plasma in goats. Int J Oral Maxillofac Surg. 2004; 33:48-55. [ Links ]
36. Merkx MA, Fennis JP, Verhagen CM, Stoelinga PJ. Reconstruction of the mandible using preshaped 2.3mm titanium plates, autogenous particulate cortico-cancellous bone grafts and platelet-rich plasma: a report of eight patients. Int J Oral Maxillofac Surg. 2004; 33:733-9. [ Links ]
37. Fennis JP, Stoelinga PJ, Jansen JA. Reconstruction of the mandible with an autogenous irradiated cortical scaffold, autogenous corticocancellous bone-graft and autogenous platelet-rich plasma: an animal experiment. Int J Oral Maxillofac Surg. 2005; 34:158-66. [ Links ]
38. Fennis JP, Stoelinga PJ, Merkx MA, Jansen JA. Reconstruction of the mandible with a poly (D,L-lactide) scaffold, autogenous corticocancellous bone graft, and autogenous platelet-rich plasma: an animal experiment. Tissue Eng. 2005; 11:1045-53. [ Links ]
39. Reinholz GG, Fitzsimmons JS, Casper ME, Ruesink TJ, Chung HW, Schagemann JC, et al. Rejuvenation of periosteal chondrogenesis using local growth factor injection. Osteoarthritis Cartilage. 2009; 17:723-34. [ Links ]
40. Hegewald AA, Ringe J, Sittinger M, Thome C. Regenerative treatment strategies in spinal surgery. Front Biosci. 2008; 13:1507-25. [ Links ]
41. Masuda K, Oegema TR, An HS. Growth factors and treatment of intervertebral disc degeneration. Spine (Phila Pa 1976). 2004; 29:2757-69. [ Links ]
42. Cervelli V, Gentile P, Scioli MG, Grimaldi M, Casciani CU, Spagnioli LG, et al. Application of platelet-rich plasma to fat grafting during plastic surgical procedures: clinical and in vitro evaluation. Tissue Eng Part C Methods. 2009; 15:625-34. [ Links ]
43. Lavik E, Langer R. Tissue engineering: current state and perspectives. Appl Microbiol Biotechnol. 2004; 65:1-8. [ Links ]
44. Rodríguez-Flores J, Palomar-Gallego MA, Enguita-Valls AB, Rodríguez-Peralto JL, Torres J. Influence of Platelet-Rich Plasma on the Histologic Characteristics of the Autologous Fat Graft to the Upper Lip of Rabbits. Aesth Plast Surg. 2011; 35:480-6. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
jrodri20@hotmail.com
(J. Rodríguez Flores)
Recibido 13 Agosto 2011
Aceptado 16 Octubre 2011















