Introducción
El carcinoma análogo secretor de mama (MASC) es una nueva entidad de tumores de glándula salival, descrito por primera vez en 2010 por Skálová et al.1, que cuenta con menos de 100 casos publicados hasta el momento. Se presenta con un ratio 1,4:1 hombre-mujer2, y en edades entre los 13 y 77 años3. La forma de presentación más frecuente es como una masa asintomática en la glándula parótida, seguido de la cavidad oral, labio, paladar blando y mucosa oral1. Es considerado un tumor de bajo grado, con potencial de transformación a carcinoma de alto grado4. Además, actualmente, se están describiendo variantes genéticas más agresivas que la clásica5.
La gran diversidad de tumores de glándulas salivales que existen (alrededor de 40 tipos histológicos de tumores epiteliales) hace que sea difícil su diagnóstico preoperatorio. A este respecto, el estudio citomorfológico molecular de translocaciones supone un gran avance.
Se conocen translocaciones en muchos de estos tumores glandulares, como por ejemplo en el adenoma pleomorfo, el carcinoma mucoepidermoide, el MASC, el carcinoma adenoide quístico, el carcinoma de células claras, el carcinoma exadenoma pleomorfo y el adenocarcinoma cribiforme. Estas translocaciones tienen influencia en el pronóstico como marcadores y representan una posible diana terapéutica para el futuro6.
En casi el 100% de los casos de MASC, al igual que en el carcinoma mamario secretor7, existe una translocación cromosómica t(12,15) (p13,q25) que produce la fusión oncogénica ETV6-NTRK3, que resulta en un gen que codifica una tirosina-quinasa que tiene un papel importante en la oncogénesis, activando así la proliferación celular y aumentando la supervivencia de las células tumorales, hecho que ya se ha visto en otros tumores, como el fibrosarcoma infantil, leucemia mieloide aguda y nefroma mesoblástico congénito6. Además de estos rasgos, el MASC comparte con el carcinoma secretor de mama una inmunohistoquímica similar, siendo proteína S-100, GCDFP-15, vimentina, mamoglobina y EMA positivas. Sin embargo, el MASC es ER/PR/Her2 negativo4.
Presentamos 2 casos nuevos de MASC, su diagnóstico, tratamiento y supervivencia hasta el momento actual y una revisión de la literatura.
Material y métodos
Se ha realizado un estudio retrospectivo de los tumores parotídeos intervenidos en los últimos 5 años en nuestro servicio y una revisión de los casos publicados con localización parotídea (tabla 1). De los 367 casos operados, 45 eran malignos, y de estos, encontramos 2 únicos casos de MASC.
Tabla 1 Revisión de los casos de carcinoma análogo secretor de mama publicados en la literatura, con localización parotídea exclusivamente
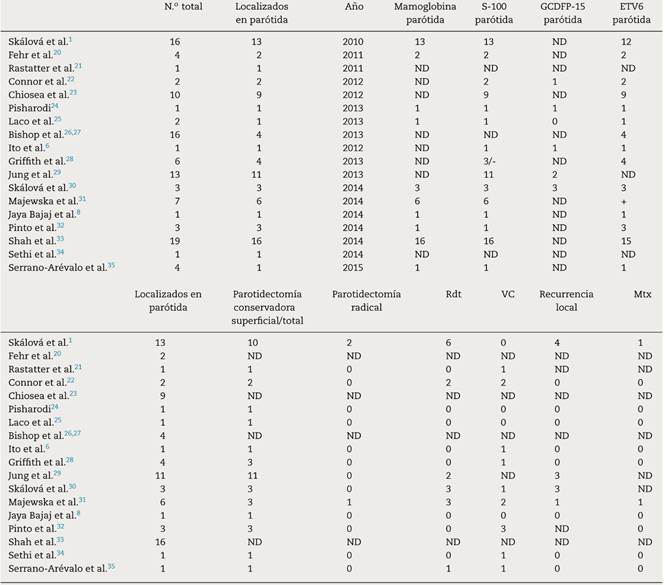
ND: no disponible.
El primer caso correspondía a una paciente mujer de 55 años, alérgica a AINES, con antecedentes médicos de hipertensión arterial, fibromas uterinos, artrosis y migrañas, que acudió a nuestras consultas por presentar una tumoración en la glándula parótida derecha de 3 × 3 cm de un año de evolución. En la resonancia magnética se identificó una tumoración parotídea derecha con predominio de componente quístico y alguna zona de componente sólido, sin poder descartar malignidad. Se realizó una PAAF en la que se identificaba un fondo quístico constituido por macrófagos, muchos de ellos cargados con hemosiderina y células de talla intermedia con amplios citoplasmas granulares oncocíticos y con ocasionales vacuolas. Los núcleos eran centrales, ovalados, monomorfos y con pequeño nucléolo central. Se consideró un tumor de Whartin como primer diagnóstico.
La paciente fue intervenida en nuestro servicio, realizándose parotidectomía subtotal derecha. Se envió una muestra anatomopatológica intraoperatoria, en la que se reconocía una tumoración en parte quística, con características de tumor epitelial con metaplasia oncocítica no tipificable (fig. 1).

Figura 1 En la imagen se observa una tumoración predominantemente sólida con áreas quísticas. La tumoración se halla bien delimitada, con una seudocápsula fibrosa que la separa del parénquima de glándula salival. Hematoxilina-eosina (lupa).
El segundo caso correspondía a una paciente mujer de 82 años de edad, que acudió a consultas por presentar una tumoración en parótida izquierda de 5 meses de evolución. Como método diagnóstico, se realizó una ecografía en la que se visualizaba una tumoración parotídea de 11 × 18 mm, bien delimitada, de ecogenicidad homogénea, con diagnóstico de adenoma pleomorfo como primera posibilidad. En la PAAF se observaron células epiteliales de talla intermedia y grande, con abundante citoplasma microgranular eosinófilo y núcleo grande, que sugirió el diagnóstico de lesión oncocitoide con atipia citológica leve.
Fue intervenida, realizándose parotidectomía superficial izquierda.
Resultados
En la primera tumoración, el primer diagnóstico anatomopatológico fue de carcinoma de glándula salival menor, probable MASC, sin poder descartarse carcinoma de células acinares (T2N0M0). Se visualizaban células de citoplasma eosinófilo, con patrón de crecimiento variable: microquístico, sólido, papilar, folicular y tubular. Bajo porcentaje de atipia e invasión perineural y linfovascular ausente. Mediante técnicas inmunohistoquímicas el diagnóstico más probable fue de MASC, siendo positivas para CK7, vimentina, S-100, mamoglobina, GATA-3 y GCDFP-15, y negativas para DOG1 y p63. Para confirmar el diagnóstico se analizó la translocación molecular ETV6-NTRK3, que fue positiva y confirmatoria.
A pesar de que los márgenes quirúrgicos de la parotidectomía subtotal estaban respetados, como expresaba ampliamente proteína S-100, relacionada en algún estudio con mayor riesgo de transformación a alto grado8, se decidió realizar tratamiento complementario con radioterapia postoperatoria.
En el segundo tumor la anatomía patológica postoperatoria informó de tumoración quística con patrón quístico, sólido, ductal y cribiforme, con diagnóstico de MASC, y con patrón de crecimiento infiltrativo. Las técnicas inmunohistoquímicas revelaron CK7, EMA, mamoglobina, GATA-3 y GCDFP-15 positivas; p63 y actina negativas y, aunque raro en este tipo de carcinomas, también la proteína S-100 era negativa. Dos de los márgenes de resección estaban a menos de 5 mm.
En este caso, la histología y la inmunohistoquímica fueron suficientes para el diagnóstico y no fue necesaria confirmación mediante FISH.
El tratamiento se completó con radioterapia postoperatoria, debido a la proximidad de los márgenes.
En las figuras 2 y 3 pueden observarse, respectivamente, imágenes de la citología y la inmunohistoquímica con H-E de ambas lesiones.

Figura 2 Rasgos citológicos de las neoplasias (hematoxilina-eosina 20×). A) La celularidad es de talla media, con amplio citoplasma eosinófilo. Los núcleos son de localización central y presentan leve atipia, con nucléolo prominente y refuerzo de la membrana nuclear. B) La segunda neoformación, por contra, mostraba un crecimiento más trabecular y en hileras, con márgenes mal definidos. Las células también eran de talla media, con citoplasma eosinófilo. La atipia nuclear era mayor, con más anisocariosis y cromatina vesiculosa.
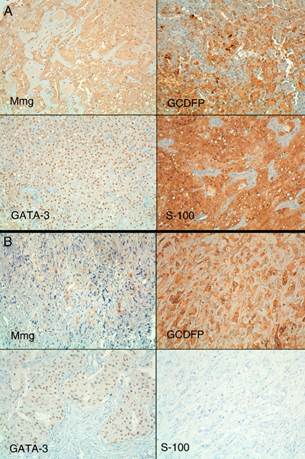
Figura 3 Perfil inmunohistoquímico de ambas lesiones (hematoxilina-cromógeno 20×). A) La primera lesión mostró expresión difusa e intensa de mamoglobina (Mmg), gross cystic disease fluid protein (GCDFP), GATA-3 y S-100. B) En la segunda lesión la expresión difusa de GCDFP y GATA-3 se mantenía, siendo la expresión de Mmg débil. La segunda lesión no mostró expresión de S-100.
Durante el seguimiento llevado a cabo 12 y 18 meses después, no se han observado recurrencias ni metástasis a distancia.
Discusión
El MASC es una variante de reciente aparición, lo que, añadido a la gran cantidad de tumores de glándulas salivales que existen, dificulta todavía más su diagnóstico preoperatorio, como queda reflejado en nuestros 2 casos; de los 45 malignos solo 2 eran MASC, aunque deberíamos tener en cuenta que, debido a su reciente descripción, muchos tumores han podido ser mal tipificados o diagnosticados. Desde su descripción en 2010 se han realizado varios estudios sobre su diagnóstico diferencial con el resto de tumores de glándulas salivales, según técnicas histológicas, inmunohistoquímicas y de genética molecular, dado que a veces es necesaria la confirmación del mismo mediante el análisis de la translocación molecular ETV6. Histológicamente sabemos que se caracteriza por presentar células con citoplasma vacuolado rosa, con secreciones de mucinosas a eosinófilas y gránulos de zimógeno, formando patrones microquísticos, tubulares, papilares o sólidos, patrón similar al presentado por otro tipo de tumores como son el carcinoma secretor de mama, el nefroma mesoblástico, el fibrosarcoma congénito y algunas formas de leucemia mieloide aguda. Su forma de presentación más frecuente es el patrón papilar9.
Por otro lado, el MASC debería ser incluido en el diagnóstico diferencial de lesiones mucinosas de glándula salival con cambios quísticos, como son el carcinoma adenoide quístico, el carcinoma mucoepidermoide de bajo grado y otras lesiones benignas como el adenoma pleomorfo con metaplasia mucinosa o el tumor de Whartin.
Para ello, además del estudio genético-molecular FISH para la fusión ETV6-X, que nos da el diagnóstico confirmatorio en la mayoría de las ocasiones, la inmunohistoquímica se ha convertido en una de las armas más potentes para el diagnóstico diferencial, debido a que no es posible realizar en todos los tumores técnicas de estudio genético, dado el tiempo que supone su realización y su alto coste. Aunque ninguno de los marcadores inmunohistoquímicos tiene una especificidad del 100%, estos son muy útiles en el cribado inicial, para posteriormente confirmar el diagnóstico si fuera necesario con técnicas moleculares10.
En la tabla 2 se muestran algunos de los marcadores inmunohistoquímicos que sirven para diferenciar los diferentes tipos de tumores de glándula salival.
Tabla 2 Marcadores inmunohistoquímicos en el diagnóstico diferencial de tumores de glándula salival
| MASC | AcCC | Carcinoma adenoide quístico | Mucoepidermoide bajo grado | Carcinoma ductal bajo grado | Carcinoma ductal de alto grado | |
|---|---|---|---|---|---|---|
| Mamoglobina | + | −/+ | + | +/− | + | +/− |
| S-100 | + | −/+ | - | − | + | −/+ |
| GCDFP-15 | + | +/− | - | +/− | ||
| GATA-3 | + | - | - | + | - | + |
| p63 (n) | −/+ | −/+ | + | + | ||
| p63 (c) | + | - | - | - | ||
| STAT5 | + | |||||
| DOG1 | +/− (p) | ++ (c) | + | −/+ (p) | −/+ (p) | |
| Herz2 | − | −/+ | - | + | - | +++ |
(c): citoplasmático; (n): nuclear; (p): periférico.
Uno de los diagnósticos diferenciales más importantes del MASC es con el carcinoma de células acinares (AcCC), y aunque hay pocos casos descritos, el MASC parece ser más agresivo8. Citológicamente son muy similares, y aunque no se han encontrado diferencias significativas, se ha observado un mayor número de metástasis linfáticas en el MASC10. Fundamentalmente se diferencian en que el carcinoma de células acinares es generalmente mamoglobina, GATA-3 y S-100 negativas, DOG1 citoplasmático positivo y, citlógicamente, tiene gránulos citoplasmáticos basófilos y macronúcleos y suele ser de patrón sólido y microquístico, mientras que en el MASC el patrón suele ser microquístico o papilar y mamoglobina, GATA-3 y S-100 positivas10-12.
Respecto al carcinoma adenoide quístico, recientemente ha sido publicado que muchos de estos tumores, sobre todo los que no son de parótida, podrían ser MASC mal diagnosticados2. Existen 4 patrones de carcinoma adenoide quístico: sólido, microquístico, folicular y quístico-papilar. Este último y el microquístico, como hemos descrito anteriormente, son histológicamente similares al MASC, con la diferencia de que en el carcinoma adenoide quístico la proteína S-100 y GCDFP-15 son negativas. Debido a esta semejanza, sería recomendable que se realizara rutinariamente el estudio de la proteína S-100 y GCDFP-15 en todos los tumores adenoides quísticos con patrón papilar o microquístico con apariencia histopatológica de no serosos. Si la inmunohistoquímica es negativa, entonces, el diagnóstico es de carcinoma adenoide quístico7,10,13.
También se ha descrito la confusión citológica con el cistoadenocarcinoma cribiforme y el ductal de bajo grado, que son proteína S-100, GCDFP-15 y mamoglobina positivas en muchas ocasiones9,14. Pero que se caracterizan por mayor pleomorfismo nuclear y diátesis15. El carcinoma ductal de bajo grado se caracteriza por presentar proliferación intraductal multiquística con citoplasma amarillo, sin vacuolas, ni gránulos de zimógeno basófilo o secreciones mucinosas9.
Con el carcinoma ductal de alto grado, la diferencia fundamental es que este último es Her2 positivo.
Con el carcinoma mucoepidermoide de bajo grado que también es mamoglobina y GCDFP-15 positivas, la diferencia es que la proteína S-100 es negativa generalmente. La presencia de células con diferenciación epidermoide y mucinosa a la vez es un rasgo del carcinoma mucoepidermoide. Otro rasgo diferenciador es, además, el hecho de estar compuesto por más de una población de células, que suelen ser univacuoladas, mientras que en el MASC son más uniformes y multivacuoladas7,8,15.
La expresión de mamoglobina es por tanto sensible, pero no específica en el diagnóstico del MASC, siendo también positiva en el carcinoma ductal de bajo y alto grados y en el mucoepidermoide de bajo grado. La utilidad del marcador GCDFP-15, característico del carcinoma de mama, es discordante en la literatura, por ser poco específica y menos útil que la mamoglobina según los últimos estudios. La expresión de GCDFP-15 es negativa en el carcinoma adenoide quístico, pero positiva con expresión variable en el carcinoma de células acinares, en el cistoadenocarcinoma cribiforme, en el mucoepidermoide y en los adenocarcinomas no específicos7.
La coexpresión conjunta de mamoglobina, GCDFP-15, GATA-3 y S-100 es por tanto más específica, y suele limitar el diagnóstico a MASC, excluyendo la mayoría del resto de tumores. En nuestros 2 casos los 3 primeros marcadores fueron positivos en ambas tumoraciones, pero la proteína S-100, que ha demostrado ser bastante específica del MASC, fue negativa en el segundo.
Otro marcador importante es la proteína p63. Se ha visto que la expresión citoplasmática y no nuclear de esta proteína puede tener interés para el diagnóstico de MASC. Generalmente la expresión citoplasmática de p63 es negativa en los tumores de glándula salival, excepto en el adenocarcimona polimorfo de bajo grado y en el adenocarcinoma no específico. Sin embargo, es importante saber que aparece muy focalmente en el citoplasma y es difícil su interpretación en la biopsia7.
La expresión inmunohistoquímica y citológica de p-STAT5a es un nuevo marcador, que se ha relacionado con la fusión ETV6-NTRK3, y que ayudaría al diagnóstico diferencial de los demás tumores de glándulas salivales4. Por otra parte, además de la fusión oncogénica ETV6-NTRK3, se han encontrado otras translocaciones alternativas ETV6-X, que quizá estén asociadas con las variantes genéticas que tienen un curso clínico de la enfermedad más agresiva16. Como se ha visto en la leucemia mieloide aguda, donde la fusión de ETV6 con un gen u otro se asocia a mejor o peor pronóstico12.
En cuanto al tratamiento del MASC, todavía no está bien definido, debido a que la mayoría de los estudios son retrospectivos. No suele existir invasión perineural y linfovascular17, y, en los casos en los que se ha descrito, se ha visto que la translocación de genes era diferente a la clásica ETV6-NTRK312. A poca experiencia limita la evidencia de si medidas más agresivas para los carcinomas de bajo grado deberían de ser tomadas, ya que por la poca cantidad de casos descritos y la transformación a carcinomas de alto grado que se ha visto en algunos casos, no podemos concluir todavía si nos encontramos ante un tumor de bajo grado o no8,18.
El tratamiento contempla desde los tratamientos descritos hasta una parotidectomía radical con disección cervical y radioterapia adyuvante, y, en el futuro, la inhibición del gen ETV6-NTRK3 podría ser un tratamiento eficaz2. En la guía NCCN de tumores de cabeza y cuello, el protocolo estándar para los tumores de bajo grado, T1 y T2 N0 de glándula salival, es la resección quirúrgica sin vaciamiento cervical seguido de radioterapia si los márgenes quirúrgicos son de <5 mm, la resección es incompleta o hay invasión perineural; en los T3 y T4a de glándula parótida el tratamiento es la parotidectomía con exéresis completa del tumor, más vaciamiento cervical si son tumores de alto grado, estadio avanzado o N positivo18. Pero en algunos estudios como el de Jaya Bajaj et al.8 y Salat et al.11 ya se recomienda, en este tipo de tumor, realizar parotidectomía radical-subtotal y vaciamiento cervical, sobre todo si existen características o sospecha de transformación a alto grado.
En nuestros 2 casos se realizó una parotidectomía subtotal en un caso y una parotidectomía superficial en el otro. Sin vaciamiento cervical en ninguno de los 2 debido a la falta de un diagnóstico preoperatorio correcto y porque, clínica y radiológicamente, no presentaban adenopatías sospechosas, y postoperatoriamente el diagnóstico fue de tumor de bajo grado T2N0 en ambos casos. Se añadió tratamiento complementario con radioterapia en ambos. Y durante el seguimiento, 12 y 18 meses después de la cirugía respectivamente, no han presentado signos de recidiva locorregional.
En cuanto al uso de radioterapia postoperatoria, está normalmente indicada en márgenes quirúrgicos de <5 mm, resección incompleta, invasión perineural o tumores mayores de T28,11,18.
Respecto a la supervivencia y seguimiento, parece ser un tumor de bajo grado con buen pronóstico, pero también se han reportado casos de transformación a tumores de alto grado. Según Skálová, la tasa de recurrencia local es de un 15%, la de metástasis linfáticas de un 20% y la de metástasis a distancia de un 5%4,6,8. Y en algún estudio ya se ha observado una mayor probabilidad de metástasis regionales, recurrencia y metástasis a distancia que en los carcinomas de bajo grado, pero sin significación estadística19. El período de seguimiento varía entre 71 y 115 meses.
Conclusión
Poco a poco se están conociendo nuevos marcadores para realizar el diagnóstico diferencial entre el MASC y otras variantes tumorales de glándula salival. A pesar de que hasta el momento actual, la translocación ETV6-NTRK3 es la única que nos da el diagnóstico confirmatorio de MASC, cada vez son más los marcadores inmunohistoquímicos que se conocen, y que, añadidos a las características histológicas de los tumores, nos permiten realizar un cribado inicial. Sin embargo, más difícil e importante que el diagnóstico preoperatorio, y de lo que apenas se conocen datos, es su pronóstico y tratamiento. Son necesarios estudios prospectivos referentes a su tratamiento, comportamiento y supervivencia a largo plazo, para así poder establecer unas bases correctas en cuanto al manejo apropiado de este tipo de tumor.














