Introducción
La periodontitis crónica es una infección mixta causada principalmente por bacterias periodontopatógenas que residen en la placa subgingival. El primer paso en su tratamiento es reducir la infección, inflamación y bacterias causantes mediante el raspado y alisado radicular1,2.
El reconocimiento del origen y la especificidad de los microorganismos en la enfermedad periodontal fueron identificados al finalizar la década de los 70 del siglo pasado, incrementándose el interés por el empleo de terapias antimicrobianas que promuevan la supresión de los probables agentes etiológicos. A partir de esa fecha muchos grupos de investigadores empezaron a investigar los efectos de la administración sistémica de estos antimicrobianos como coadyuvantes al raspado y alisado radicular. Desafortunadamente por muchos años los resultados de esas investigaciones han sido inconclusos o contradictorios, especialmente al medir los efectos sobre la composición de la flora subgingival2.
Las dificultades técnicas para evaluar el complejo microbiano subgingival que es altamente colonizado por microorganismos anaerobios estrictos pasan por las carencias de métodos microbiológicos adecuados, sin embargo, al descubrir técnicas que no son dependientes de la viabilidad de la bacteria para su identificación como PCR, microarrays, u oligonucleótidos se lograron conocer los agentes etiológicos de la enfermedad periodontal3.
Los resultados de estos estudios confirman el rol de ciertos microorganismos como Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Treponema denticola, Tannerella forsythia, Prevotella intermedia, Parvimonas micra, Fusobacterium nucleatum, Selenomonas sputigena y Eubacterium nodatum en la aparición y el avance de la periodontitis4. Y tras la inclusión de pruebas de diagnóstico molecular incluyendo métodos de secuenciación se logró identificar otros microorganismos que se encuentran presente y podrían ser especies patógenas asociadas a la aparición de enfermedad periodontal; dentro de estas nuevas especies encontramos : Porphyromonas endodontalis y Bacteroidales; y dentro de las espiroquetas: Treponema lecithinolyticum y Treponema médium; Firmicutes: Filifactor alocis y S. sputigena4-8. Estos hallazgos han desempeñado un papel importante en nuestra comprensión de la etiología de las enfermedades periodontales, especialmente de la periodontitis crónica. Además, los resultados de estos estudios indican que para obtener efectos terapéuticos exitosos es tan importante fomentar el crecimiento de especies bacterianas compatible con el huésped como eliminar o suprimir los patógenos periodontales.
Los criterios de valoración clínica para la terapia periodontal son muy sencillos e incluyen ganancia de inserción clínica, la reducción de la profundidad de sondaje, sangrado al sondaje y supuración, evaluando la progresión de la enfermedad en el tiempo. Diversos ensayos clínicos aleatorizados han buscado evaluar los efectos de diferentes antibióticos sistémicos, usando terapias dobles como la combinación de metronidazol y amoxicilina9. Sin embargo, estos antibióticos exigen regímenes de dosificación necesarios que abarcan de 2 a 4 veces al día, durante 5 a 14 días contribuyendo en ocasiones a la disminución de la tasa de éxito debido al incumplimiento de la dosificación10.
Por otra parte la azitromicina, antibiótico de la familia de los macrólidos, posee un régimen de dosificación bastante simple y efectos secundarios limitados manteniendo concentraciones más altas y sostenidas en el fluido crevicular gingival que en el suero, además de poseer un amplio espectro de acción antimicrobiana hacia las bacterias anaerobias11.
Sayán y Chumpitaz12, en 2013, realizaron un estudio para evaluar la eficacia de la azitromicina asociada al raspado y alisado radicular en pacientes con enfermedad periodontal crónica, encontrando que el grupo que recibió la terapia periodontal convencional más azitromicina obtuvo una respuesta clínica favorable superior al grupo control, en términos de profundidad al sondaje y nivel de adherencia clínica. Estas diferencias fueron mayores durante los primeros meses de evaluación, sin embargo hasta la última evaluación realizada a los 6 meses los parámetros evaluados resultaron no significativos.
Buset et al.13, en 2015, encontraron mediante una revisión sistemática un beneficio potencial de la administración sistémica de azitromicina como adyuvante a la terapia periodontal no quirúrgica en pacientes con periodontitis crónica.
Por su parte Zhang et al.14, en 2015, encontraron un beneficio adicional de la administración sistémica de azitromicina en las bolsas periodontales inicialmente profundas pero no en los sitios de poca profundidad o moderados, asimismo mostró una tendencia a disminuir su efecto con relación al tiempo.
Sin embargo, Fonseca et al.15, en 2015, demostraron mediante un ensayo clínico controlado en 85 pacientes que la administración simultánea de la azitromicina al raspado y alisado radicular no provee ningún beneficio significativo independiente del protocolo usado.
Con todo ello, el empleo de estos antimicrobianos no solo puede traer efectos beneficiosos sino que también puede tener algunos riesgos para el sistema microbiano. Al no ser una terapia específica no solo afectaría a patógenos periodontales sino también a otros microorganismos residentes habituales y que más adelante podrían transformarse en resistentes o menos susceptible, comprometiendo la eficacia de la terapia antimicrobiana y el aumento de un fracaso clínico16.
El empleo de antimicrobianos sistémicos en el tratamiento de la periodontitis demostrados mediante ensayos clínicos aleatorios bien realizados debe conducir a un cambio en los protocolos de tratamiento periodontal; por esta razón se propuso realizar el presente estudio, cuyo propósito fue evaluar la eficacia de la antibioticoterapia sistémica con azitromicina asociada al raspado y alisado radicular para el tratamiento de pacientes con periodontitis crónica.
Material y método
El presente estudio fue un ensayo clínico controlado aleatorizado y triple ciego en grupos paralelos. La población estuvo constituida por los pacientes que acudieron con el diagnóstico de periodontitis crónica al servicio de Periodoncia de la Escuela de odontología en la Clínica Dental de la Universidad Católica Los Ángeles de Chimbote, sede Trujillo, entre marzo y diciembre de 2015. Considerando una población de 70 pacientes, divididos en 2 grupos.
Fueron incluidos en el estudio pacientes entre 30 y 60 años que firmaron un consentimiento informado, con diagnóstico de periodontitis crónica con al menos 15 piezas dentarias y al menos 6 lugares con profundidad de sondaje entre 5 y 7 mm y un nivel de inserción clínica entre 5 y 10 mm antes de iniciar el tratamiento.
Fueron excluidos del estudio los pacientes que estuvieron recibiendo terapia con antibióticos, analgésicos o antiinflamatorios durante los 30 días previos a su incorporación al estudio, así como aquellos que referían ser alérgicos a los macrólidos, fumadores, alcohólicos y/o drogadictos o aquellos que presentaron enfermedades sistémicas; tampoco fueron incluidas gestantes o pacientes que presentaron alteraciones físicas y mentales que pudieran impedir el cumplimiento de las indicaciones.
Fueron eliminados aquellos pacientes que no acudieron a sus citas de control en tiempo indicado y los que no cumplieron con las indicaciones postoperatorias.
Para la ejecución de la presente investigación, se contó con la aprobación de la Escuela de Odontología de la Universidad Católica los Ángeles de Chimbote, considerando los principios de la Declaración de Helsinki y la ley General de salud del Perú (Ley n.o 268429).
Se seleccionaron aleatoriamente 2 grupos. El primero de ellos, denominado grupo A, fue enmascarado para el operador, paciente y estadístico hasta el final de la elaboración de las tablas. Luego de realizado el RAR recibió una capsula de azitromicina 500 mg de laboratorios Farmindustria Lote N. 11171104, cada 24 h por 3 días. Cada paciente del grupo de estudio recibió llamadas telefónicas diarias con la finalidad de recordarles el cumplimiento de su dosis.
Mientras que el segundo grupo, denominado grupo B, también fue enmascarado para el operador, paciente y estadístico hasta el final de la elaboración de las tablas. Luego de realizado el RAR recibió una capsula placebo conteniendo gel de glucosa elaborados con todas las características físicas de la tableta de azitromicina, de la cual tomó una dosis diaria por 3 días.
Se realizaron controles a los 3, 4 y 5 meses, evaluando en cada control la profundidad de sondaje periodontal y el nivel de inserción clínica. Todas las evaluaciones fueron realizadas por una sola persona.
Ambos grupos recibieron pastas dentales Kolinos Herbal y cepillos dentales Oral B Pro-salud, además de la técnica de higiene de Bass modificada en cada control.
La azitromicina + RAR fue comparada con la administración RAR + placebo, para el tratamiento de pacientes con periodontitis crónica, al basal a los 3, 4 y 5 meses postratamiento, empleando el test T de Student para comparación de medias. La evaluación de la eficacia de la azitromicina a lo largo del tiempo, comparando los 2 tratamientos, fue realizada empleando el análisis de medidas repetidas a través del coeficiente Lambda de Wilks, con una significación estadística considerada de p < 0,05.
Resultados
La investigación incluyó a un total de 70 pacientes, de los cuales 35 recibieron azitromicina 500 mg vía oral como terapia antibiótica y 35 fueron pacientes placebo. Se observó que las medidas de profundidad y nivel de inserción clínica mejoraron en ambos grupos (tabla 1), sin embargo al realizar la prueba estadística para la comparación de grupos, estas no mostraron diferencias significativas (p = > 0,05).
Tabla 1 Eficacia de la azitromicina asociada al raspado y alisado radicular para el tratamiento de pacientes con periodontitis crónica.

La profundidad de sondaje (p = 0,000 < 0,05) y el nivel de inserción clínica (p = 0,000 < 0,05) indica que cambian con el tiempo, pero la interacción con el grupo evidencia que no hay diferencia en la evolución a lo largo del tiempo entre los grupos de administración ni en la profundidad de sondaje (p = 0,717 > 0,05) ni en el nivel de inserción (p = 0,347 > 0,05) El grupo de edad no modifica el comportamiento de ambas variables en el tiempo.
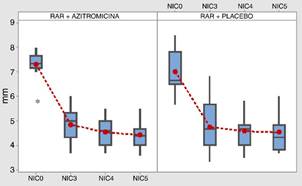
La medida de la profundidad al sondaje cambió con el tiempo tanto en el grupo que recibió azitromicina como en el grupo que recibió placebo (p = 0,000 < 0,05), pero no se evidencia diferencia en la evolución entre los grupos de administración (p = 0,717 > 0,05) (fig. 1).
En cuanto al nivel de inserción clínica, también cambió con el tiempo en ambos grupos (p = 0,000 < 0,05), sin embargo no se aprecia diferencia en la evolución al comparar los grupos que recibieron azitromicina y placebo (p = 0,347 > 0,05) (fig. 2).
Discusión
La azitromicina, es un macrólido bacteriostático cuyo espectro de acción cubre bacterias anaerobias estrictas como los periodontopatógenos17. Presenta buenas propiedades farmacológicas como una rápida absorción, alta concentración tisular y prolongada vida media lo cual permite una sola administración diaria de 500 mg por un periodo de 3 días11,18. Este sencillo protocolo de administración así como su baja incidencia de efectos secundarios tiende a reducir los problemas relacionados con el cumplimiento del paciente, motivo por el cual ha sido considerado por algunas investigaciones para su empleo como terapia coadyuvante en la enfermedad periodontal; así, Oteo et al.18, en 2010, demostraron que la administración conjunta de la azitromicina más el raspado y alisado radicular tenían un efecto clínico superior al grupo control con placebo, ellos evaluaron la profundidad al sondaje así como el nivel de inserción clínica, sin embargo ese efecto superior solo se encontró en los 5 primeros meses, no encontrando diferencias a partir del sexto mes. Resultados similares fueron encontrados por Sayán y Chumpitaz12, Sampaio et al.17, Mascarenhas et al.19, y Yashima et al.20, quienes evaluaron también al mismo antibiótico por el mismo periodo de tiempo, encontrando también solo efecto superior en el grupo que recibió azitromicina hasta el quinto mes.
En el presente estudio se encontró que ambos grupos mostraron una disminución de la profundidad al sondaje y ganancia de inserción clínica, sin embargo no se hallaron diferencias estadísticamente significativas entre los grupos de azitromicina y el grupo placebo (p > 0,05), resultados que coinciden con los encontrados con Han et al.2, Dastoor et al.21 y Smith et al.22, quienes también evaluaron los mismos parámetros clínicos por un periodo de 6 meses y además realizaron estudios microbiológicos donde se evidenció una disminución de microorganismos periodontales en ambos grupos pero sin mostrar diferencias significativas.
Al realizar la evaluación individual de los parámetros clínicos, tampoco se encontraron diferencias entre el grupo control y de estudio, hallándose similares promedios en las medias de la profundidad al sondaje y nivel de inserción clínica a los 3, 4 y 5 meses. Estos resultados difieren con los evaluados por Gomi et al.23, quienes encontraron diferencias significativas en el grupo de estudio (2,4 ± 0,8 mm) respecto al grupo control (3,3 ± 0,4 mm) (p < 0,05) al medir la profundidad al sondaje, sin embargo no se observó diferencia en el nivel de inserción clínica (4,8 ± 1 mm y 5,7 ± 1 mm) (p > 0,05).
Uno de los trabajos con mayor tiempo de seguimiento fue realizado por Ramberg et al.24, quienes hicieron evaluaciones al año, a los 3, 5 y 13, encontrando solo efecto benéfico superior en el grupo que recibió antibioticoterapia durante el primer año; en las subsiguientes evaluaciones no se encontró diferencias estadísticamente significativas entre los grupos. Se hace importante en este punto señalar, si la administración de antimicrobianos sistémicos solo brinda un efecto inicial, sin encontrar beneficios a mediano y largo plazo, con la consecuente modificación y/o mutación del ecosistema bacteriano del huésped por cada administración que recibe el paciente se debería instaurar protocolos restringiendo su uso solo a casos específicos en donde su empleo está justificado, como el caso de la enfermedad periodontal de avance rápido o de aparición temprana. Los resultados de esta investigación han mostrado en un plazo de seguimiento de 5 meses que no existe evidencia que justifique el empleo de azitromicina como terapia complementaria en pacientes con enfermedad periodontal crónica.
Por último, el efecto de la edad en la evaluación de los parámetros clínicos estudiados no mostró diferencias significativas probablemente por considerar a pacientes de grupos etarios bastante cercanos.
Esta investigación pretendió contribuir a establecer o mejorar el protocolo de atención de los pacientes con enfermedad periodontal crónica. Consideramos que se deben realizar más ensayos clínicos que permitan determinar si pautas habituales de antibioticoterapia son eficaces como coadyuvantes al RAR. Considerar que los antibióticos sistémicos no son los únicos tratamientos complementarios, sino que también los agentes tópicos como la clorhexidina son alternativas viables. Las ventajas o desventajas de cada una de estas estrategias en la práctica clínica debe ser tomado en cuenta por el odontólogo al obtener evidencia científica y evaluar la mejor opción para cada paciente.