INTRODUCCIÓN
La fibrina rica en plaquetas (PRF) es un concentrado plaquetario de segunda generación que ofrece una elevada cantidad de factores de crecimiento, leucocitos y citocinas que se obtienen mediante la centrifugación de sangre autógena1).
Según la clasificación de Dohan-Ehrenfest y cols. 2, la fibrina rica en plaquetas y leucocitos (L-PRF) se puede obtener mediante un procedimiento muy sencillo y a un bajo coste económico, además de permitir la liberación de una elevada cantidad de factores de crecimiento y proteínas de adhesión3. Para la presente revisión el término L-PRF y PRF se utilizan de forma indistinta. El coágulo de L-PRF contiene un 97 % de plaquetas y más del 50 % de los leucocitos del coágulo inicial, y da lugar a una matriz de fibrina capaz de liberar factores de crecimiento y proteínas implicadas en la curación de heridas durante más de 7 días in vitro3 4 5 6 7 8-9.
Se ha demostrado que el uso del L-PRF en combinación con sustitutos óseos presenta un excelente comportamiento como conector biológico entre las partículas óseas3,10 11-12). La combinación parece tener un efecto sinérgico en el proceso de cicatrización y regeneración; sin embargo, se ha observado que sus efectos no son duraderos a largo plazo debido a la rápida acción de sus proteínas bioactivas13.
Actualmente se están intentando utilizar diferentes activadores14 y transportadores15 para prolongar el efecto del PRF. Las mezclas parecen acelerar la regeneración ósea y permiten colocar los implantes dentales en menos tiempo16. Es difícil determinar si la adición del PRF permite mejorar el depósito de nuevo hueso y, por ende, acelerar el proceso de regeneración ósea. Surge así la necesidad de conocer si los ensayos clínicos realizados en los procedimientos de regeneración ósea guiada (ROG) encuentran resultados eficaces. La presente revisión sistemática sintetizó las publicaciones más actualizadas sobre los resultados de la combinación de PRF más rellenos óseos en las técnicas de ROG.
MATERIALES Y MÉTODOS
Protocolo PICO
La revisión sistemática siguió el siguiente protocolo: Población (P): pacientes sistémicamente sanos (ASA I) con atrofia de reborde alveolar con/sin la necesidad de colocación de implantes dentales. Intervención (I): aplicación del PRF como biomaterial (solo o en combinación con rellenos óseos) en la ROG. Comparación (C): técnicas clásicas que utilizan rellenos óseos (aloinjertos, xenoinjertos, aloplásticos) con o sin el uso de membranas de colágeno o injertos conectivos subepiteliales. Resultado (O): regeneración ósea alveolar (expresado como porcentaje de formación ósea, cicatrización de tejido óseo y de tejidos blandos, grado de reabsorción ósea) y oseointegración implantaria (expresada como valores de inserción del torque del implante y la pérdida ósea marginal en milímetros).
Estrategia de búsqueda
Los autores exploraron los artículos en las bases de datos PubMed, Scopus, Web of Science, ScienceDirect, Cochrane y SciELO desde enero de 2009 hasta julio del 2017. La limitación temporal tenía como fin la búsqueda de los artículos más actuales y que utilizasen las técnicas más comunes. La investigación fue complementada con una búsqueda manual en el mismo periodo en las revistas: Journal of Periodontology, International Journal of Oral & Maxillofacial Implants, International Journal of Oral & Maxillofacial Surgery, Journal of Oral and Maxillofacial Surgery, Journal of Dental Research, Journal of Clinical Periodontology, International Journal of Periodontics & Restorative Dentistry y European Journal of Oral Implantology. Una vez encontrados los artículos, se complementó con una búsqueda a través de las referencias bibliográficas para detectar aquellas publicaciones que no fueron identificadas electrónicamente.
Términos de búsqueda
Las palabras clave seleccionadas fueron: ["Guided Bone Regeneration" -MeSH-] o ["Bone" y "regeneration" -todos los campos-] o ["Platelet-Rich Fibrin" -MeSH-] o ["Platelet-Rich Plasma" y "Platelet-Rich-Fibrin" -todos los campos-] o ["Dental Implants" -Todos los campos-] o ["Surgery techniques" -MeSH-] o ["Clinical Trial" -todos los campos-].
Criterios de inclusión y exclusión
Se incluyeron: publicaciones en inglés o español; ensayos clínicos que comparasen los resultados entre PRF versus PRF más rellenos óseos en la ROG; ensayos clínicos que comparasen los resultados entre PRF versus PRF más membranas de colágeno/injertos conectivos en la ROG; ensayos clínicos que evaluaran las características de grado de relleno óseo, complicaciones posquirúrgicas, éxito de la cirugía y supervivencia del implante. Se excluyeron: estudios preclínicos o estudios piloto; ensayos clínicos que no describiesen los resultados postoperatorios de grado de relleno óseo, complicaciones posquirúrgicas, éxito de la cirugía y supervivencia del implante; estudios clínicos de los tipos: reportes de caso, series de caso, estudios retrospectivos y revisiones sistemáticas.
Proceso de selección
Inicialmente fueron seleccionados todos los títulos, para después eliminar las publicaciones no relevantes; en la primera búsqueda se encontraron 965 artículos. Durante una segunda etapa se utilizaron los filtros de cada base de datos seleccionando las opciones de "búsqueda por tiempo", "búsqueda de ensayos clínicos" y "búsqueda de artículos", principalmente en las bases Scopus, Web of Science, PubMed y ScienceDirect. Los artículos resultantes fueron analizados a través de sus resúmenes; los dos autores (MN y YC) seleccionaron de forma independiente todos los resúmenes. El grado de concordancia kappa entre los dos autores fue de 0,89 para la concordancia de selección de los resúmenes. Luego se obtuvieron los artículos que cumplían los criterios de inclusión. Tras esta búsqueda, se analizaron los artículos relevantes y las referencias bibliográficas para añadir más artículos que cumplían con los criterios (Figura 1).
Valoración de la calidad científica de los estudios
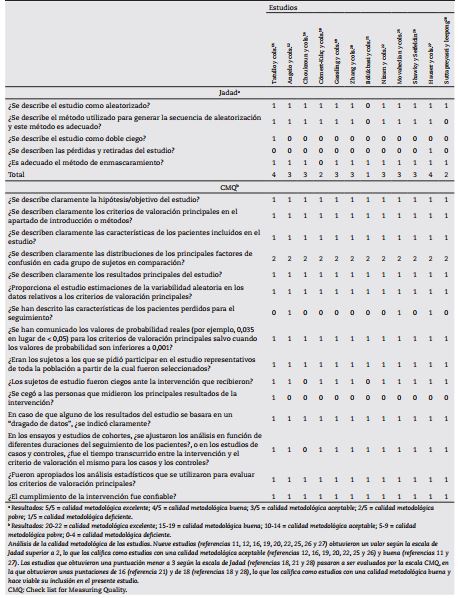
Para la evaluación de la calidad metodológica, los datos de cada estudio fueron analizados según la escala de Jadad17 y la escala de Downs y Black17) (Check list for Measuring Quality o CMQ) modificada con 27 ítems, eliminando las preguntas relacionadas con estudios experimentales (4, 8, 12, 13, 24 y 27). Si algún estudio obtenía en la escala de Jadad un valor menor a 3, el artículo era evaluado mediante la escala CMQ para poder determinar si se incluía en el estudio (Tabla 1).
RESULTADOS
La selección de los 438 artículos filtrados excluyó 381 según sus títulos y resúmenes, resultando así 57 artículos potencialmente relevantes. La lectura completa de cada artículo excluyó 45, quedando así 12 artículos seleccionados para el análisis y extracción de datos.
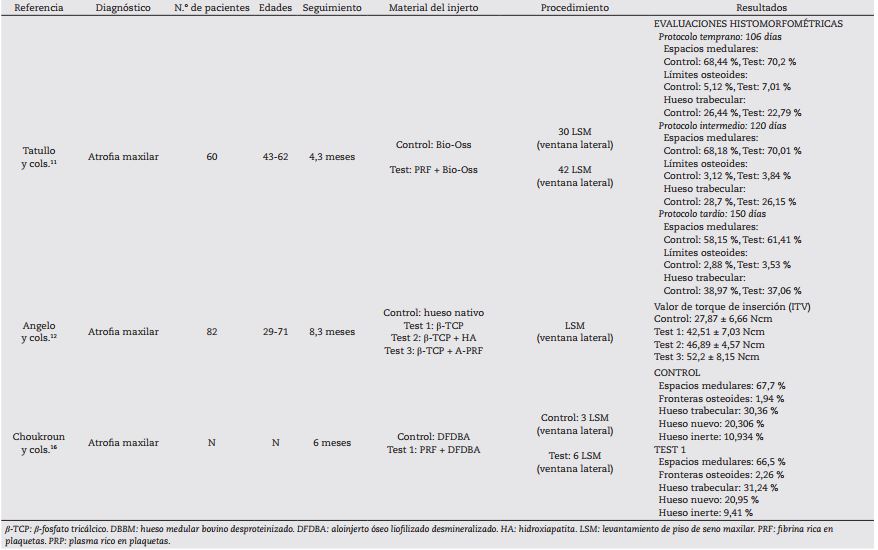
Ocho artículos11,12,16,18-22 se relacionaron con la atrofia del maxilar e indicación de levantamiento de piso del seno maxilar con la técnica de Boyne y James23 y Tatum24). Algunos estudios11,16,18 19 20 21-22 evaluaron el efecto del PRF en los procedimientos de ROG tratando en total 188 senos maxilares. Sus análisis histomorfométricos20,21,22 indicaron que, al combinar hueso bovino con PRF, el porcentaje de formación ósea osciló entre el 18,35 % y el 35 %, mientras que al combinar aloinjerto óseo liofilizado con PRF, el porcentaje de formación ósea fue del 20,95 %16, sin obtener diferencias estadísticamente significativas. La combinación de β-fosfato tricálcico (β-TCP) con PRF arrojó un porcentaje de formación ósea del 32,03 %18. Al combinar hueso autólogo con hueso bovino y con PRF, el porcentaje de hueso vital fue del 17 %19. En un estudio12, al combinar β-TCP con A-PRF, se encontraron mayores valores de torque de inserción del implante que los implantes que no utilizaron la combinación (p < 0,05) (Tabla 2).
Tabla II. Estudios que evaluaron el efecto de la fibrina rica en plaquetas en los procedimientos de regeneración ósea


Dos artículos25,26 estuvieron relacionados con el tratamiento de las hendiduras alveolares maxilares unilaterales. Uno de los estudios25) comparó el uso del injerto óseo iliaco versus hueso de mentón más relleno alogénico más PRF, obteniéndose una ganancia ósea de volumen del 69,57 % en el grupo PRF. En el otro estudio26 se utilizó el injerto óseo iliaco versus injerto óseo iliaco más PRF, obteniéndose una ganancia ósea del 82,61 % en el grupo de PRF.
Dos artículos evaluaron la preservación de rebordes alveolares27,28. Uno comparó dos grupos27: exodoncia más PRF versus exodoncia con colgajo más PRF; el grupo sin colgajo presentó un porcentaje significativo (p < 0,05) menor de pérdida de anchura alveolar (-0,48 %). El otro estudio28 comparó la exodoncia versus exodoncia más PRF, evidenciándose una pérdida ósea marginal para el grupo control de 2,48 mm y de 2,15 mm para el grupo experimental, sin diferencias significativas (p > 0,05).
DISCUSIÓN
Los estudios relacionados con la elevación de piso de seno maxilar mediante la técnica de ventana lateral refirieron que al cabo de 6 meses se encuentra mayor neoformación ósea al combinar plasma rico en plaquetas (PRP) o PRF con β-TCP29 30 31 32-33. Se conoce que los concentrados otorgan los factores de crecimiento al β-TCP. De esta forma la neoformación ósea aumentaría, aunque algunos estudios solo han encontrado entre el 19 y el 30 % de formación ósea34 35 36-37; quizás porque no hay beneficio en el aumento de células, vasos capilares y nueva formación ósea, además de que los resultados encontrados a largo plazo no evidenciaron diferencias significativas con los grupos que utilizaron la mezcla PRF y β-TCP18,38,39.
La liberación de factores de crecimiento estimula las células cercanas a la quimiotaxis40, proliferación y maduración41,42; sin embargo, los rellenos óseos como el β-TCP carecen de células óseas libres, por lo que el potencial efecto del PRP o PRF sería nulo43,44. Esto podría explicar la no superioridad de la mezcla, además que la lenta degradación del β-TCP puede retardar la capacidad de ROG del PRP o PRF21,45,46).
Respecto al hueso medular desmineralizado bovino, se conoce que es osteoconductivo y permite el transporte de células osteogenéticas desde la pared del seno maxilar hasta las partículas del injerto47 48-49. Su uso en forma de Bio-Oss (hueso bovino desproteinizado) ha demostrado mayor neoformación ósea al mezclarlo con PRF21,22. También se ha descrito que las partículas de Bio-Oss se incorporan en el hueso recién formado y la proporción de hueso neoformado aumenta con un mayor periodo de observación50,51. Quizás se deba al largo tiempo de reabsorción del hueso bovino50,52,51 52 53 54-55. Sin embargo, los estudios de largo plazo que evaluaron la biodegradación de Bio-Oss son escasos; los informes de casos han demostrado la presencia de partículas de Bio-Oss 9-10 años después de elevaciones de pisos de seno maxilar56,57.
Se ha sugerido que el PRF es una membrana bioactiva para la ROG, pero solo se han publicado informes clínicos sobre este tema58 59 60-61. Debido a la preocupación por la degradación de la membrana de PRF, recientemente Kawase y cols.(62 lograron reducir la tasa de biodegradación de la membrana de PRF utilizando una técnica de compresión por calor que no involucraba su biocompatibilidad.
Respecto al empleo de hueso autólogo en la ROG, se ha utilizado el injerto óseo autógeno de la cresta iliaca como el estándar para estimular la cicatrización ósea y rellenar los defectos óseos grandes63 64 65-66. Los procedimientos para regenerar hendiduras alveolares maxilares mediante este tipo de injerto demostraron mayor formación ósea cuando se combina con PRF26, mientras que en otro estudio los cambios no fueron diferentes estadísticamente25.
La reabsorción ósea alveolar tras de la exodoncia dental es un proceso inevitable. En relación con los rebordes alveolares, se conoce que el reborde alveolar residual se reduce en anchura y altura, siendo mayor en anchura67, mayor en la zona bucal68,69 y más rápido durante los seis primeros meses70,71,72. Se ha reportado que la realización de una exodoncia combinada con el uso del PRF reduce la reabsorción de las crestas marginales28. No obstante, Araujo y Lindhe73 indican que la cresta bucal migra constantemente hacia apical después de una exodoncia.
Hauser y cols.(27 también encontraron menor reducción del ancho de la cresta alveolar en el procedimiento de exodoncia más PRF y la mayor reducción del ancho de la cresta alveolar en los procedimientos de exodoncia más colgajo y PRF. Algunos estudios74 75-76 refieren que utilizar un colgajo mucoso presenta desventajas significativas, ya que la elevación del periostio del hueso comprometería el suministro vascular a la superficie del hueso, lo que conduciría a la actividad osteoclástica y al aumento de la reabsorción ósea.
La presente revisión sistemática posee algunas limitaciones que se han de tener en cuenta: en primer lugar, la mayoría de los estudios analizados presentaron riesgos de sesgos moderados y elevados. La heterogeneidad de estudios y variables analizadas no permitió la realización de un metaanálisis, y principalmente se analizaron resultados desde el punto de vista cualitativo. Se resalta que la mayoría de ensayos clínicos estuvieron relacionados con la técnica de levantamiento de piso de seno maxilar, con una elevada cantidad de pacientes evaluados.
CONCLUSIONES
La combinación de PRF y rellenos óseos promueve la neoformación ósea, aumenta el trabeculado y reduce los tiempos de cicatrización en los procedimientos de elevación de piso de seno maxilar; sin embargo, al cabo de seis meses de control los resultados no son diferentes significativamente cuando se comparan con los obtenidos por los grupos que no utilizan PRF.
Los resultados de la combinación de PRF y rellenos óseos en preservaciones del reborde alveolar aún no son claros, pero se reporta el beneficio de la matriz de fibrina en el cierre de la herida y la reepitelización.
Los estudios relacionados con el tratamiento regenerativo de las hendiduras alveolares evidencian una notoria ROG al combinar hueso autólogo con PRF.