Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Neurocirugía
versión impresa ISSN 1130-1473
Neurocirugía vol.18 no.1 feb. 2007
Perspectivas en el tratamiento del vasospasmo cerebral inducido por hemorragia subaracnoidea
Perspectives in the treatment of subarachnoid-hemorrhage-induced cerebral vasospasm
J. Fandino*,**,***; A.R. Fathi*; T. Graupner*; S. Jacob*** y H. Landolt**
Departamentos de Neurocirugía* y Cuidado Intensivo***. Hospital Universitario de Berna. Universidad de Berna. Berna. Suiza. Departamento de Neurocirugía**. Hospital Cantonal de Aarau. Aarau. Suiza
Dirección para correspondencia
RESUMEN
El vasospasmo cerebral sigue siendo la causa más importante de invalidez y muerte posterior a la ruptura de aneurismas saculares intracerebrales. Las estrategias terapéuticas en el vasospasmo inducido por la hemorragia subaracnoidea pueden ser agrupadas en cuatro categorías a saber: 1) terapias de prevención; 2) terapias de reversión; 3) terapias para el aumento de la perfusión cerebral; y 4) terapias de neuroprotección y rescate. Estudios experimentales recientes han permitido la realización de estudios clínicos fase II que sugieren resultados positivos con medicamentos que incluyen estatinas (simvastatina y pravastatina) y antagonistas de receptores tipo A de la endotelina-1 (clasozentan). De igual manera, evidencias experimentales y clínicas han mostrado las ventajas del drenaje de líquido cefalorraquídeo, administración intratecal de donadores de óxido nítrico, y los efectos desinhibidores de la Ca2+ Protein Kinasa C (Fasudil) y catecolaminas sobre la vascularización cerebral. Este artículo resume el estado de investigación actual de posibles agentes y estrategias terapéuticas relevantes en el tratamiento del vasospasmo cerebral.
Palabras clave: Hemorragia subaracnoidea. Vasospasmo cerebral. Angioplastia. Donadores de óxido nítrico. Estatinas. Antagonistas de los receptores de la endotelina.
SUMMARY
Cerebral vasospasm is still the most important cause of death and disability after rupture of intracranial aneurysms. The therapeutic strategies in the treatment of subarachnoid hemorrhage induced vasos pasm include four groups: 1) prevention of vasospasm; 2) reversion of vasospasm; 3) improvement of cerebral perfusion; and 4) neuroprotection and rescue therapies. Recent experimental studies allowed the design of phase II clinical studies which demonstrated positive results with medications and compounds such as statins (simvastatin and pravastatin) and endothelin-1 receptor antagonists (clasozentan). Moreover, experimental and clinical evidences showed the advantages of early cerebrospinal fluid drainage, intrathecal administration of NO-donors, effects of Ca2+ protein kinase inhibitor (Fasudil) and catecholamines on the cerebral vessels. This review article summarizes the stage of investigation of these medications and therapeutic strategies which will be relevant in the treatment of cerebral vasospasm.
" I would caution that vasospasm is still around, it is still alive and living in every neurosurgical unit. Hence my plea that our scientists not falter or lose interest for a final understanding and solution" C.G. Drake,1990 9
Key words: Subarachnoid hemorrhage. Cerebral vasospasm. Angioplasty. NO donors. Statins. Endothelin receptors antagonists.
Introducción
A pesar de los avances en el tratamiento neurointesivo y la introducción de nuevas técnicas endovasculares en el tratamiento del aneurisma de arterias cerebrales, el vasospasmo cerebral (VC) es causa importante de muerte, morbilidad e incapacidad después de la hemorragia subaracnoidea (HSA) 4-10. El déficit neurológico isquémico tardío o también llamado "delayed ischemic neurological deficit (DIND)" causado por el VC sigue siendo una complicación que se presenta en un 20 al 30% de los pacientes que ingresan con el diagnóstico de una HSA 33. En series contemporáneas, del 15 al 20% de estos pacientes sufren un accidente cerebrovascular (ACV) o mueren a causa del vasospasmo a pesar de un tratamiento agresivo 17,31,33,48. El presente artículo tiene como objetivo presentar una actualización de las diferentes modalidades terapéuticas en desarrollo e investigación que serán tema de discusión y lectura obligada en el futuro próximo.
Historia
En el año 1947 Graerne Robertson presentó por primera vez durante una conferencia ante el Royal Australasian College of Physicians en Sydney, Australia, el fenómeno del vasospasmo inducido por la HSA y describió su importancia esencial para el plan de ataque quirúrgico del aneurisma cerebral 67. El incremento del uso de la angiografía cerebral a comienzos de los años cincuenta trajo consigo la apreciación de la frecuencia del espasmo cerebral inducido por la HSA. En 1951, Arthur Ecker y Paul Riemenscheider de Syracuse, Nueva York, presentaron un estudio a este respecto 11. Estos autores reconocieron la importancia de los hallazgos en el pronóstico de la HSA. Posteriormente, trabajos como los de J.L. Pool en 1958 61, S.A. Stornelli y French en 1964 78, J. Allock y C. Drake en 1965 3 definieron el vasospasmo clínico y angiográfico inducido por la HSA. La importancia del vasospasmo cerebral fue finalmente confirmada por estudios del flujo cerebral sanguíneo (CBF) en los que se demostró una reducción del mismo como causa de morbilidad y mortalidad 6,22.27,28,32. Vale la pena mencionar el avance en los años ochenta que trajo la introducción del Doppler transcraneal (TCD) en el diagnóstico no invasivo del vasospasmo, técnica inventada por R. Aaslid en la Universidad de Berna, Suiza l. Sin embargo, las técnicas no invasivas no han podido reemplazar la angiografía cerebral como método estándar de oro para el diagnóstico del VC. Después de casi 50 años de la descripción de esta patología, el vasospasmo sigue siendo un problema que no ha sido solucionado a pesar de grandes inversiones de la industria farmacéutica y endovascular, la cual ha concentrado sus esfuerzos paradójicamente en la introducción de técnicas de obliteración del aneurisma que poco han influido en el pronóstico de la HSA.
Posibilidades terapéuticas
El VC debe ser entendido como una enfermedad sistémica y como tal debe tratarse. Las causas del VC son multifactoriales y es por ello que una sola estrategia o medicamento nunca será la solución de problema.
Los factores de riesgo para el desarrollo del VC inducido por la HSA incluyen el volumen de sangre en el espacio subaracnoideo 24, edad y sexo del paciente 40, tabaquismo 86 y tipo de tratamiento del aneurisma 54. Además de la angiografía cerebral como método diagnóstico mas sensible del VC 17, existen hoy en día técnicas no invasivas como la angiografía por tomografía computarizada o angiotac (ACT) 57, por resonancia magnética (ARM) 29, las mediciones cuantitativas y semicuantitativas del CBF 35, y el Doppler transcraneal l,75. Las posibilidades terapéuticas del VC pueden ser agrupadas en cuatro categorías (Tabla 1): 1) terapias de prevención; 2) terapias de reversión; 3) terapias para el aumento de la perfusión cerebral; y 4) terapias de neuroprotección y rescate.
Siguiendo el orden de las diferentes estrategias terapéuticas del VC citadas en la Tabla 1, nos concentraremos en los tipos de tratamiento que en el marco de esta actualización considero como relevante.
Extracción y disolución del coágulo sanguíneo
Aunque cabría suponer un buen resultado, las técnicas de extracción, irrigación y disolución del coágulo sanguíneo en el espacio subaracnoideo no han mostrado ser tan efectivas como era de esperarse. De igual modo, técnicas de trombolisis intratecal y subaracnoidea intraoperatoria postoperatoria con la ayuda de irrigación por drenajes se han acompañado de complicaciones como el incremento de hemorragias postoperatorias e infecciones 23. Recientemente, Amin-Hanjani y col. 4 publicó un metaanálisis sobre la efectividad de la trombolisis intratecal con activador tisular del plasminógeno (t-PA) o uroquinasa (UK). Los 9 estudios existentes (sólo uno de ellos randomizado) incluyeron 652 pacientes y demostraron una reducción del 14% de riesgo para desarrollar DIND, 9.5% reducción de resultados pobres (GOS 2-3), y 4.5% de reducción de la mortalidad (95% intervalo de confianza, 1.5-7.5%, P < 0.05). A pesar de estos resultados, la técnica ha sido abandonada en la mayoría de centros por sus limitaciones técnicas y el aumento de la incidencia de hemorragias e infecciones. Otra técnica utilizada como rutina durante la cirugía de aneurismas cerebrales es la incisión o apertura de la lamina terminalis. Esta técnica descrita por Yaşargil en Zürich a comienzos de los años setenta se popularizó rápidamente al demostrarse que tenía un efecto positivo sobre la incidencia de la hidrocefalia inducida por la HSA. Algunos autores han demostrado una reducción hasta del 80% si la técnica se realiza de rutina durante el ataque microquirúrgico del aneurisma 44,91. El grupo de Cincinnati demostró recientemente en un estudio comparativo retrospectivo que incluyó 106 pacientes una reducción del 54.7% al 29.6% (p >0.001) de incidencia de VC en pacientes a los que se le realizó una fenestración de la lamina terminalis 5. Finalmente, otra estrategia que ha mostrado ser atractiva y simple es el drenaje de líquido cefalorraquídeo (LCR) de rutina por drenaje lumbar. Schmidt y col. 43 presentaron recientemente en la última Conferencia Internacional de Vasospasmo Cerebral (ICCV) celebrada en Chicago, USA, un estudio con un total de 266 pacientes. Los autores pudieron demostrar una reducción de la incidencia del VC del 27 al 7%43.
En nuestro centro realizamos de rutina en todos nuestros pacientes la fenestración de la lamina terminalis. De igual modo, implantamos un catéter para lumbar de LCR durante 4 a 5 días con la excepción de los pacientes que ingresan con signos de hidrocefalia que requieren una ventriculostomía de urgencia. La trombolisis intratecal con t-PA o UK, al igual que en la mayoría de los centros, no la practicamos.
Bloqueo de la Respuesta Inflamatoria
El bloqueo de la respuesta inflamatoria ha recobrado importancia en la investigación de terapias del VC. Los argumentos patofisiológicos de la inflamación en el VC hasta ahora demostrados incluyen: 7,10,20,60) adhesión, migración y proliferación vascular de leucocitos durante el VC; 2) infiltración prominente de leucocitos en las arterias una semana posterior a la HSA; 3) correlación de depósitos de IgG en los vasos cerebrales posterior a HSA experimental; 4) aumento de la síntesis de leucotrienos vasculares; y 5) VC moderado causado por inyección de microesferas de poliestireno. La adhesión de leucocitos es mediada por la interacción entre moléculas de adhesión celular expresadas en el endotelio vascular, como por ejemplo la molécula-1 de adhesión intercelular (ICAM-1, CD54) y la molécula-1 de adhesión vascular (VCAM-1, CD106), y las integrinas expresadas en la membrana de los leucocitos, como son por ejemplo el antígeno-1 de función Iinfocítica (CD11a/CD18) y antígeno macrófago (CD11b/CD18) presente en la superficie de neutrófilos y macrófagos 77. El grupo de investigación de la Universidad de Virginia, USA, pudo demostrar recientemente niveles séricos y en LCR de estas proteínas en pacientes con VC posterior a HSA 60. Estos hallazgos han llevado a diseñar estudios con agentes inflamatorios. Es así como recientemente un antiinflamatorio Ibuprofeno ha sido motivo de estudio como terapia para el VC. El Ibuprofeno ha sido estudiado en primates y conejos en un modelo experimental de HSA en el cual el agente es colocado dentro del coágulo incorporado en un implante de polímero (Acetato de ethilenvinil o EVAc) que permite su liberación lenta y controlada 62,65. Estos estudios, publicados recientemente, mostraron un diámetro normal de la arteria cerebral media en el 91% de los casos, comparado con el 53% en los animales que recibieron el polímero sin Ibuprofeno (p < 0.001). De igual modo, no se pudieron evidenciar efectos tóxicos locales o sistémicos 62. El mismo grupo reportó en 2005, basados en un estudio en primates, que el Ibuprofeno disminuye el ICAM-1 endotelial 64. De tal forma, agentes antiinflamatorios como el Ibuprofeno podrían convertirse en una gran herramienta en el tratamiento del VC. Hasta ahora, sin embargo, no existen estudios clínicos finalizados que permitan el uso de estos implantes.
Bloqueo de espasmógenos: antagonistas de receptores tipo A de la endotelina-1
La endotelina (ET) fue descubierta en los años ochenta y aún se considera el vasoconstrictor más potente conocido en la naturaleza 80,90. De las tres isoformas conocidas, la ET1 y la ET-3 han sido involucradas en la patofisiología del VC inducido por HSA. Aunque se han descrito algunas discrepancias, se reconoce que los pacientes que han sufrido una HSA tienen niveles altos de ET-1 y ET-3 en LCR y plasma 12,36,74. Algunos autores han basado la polémica de la ET en el VC en que ésta también es producida por los astrocitos y en el hecho de que no siempre se ha encontrado una correlación clínica en pacientes con VC 25,58. Los efectos de la ET-1 en los vasos cerebrales es mediada por dos subtipos de receptores llamados ETA y ETB 69.
La activación de receptores ETA del músculo liso vascular induce una vasoconstricción 70, mientras la liberación de óxido nítrico (NO), que produce una vasodilatación, es mediada por los receptores ETB localizados en el endotelio 42. El efecto de vasoconstrictores tras la activación de receptores ETB es polémico; sin embargo, los estudios experimentales han mostrado su papel en el desarrollo del VC inducido por la HSA 93. Por este motivo, los receptores ETB se han clasificado en dos tipos: (ETB1 y ETB2) 50,94. Recientemente, nuestro grupo demostró en un modelo experimental, que ratas transgénicas que carecen de expresión genética de receptores ETB ("ETB deficitarias") no desarrollan vasoconstricción de la arteria basilar posterior a la HSA (Figura 1) 16. Recientes estudios han probado que el agente Clazosentan tiene efectos competitivos antagonistas en la vasoconstricción mediada por receptores ETA 84. Un estudio experimental en perros, en el que se aplicó Clazosentan intratecal, mostró una reversión significativa de la vasoconstricción de la arteria basilar comparada con los controles 68. De igual modo, se pudo demostrar que el Clazosentan tiene efectos competitivos inhibitorios en la vasodilatación mediada por receptores ETA 85. Estos hallazgos llevaron a la realización de un estudio clínico Fase IIa realizado en Alemania, en el que se demostró una reducción significativa en la incidencia de VC angiográfico y clínico e infartos cerebrales en el grupo tratado con Clasozentan. A consecuencia de estos resultados positivos, la compañía farmacéutica Suiza Actelion Ltda., la cual desarrolló el Clasozentan, financió el estudio (Fase IIb) llamado CONSCIOUS-1. Este estudio incluyó a 402 pacientes en EEUU, Europa e Israel y fue concluido en noviembre de 2005. Los resultados preliminarios serán reportados aproximadamente en junio de 2006. En caso de ser positivos, Clazosentan será sometido a un estudio final Fase III. Si logra demostrarse un efecto positivo en el tratamiento del VC, Clazosentan no sólo validaría las teorías de la ET-1, sino también ayudaría a mejorar el pronóstico de nuestros pacientes.
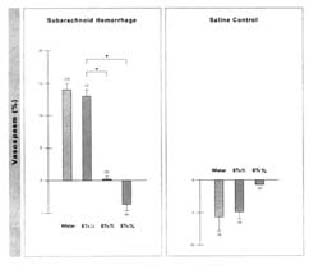
Figura 1. Cambios de diámetro en la arteria basilar de la rata posterior
a la inyección de sangre en la cisterna magna. La HSA no indujo vasospasmo en
los animales con expresión deficitaria de los receptores ETB (sl/+ y sl/sl),
comparado con los controles (ratas wistar) (* p<0.0001).1
Donadores del óxido nítrico: estatinas y medicamentos intratecales
El endotelio genera un gran número de sustancias vaso-activas de las cuales el más importante es el factor relajante derivado del endotelio (EDRF), que ha sido identificado como óxido nítrico (NO). El NO se forma a partir de la arginina, en presencia de la NO-sintetasa (NOS), que es calcio dependiente y se produce en el endotelio. El NO es un potente vasodilatador a través de la activación de la cGMP y tiene un papel importante en el mantenimiento del tono cerebrovascular en reposo 66. Se ha comprobado que los niveles de NO disminuyen 60 minutos después de la HSA 73. y que la administración de un "donador de NO" puede aumentar el CBF y disminuir la isquemia cerebral en la HSA 72. Una disminución del NO por inhibición de la NOS tiene como consecuencia una reducción del CBF debido a una vasoconstricción cerebral 19. Schwartz y col. 71 demostraron recientemente que una disminución de la disponibilidad de NO contribuye en isquemia cerebral aguda posterior a una HSA. En este estudio experimental en ratas se utilizó un inhibidor de la NOS llamado L-NAME y se monitorizó el CBF durante 60 minutos después de la HSA. A pesar de observaciones clínicas que prueban la presencia de metabolitos del NO en el LCR 89, otros grupos no han podido confirmar los efectos positivos de los donadores de NO 2. El uso intratecal de donadores de NO ha cogido auge desde la publicación de Wolf y col. 88 en 1998. Estos autores comprobaron, en un estudio con perros, que la administración de DETA, un donador de NO de la clase diazeniumdiolato, puede revertir el VC después de su aplicación en el séptimo día post-HSA. Sin embargo, la administración por vía intratecal de nitroprusiato de sodio, también un donador de NO, no mostró efectos positivos en otro estudio experimental, quizás debido a sus efectos tóxicos 51. Es posible que otras vías de administración, como por ejemplo la incorporación a polímeros que permitan una liberación controlada, sea la alternativa adecuada 63. Nuestro grupo en la Universidad de Berna pudo demostrar en un estudio experimental en conejos (Figura 2), que la administración intratecal de nitroglicerina, también donador de NO, causó una dilatación de la arteria basilar 30. Encontramos una reducción del 14% del vasospasmo en el grupo en el que se realizó una HSA y fue tratado con infusión continua de nitroglicerina intratecal (p < 001).
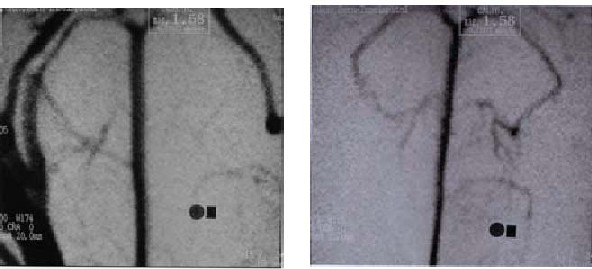
Figura 2A y 2B. Modelo experimental de HSA en el conejo llevado a cabo en el laboratorio cerebrovascular
de la Universidad de Berna, Suiza 30. En este animal control, la HSA produjo una vasoconstricción del 28%
de la arteria basilar 5 días posterior a la inyección de sangre autóloga en la cisterna magna
(A: angiografía vertebrovascular previa a la HSA, B: angiografía en el quinto día posterior a la HSA).
Basados también en la teoría de los donadores de NO, las estatinas HSA han ganado importancia e interés en el estudio de nuevas perspectivas en el tratamiento del VC. La disfunción endotelial es un marcador temprano de la ateroesclerosis y es definido por inactividad del EDRF, cuya disminución también contribuye al proceso aterógeno de las arterias 46. Se ha comprobado que las estatinas, además de tener un efecto positivo en la disminución del colesterol y trigliceridos 41, aumentan la producción de la NOS en el endotelio 47. Siguiendo estos hallazgos que despertaron el interés científico en el estudio de posibles usos de las estatinas en el VC, estudios experimentales demostraron que la Simvastatina aumenta la NOS endotelial y mejora los signos del VC. En un estudio experimental realizado en la Universidad de Duke en Durham, USA, se pudo comprobar que la Simvastatina aumenta la expresión de NOS endotelial y reduce el déficit neurológico 53. La publicación de dos estudios clínicos (Fase II) a finales del año 2005 abrió el horizonte de las estatinas en el tratamiento del VC 49,82. Los grupos de las Universidades de Duke, USA, y Cambridge, Inglaterra, pudieron demostrar que ambos, la Simvastatina 49 y la Pravastatina 82 administradas oralmente, son eficaces y seguros en la prevención del VC. Adicionalmente Lynch y col. 49 encontraron una disminución de los marcadores de VC (factor von Wiillebrand y proteína S100β) en los pacientes tratados con Simvastatina. Ambos grupos anunciaron en el año 2005 la realización de estudios multicéntricos e internacionales (Fase III) para validar los resultados positivos de estos medicamentos. De ser exitosos los hallazgos, las estatinas podrían convertirse en un medicamento seguro en el tratamiento del VC teniendo la ventaja de no presentar efectos secundarios hemodinámicos durante su administración oral.
Terapias endovasculares: angioplastia farmacológica y mecánica
Las terapias endovasculares del VC comprenden la aplicación de sustancias dilatadoras como la papaverina PPV), nicardipina o nimodipina (angioplastia farmacológica), y por otro lado, la dilatación endovascular del segmento arterial espástico con la ayuda de un balón (angioplastia mecánica). Desde la introducción de la angioplastia con balón por el ruso Zubkov en 1984 92, ha habido un gran número de descripciones de series de pacientes tratados con esta técnica 14,34,55,81. Todos los autores coinciden en tener una reversión del segmento vascular espástico y una mejoría clínica. Nuestra experiencia en Zürich mostró de igual manera estos resultados a tal punto que la hemos incluido en nuestra rutina 15,17. Las desventajas de esta técnica incluyen la imposibilidad de acceso en arterias distales, los costos del material requerido, la carencia de disponibilidad durante 24 horas de personal que pueda realizar el procedimiento y los peligros de la técnica en cuanto a perforación arterial durante la dilatación 13,34. En lo que se refiere a la angioplastia farmacológica, quizás sea la PPV el agente más usado. Este opiáceo es capaz de dilatar proximal y distalmente las arterias comprometidas en el VC (Tabla 2) 37,38.
En nuestra experiencia, la angioplastia farmacológica PPV produce un mejoramiento rápido de la oxigenación cerebral medida en términos de saturación de oxígeno en el bulbo de la vena yugular interna 15. Aunque un análisis retrospectivo multicéntrico no mostró beneficios de esta técnica 59, a nuestro modo de ver, la PPV intraluminal sigue siendo una herramienta importante en el tratamiento del VC siempre y cuando sea apoyada por una terapia triple H intensiva antes, durante y después del tratamiento 17.
Factores hemodinámicos y noradrenalina
La base de toda terapia de VC es la optimización de los factores hemodinámicos y reológicos del paciente. No es objetivo de la presente actualización entrar en detalles sobre las controversias acerca de la terapia triple H (hipertensión, hipervolemia y hemodilución). La razón principal por la que este tratamiento no ha sido sometido a estudios controlados, radica en la suficiente evidencia anecdótica de las últimas dos décadas que respaldan una mejoría de la perfusión cerebral y por consiguiente de los déficit neurológicos y que imposibilitaría el diseño de un estudio prospectivo de este tipo 39,56. Gran controversia existe, sin embargo, en la iniciación de la terapia triple H como profilaxis del VC en los pacientes con factores de riesgo. En nuestro centro tenemos como principio la optimización hemodinámica del paciente, es decir, evitar la hipovolemia y deshidratación, y el control periódico clínico con escalas estandarizadas (mGCS) y monitoreo sonográfico diario (TCD). La angiografía de control en el día séptimo la realizamos en todos nuestros pacientes para evitar la subestimación del VC angiográfico (presente en aproximadamente el 60% de los pacientes) que puede tornarse en sintomático en los días siguientes 17. Finalmente, el uso de catecolaminas durante el VC ha sido igualmente motivo de controversia en los últimos años. Existen pocos datos en la literatura acerca de los efectos de las catecolaminas en la vascularización cerebral. Es por eso que la noradrenalina (NA) ha sido motivo de investigación en nuestro laboratorio. Si bien es cierto que la NA causa una vasoconstricción sistémica, no es claro porqué su uso en las unidades de cuidado intensivo para inducir una hipertensión en el marco de una terapia triple H, no agrava el DIND y causan mayor isquemia cerebral. Nuestras investigaciones en un modelo experimental han demostrado una dilatación (no constricción) de la arteria basilar posterior a la administración de NA y consecuente aumento de la presión arterial (Figura 3) 21. Estos resultados preliminares pueden ser explicados por una pérdida de sensibilidad o un mecanismo de "down-regulation" de los receptores adrenérgicos durante el VC. Con estos hallazgos se podría hipotetizar la dependencia vasomotora cerebral con la situación hemodinámica del paciente que sufre de VC inducido por HSA.

Figura 3. Resultados preliminares del tratamiento del VC con noradrenalina (NE) 21.
La dilatación de la arteria basilar puede ser explicada por la pérdida de sensibilización
de receptores adrenérgicos durante posterior a la HSA (=SAH). La diferencia de calibre entre
el grupo HSA y HSA+ NE fue estadísticamente significativo (p < 0.005).
Conclusiones
El vasospasmo cerebral sigue siendo la causa más importante de isquemia cerebral inducida por la HSA en pacientes tratados con técnicas microquirúrgicas o endovasculares para la obliteración del aneurisma cerebral. Los estudios clínicos en desarrollo mostrarán en los próximos años si medicamentos tales como las estatinas, donadores de NO intratecal, antiinflamatorios, y antagonistas de receptores de la endotelina serán efectivos en el tratamiento del VC (Tabla 3). Los efectos de las catecolaminas en la vascularización cerebral siguen siendo en gran parte desconocidos y serán objeto de investigación en los próximos años. De igual modo, los avances en las técnicas endovasculares y monitorización en cuidados intensivo permitirán una opción terapéutica más segura. El descubrimiento de marcadores adicionales del, VC y su diagnóstico temprano permitirán un ataque terapéutico en plazo más corto.
Bibliografía
1. Aaslid, R., Markwalder, T.M., Nornes, H.: Noninvasive transcranial doppler ultrasound recording of flow velocity in basal cerebral arteries. J Neurosurg. 1982; 57:769-774. [ Links ]
2. Aihara, Y., Jahromi, B.S., Yassari, R., Sayama, T., Macdonald, R.L.: Effects of a nitric oxide donor on and correlation of changes in cyclic nucleotide levels with experimental vasospasm. Neurosurgery. 2003; 52: 661-667; discussion 666- 667. [ Links ]
3. Allcock, J.J., Drake, C.G.: Ruptured intracranial aneurysms- the role of arterial spasm. J Neurosurg. 1965; 22: 21- 29. [ Links ]
4. Amin-Hanjani, S., Ogilvy, C.S., Barker, F.G.N.: Does intracisternal thrombolysis prevent vasospasm after aneurysmal subarachnoid hemorrhage? A meta-analysis. Neurosurgery. 2004; 54: 326-334. [ Links ]
5. Andaluz, N., Zuccarello, M.: Fenestration of the lamina terminalis as a valuable adjunct in aneurysm surgery. Neurosurgery. 2004; 55: 1050-1059. [ Links ]
6. Bergvall, U., Steiner, L., Forster, D.M.C.: Early pattern of cerebral circulatory disturbances following subarachnoid hemorrhage. Neuroradiology. 1979; 5: 24-32. [ Links ]
7. Clatterbuck, R.E., Gailloud, P., Ogata, L., Gebremariam, A., Dietsch, G.N., Murphy, K.J., Tamargo, R.J.: Prevention of cerebral vasospasm by humanized anti cd11/cd18 monoclonal antibody administrated after experimental subarachnoid hemorrhage in nonhuman primates. J Neurosurg. 2003; 99: 376-382. [ Links ]
8. Clousten, J., Numagushi, Y., Zoarski, G.H., et al.: Intraarterial papaverine infusion for cerebral vasospasm after subarachnoid hemorrhage. AJNR. 1995; 16: 27-38. [ Links ]
9. Drake, C.G.: Concluding remaks. In: Sano K, Takakura K, Kassell NF, eds. International confererence on cerebral vasospasm in tokyo. Tokyo: Univ. of Tokyo Press; 1990: 527- 531 [ Links ]
10. Dumont, A.S., Dumont, R.J., Chow, M.M., Lin, C.L.,Calisaneller, T., Ley, K.F., Kassell, N.F., Lee, K.S.: Cerebral vasospasm after subarachnoid hemorrhage: Putative role of inflamation. Neursurgery. 2003; 53: 123-135. [ Links ]
11. Ecker, A., Riemenschneider, P.A.: Arteriographic demonstration of spasm of the intracranial arteries with special reference to saccular arterial aneurysms. J Neurosurg. 1951; 8: 660-667. [ Links ]
12. Ehrenreich, H., Schilling, L.: New developments in the understanding of cerebral vasoregulation and vasospasm: The endothelin-nitric oxide network. Cleve Clin J Med. 1995; 62: 105-116. [ Links ]
13. Eskridge, J.M., Mc Auliffe, W., Song, J.K., et al.: Balloon angioplasty for the treatment of vasospasm: Result of first 50 cases. Neurosurgery. 1998; 42: 510-517. [ Links ]
14. Eskridge, J.M., Newell, D.W., Winn, H.R.: Endovascular treatment of vasospasm. Neurosurg Clin N Am. 1994; 5: 437-447. [ Links ]
15. Fandiño, J., Kaku, Y., Schuknecht, B, et al.: Improvement of cerebral oxygenation patterns and metabolic validation of superselective intraarterial infusion of papaverine for the treatment of cerebral vasospasm. J Neurosurg. 1998; 89: 93-100. [ Links ]
16. Fandiño, J., Rapoport, R.M., Geriepy, C.E., Yanagisawa, M., Zuccarello, M.: Endothelin B receptor null mutation prevents subarachnoid hemorrhage induced cerebral vasospasm in the rat in vivo. In: McDonald R, ed. Cerebral vasospasm. New York, NY: Thieme Medical Publishers; 2003. [ Links ]
17. Fandiño, J., Schuknecht, B., Yüksel, C., Wieser, H.G., Valavanis, A., Yonekawa, Y.: Clinical, angiographic, and sonographic findings after structured treatment of cerebral vasospasm and their relation to final outcomes. Acta Neurochir. 1999; 141: 677-690. [ Links ]
18. Fandiño, J., Wieser, H.G., Krayer, S., et al.: Barbiturate coma for intractable cerebral vasospasm after aneurysmal subarachnoid hemorrhage. J Neurosurg. 1998; 88:192A [ Links ]
19. Faraci, F., Brian, J.E.: Nitric oxide and the cerbral circulation. Stroke. 1994; 25: 692-703. [ Links ]
20. Fassbender, K., Hodapp, B., Rossol, S., Bertsch, T., Schmeck, J., Schutt, S., Fritzinger, M., Horn P., Vajkoczy P., Kreisel S., Brunner J., Schmiedek P., Hennerici, M.: Inflammatory citokines in subarachnoid hemorrhege: Association with abnormal blood flow velocities in the basal cerebral arteries. J Neurol Neurosurg Psychiatry. 2001; 70:534-537. [ Links ]
21. Fathi., A.R., Graupner, T., Hidalgo, T., Rohrer, J., Schroth, G., Fandiño, J.: Norepinephrine induces dilatation in the rabbit basilar artery after subarachnoid hemorrhage in vivo Schweiz Arch Neurol Psych 2005; 156: 382. [ Links ]
22. Ferguson, G.G., Harper, Fitch, W., et al.: Cerebral blood flow measurements after spontaneous subarachnoidhemorrhage. Eur Neurol. 1972; 8: 15-22. [ Links ]
23. Findlay, J.M., Weir, B.K.A., Gordon, P., Grace, M., Baugham, R.: Safety and efficacy of intratechal thrombolytic therapy in a primate model of cerebral vasospasm. Neurosurgery.1989; 24: 491-498. [ Links ]
24. Fisher, C.M., Kistler, J.P., Davis, J.M.: Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning. Neurosurgery. 1980; 6: 1-9. [ Links ]
25. Gaetani, P., Rodríguez y Baena, R., Grignani, G., Spanu, G., Pacchiarini, L., Paoletti, P.: Endothelin and aneurysmal subarachnoid haemorrhage: A study of subarachnoid cisternal cerebrospinal fluid. J Neurol Neurosurg Psychiatry. 1994; 66-72. [ Links ]
26. Gasser, S., Kahn, N., Yonekawa, Y., Imhof, H.G., Keller, E.: Long-term hypothermia in patients with severe brain edema after poor-grade subarachnoid hemorrhage: Feasibility and intensive care complications. J Neusurg Anesthesiol. 2003; 15: 240-248. [ Links ]
27. Gelmers, H., Beks, J.W.F., Journée, H.L.: Regional cerbral blood flow in patients with subarachnoid hemorrhage. Acta Neurochir (Wien). 1979; 47: 245-251. [ Links ]
28. Géraud, G., Tremoulet, M., Guell, A., et al.: The prognostic value of noninvasive cbf measurement in subarachnoid hemorrhage. Stroke. 1984; 15: 301-305. [ Links ]
29. Grandin, C.B., Cosnard, G., Hammer, F., Duprez, T.P., Stroobandt, G., Mathurin, P.: Vasospasm after subarachnoid hemorrhage: Diagnosis with mr angiography. AJNR. 2000; 21: 1571-1572. [ Links ]
30. Graupner, T, Fathi, A.R., Wehrli, F., Schmidt, J., Fandiño, J.: Effects of intrathecal nitroglycerin on subarachnoid hemorrhage-induced cerebral vasospasm in the rabbit in vivo Schweiz Arch Neurol Psych. 2005; 156: 383. [ Links ]
31. Haley, E., Kassell, N.F., Apperson-Hansen, C, Alves, W.M.: A randomized, double-blind, vehicle-controlled trial of tirilazad mesylate in patients with neurysmal subarachnoid hemorrhage: A sooperative study in north america. J Neurosurg. 1997; 86: 467-474. [ Links ]
32. Heilbrum, M., Olesen, J., Lasen, N.A.: Regional cerebral blood flow studies in subarachnoid hemorrhage. J Neurosurg. 1972; 37: 36-44. [ Links ]
33. Heros, R., Zervas, N.T., Varsos, V.G.: Cerebral vasospasm after subarachnoid hemorrhage: An update. Ann Neurol. 1983; 14: 599-608. [ Links ]
34. Higashida, R., Halbach, V.V., Cahan L.D., et al.: Transluminal angioplasty for the treatment of intracranial arterial vasospasm. J Neurosurg. 1989; 71: 648-653. [ Links ]
35. Jost, S.C., Diringer, M.N., Zazulia, A.R., Videen, T.O., Aiyagari, V., Grubb, R.L., Powers, W.J.: Effect of normal saline bolus on cerebral blood flow in regions with low baseline flow in patients with vasospasm following subarachnoid hemorrhage. J Neurosurg. 2005; 103: 25-30. [ Links ]
36. Juvela, S.: Plasma endothelin concentrations after aneurysmal subarachnoid hemorrhage. J Neurosurg. 2000; 92: 390-400. [ Links ]
37. Kaku, Y., Yonekawa, Y., Tsukahara, T., Kazekawa, K.: Supraselective intra-arterial infusion of papaverine for thetreatment of cerebral vasospasm after subarachnoid hemorrhage. J Neurosurg. 1992; 77: 842-848. [ Links ]
38. Kassell, N., Helm, G., Simmons, N., Philips, C.G., Cail, W.S.: Treatment of cerebral vasospasm with intra-arterial papaverine. J Neurosurg. 1992; 77: 848-853. [ Links ]
39. Kassell, N., Peerless, S.J., Durward, O.J., et al.: Treatment of ischemic deficits from vasospasm with intravascular volume expansion and induced arterial hypertension. Neurosurgery. 1982; 11: 337-343. [ Links ]
40. Kassell, N.F., Torner, J.C., Haley, E.C.: The international cooperative study on the timing of aneurysm surgery. J Neurosurg. 1990; 73: 18-36. [ Links ]
41. Kensuke, E., Yoshitaka. H., Hisashi K.: Reduction in serum cholesterol with pravastatin improves endotheliumdependent coronary vasomotion in patients with hypercholesterolemia. Circulation. 1994; 89: 2519-2524. [ Links ]
42. Kitazono ,T., Heistad, D.D., Faraci, FM.: Enhance responses of the basilar artery mto activation of endothelinb receptors in stroke-prone spontaneously hypertensive rats. Hypertension. 1995; 25: 490-494. [ Links ]
43. Klimo, P.J., Kestle, J.R., MacDonald, J.D., Schmidt, R.H.: Marked reduction of cerebral vasopasm with lumbar drainage of cerebrospinal fluid after subarachnoid hemorrhage. J Neurosurg. 2004; 100: 215-224. [ Links ]
44. Komotar, R,J., Olivi, A., Rigamonti, D., Tamargo, R.J.: Microsurgical fenestration of the lamina terminalis reduces the incidence of shunt-dependent hydrocephalus after aneurysmal subarachnoid hemorrhage. Neurosurgery. 2002; 51: 1403- 1412. [ Links ]
45. Kroppenstedt, S.N., Thomale, U.W., Griebenow, M., Sakowitz, O.W., Schaser, K.D., Mayr, P.S., Unterberg, A.W., Stover, J.F.: Effects of early and late intravenous norepinephrine infusion on cerebral perfusion, microcirculation, braintissue oxygenation, and edema formation in brain-injured rats. Crit Care Med. 2003; 31: 2211-2221. [ Links ]
46. Laufs, U., La Fata, V., Plutzky, J.: Upregulation of endothelial nitric oxide synthesa by hnigcoa reductase inhibitors. Am Heart J. 1998; 97: 1129-1135. [ Links ]
47. Linder, L., Kiowski, W., Buffler, F.R., Luscher, T.E.: Indirect evidence for release of endothelium-derived relaxing factor in human forearm circulation in vivo: Blunted response in esetial hypertension Circulation. 1990; 81:1762-1767. [ Links ]
48. Longstreth, W,J., Nelson, L.M., Koepsell, T.D., et al.: Clinical course of spontaneous subarachnoid hemorrhage: A population-based study in king county, washington. Neurology. 1993; 43: 712-718. [ Links ]
49. Lynch, J.R., Wang, H., McGirt, M.J., Floyd, J., Friedman, A.H., Coon, A.L., Blessing, R., Alexander, M.J., Graffangnino, C., Warner, D.S., Laskowitz, D.T.: Simvastatin reduces vasospasm after aneurysmal subarachnoid hemorrhage: Results of a pilot clinical trial. Stroke. 2005; 36: 2024- 2026. [ Links ]
50. Macdonald, R.: Pathophysiology and molecular geneticsof vasospasm. Acta Neurochirur. 2001; 77 (Suppl):7-11. [ Links ]
51. Macdonald, R.L., Zhang, Z.D., Curry, D., Elas, M., Aihara, Y., Halpern, H., Jahromi, B.S., Johns, L.: Intracisternal sodium nitroprusside fails to prevent vasospasm in nonhuman primates. Neurosurgery. 2002; 51: 761-768; discussion 768- 770. [ Links ]
52. McAuliffe, W., Townsend, M., Eskridge, J.M. et al.: Intracranial pressure changes induced during papaverine infusion for treatment of vasospasm. J Neurosurg. 1995; 83: 430-434. [ Links ]
53. McGirt, M.J., Lynch, J.R., Parra, A., Sheng, H., Pearlstein, R.D., Laskowitz, D.T., Pelligrino, D.A., Warner, D.S.: Simvastatin increases endothelial nitric oxide synthase and ameliorates cerebral vasospasm resulting from subarachnoid hemorrhage. Stroke. 2002; 33: 2950-2956. [ Links ]
54. Murayama. Y., Malisch, T., Guglielmi, G., Mawad, M.E., Viñuela, F., Duckwyler, G.R., Gobin, Y.P., Klubcznic, R.P., Martin, N.A.: Incidence of cerebral vasospasm after endovascular treatment of acutely ruptured aneurysms. J Neurosurg. 1997; 87: 830-835. [ Links ]
55. Newell, D., Eskridge, J.M., Mayberg, M.R., et al.: Angioplasty for the treatment of symptomatic vasospasm following subarachnoid hemorrhage. J Neurosurg. 1989; 71: 654-660. [ Links ]
56. Origatano, T., Wascher, T.M., Reichman, O.H., Anderson, D.E.: Sustained increased cerebral blood flow with prophylactic hypertensive, hypervolemic hemodilution ("Triple-h therapy") after subarachnoid hemorrhage. Neurosurgery. 1990; 27: 729-740. [ Links ]
57. Otawara, Y., Ogasawara, K., Ogawa, A., Sasaki, M., Takahashi, K.: Evaluation of vasospasm after subarachnoid hemorrhage by use of multiislice computed tomography angiography. Neurosurgery. 2002; 51: 939-942. [ Links ]
58. Pluta, R., Boock, R.J., Afshar, J.K., Clouse, K., Bacic, M., Ehrenreich, H., Oldfield, E.H.: Source and cause of endothelin- 1 release into cerebrospinal fluid after subarachnoid hemorrhage. J Neurosurg. 1997; 87: 287-293. [ Links ]
59. Polin, R.S., Apperson-Hansen, C., German, P., Chadduck, J.B., Kassell, N.F.: Intraarterial administered papaverine for the treatment of symptomatic cerebral vasospasm. Neurosurgery. 1998; 42: 1256-1267. [ Links ]
60. Polin, R.S., Bavbek, M., Shaffrey, M.E., Billups, K., Bogaev, C.A., Kassell, N.F., Lee, K.S.: Detection of soluble eselectine, icam-1, vcam-1, and 1-selectin in the cerebrospinal fluid of patients after subarachnoid hemorrhage. J Neurosurg. 1998; 89: 559-567. [ Links ]
61. Pool, J.L.: Cerebral vasospasm. N Engl J Med. 1958;259:1259-1264. [ Links ]
62. Pradilla, G., Thai, Q.A., Legnani, F.G., Clatterbuck, R.E., Gailloud, P., Murphy, K.P., Tamargo, R.J.: Local delivery of ibuprofen via controled-release polymers prevents angiographic vasospasm in a monkey model of subarachnoid hemorrhage. Neurosurgery 2005; 57 (ONS Suppl 1):184-190. [ Links ]
63. Pradilla, G., Thai, Q.A., Legnani, F.G., Hsu, W., Kretzer, R.M., Wang, P.P., Tamargo, R.J.: Delayed intracranial delivery of a nitric oxide donor from a controlled-release polymer prevents experimental cerebral vasospasm in rabbits. Neurosurgery. 2004; 55: 1393-1399; discussion 1399-1400. [ Links ]
64. Pradilla, G., Vargas, D.L., Thai, Q.A., Legnani, F.G., Clatterbuck, R.E., Mankowski, D.V.M., Essa, A.M., Tamargo, R.J.: Endothelial expression of icam-1 and vcam-1 after subarachnoid hemorrhage in monkeys treated with locally-delivered ibuprofen (abstract). Congress of Neurological Surgeons, 55th Annual Meeting. Boston, 2005. [ Links ]
65. Pradilla, G.W., Wang, H., Legnani, F.G., Frazier, J.L., Tamargo, R.J.: Pharmacokinetics of controlled-release polymers in the subarachnoid space after subarachnoid hemorrhage in rabbits. J Neurosurg. 2004; 101: 99-103. [ Links ]
66. Rapoport, R.M., Murad, F.: Agonist-induced endothelium- dependent relaxation in rat thoracic aorta may be mediated through cgmp. Cir Res. 1983; 52: 52-357. [ Links ]
67. Robertson, E.: Cerebral lesions due to intracranial aneuryms. Brain. 1949; 72: 150-185. [ Links ]
68. Roux, S., Breu, V., Giller, T., Neidhart, W., Ramuz, H., Coassolo, P.: Ro 61-1790, a new hydrosoluble endothelin antagonist: General pharmacology and effects on experimental cerebral vasospasm. J Pharmacol Exp Ther. 1997; 283: 992-997. [ Links ]
69. Rubanyi, G.M., Polokoff, M.A.: Endothelins: Molecular biology, biochemistry, pharmacology, physiology, and pathophysiology. Pharmacol Rev. 1994; 46: 325-415. [ Links ]
70. Salom, J.B., Torregrosa, G., Alborch, E.: Endothelins and the cerebral circulation. Cerebrovasc Brain Metab Rev. 1995; 7: 131-152. [ Links ]
71. Schwartz, A.Y., Sehba, F.A., Bederson, J.B.: Decreased nitric oxide availability contributes to acute cerebral ischemia after subarachnoid hemorrhage. Neurosurgery. 2000; 47: 208- 214; discussion 214-205. [ Links ]
72. Sehba, F.A., Ding, W.H., Chereshnev, I., Bederson, J.B.: Effects of s-nitrosoglutathione on acute vasoconstriction and glutamate release after subarachnoid hemorrhage. Stroke. 1999; 30: 1955-1961. [ Links ]
73. Sehba, F.A., Schwartz, A.Y., Chereshnev, I., Bederson, J.B.: Acute decrease in cerebral nitric oxide levels after subarachnoid hemorrhage. J Cereb Blood Flow Metab. 2000; 20: 604-611. [ Links ]
74. Seifert, V., Löffler, B.M., Zimmermann, M., Roux, S., Stolke, D.: Endothelin concentrations in patients with aneurysmal subarachnoid hemorrhage. J Neurosurg. 1995; 82: 55- 62. [ Links ]
75. Seiler, R., Reulen, H.J., Huber, P., et al.: Outcome of aneurysmal subarachnoid hemorrhage in a hospital population: A prospective study including early operation, intravenous nimodipine, and transcranial doppler ultrasound. Neurosurgery. 1988; 23: 598-604. [ Links ]
76. Shibuya, M., Satoh, S.: Effects of fasudil HCL (Ca pro-tein kinase inhibitor) on cerebral vasospasm and infarction. In: McDonald R, ed. Cerebral vasospasm. New York, NY: Thieme Medical Publishers; 2003. [ Links ]
77. Staunton, D.E., Marlin, S.D., Stratowa, C., Dustin, M.L., Springer, T.A.: Primary structure of icam-1 demonstrates interaction between members of the immunoglobulin and integrin supergene families. Cell. 1988; 52: 925-933. [ Links ]
78. Stornelli, S.A., French, J.D.: Subarachnoid hemorrhage- factors in prognosis and mamgement. J Neurosurg. 1964; 21: 769-780. [ Links ]
79. Stover, J.F., Sakowitz, O.W., Thomale, U.W., Kroppenstedt, S.N., Unterberg, A.W.: Norepinephrine-induced hyperglycemia does not increase cortical lactate in brain-injured rats. Intensive Care Med. 2002; 28: 1491-1497. [ Links ]
80. Suzuki, K., Meguro, K., Sakurai, T., Saitoh, Y., Takeuchi, S., Nose, T.: Endothelin-1 concentration increases in the cerebrospinal fluid in cerebral vasospasm caused by subarachnoid hemorrhage. Surg Neurol. 2000; 53: 131-135. [ Links ]
81. Takahashi, A., Yoshoto, T., Mizoi, K., Sugawara, T., Fujii, Y.: Transluminal balloon angioplasty for vasospasm after subarachnoid hemorrhage. In: Sano K, Takakura K, Kassell NF, Sasaki T, ed. Cerebral vasospasm. Tokyo: University Tokyo Press; 1990: 429-432. [ Links ]
82. Tseng, M.Y., Czosnyka, M., Richards, H., Pickard, J.D., Kirkpatrick, P.J.: Effects of acute treatment with pravastatin on cerbral vasospasm, autoregulation, and delayed ischemic deficits after aneurysmal subarachnoid hemorrhage. A phase ii randomized placebo-controlled trial. Stroke. 2005; 36: 1627-1632. [ Links ]
83. Vajkoczy, P., Meyer, B., Weidauer, S., et al.: Clazosentan (AXV-034343), a selective endothelin a receptor antagonist, in the prevention of cerebral vasospasm following severe aneurysmal subarachnoid hemorrhage: Results of a randomized, double-blind, placebo-controlled, multicenter phase iia study. J Neurosurg. 2005; 103: 9-17. [ Links ]
84. Vatter, H., Zimmermann, M., Tesanovic, V., Raabe, A., Schilling, L., Seifert, V.: Cerebrovascular characterization of clazosentan, the first nonpeptide endothelin receptor antagonist clinically effective fro the treatment of cerbral vasospasm. Part is Inhibitory effect on endothelin a receptor-mediated contraction. J Neurosurg. 2005; 102:1101-1107. [ Links ]
85. Vatter, H., Zimmermann, M., Tesanovic, V., Raabe, A., Seifert, V., Schilling, L.: Cerebrovascular characterization of clazosentan, the first nonpeptide endothelin receptor antagonist shown to be clinically effective for the treatment of cerebral vasospasm. Part ii: Effect on endothelin b receptormediated relaxation. J Neurosurg. 2005; 102:1108-1114. [ Links ]
86. Weir, B., Kongable, G.L., Kassell, N.F., et al.: Cigarette smoking as a cause of aneurysmal subarachnoid hemorrhage and risk for vasospasm: A report of the cooperative aneurysm study. J Neurosurg. 1998; 89: 405-411. [ Links ]
87. Wickam, G., Lan, C., Vollrath, B.: Functional roles of the rho/rho kinase pathway and protein kinase c in the regulation of cerebrovascular constriction mediated by hemoglobin: Relevance to subarachnoid hemorrhage and vasospasm. Circ Res. 2003; 92: 809-816. [ Links ]
88. Wolf, E.W., Banerjee, A., Soble-Smith, J., Dohan, F.C., Jr., White, R.P., Robertson, J.T.: Reversal of cerebral vasospasm using an intrathecally administered nitric oxide donor. J Neurosurg. 1998; 89: 279-288. [ Links ]
89. Woszczyk, A., Deinsberger, W., Boker, D.K.: Nitric oxide metabolites in cisternal CSF correlate with cerebral vasospasm in patients with a subarachnoid haemorrhage. Acta Neurochir (Wien). 2003; 145: 257-263; discussion 263-254. [ Links ]
90. Yanagisawa, M., Kurihara, H., Kimura, S., et al.: A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature. 1988; 332: 411-415. [ Links ]
91. Yonekawa, Y., Fandino, J., Taub, E.: Surgical therapy. In: Fisher M, Borgousslaysky, J., ed. Current review of cerebrovascular disease. Philadelphia: Current Medicine, Inc; 2001; pp. 220-232. [ Links ]
92. Zubkov, Y., Nikiforov, B.M., Shustin, V.A,: Ballooncatheter technique for the dilatation of constricted cerebral arteries after aneurysmal sah. Acta Neurochir (Wien). 1984; 70: 65-79. [ Links ]
93. Zuccarello, M., Boccaletti, R., Romano, A., Rapoport, R.M.: Endothelin b receptor antagonists attenuate subarachnoid hemorrhage-induced cerebral vasospasm. Stroke. 1998; 29: 1924-1929. [ Links ]
94. Zuccarello, M., Lewis, A.I., Rapoport, R.M.: Endothelin et-a and et-b receptors in subarachnoid hemorrhageinduced cerebral vasospasm. Eur J of Pharmacol. 1994; 259: R1-R2. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Javier Fandino, M.D.
Department of Neurosurgery University Hospital Bern.
3010 Bern. Switzerland
Recibido: 20-01-06.
Aceptado 16-05-06
Abreviaturas. ACT: computarizada o angiotac. ACV: accidente cerebrovascular. ARM: resonancia magnética. CBF: flujo cerebral sanguíneo. CD11 a/CD18: antígeno-1 de función Iinfocítica. CD11 b/CD18: antígeno macrófago. DIND: déficit neurológico isquémico tardío. EDRF: factor relajante derivado del endotelio. ET: endotelina. ETA: receptor de la endotelina subtipo A. ETB: receptor de la endotelina subtipo B. HSA: hemorragia subaracnoidea. ICAM-1: molécula-1 de adhesión intercelular. LCR: Líquido cefalorraquídeo. NA: noradrenalina. NO: óxido nítrico. NOS: NO-sintetasa. PPV: papaverina. TCD: Doppler transcraneal. t-PA: activador tisular del plasminógeno. UK: uroquinasa. VC: vasospasmo cerebral. VCAM-1: molécula-1 de adhesión vascular.

















