My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.37 n.2 Toledo Mar./Apr. 2013
https://dx.doi.org/10.7399/FH.2013.37.2.374
ORIGINALES
Estudio de las reacciones adversas relacionadas con la infusión de paclitaxel y docetaxel
Study on the adverse reactions related to paclitaxel and docetaxel infusion
I. J. Castro1, M. Pons Busom1, G. I. Ballesteros Cabañas1, E. Ramió Montero1, A. Álvarez Méndez2, R. De Castro Chivato3, M. Centelles Ruiz4
1Servicio de Farmacia, Capio Hospital Universitari Sagrat Cor, Barcelona, España.
2Enfermera Servicio de Farmacia, Capio Hospital Universitari Sagrat Cor, Barcelona, España.
3Enfermera Hospital de Día, Capio Hospital Universitari Sagrat Cor, Barcelona, España.
4Servicio de Oncología, Capio Hospital Universitari Sagrat Cor, Barcelona, España.
Este trabajo fue presentado parcialmente como comunicación tipo póster en el 56 Congreso Nacional de la Sociedad Española de Farmacia Hospitalaria que se celebró en Santiago de Compostela del 18 al 21 de octubre de 2011.
Dirección para correspondencia
RESUMEN
Objetivo: Determinar la incidencia de reacciones a la infusión de paclitaxel y docetaxel, y las posibles causas que pueden desencadenarlas.
Método: Estudio de cohortes de las infusiones de paclitaxel y docetaxel realizadas en un hospital de tercer nivel, desde julio de 2010 hasta diciembre de 2011 (18 meses). Para cada infusión se registraron los datos clínicos del paciente y los referentes al taxano administrado. Ante la aparición de una reacción durante la infusión se especificó: tipo, gravedad y si ésta obligó a la suspensión del tratamiento. Se consultaron las historias clínicas y las órdenes médicas. El seguimiento de las infusiones se realizó contactando con las enfermeras de hospital de día. Se efectuó un estudio descriptivo de las variables más relevantes incluidas en el seguimiento y se analizó si alguna de ellas podía influir en la aparición de reacciones.
Resultados: Durante el periodo de estudio, se administraron 357 infusiones de paclitaxel y docetaxel a 92 pacientes: media de edad 61,4 años (DE 11,1), 50,0% mujeres. Se detectaron 9 reacciones infusionales que afectaron a 8 pacientes, todas ellas causadas por docetaxel (χ2 = 8,3, p = 0,004); el 14,5% de los pacientes que lo llevaron, y siempre durante el primer o segundo ciclo de tratamiento. Las variables asociadas significativamente a la aparición de reacciones fueron: neoplasia de pulmón (p<0,005), esquema docetaxel-cisplatino (p< 0,005), recibir el fármaco en primera línea (p = 0,021) y enfermedad no avanzada (p = 0,014).
Conclusiones: En nuestro centro hospitalario, docetaxel es el taxano que ha provocado más problemas de seguridad durante su infusión.
Palabras clave: Paclitaxel; Docetaxel; Reacción de hipersensibilidad.
ABSTRACT
Objective: To determine the incidence of paclitaxel and docetaxel infusion-associated reactions, and the likely causes that may trigger them.
Method: Cohort study of the paclitaxel and docetaxel infusions carried out at a tertiary hospital from July of 2010 to December of 2011 (18 months). For each infusion, the clinical data and the drug-related data were recorded. When a reaction occurred during the infusion the following data were specified: type, severity, if treatment withdrawal was needed. The clinical charts and treatment orders were reviewed. The follow-up of the infusions were done by contacting the day-care hospital nurses. A descriptive study was done for the most relevant variables included in the follow-up and we analyzed if any of them could have had an influence on the occurrence of the reactions.
Results: During the study period, 357 paclitaxel and docetaxel Infusions were administered to 92 patients: mean age 61.4 years (SD 11.1), 50.0% were female. 9 infusion reactions affecting 8 patients occurred, all of them caused by docetaxel (χ2 = 8.3, p = 0.004); 14.5% of the patients receiving it, and always during the first or second treatment cycle. The variables significantly associated to the occurrence of the reaction were: lung cancer (p<0.005), docetaxel-cisplatin regime (p<0.005), receiving the drug as first line (p = 0.021), and non-advanced disease (p = 0.014).
Conclusions: At our hospital, docetaxel is the taxane that has provoked the most frequent safety problems during the infusion.
Key words: Paclitaxel; Docetaxel; Hypersensitivity reaction.
Introducción
Desde ya hace algunas décadas, los taxanos paclitaxel y docetaxel han demostrado ser efectivos en una gran variedad de tumores. Paclitaxel está aprobado para el tratamiento de las neoplasias de mama, pulmón (células no pequeñas) y ovario; y docetaxel para las de mama, pulmón (células no pequeñas), cabeza y cuello, adenocarcinoma gástrico y próstata1,2. La acción citotóxica de los taxanos se sustenta en la estabilización de la tubulina y la posterior formación de microtúbulos no funcionales que desencadenan una mitosis errónea, por lo que las células cancerosas dejan de dividirse y acaban por morir1-3. En estudios preclínicos, docetaxel ha demostrado ser más eficaz que paclitaxel ya que se une a la tubulina con mayor afinidad, presenta una acción directa antitumoral por activación de vías apoptóticas y una mayor retención en las células tumorales4.
Uno de los inconvenientes que presentan estas sustancias es su pobre solubilización, por ello requieren el uso de vehículos surfactantes no iónicos para su formulación. El Cremophor EL, derivado polioxietilado del aceite de ricino, es el solubilizante usado para paclitaxel y el polisorbato 80 (Tween 80), otro derivado polioxietilado, lo es para docetaxel. Estos dos vehículos incrementan las interacciones farmacológicas con otros antineoplásicos (p. ej. antraciclinas) y pueden alterar la farmacocinética de los fármacos con los que se formulan, predisponiendo a una mayor toxicidad, especialmente en el caso de paclitaxel por su farmacocinética no lineal4-6. Para minimizar las reacciones adversas, evitar la premedicación y disminuir los tiempos de administración de paclitaxel y docetaxel, se han desarrollado nuevas estrategias de formulación tales como nanopartículas de albúmina, poliglutamatos, profármacos, emulsiones o liposomas5. Hasta la fecha, sólo la nueva formulación de paclitaxel a base de nanopartículas de albúmina (Abraxane®) se ha comercializado en España.
El perfil de seguridad de estos agentes antitumorales es divergente; mientras paclitaxel está más asociado a neuropatías periféricas, mialgias y artralgias, docetaxel lo está a la retención de líquidos (aumento de peso, inflamación de los tobillos o de la zona abdominal)5,7. Aproximadamente con la misma frecuencia, los dos fármacos pueden provocar reacciones a la infusión (disnea, dolor torácico, angioedema, hipotensión, urticaria y rash cutáneo) que dependen de las propias características del taxano, del solvente o de ambos, y cuya aparición es posible que se deba, entre otras causas, a la infusión rápida de estos preparados8,9. Estas reacciones, muchas veces también llamadas reacciones de hipersensibilidad, suelen ocurrir durante los primeros minutos de infusión y generalmente en la primera o segunda dosis, pudiendo aparecer incluso con una adecuada premedicación basada en corticoides y antihistamínicos8,10.
Todo ello ha motivado nuestro interés por determinar la incidencia de reacciones adversas relacionadas con la infusión de los taxanos paclitaxel y docetaxel en nuestro centro, y las posibles causas que pueden desencadenarlas.
Método
Estudio observacional, longitudinal y prospectivo de todas las infusiones de paclitaxel o docetaxel desde julio de 2010 hasta diciembre de 2011, en un hospital universitario de nivel 3 sin trasplantes.
Los pacientes tratados con paclitaxel recibieron premedicación oral con dexametasona 8 mg el día previo a la quimioterapia, y el mismo día por vía intravenosa: ondansetron 8 mg, dexametasona 8-12 mg, dexclorfeniramina 5 mg y ranitidina 50 mg, 30 minutos antes de su administración. La premedicación usada para docetaxel consistió en dexametasona oral 8mg dos veces al día durante tres días, iniciando un día antes de la quimioterapia, y además, el mismo día por vía intravenosa: ondansetron 8 mg y dexametasona 8-12 mg, 30 minutos antes de su administración.
Las marcas comerciales utilizadas fueron Paclitaxel Hospira® en el caso de paclitaxel y Taxotere® y Docetaxel Hospira® para docetaxel. Docetaxel se administró en suero fisiológico de 250 ml durante 60 minutos, y paclitaxel en suero fisiológico de 500 ml en 180 minutos de infusión. En la poliquimioterapia, los taxanos fueron administrados siempre en primer lugar, por lo que las reacciones que pudiesen aparecer durante los primeros minutos de infusión sólo podían ser atribuidas a éstos.
Se realizó un seguimiento diario de todas las administraciones de taxanos y se registraron los siguientes variables:
• Datos del paciente: edad, sexo, número de historia clínica y oncólogo responsable.
• Datos clínicos: neoplasia, estadio, antecedentes patológicos, alergias, medicación habitual y tratamientos quimioterápicos previos en el caso que los hubiera.
• Datos referentes al tratamiento oncológico: tipo de taxano (incluyendo nombre comercial), dosis, frecuencia, ciclo, quimioterapia concomitante y premedicación.
• Aparición de alguna reacción adversa medicamentosa (RAM) durante la infusión del taxano, especificando tipo y gravedad de acuerdo con la clasificación NCI-CTCAE v.3.0 2006 del National Cancer Insitute11.
Para registrar los datos relacionados con el paciente se consultaron las historias clínicas. Los datos referentes al tratamiento oncológico se obtuvieron de la receta médica por paciente y ciclo de tratamiento. El seguimiento de cada infusión fue realizado por el farmacéutico responsable del área de citostáticos y el farmacéutico residente contactando con la enfermera de hospital de día encargada de administrar el taxano. La relación de causalidad de las reacciones fue determinada mediante el algoritmo de Karch-Lasagna modificado12.
El análisis estadístico de las variables cualitativas y cuantitativas se realizó con el programa SPSS v.15.0. Se evaluó si la variable dicotómica principal RAM sí -RAM no, se asociaba o no de manera significativa con cada una de las variables independientes. La prueba de chi-cuadrado se empleó para las variables categóricas y la t de Student para la comparación de medias en muestras independientes, tomando p<0,05 como relación estadísticamente significativa.
El estudio fue aprobado por el Comité Ético de Investigación Clínica del hospital y requirió para su realización la firma de consentimiento informado por parte de los pacientes que cumplían los criterios de inclusión.
Resultados
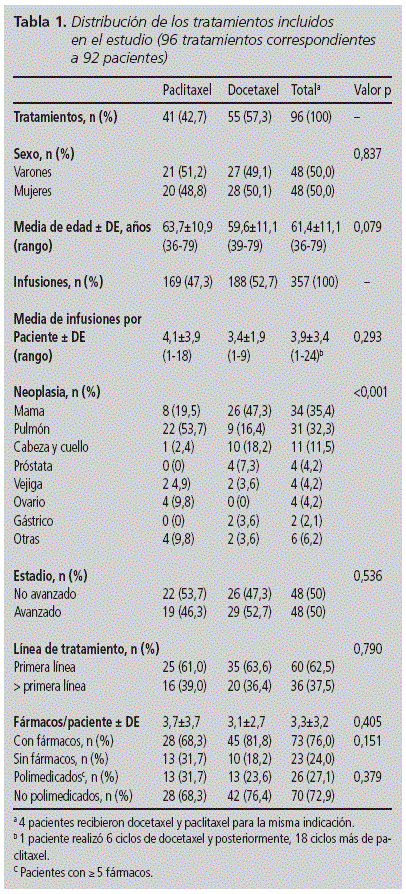
Durante los 18 meses de estudio se infundieron 4.689 fármacos oncológicos, de los cuales el 7,6% correspondieron a los taxanos incluidos en el seguimiento. En total 357 infusiones de paclitaxel y docetaxel administradas a 92 pacientes (50,0% mujeres), con edades comprendidas entre 36 y 79 años, y una media de edad de 61,4 años (DE 11,1). Docetaxel fue el taxano más utilizado tanto en número de pacientes (n = 55, 57,3%) como de infusiones (n = 188, 52,7%). No se encontraron diferencias significativas en las variables basales de ambas cohortes, a excepción de la distribución de las neoplasias (tabla 1): la indicación más habitual para docetaxel fue el cáncer de mama (47,3%), mientras que para paclitaxel fue el de pulmón (53,7%). Más de la mitad de los pacientes recibieron el tratamiento en primera línea (62,5%).
Se utilizaron un total de 36 protocolos quimioterápicos, siendo el esquema más empleado tanto para docetaxel como para paclitaxel la combinación con carboplatino (cáncer de cabeza y cuello, y pulmón respectivamente) (tabla 2).
Se detectaron 9 reacciones infusionales correspondientes a 8 pacientes (8,7% del total), todas ellas causadas por docetaxel (χ2 = 8,3, p = 0,004) y siempre durante el primer o segundo ciclo de tratamiento. Así pues, el 4,8% de las infusiones de docetaxel ocasionaron una reacción, el 66,7% (n = 6) de las cuáles aparecieron en el segundo ciclo de tratamiento y acabaron afectando al 14,5% de los pacientes que habían recibido este quimioterápico. Si se seleccionan sólo las infusiones de docetaxel administradas durante el primer o segundo ciclo, la incidencia de reacciones incrementa hasta el 10,5% de las administraciones. En todos los casos, las reacciones aparecieron en pacientes con una edad inferior a 65 años (56,3 años DE 4,1), no polimedicados, sin alergias previas conocidas y en primera línea de tratamiento.
El 66,7% (n = 6) de las reacciones fueron consideradas como moderadas según el NCI-CTCAE v.3.011. En uno de los casos la reacción fue considerada como muy grave ya que se requirieron medidas de soporte vital. Este fue el único caso en el que la reacción motivó la suspensión del tratamiento. En 6 pacientes el retratamiento con docetaxel fue tolerado sin problemas y en dos pacientes se administró paclitaxel posteriormente sin incidencias (tabla 3). Según el algoritmo de Karl-Lasagna modificado12 todas las reacciones fueron clasificadas como probables.
En el grupo de los varones aparecieron 5 reacciones que tuvieron como denominador común el cáncer de pulmón y el esquema docetaxel 75 mg/m2 + cisplatino 75mg/m2 c/21 días. Este esquema fue administrado a un total de 6 pacientes, por lo que el 83,3% de los que recibieron este protocolo presentaron una reacción a la infusión. En las 3 reacciones que aparecieron en mujeres, la única neoplasia implicada fue la de mama, y los protocolos quimioterápicos fueron en 2 ocasiones la combinación con trastuzumab y en una con carboplatino.
En este estudio las variables que se correlacionaron estadísticamente con la aparición de reacciones a la infusión de docetaxel fueron: neoplasia de pulmón (p<0,005), esquema docetaxel-cisplatino (p<0,005), recibir el fármaco en primera línea (p = 0,021) y en enfermedad no avanzada (p = 0,014). Sin embargo no se observó tal correlación con las variables sexo, edad y medicación habitual.
Discusión
La efectividad de los taxanos se puede ver comprometida por la aparición de reacciones de hipersensibilidad durante su infusión. En ocasiones éstas pueden obligar a suspender el tratamiento teniendo que recurrir a otros esquemas que podrían ser menos efectivos.
En la literatura científica se describe que docetaxel y paclitaxel provocan reacciones de hipersensibilidad con una frecuencia cercana al 30%, pero disminuye hasta el 2-5% si se realiza pretratamiento con corticoides y antihistamínicos, y si se reduce la velocidad de perfusión1,2,8,13,14. En nuestro estudio, paclitaxel no provocó ninguna reacción con la premedicación utilizada e infundiéndolo durante 3 horas2. Sin embargo, con docetaxel aparecieron 9 episodios (14,5% de los pacientes) administrándolo durante una hora y pese administrar en Hospital de Día la premedicación recomendada en ficha técnica1. La mayoría de las reacciones (6) fueron solventadas reforzando la premedicación, y reduciendo la velocidad de administración de 250 ml/h a 125 ml/h e incrementando posteriormente la velocidad de forma progresiva. Algunos autores, aparte de reducir la velocidad de administración también recomiendan otras opciones como disminuir la concentración de fármaco a administrar o bien considerar la aplicación de protocolos de desensibilización mediante perfusiones con dosis crecientes15-18. Existen estudios que abogan también por cambiar un taxano por otro cuando aparece una reacción de hipersensibilidad a uno de ellos19-21. Ciertamente, el cambio de uno por otro puede favorecer la continuación del tratamiento, sin embargo existe controversia al respecto ya que otros autores como Dizon et al.14 opinan que esto no es posible por la existencia de una reactividad cruzada entre los taxanos. En nuestro seguimiento no hubo tal reactividad cruzada, ya que dos pacientes que presentaron una reacción infusional a docetaxel recibieron posteriormente paclitaxel sin incidencias. En 6 pacientes el retratamiento con docetaxel fue bien tolerado, sin embargo, hubo un paciente que tras presentar una reacción moderada a docetaxel, volvió a recibir este taxano y nuevamente presentó una reacción, esta vez considerada como grave y que ocasionó la suspensión definitiva del tratamiento. En cualquier caso, lo que sí está claro es que la administración de cualquier taxano queda contraindicada si la reacción de hipersensibilidad ocasionada por alguno de ellos es severa (grado 3-4)1,2.
Los síntomas relacionados con estas reacciones suelen aparecer en la primera o segunda infusión de la quimioterapia y, generalmente, a los pocos minutos de iniciarla, tal y como sucedió en los 9 pacientes afectados en nuestro seguimiento. Por lo tanto, se debe prestar especial atención en las primeras administraciones del taxano, disponiendo en todo momento de personal experimentado y el soporte de un equipo de reanimación en el caso que hubiera una reacción que amenace la vida del paciente22. Otros cuidados que se podrían realizar son la monitorización de la presión arterial y la observación del paciente hasta 2 horas después de la administración del taxano.
En nuestro estudio, la sintomatología del paciente que tuvo una reacción infusional a docetaxel muy grave se caracterizó por cianosis, pérdida de conciencia, crisis comicial, insuficiencia respiratoria e hipotensión. El cuadro se revirtió rápidamente tras parar la infusión y con la ayuda de corticoides, oxigenoterapia y fluidoterapia; esta reacción fue notificada al centro de farmacovigilancia regional. En los otros casos más leves las reacciones consistieron en eritema cutáneo, rubor facial, dolor lumbar, taquicardia y en algunos casos escalofríos, hipotensión y mareo. En ninguno de ellos hubo disnea o broncoespasmo.
Dos de los pacientes que presentaron una reacción de hipersensibilidad a docetaxel reconocieron no haber tomado correctamente la dexametasona pautada el día previo a la quimioterapia (pacientes 1 y 2, tabla 3). No cabe ninguna duda, que para reducir el riesgo de aparición de estos eventos es clave concienciar a los pacientes de la toma adecuada de la premedicación que se les pauta. Administrar una premedicación basada en antihistamínicos y corticoesteroides previa al taxano es de elección puesto que ha demostrado reducir la incidencia y severidad de la retención de líquidos, así como la gravedad de las reacciones de hipersensibilidad1,2,7. Además, evita interrupciones en el tratamiento y permite incrementar las dosis acumulativas medias de los taxanos8.
Se desconoce si estas reacciones dependen del solvente, o del taxano, o de ambos componentes. Tampoco se sabe a ciencia cierta el mecanismo por el cuál aparecen. Se piensa que pueden estar mediadas por la activación del complemento, liberación inespecífica de histamina, producción de óxido nítrico o bien por la liberación de citocinas. Contrariamente a lo que sucede con los derivados del platino, en principio no se relaciona su aparición con un mecanismo mediado por las IgE, ya que las reacciones suelen aparecer a los pocos minutos de iniciar la infusión durante el primer o segundo ciclo de tratamiento, lo que sugiere que no hay necesidad de una sensibilización previa23-25. Otro aspecto a tener en cuenta, y que con la bibliografía consultada no se ha podido dilucidar con exactitud8,26, es determinar si hay aspectos clínicos o subjetivos que pudieran predisponer al paciente a una reacción de hipersensibilidad aguda o a cualquier otra RAM.
En nuestro estudio los factores que se relacionaron estrechamente con la aparición de reacciones infusionales fueron: neoplasia de pulmón, esquema docetaxelcisplatino, recibir el fármaco en primera línea y enfermedad no avanzada. De estos factores, en la bibliografía consultada únicamente recibir docetaxel en primera o segunda línea ha sido considerado como variable decisiva en la aparición de estas reacciones.
Por otro lado, cabe la posibilidad de que el uso concomitante de paclitaxel o docetaxel con otros antineoplásicos como trastuzumab, carboplatino o cisplatino, pueda potenciar la aparición de reacciones de hipersensibilidad, ya que éstos por sí mismos también pueden originarlas. Trastuzumab, como los taxanos, suele provocar estas reacciones en el primer o segundo ciclo, pero éstas no se presentan a los pocos segundos de iniciar la infusión27. En cambio, las reacciones de los derivados del platino ocurren mayoritariamente a partir del sexto ciclo, durante o posteriormente a su infusión25,28. En nuestro estudio, todas las reacciones aparecieron en pacientes en tratamiento poliquimioterápico con estos fármacos: 6 en combinación con cisplatino, 2 con carboplatino y 1 con trastuzumab. Sin embargo, sólo se puede hallar relación en aquéllas acaecidas durante el segundo ciclo, que es en el que se ha recibido con anterioridad la combinación de fármacos (en 6 de las 9 reacciones en nuestro estudio). Así pues, en el uso combinado sería recomendable usar una premedicación completa, monitorizar estrechamente los pacientes y saber diferenciar las reacciones de hipersensibilidad producidas por cada fármaco, para determinar el agente causal.
En referencia a los posibles sesgos o limitaciones del estudio, probablemente la incidencia de reacciones pudo haber sido mayor debido a que su evaluación constituye una variable subjetiva o blanda que depende de la percepción del observador. Por lo tanto, esta circunstancia pudo haber provocado una infranotificación de reacciones leves porque pudieron haber pasado desapercibidas. Otro sesgo a destacar, fue la utilización de dos marcas comerciales diferentes de docetaxel en distintas fases del estudio (Taxotere® y Docetaxel Hospira®), además de un cambio de formulación en el caso de Taxotere®. Este mismo preparado comercial fue el que presentó todas las reacciones infusionales (dos de ellas con la formulación antigua), si bien es cierto que fue con diferencia el más utilizado (91,5% de las infusiones). Los excipientes de ambas marcas comerciales son: etanol, polisorbato 80 y ácido cítrico, y en el caso de Taxotere® además macrogol 300. La composición cuantitativa de los excipientes no se pudo obtener de las fichas técnicas, por lo que desconocemos si la marca comercial o sus excipientes pudieron influir en la aparición de las reacciones. Una limitación importante del estudio, y que se debe tener en cuenta para trabajos posteriores, fue la no realización de pruebas de provocación a cargo del Servicio de Alergología para poder discernir si las reacciones aparecidas fueron provocadas por el principio activo o los excipientes.
Finalmente, con los resultados obtenidos en este estudio, las medidas que se han tomado en nuestro centro han sido reforzar la premedicación de docetaxel, y realizar una administración lenta del preparado (2-3 horas) en el primer y segundo ciclo de tratamiento. Con paclitaxel se decidió continuar con la misma metodología de trabajo, según se indica en la ficha técnica.
Conclusiones
Docetaxel es el taxano que en nuestro entorno se ha relacionado con un mayor número de reacciones adversas durante su infusión, superior a los datos descritos en la bibliografía.
Una premedicación adecuada tanto en hospital de día como en el domicilio del paciente, es crucial para reducir la incidencia de éstas.
Es imprescindible realizar más estudios para poder conocer con exactitud la etiología de estas reacciones y así poder aplicar medidas efectivas que eviten su aparición.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Ficha Técnica Docetaxel (Taxotere®) (acceso Junio 2010). Disponible en: www.agemed.es [ Links ]
2. Ficha Técnica Paclitaxel (Taxol®) (acceso Junio 2010). Disponible en: www.agemed.es [ Links ]
3. Bagnall A-M, Forbes C, Lewis R, Golder S, Kleijnen J. An update of a rapid and systematic review of the effectiveness and cost-effectiveness of the taxanes used in the treatment of advanced breast cancer. The National Institute for Clinical Excellence (NHS Centre for Reviews and Dissemination). University of York, Abril 2001 (acceso Junio 2010). Disponible en: www.nice.org.uk/nicemedia/live/11435/32235/32235.pdf [ Links ]
4. Gligorov J, Lotz J-P. Preclinical Pharmacology of the taxanes: implications of the differences. The Oncologist. 2004;9(Supl 2):3-8. [ Links ]
5. Hennenfent K L, Govindan R. Novel formulations of taxanes: a review. Old wine in a new bottle? Annals of Oncology. 2006;17:735-49. [ Links ]
6. Ten Tije AJ, Verweij J, Loos WJ, Sparreboom A. Pharmacological effects of formulation vehicles: implications for cancer chemotherapy. Clin Pharmacokinet. 2003;42(7):665-85. [ Links ]
7. Markman M. Managing taxane toxicities. Support Care Cancer. 2003;11(3):144-47. [ Links ]
8. UpToDate. Base de datos. Infusion reactions to systemic chemotherapy; Octubre 2009 (acceso Marzo 2010). Disponible en: http://www.uptodate.com/contents/infusion-reactions-to-systemicchemotherapy [ Links ]
9. Michaud LB. Methods for preventing reactions secondary to Cremophor EL. Ann Pharmacother 1997; 31:1402-4. [ Links ]
10. Weiss RB, Donehower RC, Wiernik PH, et al. Hypersensitivity reactions from Taxol. J Clin Oncol. 1990;8:1263-8. [ Links ]
11. National Cancer Institute Common Toxicity Criteria for Adverse Events (CTCAE) v3.0; Agosto 2006. (acceso Marzo 2010). Disponible en: http://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/ctcaev3.pdf [ Links ]
12. Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981;30:239-45. [ Links ]
13. Micromedex Health Care series. Drugs database. Thomson series (acceso Marzo 2010). Disponible en: www.thomsonhc.com [ Links ]
14. Dizon DS, Schwartz J, Rojan A, Miller J, Pires L, Disilvestro P, et al. Cross-sensitivity between paclitaxel and docetaxel in a women's cancers program. Gynecol Oncol. 2006;100(1):149-51. [ Links ]
15. Markman M, Kennedy A, Webster K, et al. Paclitaxel-Associated Hypersensitivity Reactions: experience of the Gynecologic Oncology Program of the Cleveland Clinic Cancer Center. J Clin Oncol. 2000;18(1):102-5. [ Links ]
16. Castells MC, Tennant NM, Sloane DE, Ida Hsu F, Barrett NA, Hong DI, et al. Hypersensitivity reactions to chemotherapy: Outcomes and safety of rapid desensitization in 413 cases. J Allergy Clin Immunol. 2008;122:574-80. [ Links ]
17. Feldweg AM, Lee CW, Matulonis UA, Castells M. Rapid desensitization for hypersensitivity reactions to paclitaxel and docetaxel: a new standard protocol used in 77 successful treatments. Gynecol Oncol. 2005;96:824-49. [ Links ]
18. Syrigou E, Dannos I, Kotteas E, Makrilia N, Tourkantonis I, Dilana K, et al. Hypersensitivity reactions to docetaxel: retrospective evaluation and development of a desensitization protocol. Int Arch Allergy Immunol. 2011;156(3):320-4. [ Links ]
19. J Lokich J, Anderson N. Paclitaxel hypersensitivity reactions: A role for docetaxel substitution. The Cancer Center of Boston. Annals of Oncology. 1998;9:573-4. [ Links ]
20. Moon C, Verschraegen CF, Bevers M, Freedman R, Kudelka AP, Kavanagh JJ. Use of docetaxel (Taxotere) in patients with paclitaxel (Taxol) hypersensitivity. Anticancer Drugs. 2000;11(7):565-8. [ Links ]
21. Bernstein BJ. Docetaxel as an alternative to paclitaxel after acute hypersensitivity reactions. Ann Pharmacother. 2000;34(11): 1332-25. [ Links ]
22. Baker J, et al. Docetaxel-related side effects and their management. European Journal of Oncology Nursing. 2009;13:49-59. [ Links ]
23. Lee C, Gianos M, Klaustermeyer WB. Diagnosis and management of hypersensitivity reactions related to common cancer chemotherapy agents. Ann Allergy Asthma Immunol. 2009;102(3):179-87. [ Links ]
24. Ardavanis A, Tryfonopoulos D, Yiotis I, Gerasimidis G, Baziotis N, Rigatos G. Non-allergic nature of docetaxel-induced acute hyper-sensitivity reactions. Anticancer Drugs. 2004;15(6):581-5. [ Links ]
25. Sánchez-Muñoz A, Mediola Fernández C, Poza Guedes P, Canto Diez G, Bezares Montes S, Cortés Funes H. Hipersensibilidad a carboplatino y paclitaxel: revisión y recomendaciones clínicas. Rev Oncol. 2002;4(2):68-71. [ Links ]
26. Cortijo-Cascajares S, Jiménez-Cerezo MJ, Herreros de Tejada A. Revisión de las reacciones de hipersensibilidad a antineoplásicos. Farm Hosp. 2012;36:148-58. [ Links ]
27. Chung CH. Managing premedications and the risk for reactions to infusional monoclonal antibody therapy. Oncologist. 2008;13: 725-32. [ Links ]
28. Markman M, Kennedy A, Webster K, et al. Clinical Features of hypersensitivity reactions to carboplatin. J Clin Oncol. 1999;17(4): 1141-5. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: ijavieca@gmail.com
(I. J. Castro)
Recibido: 13 de octubre de 2012.
Aceptado: aceptado el 31 de diciembre de 2012.