My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.37 n.6 Toledo Nov./Dec. 2013
https://dx.doi.org/10.7399/FH.2013.37.6.742
REVISIONES
Dosis superior a 6 mg/kg/día de daptomicina según parámetros farmacocinéticos/farmacodinámicos en infecciones por Staphylococcus aureus
Daptomycin dosing greater than 6 mg/kg/day depending on pharmacokinetic and pharmacodynamic parameters infections by Staphylococcus aureus
J. M.a Gutiérrez Urbón1, P. Linares Mondéjar2 y I. Martin Herranz1
1Servicio de Farmacia. 2Unidad de Infecciosos. Complejo Hospitalario Universitario. A Coruña.
Dirección para correspondencia
RESUMEN
Daptomicina es un antibiótico lipopéptido cíclico cuya dosis autorizada es de 4 a 6 mg/Kg/día. Actualmente se debate la utilización de dosis mayores de daptomicina, en un rango de 8 a 12 mg/Kg/día, para el tratamiento de infecciones producidas por Staphylococcus aureus, justificado por su acción concentración dependiente y su perfil de tolerancia y seguridad, pero los estudios disponibles no son concluyentes.
Se realiza una estratificación, por grupos de pacientes, de la recomendación de utilizar dosis superiores a 6 mg/Kg/día en función de los parámetros pk/pd predictores de eficacia y seguridad.
Se concluye que dosis de 8 a 12 mg/Kg/día pueden ser beneficiosas en pacientes con sepsis grave, pacientes con hipoalbuminemia y en infecciones que conlleven una carga bacteriana potencialmente elevada o en las que se produzca un secuestro bacteriano. Sin embargo no es adecuado sobrepasar la dosis de 6 mg/Kg/día en pacientes con obesidad y/o con aclaramiento de creatinina inferior a 50 ml/min.
Palabras clave: Daptomicina; Dosis altas; SARM; Farmacocinética; Farmacodinámica.
ABSTRACT
Daptomycin is a cyclic lipopeptide antibiotic whose approved dose is 4 to 6 mg/kg/day. Today it is a matter of controversy the use of higher doses of daptomycin in a range of 8-12 mg/kg/ day, for the treatment of Staphylococcus aureus infections, justified by its concentration-dependent action and its tolerability and safety profile, but the available studies are inconclusive. Stratification is performed by groups of patients, on the recommendation of using doses above 6 mg/kg/day based on the PK/PD parameters predictive of efficacy and safety.
We conclude that doses of 8-12 mg/kg/day may be beneficial in patients with severe sepsis, patients with hypoalbuminemia and infections involving potentially high bacterial load or where there is a bacterial kidnapping. However it is not suitable exceed the dose of 6 mg/kg/day in patients with obesity and/or creatinine clearance less than 50 ml/min.
Key words: Daptomycin; High dose; MRSA; Pharmacokinetics; Pharmacodynamics.
Introducción
Daptomicina es un antibiótico lipopéptido cíclico que tiene acción bactericida concentración dependiente al insertarse, en presencia de iones Ca++, en la membrana citoplasmàtica de las bacterias grampositivas en fase de crecimiento y estacionario, causando su despolarización y bloqueando la síntesis proteica y de ácidos nucleicos.
Su espectro de actividad engloba la práctica totalidad de las bacterias grampositivas, tanto aerobios (Staphylococcus spp., Streptococcus spp., Enterococcus sp., Bacillus sp., Listeria spp., Corynebacterium spp) como anaerobios (Peptostreptococcus spp., Clostridium spp. y Propionibacterium spp.), incluyendo cepas resistentes a penicilinas, aminoglucósidos y glucopéptidos1,2.
Daptomicina está autorizada por la Agencia Europea del Medicamento (EMA) en las infecciones complicadas de piel y partes blandas (IPPBc), en la endocarditis infecciosa del lado derecho (EID) debida a Staphylococcus aureus, y en la bacteriemia por Staphylococcus aureus cuando está asociada con EID o IPPBc3.
La dosis autorizada es de 4 mg/kg en dosis única diaria en IPPBc sin bacteriemia y de 6 mg/kg en dosis única diaria en EID e IPPBc asociadas a bacteriemia. En pacientes con aclaramiento de creatinina inferior a 30 ml/min se mantiene la misma dosis prolongando el intervalo posológico a 48 horas3.
Sin embargo es un tema de debate la utilización de dosis mayores de daptomicina, en un rango de 8 a 12 mg/ kg/día.
La justificación de la utilización de dosis altas (&8 mg/ kg/día) de daptomicina se basa en su acción concentración dependiente, en la consecución, en modelos experimentales in vitro que simulan una endocarditis por SARM, de una acción bactericida más rápida4 y una prevención de la selección de mutantes menos sensibles5 respecto a dosis menores, y en el perfil de tolerancia y seguridad en voluntarios sanos que recibieron una dosis diaria de hasta 12 mg/kg durante 14 días6.
Los estudios que describen la utilización de dosis altas de daptomicina son series de casos, estudios no controlados y estudios observacionales que muestran un perfil de seguridad similar a los que emplean dosis autorizadas y datos de eficacia prometedores7-13. Las Guías de Práctica Clínica contemplan estas dosis en bacteriemia persistente o complicada por S. aureus resistente a meticilina (SARM) e infecciones por SARM con CMI >1 mg/L a vancomicina, aunque otorgan niveles de evidencia y grados de recomendación menores14-16. Un reciente documento de consenso recomienda utilizar dosis entre 8 y 10 mg/ kg/día para el tratamiento de endocarditis e infecciones sobre prótesis articular o material de osteosíntesis por S. aureus, sepsis grave y otras situaciones que cursen con un aumento del volumen de distribución17.
De hecho estas dosis se utilizan en la "vida real" como recoge el estudio pos-autorización EU-CORE, en cuyo registro de más de 3.700 pacientes hasta junio de 2011, incluye a 230 en los que se utilizó una dosis >8 mg/kg/día durante al menos 2 semanas, con una tasa de respuesta clínica superior que la media global del registro (88% frente a 80,2%) y un perfil de tolerancia y seguridad comparable13.
En el siguiente documento se va a profundizar en el análisis de la farmacocinética (pk) y farmacodinamia (pd) de daptomicina para realizar una estratificación, por grupos de pacientes, de la recomendación de utilizar dosis superiores a 6 mg/kg/día, en función de los parámetros pk/pd predictores de eficacia y seguridad, para el tratamiento de infecciones producidas por S. aureus.
Farmacocinética y eficacia
La farmacocinética de daptomicina muestra un comportamiento lineal en un rango de dosis de 6 a 12 mg/kg6. No se producen mecanismos de saturación en la distribución y eliminación del fármaco y las concentraciones plasmáticas máximas (Cmáx) y el área bajo la curva de 24 horas (ABC24h) son predecibles a una dosis dada.
La curvas de letalidad en modelos in vivo establecen que el parámetro pk/pd que mejor se correlaciona con la actividad bactericida para S. aureus es el cociente entre el ABC24h y la concentración mínima inhibitoria (ABC24h/ CMI), siendo 600 el valor del punto de inflexión18. Como el punto de corte de susceptibilidad de daptomicina para S. aureus es 1 mg/L19 el ABC24h coincide con el valor ABC24h/CMI.
En voluntarios sanos el valor medio de ABC24h con una dosis de 6 mg/kg/día es de 729,8 mcg x h/ml (coeficiente de variación de 32,2%)6. En pacientes con bacteriemia y endocarditis por S. aureus el valor medio ± desviación estándar del ABC24h en los sujetos con aclaramiento de creatinina (ACr) superior a 80 ml/min y entre 50 y 80 ml/min es de 545 ± 296 y 637 ± 215 mcg x h/ml respectivamente20. Por tanto una proporción importante de esta población no alcanza el parámetro predictor de eficacia de ABC24h/CMI > 600 (Figura 1).
En un estudio en el que se monitorizaron las concentraciones plasmáticas de daptomicina en 24 pacientes que recibieron una dosis de 6 mg/kg/día, el valor medio ± desviación estándar del ABC24h/CMI fue de 692 ± 210, significativamente inferior al que se obtuvo en 11 pacientes que recibieron una dosis de 8 mg/Kg/día, ABC24h/CMI = 903 ± 280 (p = 0,01)21. En este estudio 4 pacientes murieron (2 que recibieron 6 mg/kg/día y 2 que recibieron 8 mg/kg/día) todos con un ABC24h/CMI < 666. La infección adquirida en UCI, la hipoalbuminemia y la consecución de un ABC24h/CMI < 666 fueron factores independientes asociados a mortalidad.
La consecución de concentraciones subóptimas de daptomicina puede agudizarse en pacientes con sepsis grave/shock séptico donde se produce un incremento del agua extracelular y del volumen de distribución que disminuyen el ABC24h del antibiótico. También en pacientes con hipoalbuminemia se produce un descenso del ABC24h al existir un mayor Vd y ACr consecuencia del desplazamiento de la extensa pero lábil unión de daptomicina a proteínas plasmáticas hacia una mayor fracción de fármaco libre.
Otras variables pueden afectar a la disposición y actividad del antibiótico en el lugar de acción como la formación de biopelículas que actúa como una barrera de difusión que dificulta la penetración del antibiótico22 y el tamaño del inóculo elevado que puede incrementar la CMI del antibacteriano23,24.
Estas situaciones que propician un descenso de la exposición de daptomicina (rápida eliminación renal, reducción del ABC24h, dificultades de acceso en el foco infeccioso) son las que se beneficiarán de forzar la dosis hasta donde podamos asegurar al máximo la eficacia del antibiótico si no existe riesgo de la seguridad.
El efecto contrario se produce en pacientes con sobrepeso y obesidad (índice de masa corporal entre 25 y 39,9 kg/m2). En estos pacientes la administración de daptomicina en dosis ajustada al peso corporal real origina una ABC24h superior en un 30% al de la población sin sobrepeso25. Este porcentaje supera el 60% en casos de obesidad mórbida (índice de masa corporal igual o mayor a 40 kg/m2)26. La ficha técnica de daptomicina no recomienda ningún ajuste posológico en base a la obesidad3, pero hay que asumir una mayor exposición de daptomicina en relación a personas no obesas, por tanto no parece aconsejable un incremento adicional por la utilización de dosis superiores a la autorizada. Un estudio describe una posible relación entre la obesidad y el aumento de creatinina fosfoquinasa (CPK) en pacientes tratados durante al menos 14 días con dosis mayores a 6 mg/kg/día de daptomicina9.
Farmacocinética y seguridad
El efecto adverso más significativo de daptomicina es el incremento de los niveles de CPK en el plasma, que puede estar asociado a síntomas musculares. Se ha observado una relación significativa entre la elevación de CPK y la concentración mínima plasmática (Cmín) de daptomicina, de forma que la probabilidad de elevación de CPK con una Cmín >24,3 mg/L y <24,3 mg/L fue de 0,5 y 0,029 respectivamente (p = 0,002)27. En el estudio pivotal de sepsis y endocarditis por S. aureus con dosis de 6 mg/ kg/día se produjo un aumento significativo de CPK en el 6,7% de los pacientes28. Una estimación mediante farmacocinética poblacional predice una tasa de elevación de CPK y toxicidad muscular asociada del 3,7 y el 1,2%, respectivamente, para dosis de 4 mg/kg/día y del 19,5 y el 6,5%, respectivamente, para dosis de 12 mg/kg/día27. Sin embargo, en los estudios clínicos con dosis altas de daptomicina no se observan estas elevaciones tan significativas de CPK6,7,9-12.
Daptomicina se elimina fundamentalmente por vía renal y en pacientes con deterioro de la función renal se produce una disminución del ACr y por tanto un incremento de la Cmín de daptomicina.
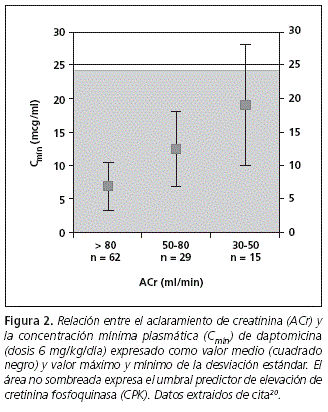
En los pacientes con bacteriemia y endocarditis por S. aureus que reciben 6 mg/Kg/día de daptomicina los valores medios y desviaciones estándar de Cmín en el estado de equilibrio por intervalos de ACr son: 6,9 ± 3,5 mcg/ml para un ACr >80 ml/min, 12,4 ± 5,6 mcg/ml para un ACr entre 50 y 80 ml/min y 19,0 ± 9,0 mcg/ml para un ACr entre 30 y 50 ml/min20. Estos datos indican que en pacientes con ACr inferior a 50 ml/min no tenemos margen de incremento de dosis sin sobrepasar la Cmín asociada a elevación de CPK (Figura 2). En este estudio sólo 2 pacientes tenían un ACr inferior a 30 ml/min, pero en este grupo de pacientes la recomendación es administrar 6 mg/kg y prolongar el intervalo posológico a 48 horas.
El informe EPAR de autorización de daptomicina por la EMA expone que en los pacientes con un ACr entre 30 y 50 ml/min la exposición a daptomicina con una dosis de 6 mg/kg/día es similar a la que se obtendría con una dosis de 8-12 mg/kg/día en pacientes con función renal normal. En la discusión del informe se consideró en estos pacientes una reducción de dosis a 4 mg/kg/día que finalmente se desestimó porque podría ser insuficiente en bacteriemia por SARM20. Esto supone un reconocimiento tácito de que dosis superiores a 6 mg/kg/día no deben ser utilizadas en pacientes con ACr inferior a 50 ml/min.
Otro de los aspectos relacionados con la seguridad es la publicación de casos de neumonía eosinofílica asociados a la administración de daptomicina29,30. La mayoría de los casos se produjeron después de más de dos semanas de tratamiento y mejoraron cuando se interrumpió, pero recurren cuando se someten a re-exposición del fármaco. Se desconoce si está relacionado con dosis altas. En los 7 casos probados notificados a la FDA hasta diciembre de 2010 el rango de dosis utilizadas fue de 4,4 a 8 mg/Kg/día31.
Conclusiones
Es probable que dosis superiores a la autorizada (en un rango de 8 a 12 mg/kg/día) produzcan beneficio en pacientes con sepsis grave y shock séptico y pacientes con déficit de albúmina, así como en infecciones que conlleven una carga bacteriana potencialmente elevada o en las que se produzca un secuestro bacteriano (ej. endocarditis, osteomielitis, infecciones asociadas a material protésico...).
Sin embargo no sería adecuado sobrepasar la dosis de 6 mg/kg/día de peso real en pacientes con obesidad (IMC >30 kg/m2) y/o cuando existe un deterioro de la función renal (ACr en orina recogida en 24 horas o filtrado glomerular estimado según la ecuación MDRD-4 inferior a 50 ml/min) porque estos pacientes ya presentan una exposición mayor a daptomicina respecto a población no obesa o con función renal normal.
Son necesarios estudios clínicos bien diseñados metodológicamente que evalúen la eficacia y seguridad de daptomicina utilizada en dosis superiores a 6 mg/kg/día. Hay un ensayo clínico en marcha -NCT01287832- que compara vancomicina frente a daptomicina a dosis de 8 mg/kg/día en pacientes con bacteriemia por SARM con CMI>1 mg/L a vancomicina (http://clinicaltrials.gov/ct2/show/NCT01287832)
Bibliografía
1.Streit JM, Jones RN, Sader HS. Daptomydn activity and spectrum: a worldwide sample of 6737 clinical Gram-positive organisms. J Antimicrob Chemother. 2004;53(4):669-74. [ Links ]
2.Goldstein EJ, Citron DM, Merriam CV, Warren YA, Tyrrell KL, Fernandez HT. In vitro activities of daptomycin, vancomycin, quinupristin- dalfopristin, linezolid, and five other antimicrobials against 307 gram-positive anaerobic and 31 Corynebacterium clinical isolates. Antimicrob Agents Chemother. 2003;47(1):337-41. [ Links ]
3.Cubicin: EPAR-Product Information. European Medicines Agency. 2012. [ Links ]
4.Rose WE, Rybak MJ, Kaatz GW. Evaluation of daptomycin treatment of Staphylococcus aureus bacterial endocarditis: an in vitro and in vivo simulation using historical and current dosing strategies. J Antimicrob Chemother. 2007;60(2):334-40. [ Links ]
5.Rose WE, Leonard SN, Rybak MJ. Evaluation of daptomycin pharmacodynamics and resistance at various dosage regimens against Staphylococcus aureus isolates with reduced susceptibilities to daptomycin in an in vitro pharmacodynamic model with simulated endocardial vegetations. Antimicrob Agents Chemother. 2008;52(9):3061-7. [ Links ]
6.Benvenuto M, Benziger DP, Yankelev S, Vigliani G. Pharmacokinetics and tolerability of daptomycin at doses up to 12 milligrams per kilogram of body weight once daily in healthy volunteers. Antimicrob Agents Chemother. 2006;50(10):3245-9. [ Links ]
7.Kullar R, Davis SL, Levine DP, Zhao JJ, Crank CW, Segreti J, et al. High-dose daptomycin for treatment of complicated gram-positive infections: a large, multicenter, retrospective study. Pharmacotherapy. 2011;31(6):527-36. [ Links ]
8.Durante-Mangoni E, Casillo R, Bernardo M, Caianiello C, Mattucci I, Pinto D, et al. High-dose daptomycin for cardiac implantable electronic device-related infective endocarditis. Clin Infect Dis. 2012;54(3):347-54. [ Links ]
9.Figueroa DA, Mangini E, Amodio-Groton M, Vardianos B, Melchert A, Fana C, et al. Safety of high-dose intravenous daptomycin treatment: three-year cumulative experience in a clinical program. Clin Infect Dis. 2009;49(2):177-80. [ Links ]
10.Moise PA, Hershberger E, Amodio-Groton MI, Lamp KC. Safety and clinical outcomes when utilizing high-dose (> or = 8 mg/kg) daptomycin therapy. Ann Pharmacother. 2009;43(7):1211-9. [ Links ]
11.Bassetti M, Nicco E, Ginocchio F, Ansaldi F, de Florentiis D, Viscoli C. High-dose daptomycin in documented Staphylococcus aureus infections. Int J Antimicrob Agents. 2010;36(5):459-61. [ Links ]
12.Parra-Ruiz J, Peña-Monje A, Tomás-Jiménez C, Pomares-Mora J, Hernández-Quero J. (Efficacy and safety of high dose (>8 mg/kg/day) daptomycin). Enferm Infecc Microbiol Clin. 2011;29(6):425-7. [ Links ]
13.Utili R TU, Gaugalianos-Kakolyris P, Nacinovich F, Floriot C, Almirante Gragera B, et al. Safety of high-dose long-term daptomycin treatment (>8 mg/Kg/day) over more than 2 or 4 weeks) in the European Cubicin® Outcomes Registry and Experience (EU-CORESM). (Abstract) In 22nd European Congress of ESCMID. London 31 March -3 April 2012. [ Links ]
14.Liu C, Bayer A, Cosgrove SE, Daum RS, Fridkin SK, Gorwitz RJ, et al. Clinical practice guidelines by the infectious diseases society of america for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children. Clin Infect Dis. 2011;52(3):e18-55. [ Links ]
15.Gudiol F, Aguado JM, Pascual A, Pujol M, Almirante B, Miró JM, et al. (Consensus document for the treatment of bacteremia and endocarditis caused by methicillin-resistent Staphylococcus aureus. Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica). Enferm Infecc Microbiol Clin. 2009;27(2):105-15. [ Links ]
16.Gould IM, Cauda R, Esposito S, Gudiol F, Mazzei T, Garau J. Management of serious meticillin-resistant Staphylococcus aureus infections: what are the limits? Int J Antimicrob Agents. 2011;37(3):202-9. [ Links ]
17.Mensa J, Soriano A, LLinares P, Barberán J, Montejo M, Salavert M, et al. Guía de tratamiento antimicrobiano de la infección por S. aureus. Rev Esp Quimiother. 2013;26(Suppl.1):1-84. [ Links ]
18.Safdar N, Andes D, Craig WA. In vivo pharmacodynamic activity of daptomycin. Antimicrob Agents Chemother. 2004;48(1):63-8. [ Links ]
19.The European Committee on Antimicrobial Suscetibility Testing. Breakpoints tables for interpretation of MICs and zone dimeters. Version 3.1,2013. URL: http://www.eucast.org. 2013. [ Links ]
20.Cubicin-H-C-637-II-05: EPAR-Scientific-Discussion-Variation. European Medicines Agency. 2007. [ Links ]
21.Falcone M, Russo A, Cassetta MI, Lappa A, Tritapepe L, d'Ettorre G, et al. Variability of pharmacokinetic parameters in patients receiving different dosages of daptomycin: is therapeutic drug monitoring necessary? J Infect Chemother. 2013. [ Links ]
22.Smith K, Pérez A, Ramage G, Gemmell CG, Lang S. Comparison of biofilm-associated cell survival following in vitro exposure of meticillin-resistant Staphylococcus aureus biofilms to the antibiotics clindamycin, daptomycin, linezolid, tigecycline and vancomycin. Int J Antimicrob Agents. 2009;33(4):374-8. [ Links ]
23.LaPlante KL, Rybak MJ. Impact of high-inoculum Staphylococcus aureus on the activities of nafcillin, vancomycin, linezolid, and daptomycin, alone and in combination with gentamicin, in an in vitro pharmacodynamic model. Antimicrob Agents Chemother. 2004;48(12):4665-72. [ Links ]
24.Michiels MJ, Bergeron MG. Differential increased survival of staphylococci and limited ultrastructural changes in the core of infected fibrin clots after daptomycin administration. Antimicrob Agents Chemother. 1996;40(1):203-11. [ Links ]
25.Dvorchik BH, Damphousse D. The pharmacokinetics of daptomycin in moderately obese, morbidly obese, and matched nonobese subjects. J Clin Pharmacol. 2005;45(1):48-56. [ Links ]
26.Pai MP, Norenberg JP, Anderson T, Goade DW, Rodvold KA, Telepak RA, et al. Influence of morbid obesity on the single-dose pharmacokinetics of daptomycin. Antimicrob Agents Chemother. 2007;51 (8):2741-7. [ Links ]
27.Bhavnani SM, Rubino CM, Ambrose PG, Drusano GL. Daptomycin exposure and the probability of elevations in the creatine phosphokinase level: data from a randomized trial of patients with bacteremia and endocarditis. Clin Infect Dis. 2010;50(12):1568-74. [ Links ]
28.Fowler VG, Boucher HW, Corey GR, Abrutyn E, Karchmer AW, Rupp ME, et al. Daptomycin versus standard therapy for bacteremia and endocarditis caused by Staphylococcus aureus. N Engl J Med. 2006;355(7):653-65. [ Links ]
29.Kalogeropoulos AS, Tsiodras S, Loverdos D, Fanourgiakis P, Skoute-lis A. Eosinophilic pneumonia associated with daptomycin: a case report and a review of the literature. J Med Case Rep. 2011;5:13. [ Links ]
30.Miller BA, Gray A, Leblanc TW, Sexton DJ, Martin AR, Slama TG. Acute eosinophilic pneumonia secondary to daptomycin: a report of three cases. Clin Infect Dis. 2010;50(11):e63-8. [ Links ]
31.Kim PW, Sorbello AF, Wassel RT, Pham TM, Tonning JM, Nambiar S. Eosinophilic pneumonia in patients treated with daptomycin: review of the literature and US FDA adverse event reporting system reports. Drug Saf. 2012;35(6):447-57. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
José Ma Gutiérrez Urbón
E-mail: Jose.Gutierrez.Urbon@sergas.es
Recibido: 11/06/2013.
Aceptado: 20/09/2013.