Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.37 no.6 Toledo nov./dic. 2013
https://dx.doi.org/10.7399/FH.2013.37.6.1077
REVISIONES
Interacciones medicamentosas de agentes hipolipemiantes: aproximación para establecer y valorar su relevancia clínica. Revisión estructurada
Hypolipidemic agents drug interactions: approach to establish and assess its clinical significance. Structured review
D. Franco1,4, Y. Henao1, M. Monsalve1,4, F. Gutiérrez1,2,3, J. Hincapié1,2 y P. Amariles1,2,4
1Grupo de investigación, Promoción y Prevención Farmacéutica. Universidad de Antioquia. Medellín. Colombia.
2Departamento de Farmacia. Facultad de Química Farmacéutica. Universidad de Antioquia. Medellín. Colombia.
3Programa de Atención Farmacéutica. Humax Pharmaceutical. Medellín. Colombia.
4Grupo de Investigación en Atención Farmacéutica. Universidad de Granada. Granada. España.
El Grupo Promoción y Prevención Farmacéutica recibió financiación en la Convocatoria Sostenibilidad 20132014 del Comité de Investigaciones de la Universidad de Antioquia.
Dirección para correspondencia
RESUMEN
Objetivo: Realizar una revisión estructurada sobre interacciones medicamentosas de los hipolipemiantes y valorar su relevancia clínica.
Método: Revisión estructurada de interacciones medicamentosas con hipolipemiantes en humanos, en PubMed/Medline de artículos publicados sin restricción de idioma, con acceso a texto completo hasta junio 30 de 2012. La búsqueda se realizó con los siguientes terminos Mesh: Drug Interactions, Lipid Regulating Agents, Herb-Drug Interactions, Food-Drug Interactions y Hypolipidemic Agents (Pharmacological Action). La información se complementó con artículos considerados importantes. Por último, se utilizó un método para evaluar la relevancia clínica de la interacción, basado en la probabilidad de ocurrencia y en la gravedad del efecto de la interacción.
Resultados: Se obtuvieron 849 publicaciones, de las cuales se seleccionaron 243 referencias, en las los que se identificaron 189 interacciones. De ellas 33 fueron valoradas como de riesgo muy alto (nivel 1) y 42 de riesgo alto (nivel 2), asociadas fundamentalmente al aumento del riesgo de rabdomiólisis. La inhibición enzimática de la CYP450 fue el mecanismo más común de las interacciones.
Conclusiones: En los pacientes en tratamiento con hipolipemiantes, de las interacciones identificadas 60,3% (128/189) son clínicamente relevantes (riesgo muy alto o alto), asociadas principalmente a la aparición de rabdomiólisis. La mayoría de dichas interacciones son atribuidas al uso simultáneo de reconocidos inhibidores de la CYP3A4. Por ello, las estatinas metabolizadas por la CYP3A4 (simvastatina, lovastatina y atorvastatina) son las que más interacciones de relevancia clínica presentan.
Palabras clave: Interacciones medicamentosas; Rabdomiólisis; Hipolipemiantes.
ABSTRACT
Objective: To carry out a structures review of drug interactions of hypolipidemic drugs and to assess their clinical relevance.
Method: Structured review of drug interactions of hypolipidemic drugs in humans through PubMed/Medline of published articles, without language restrictions and with full text access until June 30th of 2012. The following Mesh terms were used: Drug Interactions, Lipid Regulating Agents, Herb-Drug Interactions, Food-Drug Interactions y Hypolipidemic Agents (Pharmacological Action). The information was completed with those articles considered to be relevant. Finally, a method was used to assess the clinical relevance of the interaction, based on the likelihood of occurrence and the severity of the effect of the interaction.
Results: 849 publications were gathered, of which 243 references were selected, among which 189 interactions were identified. Thirty-three of them were considered of very high risk (level 1) and 42 of high risk (level 2), basically associated to increased risk for rhabdomyolisis. Enzymatic inhibition of CYP450 was the most common mechanism for these interactions.
Conclusions: Of the interactions identified in patients on hypolipidemic drugs, 60.3% (128/189) are clinically relevant (very high or high risk), mainly associated to the occurrence of rhabdomyolisis. Most of these interactions are attributed to simultaneous use of CYP3A4 inhibitors. Therefore, statins metabolized through CYP3A4 (simvastatin, lovastatin and atorvastatin) are the ones with the highest number of clinically relevant interactions.
Key words: Drug interactions; Rhabdomyolisis; Hypolipidemic drugs.
Introducción
Los inhibidores de la 3-Hidroxi-Metil-Glutaril-Coenzima A (HMG-CoA) reductasa, los fibratos y las resinas de intercambio iónico, hacen parte del arsenal terapéutico para el tratamiento de las dislipidemias. Estos medicamentos han demostrado ser efectivos, bien tolerados y de gran impacto en la reducción del riesgo y las enfermedades cardiovasculares. Además, presentan efectos pleiotrópicos como: mejoramiento de la disfunción endotelial, inhibición de la inflamación vascular, de la trombosis y del estrés oxidativo1. Sin embargo, varios de estos fármacos poseen un perfil de interacciones medicamentosas asociados a problemas de efectividad o seguridad de la farmacoterapia. Existen estudios clínicos y reportes de casos que confirman estas interacciones y señalan los mecanismos por los cuales se presentan2. En este contexto, en 2001, la FDA retiró del mercado la cerivastatina, debido a 52 muertes atribuidas a rabdomiólisis en los Estados Unidos, de ellas, más de la mitad asociadas a la combinación de cerivastatina con gemfibrozilo3. La progresión de miopatía a rabdomiólosis puede ser evitada con un diagnóstico temprano y el tratamiento de la elevación de la creatinquinasa (CK), básicamente con la suspensión de los medicamentos responsables del efecto y una adecuada hidratación. Adicionalmente, existen factores de riesgo que facilitan el desarrollo de rabdomiólosis tales como: edad mayor a 65 años, hipotiroidismo, alcoholismo, enfermedad renal, deshidratación severa, uso de medicamentos miotóxicos y polimedicación4,5.
Por tanto, la identificación prevención y manejo de las interacciones medicamentosas clínicamente relevantes se considera un aspecto clave en la consecución de los objetivos terapéuticos en pacientes en tratamiento con hipolipemiantes6. En este sentido, el objetivo de este trabajo fue realizar una revisión estructurada sobre interacciones medicamentosas de los hipolipemiantes y establecer su relevancia clínica, acorde con la probabilidad de ocurrencia y la gravedad del efecto de la interacción.
Metodología
Se realizó una búsqueda sobre interacciones medicamentosas con hipolipemiantes en humanos, en PubMed/Medline de artículos publicados sin restricción de idioma, con acceso a texto completo hasta junio 30 del 2012. La búsqueda se realizó con los siguientes términos MESH: Drug Interactions, Herb-Drug Interactions, Food-Drug Interactions, Lipid Regulating Agents y Hypolipidemic Agents (Pharmacological Action). Los criterios de inclusión fueron: 1) contener en el título o resumen información de interacciones de los hipolipemiantes, con medicamentos, alimentos, pruebas de laboratorio, nutrientes o procesos fisiopatológicos; 2) disponibilidad de acceso al texto completo o, que en su defecto, el resumen incluyera información suficiente (cambios farmacocinéticos derivados de la interacción, desenlace clínico o evaluación de la causalidad en reportes de caso). Por su parte, los criterios de exclusión fueron: 1) artículos sin ninguna relación con los objetivos de búsqueda y de la revisión; 2) artículos con información limitada para evaluar relevancia clínica de la interacción; 3) artículos relacionados con la interacción con cerivastatina (retirada del mercado en el 2001) y 4) artículos sin acceso a texto completo y resumen con información limitada para definir la relevancia clínica de la interacción.
La valoración de la relevancia clínica de las interacciones identificadas se basó en la combinación de la gravedad del efecto de la interacción con la probabilidad de ocurrencia, según el método propuesto por Amariles et al.6,7, tal como se especifica a continuación:
Gravedad de la interacción
1. Grave. La interacción puede causar daño o lesión al paciente. La consecuencia del resultado clínico negativo de la farmacoterapia puede causar o generar en el paciente la muerte, riesgo para la vida, hospitalización, una incapacidad permanente o significativa, anomalías congénitas o malformaciones al nacer, al igual que otros efectos que a juicio médico puedan comprometer la integridad del paciente y generar la necesidad de realizar una intervención quirúrgica para evitar la muerte, hospitalización o anomalías congénitas.
2. Moderada. La interacción genera la necesidad de realizar un seguimiento del paciente. La consecuencia del resultado clínico negativo de la farmacoterapia puede causar una modificación (cambio o interrupción) de la farmacoterapia o el empleo de nuevos fármacos para tratar el problema relacionado con medicamentos, o bien la prolongación de la hospitalización del paciente.
3. Leve. La interacción no causa daño al paciente. La consecuencia del resultado negativo de la medicación no requiere la modificación (cambio o interrupción) de la farmacoterapia o el empleo de nuevos fármacos para tratar el problema relacionado con medicamentos ni prolonga la hospitalización del paciente.
Probabilidad de aparición de la interacción
Por su parte, la probabilidad de aparición de la interacción se establece en 3 categorías: definida, probable o posible a partir del tipo de estudio que ha documentado la interacción y que ha sido publicado en revistas con revisión previa e indexada en bases de datos:
1. Definida: interacción documentada en metaanálisis, revisiones sistemáticas o ensayos clínicos aleatorizados o no aleatorizados.
2. Probable: interacción documentada en estudios analíticos o por la descripción de 3 o más casos.
3. Posible: interacción documentada por la descripción de menos de 3 casos o por recomendaciones de grupos de expertos.
A partir de las combinaciones posibles de gravedad y probabilidad de aparición, las interacciones pueden agruparse en 4 categorías:
• Nivel 1: Riesgo muy alto (resultante de la combinación grave y definida, o grave y probable. En este caso el uso simultáneo de los medicamentos se considera absolutamente contraindicado).
• Nivel 2: Riesgo alto (resultante de la combinación grave y posible, moderada y definida o moderada y probable. El uso simultáneo requiere ajustes en la dosificación y valoración clínica permanente de forma cuantitativa la efectividad y seguridad de la combinación de los fármacos interactuantes).
• Nivel 3: Riesgo Medio (resultante de la combinación moderada y posible, leve y definida o leve y probable. También es necesario un monitoreo clínico frecuente y un análisis sobre la necesidad de ajustar la dosis).
• Nivel 4: Riesgo Bajo (resultante de la combinación leve y posible. La interacción es de escasa relevancia clínica).
Resultados
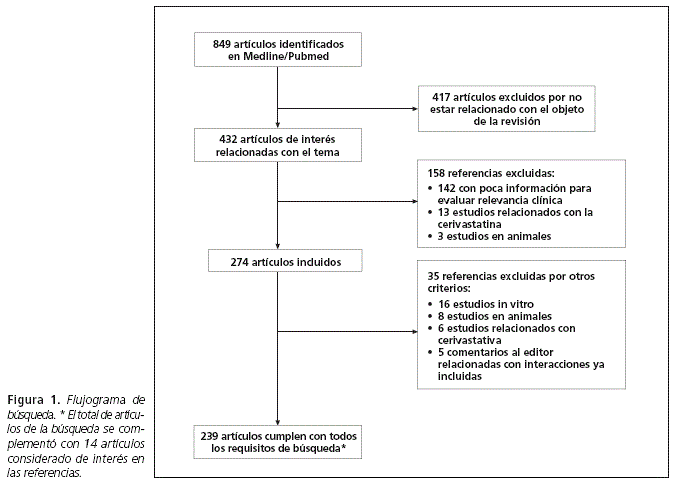
En total, 849 referencias bibliográficas fueron identificadas y se seleccionaron 239 artículos, en la figura 1 se ilustra el proceso de identificación y selección de los artículos. Adicionalmente, se complementó la búsqueda con 14 articulos de interés derivados de las referencias de los primeros. En dichos artículos se identificaron 189 interacciones. De ellas, 33 fueron valoradas como de riesgo muy alto (nivel 1) y 42 de riesgo alto (nivel 2), asociadas fundamentalmente al aumento del riesgo de rabdomiólisis. La inhibición enzimática del Citocromo P450 (CYP) fue el mecanismo más común de las interacciones halladas.
Datos generales de los hipolipemiantes
Estatinas
Los inhibidores de la HMG-CoA reductasa o estatinas (lovastatina, simvastatina, pravastatina, atorvastatina, fluvastatina, pitavastatina, rosuvastatina y cerivastatina -retirada del mercado en el 2001), son el grupo terapéutico más usado en el tratamiento de las hipercolesterolemias y la mayoría ha demostrado reducir el riesgo de eventos y la mortalidad cardiovascular8; sin embargo, los largos periodos de prescripción de estos fármacos y sus características farmacocinéticas aumentan la posibilidad de interacciones medicamentosas. Entre los efectos adversos más comunes, se destacan cefalea, molestias gastrointestinales, calambres, elevación asintomática de transaminasas y dolores musculares, entre otros. Por su parte, el problema de seguridad de mayor relevancia es la miopatía, la cual puede progresar hasta rabdomiólisis y muerte del paciente.
Las estatinas son metabolizadas por isoenzimas del CYP450, con excepción de la pravastatina que es metabolizada en el citosol celular por sulfatación. Además, sufren metabolismo de primer paso gastrointestinal y hepático. La atorvastatina, lovastatina y simvastatina sufren metabolismo de primer paso por la CYP3A4, lo que se refleja en una biodisponibilidad del 12, 20 y 5%, respectivamente. La simvastatina y la lovastatina son administradas como profármacos y son hidrolizadas a la forma hidroxiácida. Desde una perspectiva práctica, las concentraciones de la lovastatina y simvastatina pueden incrementarse hasta 10 a 20 veces cuando se administran simultáneamente con inhibidores de la CYP3A4. Por su parte, el efecto de la inhibición del metabolismo de la atorvastatina se asocia un incremento menos notorio en sus niveles9. En este sentido, en una revisión de reportes de eventos adversos a estatinas se detectaron 601 casos de rabdomiólisis en 29 meses, en su orden, asociados a simvastatina, cerivastatina, atorvastatina, pravastatina, lovastatina y fluvastatina. En 6,3% de los casos se reportó la muerte del paciente10.
Fibratos
Los fibratos causan una disminución hasta del 50% los triglicéridos (TG) y un aumento hasta del 20% el colesterol unido a lipoproteínas de alta densidad (cHDL). Por ello, los fibratos están indicados en hipertrigliceridemias aisladas, o hiperlipidemias mixtas11. Este grupo farmacológico es metabolizado por la CYP3A4 (excepto el fenofibrato). Además, el gemfibrozilo tiene efecto inhibidor de algunas isoenzimas, afecta la glucoronidación de otros medicamentos y compite con las estatinas por el metabolismo hepático. Por ello, se estima que la combinación de fibratos con estatinas aumenta hasta 5 veces más el riesgo de rabdomiólisis12.
Secuestrantes de ácidos biliares o resinas
La colestiramina, colestipol y colesevelam corresponden a resinas no digeribles cargadas positivamente que se unen a los ácidos biliares en el intestino, formando un complejo insoluble que se excreta en las heces. Desde la perspectiva de las interacciones medicamentos, su afinidad por moléculas apolares diferentes a los lípidos explica la disminución de la absorción de diversos medicamentos13.
Interacciones medicamentosas de los hipolipemiantes
Las interacciones medicamentosas identificadas se organizaron en función del grupo terapéutico al que pertenece el medicamento que interactúa con los hipolipemiantes. En la tabla 1 se detallan las interacciones más significativas. Por su parte, en la tabla 2, debido a su utilidad práctica se relacionan medicamentos de los que se dispone de evidencia de la ausencia de interacciones con las estatinas y la relevancia clínica es baja (nivel 4). A continuación se detallan los resultados considerados como destacados para cada grupo terapéutico:
Macrólidos
Los macrólidos, en especial la claritromicina y la eritromicina son potentes inhibidores enzimáticos de la CYP3A4, isoenzima que metaboliza a la simvastatina, lovastatina y atorvastatina, lo que aumenta sus concentraciones plasmáticas y el riesgo de miotoxicidad. La eritromicina aumentó la concentración máxima (Cmax) de simvastatina (en su forma lactona) en 3,4 veces, el área bajo la curva (ABC) en 6,2 veces y su forma ácida -hidroxiácido en 3,9 veces14. De igual forma, la eritromicina aumentó la Cmax y el ABC de atorvastatina en un 37,7% y 32,5% respectivamente15. Efecto que se atribuye a la disminución del metabolismo de atorvastatina, a la inhibición de la glicoproteina p (GcP) intestinal y a la disminución de la secreción biliar.
En general, se dispone de reporte de casos de rabdomiólisis por la interacción entre simvastatina y claritromicina16-22, entre lovastatina y la eritromicina23 y claritromicina y azitromicina22. Un estudio que evaluó el efecto de la azitromicina y la claritromicina en la farmacocinética de la atorvastatina, mostró que la claritromicina aumenta el ABC y la Cmax en 82% y 56% respectivamente; por su parte, con la azitromicina no se presentaron cambios significativos23.
Antifúngicos azoles
Existen reportes de casos de miopatía y rabdomiólisis por la utilización simultánea de simvastatina ha sido utilizada con itraconazol24,25 fluconazol26y ketoconazol27,28. Situación que es similar por el uso concomitante de atorvastatina con fluconazol e itraconazol29,30. En este sentido, un estudio que evaluó el efecto del itraconazol en la farmacocinética de la lovastatina en 12 voluntarios sanos, mostró un aumento de 13 veces en la Cmax (rango de 10 a 23 veces) y de 20 veces en el ABC del metabolito activo de la lovastatina31. También se encontró un reporte de un caso de rabdomiólisis de lovastatina con ketoconazol32.
Por su parte, dos estudios aleatorizados, doble ciego, cruzado de dos fases, realizados para evaluar el efecto del fluconazol en las concentraciones plasmáticas de fluvastatina y pravastatina, evidenciaron un aumento en el ABC y Cmax de la fluvastatina en un 84% y 44%, respectivamente; mientras que no se documentaron cambios importantes en los niveles de la pravastatina33.
El Itraconazol aumentó en 15 veces el ABC y las Cmax de la lovastatina, asimismo, la simvastatina presentó un aumento significativo en la Cmax y ABC de la forma acida (β-hidroxiácida) en 17 y 19 veces respectivamente. Por tanto, el uso concomitante de lovastatina y simvastatina con itraconazol debe evitarse por el aumento potencial de toxicidad sobre el músculo esquelético. Por su parte, la utilización de itraconazol con fluvastatina o pravastatina no generó cambios importantes en los niveles de estas estatinas34,35. Similarmente, la combinación de fluconazol con rosuvastatina generó un aumento en el ABC y la Cmax de la rosuvastatina sin relevancia clínica36.
Antirretrovirales (ARV)
El uso de medicamentos hipolipemiantes en pacientes con VIH/SIDA es cada vez más frecuente, debido al aumento de la esperanza de vida de este grupo de pacientes, situación que se asocia a la presentación de otros problemas de salud, tales como aumento de riesgo cardiovascular, envejecimiento biológico acelerado, proceso inflamatorio crónico y la exposición prolongada a los medicamentos ARV37,38.
El metabolismo sistémico de los inhibidores de la proteasa (IP) y los inhibidores de la transcriptasa inversa no nucleósidos (ITINN) ocurre fundamentalmente por la inhibición de la CYP3A4. En el caso de la pravastatina, debido a su mecanismo metabólico de sulfatación, se considerada de elección en pacientes en tratamiento con IP39 (excepto con darunavir), aunque en algunos casos podría ser necesario aumentar la dosis de pravastatina, por ejemplo con nelfinavir o ritonavir40. En este sentido, para simvastatina, lovastatina y atorvastatina (excepto pravastatina, fluvastatina y rosuvastatina) se debe evitar su utilización en pacientes con tratamiento con IP, especialmente con ritonavir, atazanavir, saquinavir o nelfinavir41-47. Sin embargo, es necesario tener presente que la combinación de rosuvastatina con lopinavir/ritonavir causó un aumento en el ABC y Cmax de rosuvastatina de 2,1 y 4,7 veces respectivamente48. Además, el ABC (0-24) y la Cmax de la rosuvastatina se incrementaron en un 213% y 600% respectivamente, cuando fue administrado atazanavir/ritonavir49.
Por su parte, el efavirenz disminuyó el ABC de la atorvastatina, simvastatina y pravastatina en 43%, 58% y 40%, respectivamente, por lo que se recomienda realizar un seguimiento más cercano y en caso de ser necesario, ajustar la dosis de las estatinas50-52.
Referente a los fibratos, el gemfibrozilo es metabolizado vía 5-difosfato-glucuronosiltransferasa, enzima hepática que es inducida por los IP, reduciendo las concentraciones plasmáticas y el efecto de este fibrato. En este sentido, el ABC del gemfibrozilo disminuyó en un 41% con la administración de lopinavir/ritonavir53. Por ello, el fenofibrato se considera como el fibrato de elección para el tratamiento de la hipertrigliceridemia en pacientes con VIH54.
En el caso de la niacina, la aparición de enrojecimiento, edema, e hinchazón en el sitio de la inyección de enfuvirtide, se atribuyó al inicio de la administración de niacina. Se postuló que dicho efecto se debió a un aumento en la síntesis de prostaglandinas y a la movilización de células inflamatorias, específicamente las células de Langerhans55.
Antiagregantes Plaquetarios
En general, existe controversia de la interacción clopidogrel y estatinas56,57, situación que podría atribuirse a las diferencias en los métodos y diseños de los estudios. Por ello, se acepta que es necesario realizar un estudio de mayor poder estadístico y con los mínimos sesgos posibles58-73.
Anticoagulantes
La información de la interacción warfarina y estatinas es limitada; sin embargo, los reportes de caso muestran un posible efecto sobre la coagulación, especialmente con fluvastatina74 (por su potente efecto inhibidor sobre la CYP2C9) y lovastatina (posiblemente por el desplazamiento de la unión a proteínas). Las demás estatinas, excepto la pravastatina, podrían tener interacciones, por inhibición del metabolismo de la warfarina o acenocumarol, o por el desplazamiento de la unión a proteínas75-78. En el caso del dabigatrán, se documentó un aumento del 18% de los niveles de atorvastatina, el cual se considera que no es clínicamente relevante79.
El efecto anticoagulante de la warfarina podría verse disminuido cuando se utiliza simultáneamente con fibratos, posiblemente por competición por la unión a proteínas80-84.
Antidiabéticos orales
La interacción entre el gemfibrozilo y la repaglinida es la más documentada y la cual se explica por el efecto inhibitorio importante del gemfibrozilo sobre la isoenzima CYP2C9, el cual se conserva hasta 3 o 4 días después de suspender la administración de este fibrato. En este sentido, el ABC de la repaglinida presentó un aumento de 7,6 veces con la administración de gemfibrozilo85-88. De forma similar, el gemfibrozilo causó un aumento el ABC de la pioglitazona en 3-4 veces89. El gemfibrozilo aumentó el ABC de la glimepirida y la semivida de eliminación de 2,1 a 2,3 horas, sin cambios significativos en los niveles de glucosa e insulina sérica90. Además, es importante destacar los siguientes datos:
•El bezafibrato y fenofibrato no alteran las concentraciones plasmáticas de repaglinida91.
•El gemfibrozilo aumenta en un 54% la biodisponibilidad de la sitagliptina92.
•La atorvastatina aumenta las concentraciones de repaglinida, lo que requiere un ajuste en la dosis de este antidiabético93.
•En el caso de los inhibidores de la dipeptidil-4 peptidasa, al parecer no se presenta interacciones entre simvastatina y linagliptina94. Por su parte, con la sitagliptina se documentó un reporte de caso de rabdomiólisis asociada a lovastatina95.
•La administración de fibratos con tiazolidinedionas se ha asociado con una disminución de los valores de cHDL96,97. Además, la troglitazona utilizada simultáneamente con atorvastatina podría aumentar hasta en un 20% el colesterol LDL y los triglicéridos98. Por su parte, parece ser que la simvastatina no altera la farmacocinética de la troglitazona y la pioglitazona; sin embargo, la troglitazona (ya retirada del mercado) tiene efecto inductor sobre la CYP3A4 y afecta la farmacocinética de la simvastatina sin ser clínicamente significativo99. Finalmente, la absorción de la troglitazona fue reducida al administrarse colestiramina100.
•La utilización simultánea de colesevelam con pioglitazona, repaglinida, gliburida, levotiroxina y etinilestradiol, aumenta las interacciones medicamentosas, por interferencia en su absorción101. Similarmente, este efecto se presenta con la colestiramina y la glipizida102. Sin embargo, la separación de la administración de ambos medicamentos por 4 horas previene dicha interacción.
Bloqueadores de canales de calcio
Los calcioantagonista no dihidropiridínicos como verapamilo presentan un aumento significativo en ABC y Cmax cuando son coadministrados con lovastatina y atorvastatina, al parecer por inhibición en la actividad de la Gc-P (disminución del eflujo) o por la inhibición enzimática de la CYP3A4. En este sentido, la lovastatina incrementó el ABC y la Cmax de verapamilo en un 62,8 y 32,1%; mientras que el ABC de verapamilo se aumentó en un 42,8% en presencia de atorvastatina103,104. Por su parte, la simvastatina aumentó su ABC y Cmax 2,6 y 4,6 veces, respectivamente por la utilización de verapamilo14. Adicionalmente, existe reportes de casos de rabdomiólisis por la combinación verapamilo, ciclosporina y simvastatina105,106.
El diltiazem puede causar un aumento en la Cmax en 3,6 veces y el ABC en 5 veces de la simvastatina107-109 y de 3,5 veces el ABC de lovastatina; efecto que no se evidencia en el caso de la pravastatina110. Es necesario destacar que, aunque el efecto inhibidor del diltiazem sobre la simvastatina aumenta el efecto farmacológico de las estatinas, también se observa un mayor riesgo de miopatía111-113. Según lo anterior, existe reporte de casos de miopatia y/o rabdomiólisis con dosis iguales y superiores a 20 mg de simvastatina114,115 o de atorvastatina116.
El amlodipino (calcioantagonista dihidropiridínico) produce un aumento en la Cmax y el ABC de la simvastatina y atorvastatina, sin efectos significativos en las cifras de los lípidos o de presión arterial117,118. Además, la administración separada en 4 horas, de simvastatina y amlodipino, minimiza más la posible presentación de esta interacción119. Por su parte, el lacidipino causó un aumento del ABC y de la Cmax de la simvastatina en un 35 y un 70%, respectivamente. Estos efectos se deben posiblemente al efecto inhibidor de estos calcioantagonistas sobre la CYP3A4120.
Inmunosupresores
En los pacientes trasplantados, la combinación de estatinas con inhibidores de calcineurina, principalmente ciclosporina, debido a su efecto inhibidor de la CYP, podría causar un aumento de los niveles séricos de las estatinas y, con ello, el riesgo de miopatia y rabdomiólisis, especialmente a dosis altas de las estatinas. Además:
•Existe reporte de casos de rabdomiólisis con diferentes estatinas, exceptuando la fluvastatina y, en menor medida, la pravastatina2. En el caso de la simvastatina, el ABC aumenta hasta 20 veces el ABC y el efecto se potencia por la utilización de otros inhibidores enzimáticos del CYP3A4108,121-124. Por su parte, en el caso la atorvastatina, los casos de rabdomiólisis se presentan sin alteraciones la farmacocinética de la ciclosporina25,125.
•La ciclosporina se asocia con un aumento del ABC y la Cmax de la rosuvastatina en 7,1 y 10,6 veces, respectivamente126.
•Existe evidencia de la seguridad y efectividad de la fluvastatina en pacientes trasplantados en tratamiento con ciclosporina127-131. Este efecto podría deberse a que la fluvastatina, respecto a otras estatinas, presenta una semivida de eliminación más corta, una mayor capacidad de unión a proteínas y menos metabolitos activos circulantes128,132. En el caso de la pravastatina, este fármaco no se acumula significativamente en plasma en pacientes que reciben inmunosupresión con ciclosporina133 y con la rosuvastatina, la ciclosporina aumento el ABC de esta estatina en 7,1 veces134.
•El tacrolimus no altera la farmacocinética de la atorvastatina135, similarmente, el everolimus no interacciona con atorvastatina o pravastatina de manera significativa136.
La combinación de fluvastatina- rapamicina se ha relacionado con la aparición de rabdomiólosis137. Por su parte, el gemfibrozilo y la colestiramina no alteraran los niveles plasmáticos de ciclosporina138,139. Además, el ezetimiba aumenta en 1,5 veces los niveles140, y en un 15% el ABC de la ciclosporina141. De igual manera, la ciclosporina aumenta en 3,4 veces el ABC de ezetimiba140.
Interacciones entre agentes hipolipemiantes
Algunos pacientes pueden requerir la combinación de varios agentes hipolipemiantes, siendo la asociación estatina-fibrato la más común. Sin embargo, el mayor efecto hipolipemiante se acompaña de un mayor riesgo de miopatía, especialmente con gemfibrozilo, debido a su efecto inhibidor de la glucoronidación de las estatinas, aumentando las concentraciones de estas últimas142. El gemfibrozilo aumenta el ABC de la simvastatina en un 35% y el ABC de la simvastatina en su forma ácida en un 135%143 y de la lovastatina acida en un 280%144. Además, el gemfibrozilo aumenta el ABC de la rosuvastatina en 1,88 veces y su Cmax en 2,21 veces145. Por tanto, existe reporte de casos de rabdomiólisis y enfermedad renal, debidos a la combinación de gemfibrozilo con simvastatina146, atorvastatina142 y lovastatina147. Relacionado con esta interacción, es importante destacar que el fenofibrato se considera más adecuado que el gemfibrozilo, lo que se soporta en estudios que muestran la ausencia de interacción del fenofibrato con pravastatina148,149, simvastatina150 y atorvastatina151,152. Sin embargo, el fenofibrato podría aumentar los niveles plasmáticos de rosuvastatina153 y existe un reporte de caso de falla renal en un paciente tomando esta combinación154.
El fenofibrato incrementa los niveles del ezetimiba 1,4 veces, este efecto no es considerado de relevancia clínica en el perfil de seguridad del ezetimiba155,156. Adicionalmente, el fenofibrato no presenta interacciones relevantes con colestipol157 o colesevelam158.
El ezetimiba es bien tolerado y no interacciona con fluvastatina159, lovastatina160, rosuvastatina161 o simvastatina162. Sin embargo, se han reportado casos de miopatías en pacientes por la combinación ezetimiba y atorvastatina163.
El gemfibrozilo aumenta los niveles de ezetimiba en 1,4 veces, efecto que no es clínicamente relevante164. En contraste, la coadministración con colestiramina disminuye significativamente la biodisponibilidad oral de ezetimiba, por lo que se deben administrar con 4 horas de diferencia165.
Fitoterapéuticos
Existen fitoterapéuticos que pueden tener interacciones con medicamentos. La hierba de San Juan es un reconocido inductor enzimático de la CYP3A4; mientras el zumo de pomelo (toronja) es un inhibidor enzimático de esta misma isoforma. Algunos estudios muestran disminución de las concentraciones de las estatinas y, por tanto, de su eficacia cuando se administra hierba de San Juan con rosuvastatina166, atorvastatina o simvastatina167. Efecto que no se observa para la pravastatina168.
El zumo de toronja incrementa los parámetros farmacocinéticos de la simvastatina en 3,6 veces y de su forma ácida en 3,3 veces169. Este efecto desaparece a los 3 a 7 días después de la última toma del zumo de toronja170. En el caso de la lovastatina, el zumo de pomelo causa un aumento de la Cmax de 12 veces y del ABC de 15 veces; por su parte, para la forma ácida de lovastatina, el aumento en la Cmax fue de 4 veces y en el ABC fue de 5 veces171. Para la atorvastatina, el zumo de toronja incrementa el ABC en un 83%172 y las concentraciones séricas entre 19% a 26%, sin riesgo de toxicidad hepática o muscular173. En el caso del zumo de naranja, su administración se ha relacionado con un aumento significativo del ABC de pravastatina en voluntarios sanos174.
Otros medicamentos
•La utilización conjunta de simvastatina con erlotinib175 o imatinib176 se ha relacionado con casos de rabdomiólisis. Además, el imatinib (un inhibidor de la CYP3A4) aumenta 3,5 veces el ABC de la simvastatina176.
•La utilización conjunta de digoxina con pravastatina177, rosuvastatina178, fluvastatina179 o colesevelam180 no se ha asociado con interacciones relevantes. Sin embargo, la atorvastatina181 (dosis de 80 mg) incrementa los niveles de digoxina, posiblemente por la inhibición de la glicoproteína-p.
•Rifampicina-estatinas. Con pravastatina, la información es contradictoria, por un lado en un estudio, la rifampicina aumentó el ABC de la pravastatina en 2 veces182; mientras que otro, en voluntarios sanos, mostró que la rifampicina disminuye en un 40% los niveles plasmáticos de esta estatina183. Con atorvastatina, la rifampicina disminuye el ABC de atorvastatina en un 80%184. En el caso de la simvastatina, la disminución alcanza a ser del 87%185. Por su parte, con rosuvastatina, el efecto fue menor y no fue considerado clínicamente relevante186.
•Con sildenafil, existe un reporte de miopatía con rosuvastatina187 y un caso de rabdomiólisis con simvastatina188.
•Con ciprofloxacino (inhibidor débil de la CYP3A4), existe un reporte de rabdomiólisis con simvastatina189.
•Con Efalizumab, existe un reporte de caso de rabdomiólisis con pravastatina190.
•Con paroxetina, la pravastatina causa un aumento en los niveles de glucosa191, por un mecanismo que no es claro.
Interacciones medicamentosas de mayor relevancia en hipolipemiantes
La tabla 1 es una selección de las interacciones más destacadas (nivel 1 y 2), según el método propuesto por Amariles et al.
Discusión
La mayoría de interacciones medicamentosas analizadas en esta revisión se refieren a las estatinas, seguidas de los fibratos. En el caso de otros grupos hipolipemiantes existe información limitada. Entre los mecanismos de las interacciones, se destaca las alteraciones de tipo faracocinético, ya sea por inhibición enzimática del metabolismo del hipolipemiante, alteración en el transporte por la Gc-P o disminución en su aclaramiento renal. Por ello, en los pacientes que reciben tratamiento con agentes hipolipemiantes, las interacciones medicamentosas de mayor relevancia clínica están relacionadas con inhibidores de la CYP3A4, las cuales aumentan el riesgo de rabdomiólisis.
Diferentes estudios señalan que más del 50% de eventos adversos serios por estatinas (especialmente rabdomiólosis) están asociados a las interacciones farmacológicas que se pueden presentar250,251. Por ello, los profesionales de la salud deben tener los conceptos teóricos y la competencia práctica que les permita prevenir, detectar e intervenir las interacciones, acorde con el riesgo/beneficio para el paciente. En este sentido, aunque existen estudios clínicos que cuantifican el aumento en el ABC y la Cmax de las estatinas, cuando son coadministradas con otro medicamento, estos estudios se realizan en voluntarios jóvenes (sin otros problemas de salud, otros tratamientos farmacológicos o factores de riesgo para desarrollar miopatía o rabdomiólisis). Por su parte, los reportes de casos y series de casos reflejan más las condiciones reales de uso de este grupo farmacológico. En este marco, los resultados del presente estudio muestran que las estatinas que presentan más interacciones y eventos adversos serios son en orden descendente: simvastatina, lovastatina y atorvastatina, las cuales son metabolizadas por la CYP3A4, isoenzima responsable del metabolismo un gran número de medicamentos comercializados252,253. En el caso de la simvastatina, la mayoría de estas interacciones fueron clasificadas como nivel 1 o riesgo muy alto, debido a ser más susceptible a la inhibición de la CYP3A4/5, al igual que por su extensivo metabolismo de primer paso, lo que lleva a que su biodisponibilidad sea cercana al 5%, valor mucho menor que el 12% de la atorvastatina254.
Las limitaciones principales de este estudio se deben a que la búsqueda se limitó a la base de datos PubMed/ Medline. Sin embargo, este efecto pudo disminuirse debido a que la revisión se complementó con la inclusión de las referencias bibliográficas de los artículos consideradas de interés para el tema.
Existe evidencia suficiente que demuestra que las interacciones medicamentosas de las estatinas y fibratos están relacionadas con una inhibición del metabolismo de estos y como consecuencia se pueden aumentar los niveles plasmáticos, lo que pone en riesgo al paciente, en especial por aumentarse la probabilidad de presentar rabdomiólisis. Gran parte de estas interacciones son debidas al uso simultáneo de reconocidos inhibidores de la CYP3A4. Por ello, las estatinas metabolizadas por la CYP3A4 como la simvastatina, lovastatina y atorvastatina son las estatinas que presentan mayor evidencia sobre las interacciones, mientras que la pravastatina posee un mejor perfil de seguridad debido a que no es metabolizado por CYP 450. Al contrario, existe poca información publicada sobre las interacciones con secuestradores de ácidos biliares. La valoración de la relevancia clínica de las interacciones basadas en la probabilidad de aparición y la gravedad de cada interacción desarrollada en esta revisión, otorga al equipo de salud herramientas para tomar decisiones cuando el uso de hipolipemiantes concomitante a otros medicamentos conlleva un riesgo de interacción.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de Interés.
Bibliografía
1. Mennickent C S, Bravo D M, Calvo M C, Avello L M. (Pleiotropic effects of statins). Rev Med Chil. 2008;136:775-82. [ Links ]
2. Ballantyne CM, Corsini A, Davidson MH, Holdaas H, Jacobson TA, Leitersdorf E, et al. Risk for myopathy with statin therapy in high-risk patients. Arch Intern Med. 2003;163:553-64. [ Links ]
3. SoRelle R. Baycol withdrawn from market. Circulation. 2001;104: E9015-6. [ Links ]
4. Molden E, Andersson KS, Jacobsen D. Interactions between statins and macrolide antibiotics. Tidsskr Nor Laegeforen. 2007;127:1660-1. [ Links ]
5. Pasternak RC, Smith SC Jr, Bairey-Merz CN, Grundy SM, Cleeman JI, Lenfant C, et al. ACC/AHA/NHLBI Clinical Advisory on the Use and Safety of Statins. Circulation. 2002;106:1024-8. [ Links ]
6. Amariles P, Giraldo NA, Faus MJ. Interacciones medicamentosas: aspectos generales y aproximación para establecer y utilizar su relevancia clínica. Med Clin. (Barc) 2007;129:27-35. [ Links ]
7. Amariles P, Giraldo NA, Faus MJ. Interacciones medicamentosas en pacientes infectados con el VIH: aproximación para establecer y evaluar su relevancia clínica. Farm Hosp. 2007;31:283-302. [ Links ]
8. Goldfine AB, Kaul S, Hiatt WR. Fibrates in the treatment of dyslipidemias-time for a reassessment. N Engl J Med. 2011;365:481-4. [ Links ]
9. Schmidt G, Hoehns JD, Purcell JL, Friedman RL, Elhawi Y. Severe rhabdomyolysis and acute renal failure secondary to concomitant use of simvastatin, amiodarone, and atazanavir. J Am Board Fam Med. 2007;20:411-6. [ Links ]
10. Omar MA, Wilson JP. FDA adverse event reports on statin-associated rhabdomyolysis. Ann Pharmacother. 2002;36:288-95. [ Links ]
11. Ros E, Laguna JC. Tratamiento de la hipertrigliceridemia: fibratos frente a ácidos grasos omega-3. Rev Esp Cardiol. 2006;Suppl 6:52D-61D. [ Links ]
12. Corsini A Bellosta S, Davidson MH. Pharmacokinetic interactions between statins and fibrates. Am J Cardiol 2005;96(suppl 9A):44K-9. [ Links ]
13. Scaldaferri F, Pizzoferrato M, Ponziani FR, Gasbarrini G, Gasbarrini A. Use and indications of cholestyramine and bile acid sequestrants. Intern Emerg Med. 2013;8:205-10. [ Links ]
14. Kantola T, Kivistö KT, Neuvonen PJ. Erythromycin and verapamil considerably increase serum simvastatin and simvastatin acid concentrations. Clin Pharmacol Ther. 1998;64:177-82. [ Links ]
15. Siedlik PH, Olson SC, Yang BB, Stern RH. Erythromycin coadministration increases plasma atorvastatin concentrations. J Clin Pharmacol. 1999;39:501-4. [ Links ]
16. Lee AJ, Maddix DS. Rhabdomyolysis secondary to a drug interaction between simvastatin and clarithromycin. Ann Pharmacother. 2001;35:26-31. [ Links ]
17. Kahri AJ, Valkonen MM, Vuoristo MK, Pentikäinen PJ. Rhabdomyolysis associated with concomitant use of simvastatin and clarithromycin. Ann Pharmacother. 2004;38:719. [ Links ]
18. Wagner J, Suessmair C, Pfister HW. Rhabdomyolysis caused by comedication with simvastatin and clarithromycin. J Neurol. 2009; 256:1 182-3. [ Links ]
19. Trieu J, Emmett L, Perera C, Thanakrishnan K, Van Der Wall H. Rhabdomyolysis resulting from interaction of simvastatin and clarithromycin demonstrated by Tc-99m MDP scintigraphy. Clin Nucl Med. 2004;29:803-4. [ Links ]
20. Grunden JW, Fisher KA. Lovastatin-induced rhabdomyolysis possibly associated with clarithromycin and azithromycin. Ann Pharmacother. 1997;31:859-63. [ Links ]
21. Amsden GW, Kuye O, Wei GC. A study of the interaction potential of azithromycin and clarithromycin with atorvastatin in healthy volunteers. J Clin Pharmacol. 2002;42:444-9 [ Links ]
22. Molden E, Andersson KS. Simvastatin-associated rhabdomyolysis after coadministration of macrolide antibiotics in two patients. Pharmacotherapy. 2007;27:603-7. [ Links ]
23. Wong PW, Dillard TA, Kroenke K. Multiple organ toxicity from addition of erythromycin to long-term lovastatin therapy. South Med J. 1998;91:202-5. [ Links ]
24. Tiessen RG, Lagerwey HJ, Jager GJ, Sprenger HG. (Drug interaction caused by communication problems. Rhabdomyolysis due to a combination of itraconazole and simvastatin). Ned Tijdschr Geneeskd. 2010;154:A762. [ Links ]
25. Maxa JL, Melton LB, Ogu CC, Sills MN, Limanni A. Rhabdomyolysis after concomitant use of cyclosporine, simvastatin, gemfibrozil, and itraconazole. Ann Pharmacother. 2002;36:820-3. [ Links ]
26. Hazin R, Abuzetun JY, Suker M, Porter J. Rhabdomyolysis induced by simvastatin-fluconazole combination. J Natl Med Assoc. 2008;100:444-6. [ Links ]
27. Akram K, Rao S, Parker M. A lesson for everyone in drug-drug interactions. Int J Cardiol. 2007;118:e19-20. [ Links ]
28. Itakura H, Vaughn D, Haller DG, O'Dwyer PJ. Rhabdomyolysis from cytochrome p-450 interaction of ketoconazole and simvastatin in prostate cancer. J Urol. 2003;169:613. [ Links ]
29. Kahri J, Valkonen M, Bäcklund T, Vuoristo M, Kivistö KT. Rhabdomyolysis in a patient receiving atorvastatin and fluconazole. Eur J Clin Pharmacol. 2005;60:905-7. [ Links ]
30. Kantola T, Kivistö KT, Neuvonen PJ. Effect of itraconazole on the pharmacokinetics of atorvastatin. Clin Pharmacol Ther. 1998;64:58-65. [ Links ]
31. Neuvonen PJ, Jalava KM. Itraconazole drastically increases plasma concentrations of lovastatin and lovastatin acid. Clin Pharmacol Ther. 1996;60:54-61. [ Links ]
32. Stein CA, Goel S, Ghavamian R. Hepatitis and rhabdomyolysis in a patient with hormone refractory prostate cancer on ketoconazole and concurrent lovastatina therapy. Invest New Drugs. 2007;25:277-8. [ Links ]
33. Kantola T, Backman JT, Niemi M, Kivistö KT, Neuvonen PJ. Effect of fluconazole on plasma fluvastatin and pravastatin concentrations. Eur J Clin Pharmacol. 2000;56:225-9. [ Links ]
34. Kivistö KT, Kantola T, Neuvonen PJ. Different effects of itraconazole on the pharmacokinetics of fluvastatin and lovastatin. Br J Clin Pharmacol. 1998;46:49-53. [ Links ]
35. Neuvonen PJ, Kantola T, Kivistö KT. Simvastatin but not pravastatin is very susceptible to interaction with the CYP3A4 inhibitor itraconazole. Clin Pharmacol Ther. 1998;63:332-41. [ Links ]
36. Cooper KJ, Martin PD, Dane AL, Warwick MJ, Schneck DW, Cantarini MV. The effect of fluconazole on the pharmacokinetics of rosuvastatin. Eur J Clin Pharmacol. 2002;58:527-31. [ Links ]
37. Negredo E, Rey-Joly yC. (Cardiovascular risk and human immunodeficiency virus infection: A new clinical challenge). Med Clin (Barc). 2010;135:209-1 1. [ Links ]
38. Sax PE. Strategies for management and treatment of dyslipidemia in HIV/AIDS.AIDS Care. 2006;18:149-57. [ Links ]
39. van Luin M, Colbers A, van Ewijk-Beneken Kolmer EW, Verweij-van Wissen CP, Schouwenberg B, Hoitsma A, da Silva HG, et al. Drug-drug interactions between raltegravir and pravastatin in healthy volunteers. J Acquir Immune Defic Syndr. 2010;55:82-6. [ Links ]
40. Aberg JA, Rosenkranz SL, Fichtenbaum CJ, Alston BL, Brobst SW, Segal Y, et al, ACTG A5108 team. Pharmacokinetic interaction between nelfinavir and pravastatin in HIV-seronegative volunteers: ACTG Study A5108. AIDS. 2006;20:725-9. [ Links ]
41. Giraldo NA, Amariles P, Gutiérrez FJ, Monsalve M, Faus MJ. Interacciones medicamentosas en pacientes infectados con el VIH: aproximación para establecer y evaluar su relevancia clínica: actualización 2009. Farm Hosp. 2010;34:90-3. [ Links ]
42. Amariles P, Giraldo NA, Faus MJ. Interacciones medicamentosas en pacientes infectados con el VIH: aproximación para establecer y evaluar su relevancia clínica. Farm Hosp. 2007;31:283-302. [ Links ]
43. Fichtenbaum CJ, Gerber JG, Rosenkranz SL, Segal Y, Aberg JA, Blaschke T et al; NIAID AIDS Clinical Trials Group. Pharmacokinetic interactions between protease inhibitors and statins in HIV seronegative volunteers: ACTG Study A5047. AIDS. 2002;16:569-77. [ Links ]
44. Hare CB, Vu MP, Grunfeld C, Lampiris HW. Simvastatin-nelfinavir interaction implicated in rhabdomyolysis and death. Clin Infect Dis. 2002;35:e111-2. [ Links ]
45. Cheng CH, Miller C, Lowe C, Pearson VE. Rhabdomyolysis due to probable interaction between simvastatin and ritonavir. Am J Health Syst Pharm. 2002;59:728-30. [ Links ]
46. Hsyu PH, Schultz-Smith MD, Lillibridge JH, Lewis RH, Kerr BM. Pharmacokinetic interactions between nelfinavir and 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors atorvastatin and simvastatin. Antimicrob Agents Chemother.2001;45:3445-50. [ Links ]
47. Coyne KM, Boffito M, Theobald N, Asboe D. Simvastatin coprescribed with protease inhibitors despite dangerous drug interactions. Sex Transm Infect. 2007;83:498. [ Links ]
48. Kiser JJ, Gerber JG, Predhomme JA, Wolfe P, Flynn DM, Hoody DW. Drug/Druginteraction between lopinavir/ritonavir and rosuvastatin in healthy volunteers. J Acquir Immune Defic Syndr. 2008;47:570-8. [ Links ]
49. Busti AJ, Bain AM, Hall RG 2nd, Bedimo RG, Leff RD, Meek C, Mehvar R. Effects of atazanavir/ritonavir or fosamprenavir/ritonavir on the pharmacokinetics of rosuvastatin. J Cardiovasc Pharmacol. 2008;51:605-10. [ Links ]
50. Gerber JG, Rosenkranz SL, Fichtenbaum CJ, Vega JM, Yang A, Alston BL, et al, AIDS Clinical Trials Group A5108 Team. Effect of efavirenz on the pharmacokinetics of simvastatin, atorvastatin, and pravastatin: results of AIDS Clinical Trials Group 5108 Study. J Acquir Immune Defic Syndr. 2005;39:307-12. [ Links ]
51. Pérez VE, Sánchez-Parra C, Villar SS. Interacciones medicamentosas de etravirina. Enferm Infecc Microbiol Clin. 2009;27:27-31. [ Links ]
52. Aberg JA. Lipid management in patients who have HIV and are receiving HIV therapy. Endocrinol Metab Clin North Am. 2009;38:207-22. [ Links ]
53. Busse KH, Hadigan C, Chairez C, Alfaro RM, Formentini E, Kovacs JA, Penzak SR.Gemfibrozil concentrations are significantly decreased in the presence of lopinavirritonavir. J Acquir Immune Defic Syndr. 2009;52:235-9. [ Links ]
54. Comunicado de la FDA sobre la seguridad de los medicamentos: La interacción entre ciertos medicamentos para el VIH o hepatitis C y los medicamentos con estatinas para reducir el colesterol, puede aumentar el riesgo de lesiones musculares. (citado 12-01-2013).FDA. Disponible en http://www.fda.gov/Drugs/DrugSafety/ucm295591.htm [ Links ]
55. Oates E, Dzintars K.Interaction between enfuvirtide, an injectable fusion inhibitor, and niacin in an HIV-infected patient. Ann Pharmacother. 201;44:2014-7. [ Links ]
56. Lau WC, Waskell LA, Watkins PB, Neer CJ, Horowitz K, Hopp AS, et al. Atorvastatin reduces the ability of clopidogrel to inhibit platelet aggregation: a new drug-drug interaction. Circulation. 2003;107:32-7. [ Links ]
57. Mach F, Senouf D, Fontana P, Boehlen F, Reber G, Daali Y, et al. Not all statins interfere with clopidogrel during antiplatelet therapy. Eur J Clin Invest. 2005;35:476-81. [ Links ]
58. Júnior CV, Soeiro Ade M, Araújo LF, Jabot B, Rached F, Orii NM, et al.Lack of clopidogrel-statin interaction in patients undergoing coronary stent implantation. Arq Bras Cardiol. 2010;95:321-7. [ Links ]
59. Wenaweser P, Eshtehardi P, Abrecht L, Zwahlen M, Schmidlin K, Windecker S et al. A randomised determination of the Effect of Fluvastatin and Atorvastatin on top of dual antiplatelet treatment on platelet aggregation after implantation of coronary drug-eluting stents. The EFA-Trial. Thromb Haemost. 2010;104:554-62. [ Links ]
60. Mach F, Senouf D, Fontana P, Boehlen F, Reber G, Daali Y, et al. Not all statins interfere with clopidogrel during antiplatelet therapy. Eur J Clin Invest. 2005;35:476-81. [ Links ]
61. Malmström RE, Ostergren J, Jørgensen L, Hjemdahl P; CASTOR investigators. Influence of statin treatment on platelet inhibition by clopidogrel-a randomized comparison of rosuvastatin, atorvastatin and simvastatin co-treatment. J Intern Med. 2009;266:457-66. [ Links ]
62. Farid NA, Small DS, Payne CD, Jakubowski JA, Brandt JT, Li YG, et al. Effect of atorvastatin on the pharmacokinetics and pharmacodynamics of prasugrel and clopidogrel in healthy subjects. Pharmacotherapy. 2008;28:1483-94. [ Links ]
63. Riondino S, Petrini N, Donato L, Torromeo C, Tanzilli G, Pulcinelli FM, et al. Effects of rosuvastatin on platelet inhibition by clopidogrel in cardiovascular patients. J Thromb Thrombolysis. 2009;28:151-5. [ Links ]
64. Polena S, Gupta MP, Shaikh H, Zazzali K, Coplan N, Gintautas J, et al. Platelet aggregation inhibition in patients receiving statins either fully or partially metabolized by CYP3A4. Proc West Pharmacol Soc. 2008;51:60-2. [ Links ]
65. Ayalasomayajula SP, Vaidyanathan S, Kemp C, Prasad P, Balch A, Dole WP. Effect of clopidogrel on the steady-state pharmacokinetics of fluvastatin. J Clin Pharmacol. 2007;47:613-9. [ Links ]
66. Wenaweser P, Windecker S, Billinger M, Cook S, Togni M, Meier B, et al. Effect of atorvastatin and pravastatin on platelet inhibition by aspirin and clopidogrel treatment in patients with coronary stent thrombosis. Am J Cardiol. 2007;99:353-6. [ Links ]
67. Mitsios JV, Papathanasiou AI, Elisaf M, Goudevenos JA, Tselepis AD. The inhibitory potency of clopidogrel on ADP-induced platelet activation is not attenuated when it is co-administered with atorvastatin (20 mg/day) for 5 weeks in patients with acute coronary syndromes. Platelets. 2005;16:287-92. [ Links ]
68. Poulsen TS, Vinholt P, Mickley H, Korsholm L, Kristensen SR, Damkier P. Existence of a clinically relevant interaction between clopidogrel and HMG-CoA reductase inhibitors? Reevaluating the evidence. Basic Clin Pharmacol Toxicol. 2005;96:103-10. [ Links ]
69. Gorchakova O, von Beckerath N, Gawaz M, Mocz A, Joost A, Schömig A, Kastrati A. Antiplatelet effects of a 600 mg loading dose of clopidogrel are not attenuated in patients receiving atorvastatin or simvastatin for at least 4 weeks prior to coronary artery stenting. Eur Heart J. 2004;25:1898-902. [ Links ]
70. Serebruany VL, Midei MG, Malinin AI, Oshrine BR, Lowry DR, Sane DC et al. Absence of interactionbetween atorvastatin or other statins and clopidogrel: results from the interaction study. Arch Intern Med. 2004;164:2051-7. [ Links ]
71. Mitsios JV, Papathanasiou AI, Rodis FI, Elisaf M, Goudevenos JA, Tselepis AD. Atorvastatin does not affect the antiplatelet potency of clopidogrel when it is administered concomitantly for 5 weeks in patients with acute coronary syndromes. Circulation. 2004;109:1335-8. [ Links ]
72. Saw J, Topol EJ. Lack of adverse clopidogrel-atorvastatin clinical interaction. Am J Cardiol. 2004;93:669-70. [ Links ]
73. Saw J, Steinhubl SR, Berger PB, Kereiakes DJ, Serebruany VL, Brennan D, et al. Clopidogrel for the Reduction of Events During Observation Investigators. Lack of adverse clopidogrel-atorvastatin clinical interaction from secondary analysis of a randomized, placebo-controlled clopidogrel trial. Circulation. 2003;108:921-4. [ Links ]
74. Wienbergen H, Gitt AK, Schiele R, Juenger C, Heer T, Meisenzahl C, et al; MITRA PLUS Study Group. Comparison of clinical benefits of clopidogrel therapy in patients with acute coronary syndromes taking atorvastatina versus other statin therapies. Am J Cardiol. 2003;92:285-8. [ Links ]
75. Trilli LE, Kelley CL, Aspinall SL, Kroner BA. Potential interaction between warfarin and fluvastatin. Ann Pharmacother. 1996;30: 1399-402. [ Links ]
76. tern R, Abel R, Gibson GL, Besserer J. Atorvastatin does not alter the anticoagulant activity of warfarin. J Clin Pharmacol. 1997;37:1062-4. [ Links ]
77. Andrus MR. Oral anticoagulant drug interactions with statins: case report of fluvastatin and review of the literature. Pharmacotherapy. 2004;24:285-90. [ Links ]
78. Mondillo S, Ballo P, Galderisi M. Rosuvastatin-acenocoumarol interaction. Clin Ther. 2005;27:782-4. [ Links ]
79. Mackay JW, Fenech ME, Myint KS.Acute rhabdomyolysis caused by combination therapy with atorvastatin and warfarin. Br J Hosp Med (Lond). 2012;73:106-7. [ Links ]
80. Stangier J, Rathgen K, Stähle H, Reseski K, Körnicke T, Roth W. Coadministration of dabigatran etexilate and atorvastatin: assessment of potential impact on pharmacokinetics and pharmacodynamics. Am J Cardiovasc Drugs. 2009;9:59-68. [ Links ]
81. Dixon DL, Williams VG. Interaction between gemfibrozil and warfarin: case report and review of the literature. Pharmacotherapy. 2009;29:744-8. [ Links ]
82. Aldridge MA, Ito MK. Fenofibrate and warfarin interaction. Pharmacotherapy. 2001;21:886-9. [ Links ]
83. Ascah KJ, Rock GA, Wells PS. Interaction between fenofibrate and warfarin. Ann Pharmacother. 1998;32:765-8. [ Links ]
84. Beringer TR. Warfarin potentiation with bezafibrate. Postgrad Med J. 1997;73:657-8. [ Links ]
85. Rindone JP, Keng HC. Gemfibrozil-warfarin drug interaction resulting in profound hypoprothrombinemia. Chest. 1998;114:641-2. [ Links ]
86. Gan J, Chen W, Shen H, Gao L, Hong Y, Tian Y, et al. Repaglinide-gemfibrozil drug interaction: inhibition of repaglinide glucuronidation as a potential additional contributing mechanism. Br J Clin Pharmacol. 2010;70:870-80. [ Links ]
87. Tornio A, Niemi M, Neuvonen M, Laitila J, Kalliokoski A, Neuvonen PJ et al. The effect of gemfibrozil on repaglinide pharmacokinetics persists for at least 12 h after the dose: evidence for mechanism-based inhibition of CYP2C8 in vivo. Clin Pharmacol Ther. 2008;84:403-11. [ Links ]
88. Backman JT, Honkalammi J, Neuvonen M, Kurkinen KJ, Tornio A, Niemi M, et al. CYP2C8 activity recovers within 96 hours after gemfibrozil dosing: estimation of CYP2C8 half-life using repaglinide as an in vivo probe. Drug Metab Dispos. 2009;37:2359-66. [ Links ]
89. Niemi M, Backman JT, Neuvonen M, Neuvonen PJ. Effects of gemfibrozil, itraconazole, and their combination on the pharmacokinetics and pharmacodynamics of repaglinide: potentially hazardous interaction between gemfibrozil and repaglinide. Diabetologia. 2003;46:347-51. [ Links ]
90. Deng LJ, Wang F, Li HD. Effect of gemfibrozil on the pharmacokinetics of pioglitazone. Eur J Clin Pharmacol. 2005;61:831-6. [ Links ]
91. Niemi M, Neuvonen PJ, Kivistö KT. Effect of gemfibrozil on the pharmacokinetics and pharmacodynamics of glimepiride. Clin Pharmacol Ther. 2001;70:439-45. [ Links ]
92. Kajosaari LI, Backman JT, Neuvonen M, Laitila J, Neuvonen PJ. Lack of effect of bezafibrate and fenofibrate on the pharmacokinetics and pharmacodynamics of repaglinide. Br J Clin Pharmacol. 2004;58:390-6. [ Links ]
93. KPA, Meda VS, Kucherlapati VS, Dubala A, M D, PR AV, et al. Pharmacokinetic drug interaction between gemfibrozil and sitagliptin in healthy Indian male volunteers. Eur J Clin Pharmacol. 2012;68: 709-14. [ Links ]
94. Kalliokoski A, Backman JT, Kurkinen KJ, Neuvonen PJ, Niemi M. Effects of gemfibrozil and atorvastatin on the pharmacokinetics of repaglinide in relation to SLCO1B1 polymorphism. Clin Pharmacol Ther. 2008;84:488-96. [ Links ]
95. Graefe-Mody U, Huettner S, Stähle H, Ring A, Dugi KA. Effect of linagliptin (BI 1356) on the steady-state pharmacokinetics of simvastatin. Int J Clin Pharmacol Ther. 2010;48:367-74. [ Links ]
96. DiGregorio RV, Pasikhova Y. Rhabdomyolysis caused by a potential sitagliptinovastatin interaction. Pharmacotherapy. 2009;29:352-6. [ Links ]
97. Keidar S, Guttmann H, Stam T, Fishman I, Shapira C. High incidence of reduced plasma HDL cholesterol in diabetic patients treated with rosiglitazone and fibrate. Pharmacoepidemiol Drug Saf. 2007;16:1192-4. [ Links ]
98. Schwing W, Hustak L, Taylor HC. Paradoxical severe decrease in high-density lipoprotein cholesterol due to rosiglitazone-fenofibrate interaction. Endocr Pract. 2010;16:382-8. [ Links ]
99. DiTusa L, Luzier AB. Potential interaction between troglitazone and atorvastatin. J Clin Pharm Ther. 2000;25:279-82. [ Links ]
100. Prueksaritanont T, Vega JM, Zhao J, Gagliano K, Kuznetsova O, Musser B, et al. Interactions between simvastatin and troglitazone or pioglitazone in healthy subjects. J Clin Pharmacol. 2001;41:573-81. [ Links ]
101. Young MA, Lettis S, Eastmond R. Concomitant administration of cholestyramine influences the absorption of troglitazone. Br J Clin Pharmacol. 1998;45:37-40. [ Links ]
102. Brown KS, Armstrong IC, Wang A, Walker JR, Noveck RJ, Swearingen D, el al. Effect of the bile acid sequestrant colesevelam on the pharmacokinetics of pioglitazone, repaglinide, estrogen estradiol, norethindrone, levothyroxine, and glyburide. J Clin Pharmacol. 2010;50:554-65. [ Links ]
103. Kivistö KT, Neuvonen PJ. The effect of cholestyramine and activated charcoal on glipizide absorption. Br J Clin Pharmacol. 1990;30:733-6. [ Links ]
104. Choi DH, Chung JH, Choi JS. Pharmacokinetic interaction between oral lovastatin and verapamil in healthy subjects: role of P-glycoprotein inhibition by lovastatin. Eur J Clin Pharmacol. 2010;66:285-90. [ Links ]
105. Choi DH, Shin WG, Choi JS. Drug interaction between oral atorvastatin and verapamil in healthy subjects: effects of atorvastatin on the pharmacokinetics of verapamil and norverapamil. Eur J Clin Pharmacol. 2008;64:445-9. [ Links ]
106. Chiffoleau A, Trochu JN, Veyrac G, Petit T, Abadie P, Bourin M, Jolliet P. (Rhabdomyolysis in cardiac transplant recipient due to verapamil interaction with simvastatin and cyclosporin treatment). Therapie. 2003;58:168-70. [ Links ]
107. Kusus M, Stapleton DD, Lertora JJ, Simon EE, Dreisbach AW. Rhabdomyolysis and acute renal failure in a cardiac transplant recipient due to multiple drug interactions. Am J Med Sci. 2000;320:394-7. [ Links ]
108. Hu M, Mak VW, Tomlinson B. Simvastatin-induced myopathy, the role of interaction with diltiazem and genetic predisposition. J Clin Pharm Ther. 2011;36:419-25. [ Links ]
109. Kanathur N, Mathai MG, Byrd RP Jr, Fields CL, Roy TM. Simvastatin-diltiazem drug interaction resulting in rhabdomyolysis and hepatitis. Tenn Med. 2001;94:339-41. [ Links ]
110. Peces R, Pobes A. Rhabdomyolysis associated with concurrent use of simvastatina and diltiazem. Nephron. 2001;89:117-8. [ Links ]
111. Azie NE, Brater DC, Becker PA, Jones DR, Hall SD. The interaction of diltiazem with lovastatin and pravastatin. Clin Pharmacol Ther. 1998;64:369-77. [ Links ]
112. You JH, Chan WK, Chung PF, Hu M, Tomlinson B. Effects of concomitant therapy with diltiazem on the lipid responses to simvastatin in Chinese subjects. J Clin Pharmacol. 2010;50:1151-8. [ Links ]
113. Watanabe H, Kosuge K, Nishio S, Yamada H, Uchida S, Satoh H et al. Pharmacokinetic and pharmacodynamic interactions between simvastatin and diltiazem in patients with hypercholesterolemia and hypertension. Life Sci. 2004;76:281-92. [ Links ]
114. Yeo KR, Yeo WW, Wallis EJ, Ramsay LE. Enhanced cholesterol reduction by simvastatin in diltiazem-treated patients. Br J Clin Pharmacol. 1999;48:610-5. [ Links ]
115. Mousa O, Brater DC, Sunblad KJ, Hall SD. The interaction of diltiazem with simvastatin. Clin Pharmacol Ther. 2000;67:267-74. [ Links ]
116. Lewin JJ 3rd, Nappi JM, Taylor MH. Rhabdomyolysis with concurrent atorvastatina and diltiazem. Ann Pharmacother. 2002;36:1546-9. [ Links ]
117. Nishio S, Watanabe H, Kosuge K, Uchida S, Hayashi H, Ohashi K. Interaction between amlodipine and simvastatin in patients with hypercholesterolemia and hypertension. Hypertens Res. 2005;28:223-7. [ Links ]
118. Preston RA, Harvey P, Herfert O, Dykstra G, Jukema JW, Sun F, et al. A randomized, placebo-controlled trial to evaluate the efficacy, safety, and pharmacodynamic interaction of coadministered amlodipine and atorvastatin in 1660 patients with concomitant hypertension and dyslipidemia: the respond trial. J Clin Pharmacol. 2007;47:1555-69. [ Links ]
119. Park CG, Lee H, Choi JW, Lee SJ, Kim SH, Lim HE. Non-concurrent dosing attenuates the pharmacokinetic interaction between amlodipine and simvastatin. Int J Clin Pharmacol Ther. 2010;48:497-503. [ Links ]
120. Ziviani L, Da Ros L, Squassante L, Milleri S, Cugola M, Iavarone LE. The effects of lacidipine on the steady/state plasma concentrations of simvastatin in healthy subjects. Br J Clin Pharmacol. 2001; 51:147-52. [ Links ]
121. Blaison G, Weber JC, Sachs D, Korganow AS, Martin T, Kretz JG, Pasquali JL. (Rhabdomyolysis caused by simvastatinin a patient following heart transplantation and cyclosporine therapy). Rev Med Internet. 1992;13:61-3. [ Links ]
122. Segaert MF, De Soete C, Vandewiele I, Verbanck J. Drug-interaction-induced rhabdomyolysis. Nephrol Dial Transplant. 1996;11:1846-7. [ Links ]
123. Arnadottir M, Eriksson LO, Thysell H, Karkas JD. Plasma concentration profiles of simvastatin 3-hydroxy-3-methylglutaryl-coenzyme A reductase inhibitory activity in kidney transplant recipients with and without ciclosporin. Nephron. 1993;65:410-3. [ Links ]
124. Maltz HC, Balog DL, Cheigh JS. Rhabdomyolysis associated with concomitant use of atorvastatin and cyclosporine. Ann Pharmacother. 1999;33:1176-9. [ Links ]
125. Wong WM, Wai-Hung Shek T, Chan KH, Chau E, Lai KC. Rhabdomyolysis triggered by cytomegalovirus infection in a heart transplant patient on concomitant cyclosporine and atorvastatin therapy. J Gastroenterol Hepatol. 2004;19:952-3. [ Links ]
126. Olbricht C, Wanner C, Eisenhauer T, Kliem V, Doll R, Boddaert M, et al. Accumulation of lovastatin, but not pravastatin, in the blood of cyclosporine-treated kidney graft patients after multiple doses. Clin Pharmacol Ther. 1997;62:311-21. [ Links ]
127. Li PK, Mak TW, Wang AY, Lee YT, Leung CB, Lui SF, Lam CW, Lai KN. The interaction of fluvastatin and cyclosporin A in renal transplant patients. Int J Clin Pharmacol Ther. 1995;33:246-8. [ Links ]
128. Holdaas H, Hartmann A, Stenstrøm J, Dahl KJ, Borge M, Pfister P. Effect of fluvastatin for safely lowering atherogenic lipids in renal transplant patients receiving cyclosporine. Am J Cardiol. 1995;76: 102A-6. [ Links ]
129. Jardine A, Holdaas H. Fluvastatin in combination with cyclosporin in renal transplant recipients: a review of clinical and safety experience. J Clin Pharm Ther. 1999;24:397-408. [ Links ]
130. Park JW, Siekmeier R, Lattke P, Merz M, Mix C, Schüler S, Jaross W. Pharmacokinetics and pharmacodynamics of fluvastatin in heart transplant recipients taking cyclosporine A. J Cardiovasc Pharmacol Ther. 2001;6:351-61. [ Links ]
131. Holdaas H, Hagen E, Asberg A, Lund K, Hartman A, Vaidyanathan S et al. Evaluation of the pharmacokinetic interaction between fluvastatin XL and cyclosporine in renal transplant recipients. Int J Clin Pharmacol Ther. 2006;44:163-71. [ Links ]
132. Goldberg RB, Roth D. A preliminary report of the safety and efficacy of fluvastatin for hypercholesterolemia in renal transplant patients receiving cyclosporine. Am J Cardiol. 1995;76:107A-9. [ Links ]
133. Park JW, Siekmeier R, Merz M, Krell B, Harder S, März W, Seidel D, Schüler S, Gross W. Pharmacokinetics of pravastatin in heart-transplant patients taking cyclosporin A. Int J Clin Pharmacol Ther. 2002;40:439-50. [ Links ]
134. Simonson SG, Raza A, Martin PD, Mitchell PD, Jarcho JA, Brown CD, Windass AS, Schneck DW. Rosuvastatin pharmacokinetics in heart transplant recipients administered an antirejection regimen including cyclosporine. Clin Pharmacol Ther. 2004;76:167-77. [ Links ]
135. Lemahieu WP, Hermann M, Asberg A, Verbeke K, Holdaas H, Vanrenterghem Y, Maes BD. Combined therapy with atorvastatin and calcineurin inhibitors: no interactions with tacrolimus. Am J Transplant. 2005;5:2236-43. [ Links ]
136. Kovarik JM, Hartmann S, Hubert M, Berthier S, Schneider W, Rosenkranz B, et al. Pharmacokinetic and pharmacodynamic assessments of HMG-CoA reductase inhibitors when coadministered with everolimus. J Clin Pharmacol. 2002;42:222-8. [ Links ]
137. Basic-Jukic N, Kes P, Bubic-Filipi L, Vranjican Z. Rhabdomyolysis and acute kidney injury secondary to concomitant use of fluvastatin and rapamycin in a renal transplant recipient. Nephrol Dial Transplant. 2010;25:2036. [ Links ]
138. Pisanti N, Stanziale P, Imperatore P, D'Alessandro R, De Marino V, Capone D, De Marino V. Lack of effect of gemfibrozil on cyclosporine blood concentrations in kidney-transplanted patients. Am J Nephrol. 1998;18:199-203. [ Links ]
139. Jensen RA, Lal SM, Diaz-Arias A, James-Kracke M, Van Stone JC, Ross G Jr. Does cholestyramine interfere with cyclosporine absorption? A prospective study in renal transplant patients. ASAIO J. 1995;41:M704-6. [ Links ]
140. Bergman AJ, Burke J, Larson P, Johnson-Levonas AO, Reyderman L, et al. Interaction of single-dose ezetimibe and steady-state cyclosporine in renal transplant patients. J Clin Pharmacol. 2006;46:328-36. [ Links ]
141. Bergman AJ, Burke J, Larson P, Johnson-Levonas AO, Reyderman L, Statkevich P, et al. Effects of ezetimibe on cyclosporine pharmacokinetics in healthy subjects. J Clin Pharmacol. 2006;46:321-7. [ Links ]
142. Duell PB, Connor WE, Illingworth DR. Rhabdomyolysis after taking atorvastatin with gemfibrozil. Am J Cardiol. 1998;81:368-9. [ Links ]
143. Backman JT, Kyrklund C, Kivistö KT, Wang JS, Neuvonen PJ. Plasma concentrations of active simvastatin acid are increased by gemfibrozil. Clin Pharmacol Ther. 2000;68:122-9. [ Links ]
144. Kyrklund C, Backman JT, Kivistö KT, Neuvonen M, Laitila J, Neuvonen PJ. Plasma concentrations of active lovastatin acid are markedly increased by gemfibrozilo but not by bezafibrate. Clin Pharmacol Ther. 2001;69:340-5. [ Links ]
145. Schneck DW, Birmingham BK, Zalikowski JA, Mitchell PD, Wang Y, Martin PD, et al. The effect of gemfibrozil on the pharmacokinetics of rosuvastatin. Clin Pharmacol Ther. 2004;75:455-63. [ Links ]
146. van Puijenbroek EP, Du Buf-Vereijken PW, Spooren PF, van Doormaal JJ. Possible increased risk of rhabdomyolysis during concomitant use of simvastatin and gemfibrozil. J Intern Med. 1996;240:403-4. [ Links ]
147. Marais GE, Larson KK. Rhabdomyolysis and acute renal failure induced by combination lovastatin and gemfibrozil therapy. Ann Intern Med. 1990;112:228-30. [ Links ]
148. Pan WJ, Gustavson LE, Achari R, Rieser MJ, Ye X, Gutterman C, Wallin BA. Lack of a clinically significant pharmacokinetic interaction between fenofibrate and pravastatin in healthy volunteers. J Clin Pharmacol. 2000;40:316-23. [ Links ]
149. Gustavson LE, Schweitzer SM, Koehne-Voss S, Achari R, Chira TO, Esslinger HU, et al. The effects of multiple doses of fenofibrate on the pharmacokinetics of pravastatin and its 3alpha-hydroxy isomeric metabolite. J Clin Pharmacol. 2005;45:947-53. [ Links ]
150. Bergman AJ, Murphy G, Burke J, Zhao JJ, Valesky R, Liu L, et al. Simvastatin does not have a clinically significant pharmacokinetic interaction with fenofibrate in humans. J Clin Pharmacol. 2004;44:1054-62. [ Links ]
151. Whitfield LR, Porcari AR, Alvey C, Abel R, Bullen W, Hartman D. Effect of gemfibrozil and fenofibrate on the pharmacokinetics of atorvastatin. J Clin Pharmacol. 2011;51:378-88. [ Links ]
152. Unal A, Torun E, Sipahioglu MH, Tokgoz B, Kaya MG, Oymak O, Utas C. Fenofibrate-induced acute renal failure due to massive rhabdomyolysis after coadministration of statin in two patients. Intern Med. 2008;47:1017-9. [ Links ]
153. Martin PD, Dane AL, Schneck DW, Warwick MJ. An open-label, randomized, three-way crossover trial of the effects of coadministration of rosuvastatin and fenofibrate on the pharmacokinetic properties of rosuvastatin and fenofibric acid in healthy male volunteers. Clin Ther. 2003;25:459-71. [ Links ]
154. Buyukhatipoglu H, Sezen Y, Guntekin U, Kirhan I, Dag OF. Acute renal failure with the combined use of rosuvastatin and fenofibrate. Ren Fail. 2010;32:633-5. [ Links ]
155. Kosoglou T, Statkevich P, Fruchart JC, Pember LJ, Reyderman L, Cutler DL, et al. Pharmacodynamic and pharmacokinetic interaction between fenofibrate and ezetimibe. Curr Med Res Opin. 2004;20:1 197-207 [ Links ]
156. Gustavson LE, Schweitzer SM, Burt DA, Achari R, Rieser MJ, Edeki T, et al. Evaluation of the potential for pharmacokinetic interaction between fenofibrate and ezetimibe: A phase I, open-label, multiple-dose, three-period crossover study in healthy subjects. Clin Ther. 2006;28:373-87. [ Links ]
157. Harvengt C, Desager JP. Lack of pharmacokinetic interaction of colestipol and fenofibrate in volunteers. Eur J Clin Pharmacol. 1980;17:459-63. [ Links ]
158. Jones MR, Baker BA, Mathew P. Effect of colesevelam HCl on single-dose fenofibrate pharmacokinetics. Clin Pharmacokinet. 2004;43:943-50. [ Links ]
159. Reyderman L, Kosoglou T, Cutler DL, Maxwell S, Statkevich P. The effect of fluvastatin on the pharmacokinetics and pharmacodynamics of ezetimibe. Curr MedRes Opin. 2005;21:1171-9. [ Links ]
160. Reyderman L, Kosoglou T, Boutros T, Seiberling M, Statkevich P. Pharmacokinetic interaction between ezetimibe and lovastatin in healthy volunteers. Curr Med Res Opin. 2004;20:1493-500. [ Links ]
161. Kosoglou T, Statkevich P, Yang B, Suresh R, Zhu Y, Boutros T, et al. Pharmacodynamic interaction between ezetimibe and rosuvastatin. Curr Med Res Opin. 2004;20:1185-95. [ Links ]
162. Kosoglou T, Meyer I, Veltri EP, Statkevich P, Yang B, Zhu Y, et al. Pharmacodynamic interaction between the new selective cholesterol absorption inhibitor ezetimibe and simvastatin. Br J Clin Pharmacol. 2002;54:309-19. [ Links ]
163. Simard C, Poirier P. Ezetimibe-associated myopathy in monotherapy and in combination with a 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitor. Can J Cardiol. 2006;22:141-4. [ Links ]
164. Reyderman L, Kosoglou T, Statkevich P, Pember L, Boutros T, Maxwell SE, et al. Assessment of a multiple-dose drug interaction between ezetimibe, a novel selective cholesterol absorption inhibitor and gemfibrozil. Int J Clin Pharmacol Ther. 2004;42:512-8. [ Links ]
165. Kosoglou T, Statkevich P, Johnson-Levonas AO, Paolini JF, Bergman AJ, Alton KB. Ezetimibe: a review of its metabolism, pharmacokinetics and drug interactions. Clin Pharmacokinet. 2005;44:467-94. [ Links ]
166. Gordon RY, Becker DJ, Rader DJ. Reduced efficacy of rosuvastatin by St. John's Wort. Am J Med. 2009;122:e1-2. [ Links ]
167. Andren L, Andreasson A, Eggertsen R. Interaction between a commercially available St. John's wort product (Movina) and atorvastatin in patients with hypercholesterolemia. Eur J Clin Pharmacol. 2007;63:913-6. [ Links ]
168. Sugimoto K, Ohmori M, Tsuruoka S, Nishiki K, Kawaguchi A, Harada K, et al. Different effects of St John's wort on the pharmacokinetics of simvastatin and pravastatin. Clin Pharmacol Ther. 2001;70:518-24. [ Links ]
169. Lilja JJ, Neuvonen M, Neuvonen PJ. Effects of regular consumption of grapefruit juice on the pharmacokinetics of simvastatin. Br J Clin Pharmacol. 2004;58:56-60. [ Links ]
170. Lilja JJ, Kivistö KT, Neuvonen PJ. Duration of effect of grapefruit juice on the pharmacokinetics of the CYP3A4 substrate simvastatin. Clin Pharmacol Ther. 2000;68:384-90. [ Links ]
171. Kantola T, Kivistö KT, Neuvonen PJ. Grapefruit juice greatly increases serum concentrations of lovastatin and lovastatin acid. Clin Pharmacol Ther. 1998;63:397-402. [ Links ]
172. Ando H, Tsuruoka S, Yanagihara H, Sugimoto K, Miyata M, Yamazoe Y, et al. Effects of grapefruit juice on the pharmacokinetics of pitavastatin and atorvastatin. Br J Clin Pharmacol. 2005;60:494-7. [ Links ]
173. Reddy P, Ellington D, Zhu Y, Zdrojewski I, Parent SJ, Harmatz JS, et al. Serum concentrations and clinical effects of atorvastatin in patients taking grapefruit juice daily. Br J Clin Pharmacol. 2011;72:434-41 [ Links ]
174. Koitabashi Y, Kumai T, Matsumoto N, Watanabe M, Sekine S, Yanagida Y, Kobayashi S. Orange juice increased the bioavailability of pravastatin, 3-hydroxy-3-methylglutaryl CoA reductase inhibitor, in rats and healthy human subjects. Life Sci. 2006;78:2852-9. [ Links ]
175. Veeraputhiran M, Sundermeyer M. Rhabdomyolysis resulting from pharmacologic interaction between erlotinib and simvastatin. Clin Lung Cancer. 2008;9:232-4. [ Links ]
176. O'Brien SG, Meinhardt P, Bond E, Beck J, Peng B, Dutreix C, et al. Effects of imatinib mesylate (STI571, Glivec) on the pharmacokinetics of simvastatin, a cytochrome p450 3A4 substrate, in patients with chronic myeloid leukaemia. Br J Cancer. 2003;89:1855-9. [ Links ]
177. Triscari J, Swanson BN, Willard DA, Cohen AI, Devault A, Pan HY. Steady state serum concentrations of pravastatin and digoxin when given in combination. Br J Clin Pharmacol. 1993;36:263-5. [ Links ]
178. Martin PD, Kemp J, Dane AL, Warwick MJ, Schneck DW. No effect of rosuvastatin on the pharmacokinetics of digoxin in healthy volunteers. J Clin Pharmacol. 2002;42:1352-7. [ Links ]
179. Garnett WR, Venitz J, Wilkens RC, Dimenna G. Pharmacokinetic effects of fluvastatin in patients chronically receiving digoxin. Am J Med. 1994;96:84S-6. [ Links ]
180. Donovan JM, Stypinski D, Stiles MR, Olson TA, Burke SK. Drug interactions with colesevelam hydrochloride, a novel, potent lipidlowering agent. Cardiovasc Drugs Ther. 2000;14:681-90. [ Links ]
181. Boyd RA, Stern RH, Stewart BH, Wu X, Reyner EL, Zegarac EA, Randinitis EJ, Whitfield L. Atorvastatin coadministration may increase digoxin concentrations by inhibition of intestinal P-glycoprotein-mediated secretion. J Clin Pharmacol. 2000;40:91-8. [ Links ]
182. Deng S, Chen XP, Cao D, Yin T, Dai ZY, Luo J, Tang L, Li YJ. Effects of a concomitant single oral dose of rifampicin on the pharmacokinetics of pravastatina in a two-phase, randomized, single-blind, placebo-controlled, crossover study in healthy Chinese male subjects. Clin Ther. 2009;31:1256-63. [ Links ]
183. Kyrklund C, Backman JT, Neuvonen M, Neuvonen PJ. Effect of rifampicin on pravastatin pharmacokinetics in healthy subjects. Br J Clin Pharmacol. 2004;57:181-7. [ Links ]
184. Backman JT, Luurila H, Neuvonen M, Neuvonen PJ. Rifampin markedly decreases and gemfibrozil increases the plasma concentrations of atorvastatin and its metabolites. Clin Pharmacol Ther. 2005;78:154-67. [ Links ]
185. Kyrklund C, Backman JT, Kivistö KT, Neuvonen M, Laitila J, Neuvonen PJ. Rifampin greatly reduces plasma simvastatin and simvastatin acid concentrations. Clin Pharmacol Ther. 2000;68:592-7. [ Links ]
186. Zhang W, Deng S, Chen XP, Zhou G, Xie HT, He FY,et al.Pharmacokinetics of rosuvastatin when coadministered with rifampicin in healthy males: a randomized, single-blind, placebo-controlled, crossover study. Clin Ther. 2008;30:1283-9. [ Links ]
187. Pennisi G, Vacante M, Russo C, Malaguarnera M. Rhabdomyolysis induced by rosuvastatin and sildenafil. South Med J. 2010;103:1052-4. [ Links ]
188. Gutiérrez CA. Sildenafil-simvastatin interaction: possible cause of rhabdomyolysis? Am Fam Physician. 2001;63:636-7. [ Links ]
189. Sawant RD. Rhabdomyolysis due to an uncommon interaction of ciprofloxacin with simvastatin. Can J Clin Pharmacol. 2009;16:e78-9. [ Links ]
190. Cid Conde L, Silveria Cancela D. Rabdomiolisis probablemente causada por interacción entre efalizumab y pravastatina. Farm Hosp. 2007;31:135-6. [ Links ]
191. Tatonetti NP, Denny JC, Murphy SN, Fernald GH, Krishnan G, Castro V, et al. Detecting drug interactions from adverse-event reports: interaction between paroxetine and pravastatin increases blood glucose levels. Clin Pharmacol Ther. 2011;90:133-42. [ Links ]
192. Simonson SG, Martin PD, Mitchell PD, Lasseter K, Gibson G, Schneck DW. Effect of rosuvastatin on warfarin pharmacodynamics and pharmacokinetics. J ClinPharmacol. 2005;45:927-34. [ Links ]
193. Ledl M, Hohenecker J, Francesconi C, Roots I, Bauer MF, Roden M. Acute myopathy in a type 2 diabetic patient on combination therapy with metformin, fenofibrate and rosiglitazone. Diabetologia. 2005;48:1996-8. [ Links ]
194. Lewin JJ 3rd, Nappi JM, Taylor MH. Rhabdomyolysis with concurrent atorvastatin and diltiazem. Ann Pharmacother. 2002;36:1546-9. [ Links ]
195. Burtenshaw AJ, Sellors G, Downing R. Presumed interaction of fusidic acid with simvastatin. Anaesthesia. 2008;63:656-8. [ Links ]
196. Yuen SL, McGarity B. Rhabdomyolysis secondary to interaction of fusidic acid and simvastatin. Med J Aust. 2003;179:172. [ Links ]
197. O'Mahony C, Campbell VL, Al-Khayatt MS, Brull DJ. Rhabdomyolysis with atorvastatin and fusidic acid. Postgrad Med J. 2008;84:325-7. [ Links ]
198. Teckchandani S, Robertson S, Almond A, Donaldson K, Isles C. Rhabdomyolysis following co-prescription of fusidic acid and atorvastatin. J R Coll Physicians Edinb. 2010;40:33-6. [ Links ]
199. Marot A, Morelle J, Chouinard VA, Jadoul M, Lambert M, Demoulin N. Concomitant use of simvastatin and amiodarone resulting in severe rhabdomyolysis: a case report and review of the literature. Acta Clin Belg. 2011;66:134-6. [ Links ]
200. Nägele H, Behrens S, Hashagen S, Azizi M. Rhabdomyolysis after addition of digitoxin to chronic simvastatin and amiodarone therapy. Drug Metabol Drug Interact. 2007;22:195-200. [ Links ]
201. Becquemont L, Neuvonen M, Verstuyft C, Jaillon P, Letierce A, Neuvonen PJ, et al. Amiodarone interacts with simvastatin but not with pravastatin disposition kinetics. Clin Pharmacol Ther. 2007;81:679-84. [ Links ]
202. Roten L, Schoenenberger RA, Krähenbühl S, Schlienger RG. Rhabdomyolysis in association with simvastatin and amiodarone. Ann Pharmacother. 2004;38:978-81. [ Links ]
203. de Denus S, Spinler SA. Amiodarone's role in simvastatin-associated rhabdomyolysis. Am J Health Syst Pharm. 2003;60:1791;author reply 1791-2. [ Links ]
204. Franz CC, Bruggisser M, Krähenbühl S, Rätz Bravo AE. Rhabdomyolysis associated with atorvastatin combined with amiodarone and fluconazole. Praxis (Bern 1994). 2011;100:273-84. [ Links ]
205. Justiniano M, Dold S, Espinoza LR. Rapid onset of muscle weakness (rhabdomyolysis) associated with the combined use of simvastatin and colchicine. J Clin Rheumatol. 2007;13:266-8. [ Links ]
206. Tufan A, Dede DS, Cavus S, Altintas ND, Iskit AB, Topeli A. Rhabdomyolysis in a patient treated with colchicine and atorvastatin. Ann Pharmacother. 2006;40:1466-9. [ Links ]
207. Atasoyu EM, Evrenkaya TR, Solmazgul E. Possible colchicine rhabdomyolysis in a fluvastatin-treated patient. Ann Pharmacother. 2005;39:1368-9. [ Links ]
208. Alayli G, Cengiz K, Cantürk F, Durmu D, Akyol Y, Menek e EB. Acute myopathy in a patient with concomitant use of pravastatin and colchicine. Ann Pharmacother. 2005;39:1358-61. [ Links ]
209. Sugie M, Kuriki A, Arai D, Ichikawa H, Kawamura M. A case report of acute neuromyopathy induced by concomitant use of colchicine and bezafibrate. No To Shinkei. 2005;57:785-90. [ Links ]
210. Atmaca H, Sayarlioglu H, Külah E, Demircan N, Akpolat T. Rhabdomyolysis associated with gemfibrozil-colchicine therapy. Ann Pharmacother. 2002;36:1719-21. [ Links ]
211. Martin PD, Schneck DW, Dane AL, Warwick MJ. The effect of a combination antacid preparation containing aluminium hydroxide and magnesium hydroxide on rosuvastatin pharmacokinetics. Curr Med Res Opin. 2008;24:1231-5. [ Links ]
212. Ucar M, Neuvonen M, Luurila H, Dahlqvist R, Neuvonen PJ, Mjörndal T. Carbamazepine markedly reduces serum concentrations of simvastatin and simvastatin acid. Eur J Clin Pharmacol. 2004;59:879-82. [ Links ]
213. Andreou ER, Ledger S. Potential drug interaction between simvastatin and danazol causing rhabdomyolysis. Can J Clin Pharmacol. 2003;10:172-4. [ Links ]
214. Stankovic I, Vlahovic-Stipac A, Putnikovic B, Cvetkovic Z, Neskovic AN. Concomitant administration of simvastatin and danazol associated with fatal rhabdomyolysis. Clin Ther. 2010;32:909-14. [ Links ]
215. Hsieh CY, Chen CH. Rhabdomyolysis and pancreatitis associated with coadministration of danazol 600 mg/d and lovastatin 40 mg/d. Clin Ther. 2008;30:1330-5. [ Links ]
216. Karonen T, Filppula A, Laitila J, Niemi M, Neuvonen PJ, Backman JT. Gemfibrozil markedly increases the plasma concentrations of montelukast: a previously unrecognized role for CYP2C8 in the metabolism of montelukast. Clin Pharmacol Ther. 2010;88:223-30. [ Links ]
217. Karonen T, Neuvonen PJ, Backman JT. CYP2C8 but not CYP3A4 is important in the pharmacokinetics of montelukast. Br J Clin Pharmacol. 2012;73:257-67. [ Links ]
218. Karnik NS, Maldonado JR. Antidepressant and statin interactions: a review and case report of simvastatin and nefazodone-induced rhabdomyolysis and transaminitis. Psychosomatics. 2005;46:565-8. [ Links ]
219. Skrabal MZ, Stading JA, Monaghan MS. Rhabdomyolysis associated with simvastatin-nefazodone therapy. South Med J. 2003;96:1034-5. [ Links ]
220. Thompson M, Samuels S. Rhabdomyolysis with simvastatin and nefazodone. Am J Psychiatry. 2002;159:1607. [ Links ]
221. Shin KH, Kim TE, Kim SE, Lee MG, Song IS, Yoon SH, et al. The effect of the newly developed angiotensin receptor II antagonist fimasartan on the pharmacokinetics of atorvastatin in relation to OATP1B1 in healthy male volunteers. J Cardiovasc Pharmacol. 2011;58:492-9. [ Links ]
222. Allred AJ, Bowen CJ, Park JW, Peng B, Williams DD, Wire MB, et al. Eltrombopag increases plasma rosuvastatin exposure in healthy volunteers. Br J Clin Pharmacol. 2011;72:321-9. [ Links ]
223. Gutiérrez CA. Sildenafil-simvastatin interaction: possible cause of rhabdomyolysis? Am Fam Physician. 2001;63:636-7. [ Links ]
224. Sawant RD.Rhabdomyolysis due to an uncommon interaction of ciprofloxacin with simvastatin.Can J Clin Pharmacol. 2009;16:e78-9. [ Links ]
225. Dieterle W, Corynen S, Vaidyanathan S, Mann J. Pharmacokinetic interactions of the oral renin inhibitor aliskiren with lovastatin, atenolol, celecoxib and cimetidine. Int J Clin Pharmacol Ther. 2005;43:527-35. [ Links ]
226. Wu LX, Guo CX, Chen WQ, Yu J, Qu Q, Chen Y, et al. Inhibition of the organic anion-transporting polypeptide 1B1 by quercetin: an in vitro and in vivo assessment. Br J Clin Pharmacol. 2012;73:750-7. [ Links ]
227. Ayalasomayajula SP, Vaidyanathan S, Kemp C, Prasad P, Balch A, Dole WP. Effect of clopidogrel on the steady-state pharmacokinetics of fluvastatin.J Clin Pharmacol. 2007;47:613-9. [ Links ]
228. Van Luin M, Colbers A, van Ewijk-Beneken Kolmer EW, Verweij-van Wissen CP, Et al. Drug-drug interactions between raltegravir and pravastatin in healthy volunteers. J Acquir Immune Defic Syndr. 2010;55:82-6. [ Links ]
229. Donovan JM, Kisicki JC, Stiles MR, Tracewell WG, Burke SK. Effect ofcolesevelam on lovastatin pharmacokinetics. Ann Pharmacother. 2002;36:392-7. [ Links ]
230. Zhou LX, Finley DK, Hassell AE, Holtzman JL. Pharmacokinetic interaction between isradipine and lovastatin in normal, female and male volunteers. J Pharmacol Exp Ther. 1995;273:121-7. [ Links ]
231. Bao T, Blackford AL, Stearns V. Effect of simvastatin on the pharmacokinetics of anastrozole. Breast Cancer Res Treat. 2012;131:709-11. [ Links ]
232. Foley-Comer AJ, Young AM, Russell-Yarde F, Jordan P. Aleglitazar, a balanced PPAR/agonist, has no clinically relevant pharmacokinetic interaction with high-dose atorvastatin or rosuvastatin. Expert Opin Investig Drugs. 2011;20:3-12. [ Links ]
233. Schmitt-Hoffmann AH, Roos B, Sauer J, Spickermann J, Maares J, Schoetzau A, et al. Pharmacokinetic interactions between alitretinoin and ketoconazole or simvastatin or ciclosporin A. Clin Exp Dermatol. 2011;36 Suppl 2:24-8. [ Links ]
234. Hang W, Deng S, Chen XP, Zhou G, Xie HT, He FY, et al. Pharmacokinetics of rosuvastatin when coadministered with rifampicin in healthy males: a randomized, single-blind, placebo-controlled, crossover study. Clin Ther. 2008;30:1283-9. [ Links ]
235. Derks M, Abt M, Parr G, Meneses-Lorente G, Young AM, Phelan M. No clinically relevant drug-drug interactions when dalcetrapib is co-administered with atorvastatin. Expert Opin Investig Drugs. 2010;19:1 135-45. [ Links ]
236. Simonson SG, Martin PD, Warwick MJ, Mitchell PD, Schneck DW. The effect of rosuvastatin on oestrogen & progestin pharmacokinetics in healthy women taking an oral contraceptive. Br J Clin Pharmacol. 2004;57:279-86. [ Links ]
237. Stern RH, Gibson DM, Whitfield LR. Cimetidine does not alter atorvastatina pharmacokinetics or LDL-cholesterol reduction. Eur J Clin Pharmacol. 1998;53:475-8. [ Links ]
238. Krishna R, Garg A, Jin B, Keshavarz SS, Bieberdorf FA, Chodakewitz J, et al. Assessment of a pharmacokinetic and pharmacodynamic interaction between simvastatin and anacetrapib, a potent cholesteryl ester transfer protein (CETP)inhibitor, in healthy subjects. Br J Clin Pharmacol. 2009;67:520-6. [ Links ]
239. Sarich TC, Schützer KM, Dorani H, Wall U, Kalies I, Ohlsson L, et al. No pharmacokinetic or pharmacodynamic interaction between atorvastatin and the oral direct thrombin inhibitor ximelagatran. J Clin Pharmacol. 2004;44:928-34. [ Links ]
240. Sunkara G, Reynolds CV, Pommier F, Humbert H, Yeh C, Prasad P. Evaluation of a pharmacokinetic interaction between valsartan and simvastatin in healthy subjects. Curr Med Res Opin. 2007;23:631-40. [ Links ]
241. Cooper KJ, Martin PD, Dane AL, Warwick MJ, Raza A, Schneck DW. The effect of erythromycin on the pharmacokinetics of rosuvastatin. Eur J Clin Pharmacol. 2003;59:51-6. [ Links ]
242. Vaidyanathan S, Camenisch G, Schuetz H, Reynolds C, Yeh CM, Bizot MN, et al. Pharmacokinetics of the oral direct renin inhibitor aliskiren in combination with digoxin, atorvastatin, and ketoconazole in healthy subjects: the role of P-glycoprotein in the disposition of aliskiren. J Clin Pharmacol. 2008;48:1323-38. [ Links ]
243. Nishio S, Watanabe H, Kosuge K, Uchida S, Hayashi H, Ohashi K. Interaction between amlodipine and simvastatin in patients with hypercholesterolemia and hypertension. Hypertens Res. 2005;28:223-7. [ Links ]
244. Zhi J, Moore R, Kanitra L, Mulligan TE. Effects of orlistat, a lipase inhibitor, on the pharmacokinetics of three highly lipophilic drugs (amiodarone, fluoxetine, and simvastatin) in healthy volunteers. J Clin Pharmacol. 2003;43:428-35. [ Links ]
245. Simard C, O'Hara GE, Prévost J, Guilbaud R, Masseé R, Turgeon J. Study of the drug-drug interaction between simvastatin and cisapride in man. Eur J Clin Pharmacol. 2001;57:229-34. [ Links ]
246. McDonnell CG, Malkan D, Van Pelt FD, Shorten GD.Elimination of alfentanil delivered by infusion is not altered by the chronic administration of atorvastatin.Eur J Anaesthesiol. 2003; 20:662-7. [ Links ]
247. Marino MR, Vachharajani NN, Hadjilambris OW. Irbesartan does not affect the pharmacokinetics of simvastatin in healthy subjects. J Clin Pharmacol. 2000;40:875-9. [ Links ]
248. Stern RH, Smithers JA, Olson SC. Atorvastatin does not produce a clinicallysignificant effect on the pharmacokinetics of terfenadine. J Clin Pharmacol. 1998; 38:753-7. [ Links ]
249. Meyer BH, Scholtz HE, Müller FO, Luus HG, de la Rey N, Seibert-Grafe, et al. Lack of interaction between ramipril and simvastatin. Eur J Clin Pharmacol. 1994;47:373-5. [ Links ]
250. Bellosta S, Paoletti R, Corsini A. Safety of statins: focus on clinical pharmacokinetics and drug interactions. Circulation. 2004;109 Suppl 1:III50-7. [ Links ]
251. Law M, Rudnicka AR. Statin safety: a systematic review. Am J Cardiol. 2006;97:52C-60C. [ Links ]
252. Shitara Y, Sugiyama Y. Pharmacokinetic and pharmacodynamic alterations of 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase inhibitors: drug-drug interactions and interindividual differences in transporter and metabolic enzyme functions. Pharmacol Ther. 2006;112:71-105. [ Links ]
253. Rowan C. Clinical Importance of the drug Interaction between statins and CYP3A4 Inhibitors (2010). Publicly accessible Penn Dissertations. Paper 283. Citado el 14-11-2012. Disponible en: http://repository.upenn.edu/edissertations/283. [ Links ]
254. Neuvonen PJ, Niemi M, Backman JT. Drug interactions with lipid-lowering drugs: mechanisms and clinical relevance. Clin Pharmacol Ther. 2006;80:565-81. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Pedro Amariles
E-mail: pamaris@farmacia.udea.edu.co
Recibido: 18/07/2013.
Aceptado: 11/10/2013.