Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.38 no.1 Toledo ene./feb. 2014
https://dx.doi.org/10.7399/FH.2014.38.1.1142
ORIGINALES
Seguridad de boceprevir y telaprevir en la práctica clínica habitual
Boceprevir and telaprevir safety in routine clinical practice
R. López-Sepúlveda1, C. Fernández-López2, C. García Collado1, A. Jiménez Morales1, C. Valencia Soto1 y M. Á. Calleja Hernández1
1 Hospital Universitario Virgen de Las Nieves.
2 Hospital Universitario San Cecilio. Unidad de Gestión Intercentros e Interniveles de Farmacia de la Provincia de Granada. España.
Este trabajo ha sido presentado parcialmente, como comunicación oral, en el 58 congreso de la SEFH.
Dirección para correspondencia
RESUMEN
Objetivo: Comparar el perfil de seguridad telaprevir (TLV) y boceprevir (BOC) entre sí y con lo descrito en ensayos clínicos (EECC).
Material y método: Estudio multicéntrico observacional retrospectivo. Variables recogidas: edad, sexo, tipo de paciente (naïve, no respondedor o recidivantes), fibroscan, Hb nadir, recuento de neutrófilos y plaquetas, presencia de exantema, malestar anorrectal, número de pacientes tratados con estimuladores de la eritropoyesis (EPO) y factores estimuladores de colonias de granulocitos (G-CSF).
Resultados: BOC vs EECC: anemia (56,5% vs. 49%), trombocitopenia (56,5% vs. 32%; p = 0,023). Neutropenia (17,4% vs. 29,5%). Utilización de EPO (13% vs. 43%; p = 0,008), prurito (13% vs. 21,1%), exantema (8,7% vs. 16,1%); molestias anorrectales (4,3% vs. 0%; p = 0,0001), disgeusia (47,8% vs. 37%). TLV vs. EECC: anemia (51,2% vs. 32%; p = 0,014), neutropenia (2,3 vs. 3,6%), trombocitopenia (41,9% vs. 27,4%; p = 0,05), prurito (39,5 vs. 47%), exantema (16,3% vs. 55%; p < 0,001), molestias anorrectales (39,5% vs. 26%). Disgeusia (14% vs. 9,5%). BOC vs. TLV: anemia (56,5% vs. 51,2%), neutropenia (17,4% vs. 2,3%), trombocitopenia (56,5% vs. 41,9%), exantema (8,7% vs. 16,3%), prurito (39,5% vs. 13%) y molestias anorrectales (4,3% vs. 39,5%; p = 0,006), disgeusia (47,8% vs. 14%; p = 0,007) EPO (13% vs. 25,6%). G-CSF se utilizó para un paciente tratado con TLV.
Conclusiones:
1. BOC y TLV han mostrado un perfil de seguridad peor que en los EECC en cuanto a anemia, trombocitopenia y malestar anorrectal.
2. Al igual que en EECC, anemia, neutropenia y trombocitopenia fueron más frecuentes con BOC. Por otro lado los pacientes tratados con TLV presentaron más prurito, exantema y malestar anorrectal.
Palabras clave: Boceprevir; Telaprevir; Seguridad, Efectos adversos.
ABSTRACT
Purpose: To compare the safety profile of telaprevir (TLV) and boceprevir (BOC) with each other and with those described in clinical trials (CT).
Material and methods: Retrospective multicenter observational study. Variables collected: age, sex, type of patient (naive, nonresponder or recurrent), fibroscan, Hb nadir, neutrophil and platelet count, presence of rash, anorectal discomfort, number of patients treated with erythropoiesis stimulating factors (EPO) and colony stimulating factors granulocyte (G-CSF).
Results: BOC vs CT: anemia (56.5% vs. 49%.), Thrombocytopenia (56.5% vs 32%, p = 0.023). neutropenia (17.4% vs. 29.5%). Use of EPO (13% vs 43%;. p = 0.008), pruritus (13% vs. 21.1%), rash (16.1% vs. 8.7%), anorectal discomfort (4.3% vs. 0%, p = 0.0001), dysgeusia (47.8% vs. 37%). TLV vs. CT: anemia (51.2% vs. 32%, p = 0.014), neutropenia (2.3 vs 3.6%), thrombocytopenia (41.9% vs. 27.4%, p = 0.05), pruritus (39.5% vs 47), rash (16.3% vs 55%, P < 0.001), anorectal discomfort (39.5% vs 26%), dysgeusia (14% vs. 9.5%). BOC vs TLV: anemia (56.5% vs 51.2%), neutropenia (17.4% vs 2.3%), thrombocytopenia (56.5% vs 41.9%), rash (8.7% vs 16.3%), pruritus (39.5% vs 13%) and anorectal discomfort (4.3% vs 39.5%, P = 0.006), dysgeusia (14% vs 47.8%, P = 0.007), EPO (13% vs. 25.6%). GCSF was used for a patient treated with TLV.
Conclusions:
1. BOC and TLV have shown a worse safety profile for anemia, thrombocytopenia and anorectal discomfort than those described in CT.
2. As in CT, anemia, neutropenia and thrombocytopenia were more common with BOC. Patients treated with TLV experienced more pruritus, rash and anorectal discomfort.
Key words: Boceprevir; Telaprevir; Safety, Adverse events.
Introducción
Hay más de 170 millones de personas con infección crónica por virus de hepatitis C (VHC) en el mundo, todas estas personas corren el riesgo de padecer complicaciones a largo plazo como son: cirrosis, insuficiencia hepática y carcinoma hepatocelular. Además la infección crónica por el VHC es actualmente la principal indicación para trasplante hepático en el mundo occidental.
El tratamiento estándar hasta ahora ha consistido en la combinación de interferón pegilado Α (pegIFN) y ribavirina. Desafortunadamente, este tratamiento sólo curará en el mejor de los casos al 50% de los individuos infectados1 con VHC genotipo 1, que es el genotipo del VHC más prevalente en Europa y los EE.UU. En la década pasada se han invertido muchos recursos en el desarrollo de agentes antivirales de acción directa, lo que culminó con la aprobación en 2011 de Telaprevir (TLV) y Boceprevir (BOC), los primeros anti-VHC inhibidores de la proteasa (IPs).
Los ensayos clínicos (EECC) en fases II y III1-5, han puesto de relieve la aparición frecuente de anemia y erupciones en la piel como efectos adversos (EAs) relacionados con el tratamiento con TLV y BOC. Estos EAs junto con otros síntomas menores derivados de la triple terapia con IPs como son: fatiga, dolor de cabeza, náuseas, malestar anorrectal y disgeusia, pueden comprometer la adherencia de los pacientes a estas nuevas terapias.
Los EECC, sin embargo, no pudieron sopesar correctamente el impacto de tales EAs en la práctica clínica habitual, ya que los criterios de inclusión y exclusión provocaron que algunas subpoblaciones de pacientes, como los cirróticos, estuviesen infrarrepresentados o que se excluyeran pacientes coinfectados con VIH.
El objetivo de este estudio es comparar los datos sobre seguridad recogidos de los EECC pivotales de BOC y TLV con los obtenidos la práctica clínica habitual, así como realizar una comparación del perfil de seguridad de ambos tratamientos entre sí.
Métodos
Estudio multicéntrico, observacional y retrospectivo llevado a cabo en dos hospitales: Hospital Universitario Virgen de las Nieves y Hospital Clínico San Cecilio. Se incluyeron en este estudio todos los pacientes que iniciaron tratamiento con IPs entre enero y diciembre de 2012. Se revisaron las historias farmacoterapéuticas de los pacientes para recoger los efectos adversos descritos, así como los datos analíticos relevantes para el tratamiento.
Con el objetivo de comparar nuestros resultados en seguridad con los descritos en la bibliografía, se recogieron los datos de seguridad de los EECC pivotales y se tuvieron en cuenta los EAs más frecuentes.
Se definieron anemia como hemoglobina (Hb) < 10 mg/dL, neutropenia: neutrófilos < 0,75 X 10^3/mm3 (neutropenia grado 3 y 4 según la Organización Mundial de la Salud) y trombocitopenia: plaquetas < 100.000 U/mm3. Una vez definidos estos rangos:
a) Se compararon nuestros resultados de seguridad con los descritos en la bibliografía para BOC y TLV1,2,4-8.
b) Se comparó el perfil de seguridad del tratamiento con TLV frente a BOC para nuestra muestra de pacientes.
Para realizar el análisis estadístico se utilizó la prueba de comparación de proporciones independientes. El software empleado para el análisis fue el Epidat 3.1. El Nivel de confianza para el análisis fue del 95%.
Las variables recogidas fueron: edad, sexo, tipo de paciente según el tratamiento previo (naïve, no respondedor o recidivante), fibroscan, Hb nadir, recuento de neutrófilos, recuento de plaquetas, presencia de exantemas, RAM anorrectales y si los pacientes eran coinfectados con VIH. Se calculó el porcentaje de pacientes con cada RAM para cada fármaco y el total. Se recogió también el número de pacientes que precisaron estimuladores de la eritropoyesis (EPO) y factores estimuladores de colonias de granulocitos (G-CSF).
Resultados
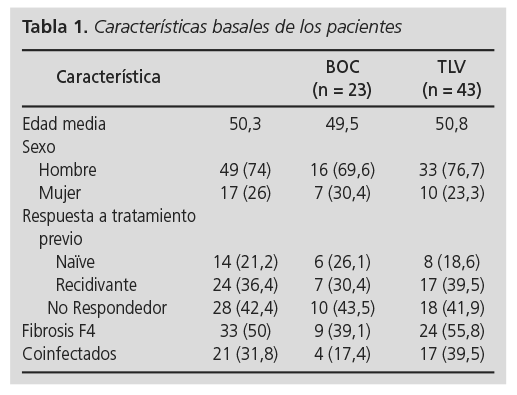
Se trataron 66 pacientes con IPs, la edad media fue 50,3 años. Hubo 49 hombres y 17 mujeres. En lo referente a la respuesta a tratamiento previo con biterapia, hubo 14 pacientes naïve (21,2%) y 52 que habían recibido tratamiento previo con interferón y ribavirina: 28 no respondedores (42,4%) y 24 recidivantes (36,4%). El valor basal medio de fibroscan fue de 18,1 KPa (F4, indicativo de cirrosis). El número de pacientes cirróticos (fibrosis F4) fue de 33 (50%). El número de pacientes coinfectados ascendió a 21 (31,8%) (Tabla 1).
Datos de seguridad descritos en ficha técnica y en EECC para BOC y TLV
TLV tiene como reacciones adversas específicas exantema (55%), anemia (32,1%) y RAM anorrectales (26%)6. En EECC con TLV se notificó además la aparición de los siguientes EAs: prurito (47%), trombocitopenia (27,4%), neutropenia (3,6%) y disgeusia (9,5%)1,2,8,9.
Los EAs más frecuentes de BOC: anemia (49%), trombocitopenia (32%) y neutropenia (29%)7. En EECC se notificaron también las siguientes reacciones adversas: disgeusia (37%), prurito (21%), exantema (16%). No se describieron molestias anorrectales4,9,10.
Datos de seguridad recogidos en nuestra muestra de pacientes
Del total de pacientes hubo 43 (65,2%) tratados con TLV y 23 (34,8%) tratados con BOC. En la tabla 2 se recoge el número de pacientes de nuestro estudio que experimentaron anemia, neutropenia, trombocitopenia, exantema, prurito, disgeusia y molestias anorrectales.
Al comparar nuestros resultados en seguridad con los descritos en los EECC encontramos que para BOC (Figura 1) nuestros pacientes experimentaron un porcentaje mayor de anemia (56,5% vs. 49%; p = no significativo (N.S.) y trombocitopenia (56,5% vs. 32%), siendo esta diferencia estadísticamente significativa para la trombocitopenia; (p = 0,023). Sin embargo el grado de neutropenia fue menor (17,4% vs. 29,5%; N.S.). El porcentaje de nuestros pacientes a los que se les administró EPO fue significativamente menor que el recogido en los EECC (13% vs. 43%; p = 0,008). En cuanto a las reacciones dermatológicas, en nuestro estudio los pacientes experimentaron menos prurito (13% vs. 21,1%; N.S.) y exantema (8,7% vs. 16,1%; N.S.); por el contrario sí se notificaron molestias anorrectales, que no están descritas en los EECC de BOC (4,3% vs. 0%; p = 0,0001). El porcentaje de disgeusia fue mayor en nuestra población (47,8% vs. 37%; N.S.). En cuanto a TLV (Figura 2) el porcentaje de anemia recogido en nuestros pacientes fue mayor que el descrito en ficha técnica (51,2% vs 32%, p = 0,014). El porcentaje de neutropenia obtenido fue comparable al descrito en la bibliografía (2,3 vs. 3,6%; N.S.) y el porcentaje de trombocitopenia fue mayor (41,9% vs 27,4%; p = 0,05). La proporción de pacientes que utilizaron EPO en nuestro estudio no pudo compararse a los datos de los EECC ya que la utilización de EPO no estuvo permitida. La incidencia de prurito (39,5 vs. 47%; N.S.) fue menor que la descrita en la bibliografía, siendo esta diferencia mayor para el porcentaje de exantema (16,3% vs 55%; p < 0,001). Las molestias anorrectales fueron más frecuentes en nuestra muestra de pacientes (39,5% vs 26%; N.S.). Finalmente, la disgeusia se experimentó en un porcentaje algo superior en nuestra población (14% vs. 9,5%; N.S.).
El porcentaje de anemia, neutropenia y trombocitopenia fue mayor para los pacientes tratados con BOC que para los tratados con TLV (56,5% vs 51,2%, 17,4% vs 2,3% y 56,5% vs 41,9% respectivamente). Los pacientes tratados con TLV experimentaron más EAs dermatológicos: exantema (16,3% vs 8,7%; N.S.), prurito (39,5% vs 13%; N.S.) y molestias anorrectales (39,5% vs 4,3% p = 0,006). Por el contrario los pacientes que tomaron BOC mostraron más casos de disgeusia (47,8% vs 14%; p = 0,007) (Figura 3). El número de pacientes que necesitó EPO fue de 11 para TLV y de 3 para BOC (25,6% vs 13%; N.S.). Sólo se utilizó G-CSF para un paciente tratado con TLV.
Discusión
Los nuevos agentes antivirales BOC y TLV, han supuesto un nuevo paradigma en el tratamiento de los pacientes infectados por el VHC, pero el éxito de la triple terapia podría verse afectado por los problemas de tolerabilidad y seguridad derivados del uso de estos IPs. Nuestro estudio incluyó a todos los pacientes que iniciaron triple terapia con TLV o BOC durante un año. La elección del tratamiento antiviral se realizó adecuándose al perfil del paciente, con lo que no es un estudio randomizado, sin embargo, este diseño nos pareció adecuado para el objetivo de nuestro estudio por ser el más parecido a la práctica clínica.
Al comparar el perfil de EAs de nuestra población de pacientes con el descrito en los EECC pivotales encontramos diferencias. El principal motivo por el que dichas diferencias podrían explicarse es, sin duda, el hecho de que las características basales de nuestros pacientes no fueron las mismas que las de las cohortes de pacientes que participaron en los EC, ya que en aquéllos casos contaron con unos estrictos criterios de inclusión para acceder al estudio.
Nuestra muestra de pacientes presentaba más anemia y trombocitopenia tanto para BOC como para TLV, siendo incluso significativa en el caso de TLV, esto puede venir determinado por el hecho de que los EECC contaban con una menor proporción de pacientes cirróticos y por tanto aquéllos pacientes se encontraban en mejores condiciones para afrontar el tratamiento con triple terapia. En el estudio REALIZE de TLV sólo el 26% de los pacientes era cirrótico1, en el estudio RESPOND-2 con BOC este porcentaje fue incluso menor, tan sólo el 49 de los 403 pacientes en estudio (12,16%) padecían cirrosis4. Nuestros resultados estarían en concordancia con lo que ya se había descrito para el tratamiento estándar con pegIFN y ribavirina. Con la biterapia, en pacientes con fibrosis hepática avanzada, sucedía que la seguridad era menor que en el resto de los pacientes11. En esta misma línea, se han publicado datos de seguridad obtenidos de un subanálisis de los propios EECC con BOC en los que, estratificando los pacientes en función de la severidad de su enfermedad hepática, se pone de manifiesto que la trombocitopenia era más común en pacientes cirróticos12, hecho que ha quedado confirmado al ser el porcentaje de trombocitopenia significativamente mayor en nuestra muestra. Aunque este estudio exponga un mayor porcentaje de EAs hematológicos para los pacientes cirróticos, no describe la aparición de anemia en mayor proporción en los pacientes con fibrosis avanzada; por el contrario, en los nuevos estudios realizados con IPs y llevados a cabo en poblaciones reales de pacientes13-15, como por ejemplo el estudio CUPIC16 con una cohorte de pacientes cirróticos, se determina que el porcentaje de aparición de anemia es elevado, y que generalmente se trata de anemias graves y difíciles de manejar, hecho en concordancia con nuestros resultados.
El porcentaje de neutropenia obtenido en nuestro estudio para los pacientes con TLV resulta similar al descrito en la bibliografía, tanto en EECC como en el estudio CUPIC16. En el caso de BOC la proporción de neutropenia es menor que la descrita en ficha técnica y sin embargo, resulta mayor que la del estudio CUPIC, donde todos los pacientes eran cirróticos, pero donde el porcentaje de no respondedores fue muy inferior al de nuestro estudio. En el caso de los pacientes tratados con BOC hemos de tener en cuenta que en el RESPOND-2 se excluyeron a los pacientes que no habían respondido previamente a la terapia con pegIFN y ribavirina4, por el contrario un tercio de los pacientes de nuestro estudio son no respondedores (36,5%). No podemos descartar que al introducir en nuestra población pacientes no respondedores tratados con BOC, se haya visto aumentado el porcentaje de EAs y esto haya influido en los peores resultados en seguridad al comparar nuestros resultados con los EECC. Al no conocerse los datos de seguridad en esta población de pacientes se necesitarían EECC para confirmar este último supuesto.
Desconocemos los motivos por los que nuestros pacientes han sufrido menos prurito y exantema, sin embargo la proporción de pacientes con algún tipo de malestar anorrectal fue mayor, así como la disgeusia. Los datos de seguridad y tolerabilidad de TLV y BOC en pacientes coinfectados por VIH y VHC en estudios en fase 2, son muy similares a los que se conocían previamente en sujetos monoinfectados tratados con estos fármacos17. La frecuencia de anemia descrita para los pacientes con TLV y BOC tampoco fue diferente a la de los EECC en monoinfectados, pero en el caso de TLV, a diferencia del estudio ADVANCE (en el que se utilizaban dosis de 1.000 ó 1.200 mg de RBV/día en función de si los pacientes pesaban menos o más de 75 Kg respectivamente) en los pacientes coinfectados se llevó a cabo un ajuste de la posología de RBV administrando 800 mg diarios a la mayoría de los pacientes y se excluyeron los pacientes tratados con zidovudina (fármaco que empeora la anemia asociada al tratamiento con pegIFN y RBV), con lo que el porcentaje de anemia podría haber sido menor del esperado18. También hay que añadir que este estudio se llevó a cabo en pacientes que no habían recibido tratamiento previo para HCV, con lo que faltan estudios para aclarar si el tratamiento con IPs es menos seguro en coinfectados y sobre todo en pretratados para el HCV. Todos estos supuestos deberían ser confirmados en estudios en fase III a gran escala.
Cuando comparamos entre sí los datos de nuestros pacientes tratados con BOC o TLV, se aprecian claras diferencias que a su vez están en concordancia con el perfil de EAs de cada fármaco. En la ficha técnica de BOC7 se indican como EAs específicos la anemia, la neutropenia y la trombocitopenia con lo que cabía esperar que el porcentaje de EAs de este tipo fuese superior para este fármaco. Los EAs específicos de TLV señalados en la ficha técnica6 son la anemia, el exantema y el malestar anorrectal. La anemia fue superior para BOC al igual que lo descrito en los EECC, sin embargo el uso de EPO fue mayor en los pacientes tratados con TLV (25,6% vs 13%). Podemos interpretar este resultado suponiendo que aunque TLV produzca menos casos de anemia, éstas son más difíciles de manejar porque alcanzan valores de Hb más bajos. El porcentaje de pacientes que experimentaron exantema y malestar anorrectal fue claramente superior con TLV, siendo esta diferencia estadísticamente significativa en el caso de las molestias anorrectales. Otra reacción dermatológica que también fue más frecuente en los pacientes del grupo TLV fue el prurito. En los EECC la disgeusia está descrita en mayor proporción en los tratados con BOC, resultado que coincide con nuestros pacientes, donde encontramos diferencias significativas. Ambos fármacos mostraron un perfil de toxicidad con EAs como los que ya están descritos en la bibliografía, pero en mayor proporción.
BOC y TLV han supuesto un aumento de eficacia en cuanto a RVS, sin embargo, este aumento de eficacia se ve acompañado de un aumento de EAs. Este hecho, unido a las características diferenciales de los pacientes infectados por VHC: cirróticos, coinfectados, trasplantados, etc. hace necesaria la colaboración de equipos interdisciplinares. En esta línea, el Farmacéutico de Hospital se muestra como una figura clave en la detección, manejo y seguimiento de los EAs de los pacientes con patología vírica tal y como han descrito otros autores19.
En resumen, el perfil de EAs hematológicos de BOC y TLV en la práctica clínica ha resultado ser peor que en los EECC en cuanto a anemia y trombocitopenia. Sin embargo a excepción de las molestias anorrectales los EAs dermatológicos fueron menos frecuentes. Al comparar ambos IPs entre sí la presencia de anemia y neutropenia fue más frecuente con BOC. Los pacientes tratados con TLV presentaron más prurito, exantema y molestias anorrectales. La disgeusia fue más común con el tratamiento con BOC.
Bibliografía
1. Zeuzem S, Andreone P, Pol S, Lawitz E, Diago M, Roberts S, et al. Telaprevir for retreatment of HCV infection. N Engl J Med. (Internet). Massachusetts Medical Society 2011;364(25):2417-28. [ Links ]
2. Jacobson IM, McHutchison JG, Dusheiko G, Di Bisceglie AM, Reddy KR, Bzowej NH, et al. Telaprevir for previously untreated chronic hepatitis C virus infection. N Engl J Med. (Internet). Massachusetts Medical Society 2011;364(25):2405-16. [ Links ]
3. Sherman KE, Flamm SL, Afdhal NH, Nelson DR, Sulkowski MS, Everson GT, et al. Response-guided telaprevir combination treatment for hepatitis C virus infection. N Engl J Med. (Internet). 2011;365 (11):1014-24. [ Links ]
4. Bacon BR, Gordon SC, Lawitz E, Marcellin P, Vierling JM, Zeuzem S, et al. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med. (Internet). Massachusetts Medical Society 2011;364(13):1207-17. [ Links ]
5. Manns MP, Sulkowski MS, Jacobson IM, Reddy KR, Goodman ZD, Ph D, et al. Boceprevir for Untreated Chronic HCV Genotype 1 Infection. New Engl J Med Med. 2011; p. 1195-206. [ Links ]
6. Ficha Técnica Telaprevir (Internet). Available from: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002313/WC500115529.pdf. [ Links ]
7. Ficha Técnica Boceprevir (Internet). Available from: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002332/WC500109786.pdf. [ Links ]
8. McHutchison JG, Manns MP, Muir AJ, Terrault NA, Jacobson IM, Afdhal NH, et al. Telaprevir for previously treated chronic HCV infection. N Engl J Med. (Internet) 2010;362(14):1292-303. [ Links ]
9. Ubago Pérez R, Muñoz Castillo MA, Navarro Caballero JA, Márquez Peláez S, Beltrán Calvo C, Molina López T. Inhibidores de la proteasa (boceprevir y telaprevir) en el tratamiento de pacientes monoinfectados por el VHC: eficacia, seguridad y eficiencia comparada. 2012. [ Links ]
10. Bacon BR, Gordon SC, Lawitz E, Marcellin P, Vierling JM, Zeuzem S, et al. Boceprevir Supplementary Appendix. 2011; p. 1-16. [ Links ]
11. Sulkowski MS, Cooper C, Hunyady B, Jia J, Ogurtsov P, Peck-Radosavljevic M, et al. Management of adverse effects of Peg-IFN and ribavirin therapy for hepatitis C. Nat Rev Gastroenterol Hepatol. (Internet). 2011 Apr (cited 2013 Oct 28);8(4):212-23. [ Links ]
12. Bruno S, Vierling JM, Esteban R, Nyberg LM, Tanno H, Goodman Z, et al. Efficacy and safety of boceprevir plus peginterferon-ribavirin in patients with HCV G1 infection and advanced fibrosis/cirrhosis. J Hepatol. (Internet). 2013 Mar (cited 2013 Oct 28);58(3):479-87. [ Links ]
13. Chou R, Hartung D, Rahman B, Wasson N, Cottrell EB. Review Annals of Internal Medicine Comparative Effectiveness of Antiviral Treatment for Hepatitis C Virus Infection in Adults: A Systematic Review. 2013. [ Links ]
14. Akiyama MJ, Piotrowski JI, Roytman MM, Chan SM, Hong LK, Huddleston L, et al. New triple therapy for chronic hepatitis C: real life clinical experience in a community setting. Hawaii. J Med Public Health (Internet). 2013 Sep (cited 2013 Oct 30);72(9 Suppl 4):6-13. [ Links ]
15. D'Ambrosio R, Colombo M. Safety of direct antiviral agents in real life. Dig Liver Dis. (Internet). 2013 Sep 30 (cited 2013 Oct 24);45 Suppl 5:S363-6. [ Links ]
16. Hézode C, Fontaine H, Dorival C, Larrey D, Zoulim F, Canva V, et al. Triple therapy in treatment-experienced patients with HCV-cirrhosis in a multicentre cohort of the French Early Access Programme (ANRS CO20-CUPIC)-NCT01514890. J Hepatol. (Internet). 2013 Sep (cited 2013 Oct 29);59(3):434-41. [ Links ]
17. Sulkowski MS. HCV therapy in HIV-infected patients. Liver Int. (Internet). 2013 Feb (cited 2013 Nov 17);33(Suppl 1):63-7. [ Links ]
18. Sulkowski MS, Sherman KE, Dieterich DT, Bsharat M, Mahnke L, Rockstroh JK, et al. Combination therapy with telaprevir for chronic hepatitis C virus genotype 1 infection in patients with HIV: a randomized trial. Ann Intern Med. (Internet). 2013 Jul 16 (cited 2013 Oct 30);159(2):86-96. [ Links ]
19. Morillo Verdugo R, Fernández Lisón LC, Huertas Fernández MJ, Martín Conde MT, Roldan Morales JC, Ruano Camps R, et al. (The role of the hospital pharmacist in the prevention, treatment and management of the side effects associated with antiretroviral treatment). Farm Hosp. (Internet). (cited 2013 Nov 21);34(5):237-50. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Email: rociolopezsepulveda@hotmail.com
(Rocío López Sepúlveda)
Recibido: 30-XI-2013
Aceptado: 5-XII-2013