Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.38 no.6 Toledo Nov./Dez. 2014
https://dx.doi.org/10.7399/FH.2014.38.6.7376
Actualización en el tratamiento de la dermatomiositis; a propósito de un caso
Update in the treatment of dermatomyositis; a case study
Dirección para correspondencia
Introducción
La dermatomiositis (DM) es una entidad heterogénea con afectación sistémica y curso progresivo, que cursa con miopatía inflamatoria y manifestaciones cutáneas. Pueden afectarse otros órganos, como el pulmón, el corazón y el aparato digestivo.
Aunque hay distintas clasificaciones, se reconocen varios tipos de DM: primaria idiopática, asociada a neoplasia, forma juvenil y la amiotrófica sin afectación muscular. Es habitual la detección de autoanticuerpos poniendo de manifiesto el carácter autoinmune que subyace en estos procesos.
Esta alteración del sistema inmunológico hace que el tratamiento esté basado en fármacos inmunosupresores. Se presenta un caso de dermatomiositis con autoanticuerpos anti Mi-2 positivos, afectación cutánea y con la particularidad de tener disfagia además de miopatía confirmada con creatinfosfoquinasa (CK) permanentemente normal descrito en casos aislados de DM activa24.
Se describe además su respuesta al tratamiento inmunosupresor.
Descripción del caso
Mujer de 71 años, sin antecedentes de interés que tras 6 meses de dermatitis en cara, tronco y extremidades, es diagnosticada en julio de 2013 mediante biopsia de piel, de DM con afectación cutánea, sin referir debilidad muscular. Las enzimas musculares CK y aldolasa son normales. Se detectan anticuerpos ANA positivos (1:320) y Mi-1:Mi-2 positivos (1:320) con anti-P155/140 negativos. Los marcadores tumorales y un TAC completo no demuestran presencia de neoplasia. Los reactantes de fase aguda están elevados, PCR 44,2 mg/L [0 - 5] y VSG 73 mm/h [0 - 19]. Se trata con prednisona a dosis de 30 mg/24 h en diversas pautas descendentes durante 4 meses. Durante este periodo de forma progresiva, comienza con mialgias y debilidad muscular que le obligan a estar encamada, con fiebre, disfagia y pérdida de 10 kg de peso.
En diciembre de 2013 ingresa ante la sospecha de DM con aparición de miopatía. Se realiza electromiograma (EMG), resonancia magnética y biopsia muscular que ratifican una miopatía inflamatoria en musculatura proximal de extremidades. Un esofagograma confirma alteración motora esofágica importante y retraso del vaciamiento gástrico. Es diagnosticada de una DM con afectación muscular y digestiva, además de cutánea. El estudio pulmonar y el ecocardiograma son normales.
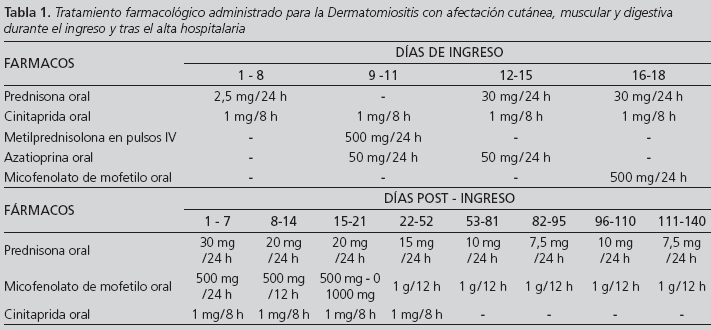
Los 8 primeros días se mantiene la terapia corticoide previa al ingreso. Se prescribe cinitaprida como procinético. Al noveno día, tras confirmar la miopatía, se inicia azatioprina 50 mg/24h. Se añaden pulsos intravenosos (IV) de metilprednisolona durante 3 días, seguido de prednisona 30 mg/24h durante 2 semanas (después una pauta descendente). Al séptimo día de iniciar azatioprina, se detecta GOT/AST 160 U/L [2 - 35] y GPT/ALT 313 U/L [2 - 35], siendo los niveles previos normales. Se decide suspender azatioprina por hepatotoxicidad y el farmacéutico notifica la sospecha de reacción adversa al Centro de Farmacovigilancia. Se inicia micofenolato 500 mg/24h para lo cual la paciente firma un consentimiento informado y se cumplimenta la documentación para uso de medicamentos en situaciones especiales. Se incrementa la dosis hasta alcanzar 1 g/12h (Tabla 1).
Tras 6 semanas de tratamiento, refiere mejoría de la fuerza muscular, aumento de la actividad física, reducción significativa de la disfagia y de la dermatitis, con normalización de los reactantes de fase aguda y transaminasas, continuando con CK y aldolasa normales. Se decide suspender cinitaprida y continuar con pauta descendente de prednisona. Transcurridas 9 semanas de terapia, refiere caída del cabello y parestesias en miembros inferiores que se describen como reacciones adversas frecuentes en la ficha técnica de micofenolato. En la semana 12 se le baja la dosis de prednisona de 10 mg a 7,5 mg /24h. En el control de la semana 14 la paciente describe una placa eritematosa pruriginosa de 10 cm similar a las presentadas al inicio de la enfermedad. En la analítica, el único cambio observado es el incremento de la PCR a 29,2 mg/L. La alopecia se estabiliza, desaparecen las parestesias y se decide volver a 10 mg de prednisona cada 24h. En la semana 16 se normaliza la PCR a 4,1 mg/L y desaparece la afección cutánea volviendo a la dosis de 7,5 mg /24h de prednisona. En el control de la semana 20, la PCR se mantiene en rango y no hay signos de dermatitis considerándose que la terapia de prednisona 7,5 mg /24h más 1 g /12h de micofenolato es segura y eficaz para controlar la enfermedad en esta paciente (Tabla 1).
Comentario
La DM es una enfermedad catalogada como rara1. Afecta a niños y adultos, desarrollándose más en mujeres (relación 2:1)2. Posee un carácter inmunopatológico que provoca inflamación y destrucción de fibras musculares y cutáneas.
Se manifiesta con síntomas característicos como debilidad muscular proximal simétrica de extremidades y dermatitis3. Además, hay síntomas generales como fiebre, malestar y pérdida de peso. A veces, se observa disfagia, afectación pulmonar y/o cardíaca. Las pruebas diagnósticas indicativas de miopatía son el EMG4 y la biopsia muscular. Las pruebas de laboratorio alteradas son: CK, aldolasa, PCR y VSG3. Dado el carácter autoinmune de la enfermedad, hay que determinar los anticuerpos antinucleares (ANA), anti Mi-2 (presente en 5-30% de las DM con afectación cutánea) y anti-p155/140, entre otros3, 4. En la paciente se expresan todos los síntomas generales y característicos de la enfermedad con la particularidad de presentar disfagia. La biopsia cutánea y muscular, el EMG, PCR y VSG elevados y los anticuerpos ANA y anti Mi-2 positivos confirman una dermatomiositis con afectación cutánea, muscular y esofágica. Aunque la CK indica el grado de actividad de la enfermedad, hay casos aislados como este de DM activa con CK normal2,4. Además, poseer anticuerpos anti Mi-2 positivos es poco frecuente (5-30%) en las DM con afección cutánea, lo cual le da un valor de singularidad al caso4.
El objetivo del tratamiento es eliminar la inflamación para prevenir el daño muscular, recuperar la fuerza y evitar la alteración de otros órganos reduciendo así la morbilidad y mejorando por tanto la calidad de vida.
El tratamiento de primera línea34 consiste en prednisona 0,5-1 mg/Kg/día (máximo 80 mg/día) 2-4 semanas asociado o no a metotrexato 15 mg/semana (máximo 25 mg/semana) o a azatioprina 0,5-3,0 mg/Kg/día . La dosis óptima de azatioprina se determina según niveles de tiopurina metiltransferasa (TPmT). Se descarta utilizar metotrexato ya que por la edad, se podría favorecer el riesgo de toxicidad requiriendo una estrecha monitorización7. Dado que azatioprina se considera de elección si hay disfunción esofágica severa8, se inicia con 50 mg /24h y se monitoriza la TPmT que es de 17,5 U/mL [13,818]. Esto supone una dosis recomendada de 1,5 mg/Kg/ día (100 mg/24h). La afectación esofágica y la debilidad muscular hacen que para frenar la sintomatología, se sume a la terapia con azatioprina, 3 días de pulsos de metilprednisolona 500 mg IV3,8. Al observar hepatotoxicidad al séptimo día de tomar azatioprina, se suspende por estar descrita esta reacción adversa7 (aunque en menos del 1% de casos) y por no presentar ningún otro factor que pueda haber influido en su aparición. De hecho, el deterioro hepático agudo revierte con normalización de las enzimas hepáticas a los 20 días de suspender el fármaco. Dentro de las alternativas de segunda línea (inmunoglobulina IV 1 g /Kg x 1-2 días/mes durante 1-6 meses o micofenolato hasta 1 g /12h), se opta por micofenolato fundamentalmente por la opción de la vía oral y por carecer de efectos tóxicos significativos a nivel hepático y renal. Otros fármacos con menor experiencia de uso son: ciclofosfamida, rituximab, ciclosporina o tacrolimus3,4,5,6. Se requieren de 3 a 6 meses para valorar la eficacia plena del tratamiento3. Por lo tanto se puede afirmar que, a los 5 meses de terapia, micofenolato 1 g /12h más prednisona 7,5 mg /24h son eficaces ya que la paciente presenta recuperación de la fuerza muscular (deambula), desaparición de la dermatitis, mejora de la disfagia y valores de PCR y VSG normalizados.
Es un caso clínico de una enfermedad rara que expresa anticuerpos anti Mi-2, disfagia y miopatía confirmada con CK permanentemente normal descrito en casos aislados de DM activa2,4. Además, la hepatotoxicidad provocada por azatioprina a los 7 días de tratamiento sin haber alcanzado la dosis óptima y la respuesta adecuada a la terapia de segunda línea (micofenolato asociado a prednisona a dosis bajas), le dan un carácter singular al mismo.
A. Martiarena1, M. Aldamiz-Echebarria2, C. Martínez1 y J. J. García1
1Servicio de Farmacia. 2Servicio de Medicina Interna.
Hospital Universitario Araba (Sede Txagorritxu). Vitoria-Gasteiz. España.
Bibliografía
1. Jacobson DL, Gange SJ, Rose NR, Graham NMH. Epidemiology and estimated population burden of selected autoimmune diseases in the United States. Clin Immunol Immunopathol. 1997;84(3):223-43. [ Links ]
2. Dalakas MC, Hohlfeld R. Polymyositis and dermatomyositis. Lancet. 2003;362:971-82. [ Links ]
3. Floranne C, Ernste MD, Reed AM. Idiopathic inflammatory myopathies: current trends in pathogenesis, clinical features, and up-to-date treatment recommendations. Mayo Clin Proc. 2013;88(1):88-105. [ Links ]
4. Lazarou IN, Guerne PA. Classification, diagnosis, and management of idiopathic ionflammatory myopathies. J Rheumatol. 2013;40(5):550-64. [ Links ]
5. Schiopu E, Phillips K, MacDonald PM, Crofford LJ, Somers EC. Predictors of survival in a cohort of patients with polymyositis and dermatomyositis: effect of corticosteroids, methotrexate and azathioprine. Arthritis Res Ther. 2012;14(1):R22. [ Links ]
6. Pisoni CN, Cuadrado MJ, Khamashta MA, Hughes GR, D'Cruz DP. Mycophenolate mofetil treatment in resistant myositis. Rheumatology (Oxford). 2007;46(3):516-8. [ Links ]
7. Fichas técnicas Metotrexato Wyeth y Cellcept. Agencia Española del Medicamento (consultado Enero 2014). Disponible en: http://www.agemed.es [ Links ]
8. Uptodate Criterio de búsqueda: treatment of dermatomyositis in adults (consultado Enero 2014). Disponible en: http://www.uptodate.com [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: amaiamarti@hotmail.com
(Amaia Martiarena Ayestaran).
Recibido el 24 de febrero de 2014;
aceptado el 17 de septiembre de 2014.