Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.41 no.2 Toledo Mar./Abr. 2017
https://dx.doi.org/10.7399/fh.2017.41.2.10534
Originales
Monitorización terapéutico del tacrolimus en pacientes pediátricos trasplantados sujetos a conversión de marcas comerciales
1Clinical Pharmacokinetics Department, J.P. Garrahan Children’s Hospital, Buenos Aires. Argentina
2Drug Monitoring Laboratory, J.P. Garrahan Children’s Hospital, Buenos Aires. Argentina
3Liver Transplant Unit, J.P. Garrahan Children’s Hospital, Buenos Aires. Argentina
4Kidney Transplant Unit, J.P. Garrahan Children’s Hospital, Buenos Aires. Argentina
5Hematopoietic Stem Cell Transplant Unit, J.P. Garrahan Children’s Hospital, Buenos Aires. Argentina
6Intensive Care Unit 35, J.P. Garrahan Children’s Hospital, Buenos Aires. Argentina
7National Scientific and Technological Research Council (CONICET). Argentina.
Objetivo:
La monitorización terapéutica durante el intercambio de marcas comerciales de inmunosupresores es esencial para mantener una similar exposición al fármaco en pacientes trasplantados. Sin embargo, la información disponible en trasplante pediátrico es limitada. El objetivo del trabajo fue evaluar la exposición, seguridad y eficacia en pacientes pediátricos trasplantados en etapa de mantenimiento, sujetos a intercambio entre el producto innovador y el genérico de tacrolimus.
Método:
El Área de Farmacia del hospital detectó aquellos pacientes sujetos a intercambio de formulaciones según la disponibilidad de medicamentos. Se obtuvieron las concentraciones de tacrolimus en el valle (C0), parámetros de laboratorio y características clínicas antes y después del intercambio. El análisis estadístico se realizó mediante el test de muestras pareadas de Wilcoxon.
Resultados:
Se incluyeron 10 pacientes con trasplante renal, hepático, cardíaco y de células hematopoyéticas. La mediana (rango) del C0 normalizado por la dosis pre y post intercambio fue 74,8((ng/ml)/(mg/kg))(13,8-518,4) y 65,1((ng/ml)/(mg/kg)) (13,5-723,5), respectivamente (p>0,05). La dosis de tacrolimus fue 0,070(mg/kg) (0,024-0,461) y 0,069(mg/kg) (0,017-0,571) para el innovador y el genérico, respectivamente (p>0,05). Los parámetros de laboratorio de funcionalidad renal y hepática no cambiaron con la conversión de marcas (p>0,05). No se observaron eventos adversos, rechazo agudo, muerte o pérdida del injerto durante el periodo analizado.
Conclusiones:
En la población estudiada, no se observaron diferencias significativas en los parámetros de laboratorio, exposición al tacrolimus o dosis en el intercambio de marcas comerciales. Destacamos el rol de la monitorización terapéutica a la hora de garantizar una sustitución segura, especialmente en poblaciones vulnerables.
PALABRAS CLAVE: Trasplante de órgano; Tacrolimus; Medicamentos genéricos; Pediatría; Monitorización terapéutica de fármacos
Introducción
El tacrolimus es ampliamente utilizado para controlar la respuesta inmune en pacientes pediátricos con trasplante y prevenir el rechazo del órgano1. La farmacocinética del tacrolimus se caracteriza por la amplia variabilidad inter e intraindividual, un estrecho margen terapéutico, y una documentada relación entre las concentraciones sanguíneas del fármaco y su eficacia y seguridad1. Consecuentemente, el monitoreo terapéutico de tacrolimus es fundamental en la rutina clínica del paciente trasplantado contribuyendo a disminuir la probabilidad de rechazo y el desarrollo de eventos adversos1,2.
El niño experimenta cambios fisiológicos durante su crecimiento incluyendo la maduración del sistema gastrointestinal y por ende se observan cambios temporales en la absorción y el metabolismo de fármacos lo cual repercute en la eficacia y seguridad3. Por ello, es muy importante estudiar y caracterizar las fuentes de variabilidad en la exposición del fármaco para así ajustar el esquema terapéutico en la población pediátrica, la cual está muy poco estudiada, y más aún durante el desarrollo de una nueva formulación o comercialización de un medicamento genérico4,5.
Los medicamentos genéricos de inmunosupresores están ampliamente distribuidos en el mercado porque representan una estrategia de reducción de costos, especialmente en países en desarrollo6,7. Incluso, en Estados Unidos los medicamentos genéricos de tacrolimus han ganado mercado extensamente8. La consolidación del mercado de genéricos ha generado controversias entre profesionales de la salud en cuanto a cuáles son los estudios necesarios para aprobarlos. Las principales agencias regulatorias exigen la realización de estudios de bioequivalencia para la comercialización del medicamento genérico. Estos estudios farmacocinéticos, al realizarse sólo en voluntarios sanos, generan inquietudes acerca de la eficacia esperada y el patrón de eventos adversos en pacientes trasplantados4,9,10. Específicamente, ha surgido un debate intenso acerca de la biodisponibilidad de las distintas marcas comerciales en pacientes alegando la alteración de las propiedades fisicoquímicas del fármaco según los excipientes utilizados o incluso, interacciones fármaco-paciente no observadas en los estudios de bioequivalencia realizados en voluntarios sanos4,10. A pesar de las opiniones encontradas, la realidad de la comercialización de los medicamentos genéricos impacta en la rutina del paciente y es fundamental generar evidencia científica al respecto.
Existen distintas publicaciones de posicionamiento y guías que proponen las acciones a realizar en el caso de la sustitución de marcas de fármacos inmunosupresores en pacientes trasplantados4,5,9. En líneas generales, se recomienda el monitoreo cercano de los pacientes sujetos a sustitución entre marcas para asegurar que la exposi ción sistémica del tacrolimus se mantiene acorde a las concentraciones sanguíneas preconversión en las cuales se ha estabilizado al paciente en mantenimiento4,9. Sin embargo, los reportes publicados provienen principalmente de pacientes adultos y hay escasa información disponible en pediatría8,11-17.
Así, el objetivo del presente trabajo fue evaluar la dosis, exposición sanguínea, seguridad y eficacia durante la conversión desde la marca innovadora a la genérica de tacrolimus en una población pediátrica trasplantada en etapa de mantenimiento.
Métodos
El desarrollo e implementación del presente estudio fue aprobado por el Comité de Ética Institucional del Hospital de Pediatría JP Garrahan (Protocolo #670). Se han seguido los protocolos establecidos por el centro sanitario (Formulario 1418F62) para acceder a los datos de las historias clínicas a los fines de poder realizar este tipo de publicación con finalidad de investigación/divulgación para la comunidad científica.
Tratamiento, criterios de inclusión y exclusión
El presente es un estudio retrospectivo, observacional, realizado entre los meses de abril y agosto de 2013 por el Área de Farmacia del Hospital de Pediatría J.P Garrahan (Buenos Aires, Argentina). En dicho periodo, la Farmacia comenzó a dispensar tacrolimus genérico (laboratorio Sandoz) acorde a la provisión del Programa Nacional implementado por el Instituto Nacional Central Único Coordinador de Ablación e Implante, Ministerio de Salud, Argentina.
Los pacientes incluidos, internados o ambulatorios, que recibían una dosis estable del medicamento innovador (Prograf®, laboratorio Astellas Irlanda) fueron sujetos a intercambio al medicamento genérico (laboratorio Sandoz Private Limited, India) bajo supervisión médica y de enfermería (Tabla 1). Durante el periodo de conversión, el Área de Farmacia dispuso de registros internos confiables sobre la marca comercial que recibían individualmente los pacientes y la fecha asociada.
El intercambio entre marcas se realizó administrando la misma dosis de mantenimiento al convertir al producto genérico. La dosis del medicamento genérico se ajustó según el criterio del médico para mantener la concentración valle (C0, 12 horas post-administración) de tacrolimus dentro del margen terapéutico establecido en consensos internacionales18. Específicamente, en trasplantados hepáticos éste fue entre 5 y 8ng/ml19, en renales entre 5 y 7ng/ml18,20, en cardíacos entre 8 y 12ng/ml luego de 3-6 meses post-trasplante o entre 5 y 10 ng/ml para pacientes con >6 meses post-trasplante21. En trasplantados de células progenitoras hematopoyéticas (CPH) las concentraciones C0 objetivo fueron entre 5 y 15 ng/ml.
Esquema terapéutico de inmunosupresión
El régimen de inmunosupresión consistió en la administración de tacrolimus como fármaco único o en combinación con esteroides (0.06-1 mg/kg/día), micofenolato mofetilo o sirolimus21,22. En pacientes trasplantados CPH se utilizó metotrexato en periodos cortos del régimen de intensificación (10 mg/m2, durante 4 días).
Cuantificación de tacrolimus en sangre
Las concentraciones de tacrolimus se cuantificaron en sangre entera por inmunología automática de quimioluminiscencia microparticulada (Architect®, Abbott, Chicago, Estados Unidos).
La aceptación del ensayo se realizó según procedimientos operativos estándar del Hospital basados en valores de controles externos de calidad (Bio-Rad Lyphochek® Whole Blood Immunosuppressant), la imprecisión del método (< 7% CV) y la desviación de los controles requerida es menos de 2 veces el desvío estándar.
Ejemplares externos e internos fueron evaluados de forma rutinaria como parte de un programa internacional de ensayos de aptitud para el control de calidad de la técnica analítica (http://www.bioanalytics.co.uk.
Monitoreo de pacientes y recolección de datos clínicos
De los pacientes incluidos se obtuvieron los siguientes parámetros demográficos y de laboratorio pre y post-intercambio de formulaciones de tacrolimus: peso corporal, dosis diaria y concentración sanguínea de tacrolimus en el valle (C0). La función hepática se analizó según concentraciones sanguíneas de las enzimas fosfatasa alcalina (FAL), gamma glutamil transpeptidasa (GGT),
aspartato aminotransferasa (AST) y alanino aminotransferasa (ALT). La función renal fue evaluada según las concentraciones de creatinina sérica y uremia. Asimismo se registraron los valores de hematocrito y albumina para evaluar posibles efectos sobre la fracción libre de tacrolimus23. Luego se calculó la mediana (rango) de los parámetros de laboratorio para cada periodo de estudio y se compararon según los valores normales reportados en literatura para pacientes pediátricos24.
Finalmente evaluamos la seguridad del tratamiento durante el periodo de seguimiento incluyendo el registro de los eventos adversos más frecuentes y serios acorde a nuestros reportes previos, que incluyen: hipertensión, nefrotoxicidad, neurotoxicidad, enfermedad linfoproliferativa post-trasplante, hipomagnesemia e hiperglucemia(22, 25). La eficacia se evaluó según la aparición de eventos de rechazo agudo, pérdida del injerto o muerte del paciente. Los episodios de rechazo se confirmaron por biopsia y se clasificaron según literatura internacional. En particular, para los pacientes con trasplante hepático y renal, el rechazo se confirmó por diagnóstico de biopsia y se registró según la clasificación de Banff 22. El rechazo agudo y la enfermedad injerto vs. huésped se diagnosticaron utilizando criterios clínicos y según biopsia , y se clasificó según el consenso del National Institutes of Health26 para pacientes con trasplante CPH. Los episodios de rechazo para pacientes trasplantados cardíacos se analizaron según el consenso de la Sociedad Internacional de Trasplante Cardíaco21,27.
Análisis estadístico
Se calculó la mediana de los valores de concentración sanguínea de tacrolimus en el valle normalizados por la dosis (CND) y la dosis corregida por el peso corporal previo y posterior al intercambio entre medicamentos innovador y genérico de tacrolimus.
El análisis estadístico se realizó utilizando el test de muestras pareadas de Wilcoxon (GraphPad Prism v.5). Se calculó el cociente individual entre la mediana de la CND del tratamiento con la formulación innovadora y de la genérica, esperando obtenerse un valor cercano a 1. Se consideró una variación mayor a la esperada, de obtenerse un valor superior al 25% en dicho cociente.
Esta hipótesis se basó en que la variabilidad intra-individual de los parámetros farmacocinéticos del tacrolimus previamente reportados fue entre 14 y 44% por lo que el valor de 25% se consideró como valor de referencia de variabilidad esperada1,28.
Resultados
Se identificaron 33 pacientes pediátricos trasplantados en el Hospital que intercambiaron marcas de tacrolimus de innovadora a genérica. Sin embargo, por criterios de inclusión, sólo permanecieron 10 pacientes para el presente análisis (Figura 1).
La mediana (rango) de edad y peso corporal fueron respectivamente 11,9 años (0,8-15,8) y 47,4 kg (7,3-77,0). Se incluyeron en el análisis igual cantidad de niños que de niñas y el tiempo mediana (rango) con el medicamento innovador fue de 32 días (10-140) mientras que el seguimiento luego de la conversión al medicamento genérico fue de 28 días (10-86) (Tabla 2). Los pacientes estudiados correspondieron a trasplantados hepáticos (n=4; 40%), renales (n=2; 20%), CPH (n=2; 20%) y cardíacos (n=2; 20%).
Tabla 2 Características demográficas de la población incluida
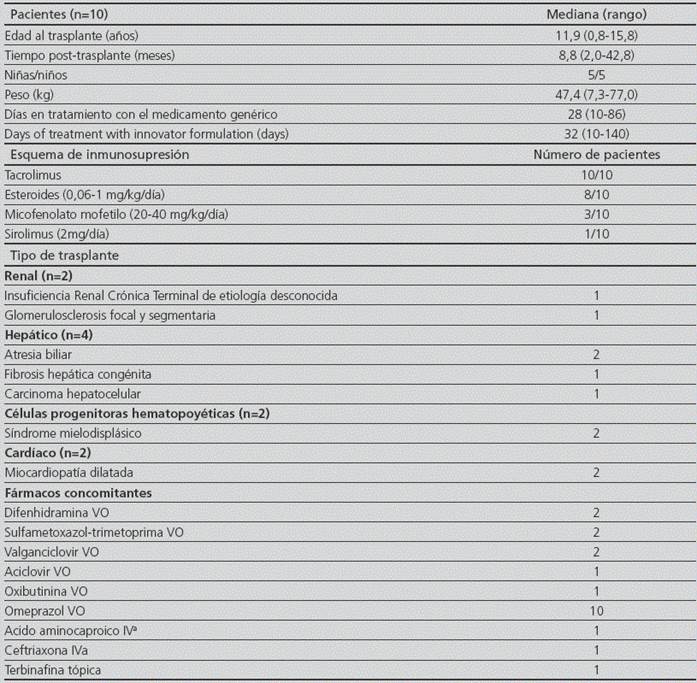
VO: vía oral, IV: vía intravenosa.
a: sospecha de infección respiratoria
La mediana (rango) de la dosis administrada por día corregida por el peso corporal luego de administrar el medicamento innovador fue de 0,070 mg/kg (0,024-0,461) mientras que la misma fue de 0,069 mg/kg (0,017-0,571) con el medicamento genérico. No se observaron diferencias estadísticamente significativas en las dosis corregidas por el peso corporal al comparar entre medicamentos (p>0,05). Tampoco se requirieron ajustes de dosis post-conversión al medicamento genérico en ningún caso analizado.
Además, durante el periodo de estudio no se modificó el tratamiento con fármacos concomitantes excepto en el paciente #9 que recibió ácido aminocaproico para tratar una hemoptisis y el paciente #2 que recibió aciclovir para tratar un herpes zoster cutáneo.
La mediana (rango) del número de mediciones de CND obtenidos por paciente en el tiempo de seguimiento para el innovador y el genérico fue de 3 (2-13) y de 5 (1-8), respectivamente (p>0,05). Específicamente, la mediana de las CND calculada individualmente para cada paciente no mostró diferencias estadísticamente significativas al comparar entre medicamentos (p>0,05). En la Tabla 3 se detallan los cocientes individuales entre los CND para el innovador y el genérico. En dicha figura puede observarse que los valores individuales de los cocientes del CND estuvieron comprendidos entre 0,75 y 1,25 para el 80% de los pacientes analizados (Figura 2). El paciente #8 mostró un cociente de 0,72, muy cercano al valor de 0,75 previamente establecido en base a los reportes previos de variabilidad intraindividual en la farmacocinética de tacrolimus. Contrariamente, el #9 mostró un cociente de 1,5 lo cual indicaría que el C0 medio alcanzado post-administración del innovador es mayor al del genérico para igual dosis.
Tabla 3 Concentraciones sanguíneas de tacrolimus normalizadas por la dosis luego de la administración del medicamento innovador y genérico

Los datos se muestran como medianas (rango) de las concentraciones sanguíneas de tacrolimus normalizadas por la dosis por kilogramos de peso para el medicamento innovador y el genérico.
aSólo una concentración valle fue obtenida en ese periodo de evaluación. CND: concentración sanguínea de tacrolimus normalizada por la dosis ó C0/dosis, I: medicamento innovador, G: medicamento genérico.

Figura 2 Concentraciones sanguíneas valle normalizadas por la dosis: Relación entre las medianas de la formulación innovadora y la genérica en pacientes trasplantados pediátricos.
Los parámetros de laboratorio evaluados, que incluyeron la creatinina sérica, uremia, AST, ALT, GGT y FAL, no mostraron diferencias significativas al comparar valores previos y post intercambio de marcas (p>0,05; Figuras 2.A, 2.B, 2.C, 2.D, 2.E) así como tampoco se observó un cambio significativo en los valores del hematocrito y la albumina en sangre (Figura 3.F y 2.G; p>0,05). Sólo los pacientes #5 y #3 mostraron valores elevados de las enzimas hepáticas pero esto sucedió en ambos periodos de estudio.

Figura 3 Evaluación de los parámetros de laboratorio individuales pre y post intercambio entre marcas comerciales de tacrolimus.
Por último, no se registraron eventos adversos frecuentes o esperados durante el periodo inmediato previo o post intercambio de marcas, así como tampoco hubo episodios de rechazo agudo, pérdida del injerto o fallecimiento.
Discusión
El presente estudio realizado en pacientes pediátricos trasplantados en terapia inmunosupresora de mantenimiento, mostró que el intercambio entre medicamentos innovador y genérico de tacrolimus se realizó satisfactoriamente en el marco del monitoreo terapéutico individual desarrollado por el equipo clínico de un hospital pediátrico en Argentina. No observamos diferencias significativas en los valores de C0 normalizados por la dosis, al comparar el tratamiento con el medicamento innovador y el genérico. Asimismo, no se observaron cambios en los parámetros bioquímicos de laboratorio durante la conversión entre formulaciones ni el desarrollo de eventos adversos frecuentes a tacrolimus, episodios de rechazo o fallecimiento de pacientes durante el periodo de seguimiento.
El Programa Nacional de Procuración de Órganos en Argentina provee gratuitamente a los pacientes que lo requieran los medicamentos inmunosupresores que ganan la licitación pública cada año. Actualmente, en Argentina se comercializan dos marcas de tacrolimus, el innovador (Prograf®, Astellas Irlanda) y un genérico (Sandoz Private Limited, India). Las instituciones participantes del Programa Nacional de Procuración de Órganos, reciben y dispensan uno u otro medicamento según el resultado de la licitación. Este programa se encuentra bajo la órbita de la autoridad regulatoria sanitaria de Argentina (ANMAT, Administración Nacional de Medicamentos, Alimentos y Tecnología Médica, www.anmat. gov.ar) la cual requiere que las compañías farmacéuticas que solicitan el registro de ciertos productos incluyendo los que contienen fármacos inmunosupresores, demuestren su calidad tanto in vitro (perfiles de disolución), como in vivo (estudios de bioequivalencia). Los productos farmacéuticos del presente estudio son equivalentes farmacéuticos y bioequivalentes. Incluso, el medicamento genérico que recibieron nuestros pacientes mostró una farmacocinética similar al medicamento innovador, en cuanto a la comparación del área bajo la curva concentración versus tiempo, Cmax y C0, demostrada en estudios previos en pacientes adultos trasplantados renales16. Por ello, era esperable observar una similitud en la exposición sistémica al tacrolimus entre medicamentos evaluados en el presente estudio.
El análisis de los resultados obtenidos en este reporte demuestra que la falta de cambio de dosis para mantener las concentraciones sanguíneas dentro de los márgenes terapéuticos de tacrolimus, se correspondió con la similitud en sus C0 corregidos por la dosis previa y posterior al intercambio entre marcas comerciales. Incluso 8 de los 10 pacientes analizados mostraron un cociente entre las concentraciones normalizadas por la dosis de tacrolimus innovador y genérico dentro del rango (0,75-1,25) correspondiente con la variabilidad intraindividual esperada en la farmacocinética reportada para tacrolimus28. Si bien es deseable que los cocientes entre dichas concentraciones normalizadas para el medicamento innovador y genérico sean cercanos al valor unitario, la variabilidad intraindividual en la farmacocinética del fármaco repercute en dicho cociente. Esta variabilidad debe tenerse en cuenta para no asignar erróneamente cambios en la exposición sistémica a una marca comercial cuando el fármaco per se varía en la exposición sistémica en un mismo paciente evaluado a repetición. Por ello, asumimos una variabilidad en los cocientes de las concentraciones normalizadas de hasta 25% como un valor esperable y aceptable según reportes previos18,28. Cabe señalar que un paciente mostró una variación mayor al 25% (#9) en dicho cociente, habiendo desarrollado un episodio de hemoptisis que se prolongó durante el intercambio al medicamento genérico. Así, la existencia de un cambio hemodinámico en éste paciente secundario al evento clínico puede haber influido en la variabilidad farmacocinética del tacrolimus.
Nuestros resultados son similares a los reportados en el único estudio realizado en pacientes pediátricos, específicamente sujetos a trasplante cardíaco8. En éste último estudio se evaluó retrospectivamente las concentraciones C0 de tacrolimus previo y posterior al intercambio de marcas comerciales. Se incluyeron en el análisis 12 pacientes que fueron convertidos de la marca innovadora a la genérica y 31 pacientes que sólo recibieron tacrolimus de la marca innovadora como grupo control. En la primera cohorte, los autores reportaron una disminución del 14% en el C0 (equivalente a 1,15 ng/ml) al intercambiar por el medicamento genérico sin modificar la dosis de tacrolimus8. La implicancia clínica de una modificación del C0 en un 14% probablemente sea baja.
Incluso, los autores reportaron que luego de un año de realizado el intercambio de marcas, 24% de los pacientes sujetos a intercambio y 18% de los pacientes del grupo control, mostraron eventos de rechazo siendo ambos porcentajes similares. Tanto los parámetros de seguridad y eficacia como la exposición sistémica a tacrolimus en la situación de intercambio entre marcas comerciales, debe ser estudiada en una cohorte de pacientes más numerosa. Por otro lado, a nuestro entender, es importante evaluar y presentar los resultados no sólo de la población sino, la modificación individual del C0 durante el intercambio de marcas la cual puede verse enmascarada por el análisis poblacional expresado como los valores medios. En nuestro estudio sólo un paciente (#9) mostró una diferencia mayor al 25% en el C0 normalizado por la dosis luego de intercambiar al genérico y esto refuerza el concepto de la necesidad de monitoreo terapéutico principalmente en situaciones que puedan derivar en exposición inadecuada de fármaco.
La experiencia reportada en pacientes adultos con trasplante de órgano sólido sujetos a intercambio de marcas comerciales de medicamentos conteniendo tacrolimus, es en ciertos aspectos, controvertida. En el estudio retrospectivo reportado por Spence et al., se detalló la experiencia obtenida de la evaluación retrospectiva de 234 pacientes adultos en terapia inmunosupre sora de mantenimiento con trasplante renal, hepático y cardíaco sujetos a intercambio entre marcas comerciales de medicamentos conteniendo tacrolimus12. Los autores reportaron la falta de diferencias significativas en los valores de C0 de tacrolimus luego de realizar la interconversión del medicamento innovador a la misma marca de medicamento genérico que utilizamos en nuestro estudio12. Es importante destacar que el 15% de los pacientes requirió ajuste de dosis y esto se logró realizando el monitoreo terapéutico del fármaco. En cuanto a la seguridad y eficacia del intercambio, no se registraron muertes o rechazos agudos por sustitución entre marcas comerciales. En línea con dichos hallazgos, McDevvitt-Potter et al., reportaron su experiencia en 70 pacientes adultos con trasplante renal, hepático y multiorgánico sujetos a un estudio prospectivo de evaluación de modificación de dosis, exposición sistémica al fármaco y costos en la situación de interconversión entre marcas comerciales de tacrolimus11. Los autores no evidenciaron cambios significativos en los C0 de tacrolimus al intercambiar al genérico de la marca Sandoz así como tampoco en la dosis/día de tacrolimus11. Sin embargo, en el 21% de los pacientes sujetos a intercambio se debió ajustar la dosis a los requerimientos individuales luego del intercambio de marcas mientras que sólo fue necesario dicho ajuste en el 7% de los pacientes asignados al grupo control (quienes sólo recibieron medicamento innovador) siendo estadísticamente significativa la diferencia en los porcentajes. Nuevamente, se pone en evidencia la importancia del monitoreo terapéutico del tacrolimus en el manejo del paciente trasplantado. Por el contrario, los estudios reportados por Momper et al. y Marfo et al., realizados en pacientes adultos trasplantados renales y/o hepáticos, mostraron en ambos casos una diferencia significativa en los valores de C0 de tacrolimus al comparar los valores previo y posterior al intercambio de marcas13,17. Específicamente, en el estudio reportado por Momper et al., los investigadores reportaron una disminución del 15,9% y 11,9% en el C0 de tacrolimus corregida por la dosis en pacientes adultos con trasplante hepático y renal, respectivamente, al realizar el intercambio de marcas. Incluso, en un subgrupo de pacientes con trasplante hepático y renal que recibieron la misma dosis previamente y posterior al intercambio, mostraron una disminución media en el C0 de tacrolimus de 1,98 ng/ml y 0,87 ng/ ml, respectivamente. Sin embargo, éste cambio en la exposición sanguínea del fármaco inmunosupresor no mostró una relevancia clínica en cuanto a seguridad y eficacia al igual que lo descripto previamente en el caso de pacientes pediátricos. En correspondencia, el estudio retrospectivo realizado por Marfo et al. puso en evidencia una diferencia de 0,8 ng/ml en los niveles de C0 de tacrolimus antes y después del intercambio a la formulación genérica, en comparación al 0,9 ng/ml en el grupo control17. Del mismo modo, a pesar de describirse dichas diferencias en el C0, no se detectó una diferencia perceptible en la eficacia y seguridad de tacrolimus genérico en comparación con el producto de marca innovadora. En conjunto, los reportes previos principalmente en adultos muestran diferentes tipos de conclusiones. Sin embargo todos los autores enfatizan la necesidad de realizar monitoreo terapéutico del inmunosupresor en pacientes sujetos a interconversión entre marcas comerciales, para así abordar un esquema racional de sustitución entre marcas y asegurar la eficacia y seguridad individualmente.
En el presente trabajo evaluamos la función renal y hepática de los pacientes como parte de la evaluación de seguridad a través del seguimiento y evaluación de parámetros bioquímicos. Específicamente, los valores de las enzimas hepáticas como la creatinina sérica no sufrieron alteraciones post-conversión (p>0,05). Puntualmente, dos pacientes trasplantados hepáticos (pacientes #3 y #5, Figura 3) presentaron elevación sostenida y estable de ALP, GGT, AST Y ALT debido a una infección por CMV y drenaje de la vía biliar, respectivamente. Además, la albúmina plasmática y el hematocrito se midieron ya que influyen en la farmacocinética de tacrolimus. El tacrolimus se une ~99 % a las proteínas del plasma y los eritrocitos1. Así, un valor bajo de albuminemia o del hematocrito representa una mayor fracción libre de tacrolimus disponible para ser distribuido, metabolizado y eliminado. Estos factores, que pueden influir en la farmacocinética de tacrolimus durante la conversión, podrían representar una variable confusora en la evaluación de la exposición a tacrolimus1. No obstante, en nuestra población, los valores de hematocrito y albúmina no se modificaron por la conversión entre marcas (p>0,05). Cabe destacar que nuestros resultados son correspondientes con aquellos reportados previamente en pacientes pediátricos y adultos trasplantados cardíacos, renales, hepáticos y multiorgánico, en los cuales no se evidenciaron diferencias significativas en los parámetros de laboratorio8,12,13,17.
En base a registros propios publicados22, se evaluaron los eventos adversos más comunes y graves en la población pediátrica que recibió tacrolimus. Durante el período de seguimiento del presente estudio, no se observaron eventos adversos, pérdida del injerto, episodios de rechazo agudo o muertes. Por ello, consideramos que el intercambio entre marcas comerciales de tacrolimus resultó seguro para los pacientes evaluados a pesar de que enfatizamos que los resultados obtenidos deben ser validados en una cohorte externa con mayor número de pacientes.
El sistema de salud argentino incluye al sector privado y al público. Aproximadamente el 20% de los pacientes con trasplante de órgano sólido recibe fármacos inmunosupresores de su seguro privado en tanto que el 80% está cubierto por el gobierno nacional (INCUCAI, Instituto Nacional Central Único Coordinador de Ablación e Implante). Por lo tanto, el producto inmunosupresor que la mayoría de los pacientes argentinos recibe depende de la licitación ganadora establecida por el gobierno en llamados públicos. Ante esta situación de intercambio de marcas según la que sea adjudicada en la licitación, se pueden tomar distintas acciones para garantizar la in terconversión segura. En este sentido, las recomendaciones internacionales proponen realizar una estrecha monitorización terapéutica de inmunosupresores cuando se cambia de producto farmacéutico4,9. Para tal efecto, los valores C0 de tacrolimus, como un subrogante de la exposición sistémica, deben ser estrechamente monitorizados inmediatamente pre y post-intercambio. Los parámetros de laboratorio deben ser monitoreados como marcadores de seguridad4,9. Ante la aparentemente inevitable sustitución de marcas en nuestro país, nuestro grupo decidió realizar una interconversión segura y eficaz siguiendo recomendaciones internacionales, lo cual se presenta en este reporte.
Nuestro estudio padece de ciertas limitaciones. El análisis exploratorio fue basado en un diseño retrospectivo y descriptivo. Además, este análisis se realizó sobre una muestra de tamaño pequeño. En contraposición con poblaciones reportadas con trasplantes de un solo tipo, nuestro estudio incluye trasplantes pediátricos de hígado, corazón, riñón y de CPH. Cada paciente fue su propio control y mostramos que el monitoreo terapéutico es una herramienta útil y necesaria. En segundo lugar, este estudio utiliza los valores de C0 para evaluar la exposición a tacrolimus aunque el mejor parámetro de exposición es el área bajo la curva de concentración sanguínea vs. Tiempo29. Igualmente cabe señalar que existe una correlación lineal entre el área bajo la curva y la concentración C0 de tacrolimus, incluso reportada para el genérico utilizado en nuestro estudio30. Finalmente, el tiempo de seguimiento de los pacientes convertidos a la formulación genérica fue escaso. Por lo tanto, más estudios en grupos más numerosos y con un seguimiento a largo plazo podrían describir datos adicionales de eventos adversos y rechazo agudo, lo que puede tardar meses en manifestarse clínicamente en el marco de inmunosupresión subterapéutica.
En resumen, en el presente estudio se realizó un seguimiento terapéutico de tacrolimus según recomendaciones internacionales en una población pediátrica sujeta a conversión entre tacrolimus innovador y genérico comercializado en Argentina. Concluimos que la sustitución entre marcas de tacrolimus fue segura y no interfiere con la eficacia del tratamiento inmunosupresor en nuestra población durante el período de seguimiento, ni se observaron diferencias en la dosis, exposición y resultados clínicos. Destacamos el rol del monitoreo terapéutico en pacientes pediátricos trasplantados sujetos a sustitución de marcas comerciales de inmunosupresor para garantizar la seguridad y eficacia del tratamiento farmacológico.
References
Staatz CE, Tett SE. Clinical pharmacokinetics and pharmacodynamics of tacrolimus in solid organ transplantation. Clinical pharmacokinetics. 2004;43(10):623-53. [ Links ]
Larkins N, Matsell DG. Tacrolimus therapeutic drug monitoring and pediatric renal transplant graft outcomes. Pediatric transplantation. 2014 Dec;18(8):803-9. [ Links ]
Kearns GL, Abdel-Rahman SM, Alander SW, Blowey DL, Leeder JS, Kauffman RE. Developmental pharmacology-drug disposition, action, and therapy in infants and children. N Engl J Med. 2003 Sep 18;349(12):1157-67. [ Links ]
Harrison JJ, Schiff JR, Coursol CJ, Daley CJ, Dipchand AI, Heywood NM, et al. Generic immunosuppression in solid organ transplantation: a Canadian perspective. Transplantation. 2012 Apr 15;93(7):657-65. [ Links ]
Uber PA, Ross HJ, Zuckermann AO, Sweet SC, Corris PA, McNeil K, et al. Generic drug immunosuppression in thoracic transplantation: an ISHLT educational advisory. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 2009 Jul;28(7):655-60. [ Links ]
Tobar F. Economía de los medicamentos genéricos en América Latina. Revista Panamericana de Salud Pública. 2008;23(1):59-67. [ Links ]
Sudhindran S, Aboobacker S, Menon RN, Unnikrishnan G, Sudheer OV, Dhar P. Cost and efficacy of immunosuppression using generic products following living donor liver transplantation in India. Indian journal of gastroenterology: official journal of the Indian Society of Gastroenterology. 2012;31(1):20-3. [ Links ]
Duong SQ, Lal AK, Joshi R, Feingold B, Venkataramanan R. Transition from brand to generic tacrolimus is associated with a decrease in trough blood concentration in pediatric heart transplant recipients. Pediatric transplantation. 2015 Dec;19(8):911-7. PubMed PMID: 26497983. [ Links ]
van Gelder T, Substitution EACoG. European Society for Organ Transplantation Advisory Committee recommendations on generic substitution of immunosuppressive drugs. Transplant international: official journal of the European Society for Organ Transplantation. 2011 Dec;24(12):1135-41. [ Links ]
van Gelder T. What Is the Future of Generics in Transplantation? Transplantation. 2015 Nov;99(11):2269-73. PubMed PMID: 26050017. [ Links ]
Alloway RR, Sadaka B, Trofe-Clark J, Wiland A, Bloom RD. A randomized pharmacokinetic study of generic tacrolimus versus reference tacrolimus in kidney transplant recipients. American journal of transplantation: official journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 2012 Oct;12(10):2825-31. [ Links ]
McDevitt-Potter LM, Sadaka B, Tichy EM, Rogers CC, Gabardi S. A multicenter experience with generic tacrolimus conversion. Transplantation. 2011;92(6):653-7. [ Links ]
Spence MM, Nguyen LM, Hui RL, Chan J. Evaluation of clinical and safety outcomes associated with conversion from brand-name to generic tacrolimus in transplant recipients enrolled in an integrated health care system. Pharmacotherapy. 2012;32(11):981-7. [ Links ]
Momper JD, Ridenour TA, Schonder KS, Shapiro R, Humar A, Venkataramanan R. The impact of conversion from Prograf to generic tacrolimus in liver and kidney transplant recipients with stable graft function. American journal of transplantation: official journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 2011;11(9):1861-7. [ Links ]
Madian AG, Panigrahi A, Perera MA, Pinto N. Case report: Inability to achieve a therapeutic dose of tacrolimus in a pediatric allogeneic stem cell transplant patient after generic substitution. BMC Pharmacol Toxicol. 2014;15:69. [ Links ]
Abdulnour HA, Araya CE, Dharnidharka VR. Comparison of generic tacrolimus and Prograf drug levels in a pediatric kidney transplant program: brief communication. Pediatric transplantation. 2010 Dec;14(8):1007-11. [ Links ]
Marfo K, Aitken S, Akalin E. Clinical outcomes after conversion from brand-name tacrolimus (prograf) to a generic formulation in renal transplant recipients: a retrospective cohort study. P T. 2013 Aug;38(8):484-8. PubMed PMID: 24222980. Pubmed Central PMCID: 3814440. [ Links ]
Monchaud C, Marquet P. Pharmacokinetic optimization of immunosuppressive therapy in thoracic transplantation: part I. Clinical pharmacokinetics. 2009;48(7):419-62. PubMed PMID: 19691367. Pubmed Central PMCID: 3678153. [ Links ]
Reding R, Gras J, Sokal E, Otte JB, Davies HF. Steroid-free liver transplantation in children. Lancet. 2003 Dec 20;362(9401):2068-70. PubMed PMID: 14697809. [ Links ]
Wallemacq P, Armstrong VW, Brunet M, Haufroid V, Holt DW, Johnston A, et al. Opportunities to optimize tacrolimus therapy in solid organ transplantation: report of the European consensus conference. Ther Drug Monit. 2009 Apr;31(2):139-52. PubMed PMID: 19177031. [ Links ]
Costanzo MR, Dipchand A, Starling R, Anderson A, Chan M, Desai S, et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 2010 Aug;29(8):914-56. PubMed PMID: 20643330. [ Links ]
Riva N, Caceres Guido P, Rousseau M, Dip M, Monteverde M, Imventarza O, et al. Pharmacovigilance of calcineurin inhibitor in peidatric kidney and liver transplantation. Farmacia hospitalaria: organo oficial de expresion cientifica de la Sociedad Espanola de Farmacia Hospitalaria. 2013 Nov-Dec;37(6):441-9. PubMed PMID: 24256007. Farmacovigilancia de inhibidores de calcineurina en trasplante renal y hepatico pediatrico. [ Links ]
Kim IW, Noh H, Ji E, Han N, Hong SH, Ha J, et al. Identification of factors affecting tacrolimus level and 5-year clinical outcome in kidney transplant patients. Basic Clin Pharmacol Toxicol. 2012 Oct;111(4):217-23. PubMed PMID: 22469198. [ Links ]
Taketomo CK, Hodding JH, Kraus DM, Cotera GE, Soberanis CP, Ortiz ML. Manual de prescripción pediátrica y neonatal. Intersistemas; 2012. [ Links ]
Micromedex-Solutions. Tacrolimus 2016 (cited 2016). Available from: http://www.micromedexsolutions.com. [ Links ]
Carpenter PA, Macmillan ML. Management of acute graft-versus-host disease in children. Pediatric clinics of North America. 2010 Feb;57(1):273-95. PubMed PMID: 20307721. Pubmed Central PMCID: 3227683. [ Links ]
Stewart S, Winters GL, Fishbein MC, Tazelaar HD, Kobashigawa J, Abrams J, et al. Revision of the 1990 working formulation for the standardization of nomenclature in the diagnosis of heart rejection. The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. 2005 Nov;24(11):1710-20. PubMed PMID: 16297770. [ Links ]
Ihara H, Shinkuma D, Ichikawa Y, Nojima M, Nagano S, Ikoma F. Intra- and interindividual variation in the pharmacokinetics of tacrolimus (FK506) in kidney transplant recipients-importance of trough level as a practical indicator. Int J Urol. 1995 Jul;2(3):151-5. PubMed PMID: 8536129. [ Links ]
Marquet P. Counterpoint: Is pharmacokinetic or pharmacodynamic monitoring of calcineurin inhibition therapy necessary? Clinical chemistry. 2010 May;56(5):736-9. PubMed PMID: 20224048. [ Links ]
Connor A, Prowse A, MacPhee I, Rowe PA. Generic tacrolimus in renal transplantation: trough blood concentration as a surrogate for drug exposure. Transplantation. 2012 Jun 27;93(12):e45-6. PubMed PMID: 23318306. [ Links ]
Recibido: 07 de Junio de 2016; Aprobado: 27 de Octubre de 2016











 texto em
texto em 




