Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.42 no.2 Toledo mar./abr. 2018
https://dx.doi.org/10.7399/fh.10807
REVISIÓN
Revisión crítica de la oritavancina en infecciones de la piel y tejidos blandos
1Servicio de Farmacia, Hospital Universitario y Politécnico La Fe, Valencia. Spain.
2Servicio de Farmacia, Hospital La Mancha Centro, Alcázar de San Juan, Ciudad Real. Spain.
3Servicio de Farmacia, Hospital Regional Universitario Carlos Haya, Málaga. Spain.
4Servicio de Farmacia, UGC Farmacia, AGS Norte de Cádiz, Cádiz. Spain.
Introducción
El concepto actual de infección bacteriana aguda de la piel y tejidos blandos (IPTB) (traducción del inglés: Acute Bacterial Skin and Skin Structure Infections (ABSSSI)), engloba según la Food and Drug Administration (FDA)1 todas aquellas infecciones con lesiones de una superficie mínima de 75 cm2 que estén incluidas en una de las siguientes categorías: celulitis/erisipelas, infecciones de heridas y abscesos cutáneos mayores. La Agencia Europea de Medicamentos (EMA)2,3, recomienda, además, para la evaluación de la gravedad de la infección, la presencia de signos o síntomas asociados a un curso agudo del proceso infeccioso.
Dada la variable presentación de las IPTB y la frecuencia de episodios recurrentes, una estimación de su incidencia y prevalencia es complicada. Se han realizado distintos estudios en EE. UU. que muestran un aumento de las mismas en los últimos años4-6. En España, dentro de las infecciones, las IPTB comparten el cuarto lugar con las infecciones gastrointestinales, mientras que en población seleccionada, como la anciana, pueden llegar a ser la segunda causa de infección. Las IPTB representan, según las series, entre un 0,66% y un 2,5% del total de infecciones7.
El tratamiento de las IPTB requiere un abordaje multidisciplinar que incluye tratamiento antibiótico y, en los casos necesarios, cirugía. El tratamiento antimicrobiano, muy heterogéneo y habitualmente empírico8,9, está condicionado por los microorganismos que colonizan la piel del área afectada, el lugar de adquisición de la infección (hospitalaria o comunitaria), la presentación clínica, los factores de riesgo, la administración previa de antibióticos y la epidemiología local de las resistencias a antimicrobianos10.
Aunque no hay un consenso generalizado sobre la terapia empírica para este tipo de infección, sí parece reconocido que uno de los tratamientos más adecuados, en los casos en los que no se sospecha la implicación de Staphylococcus aureus resistente a meticilina (SARM), son los beta-lactámicos11,12. Cuando se sospecha o hay evidencia de que la infección puede estar causada por SARM se recomienda alguno de los antimicrobianos que tienen actividad frente a este microorganismo. Hay publicaciones que resaltan la alta tasa de fracasos que se producen en las terapias antibióticas de primera línea13.
La base del tratamiento para las infecciones graves por SARM la han constituido hasta hace poco los glicopéptidos vancomicina y teicoplanina. Sin embargo, la preocupación por la eficacia y el desarrollo gradual de resistencias (las cepas SARM alcanzan 22,1% en nuestro país, superior a la media europea que se sitúa en 17,4%14) han provocado que se centre la atención en el desarrollo de nuevos agentes activos contra las bacterias Gram-positivas. Aquellos que se han autorizado para el tratamiento de IPTB son linezolid, tedizolid, daptomicina y tigeciclina.
La oritavancina no está autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) en el momento de la realización de este informe, pero sí por la EMA15 y por la FDA16 para el tratamiento de las IPTB en adultos. Su mecanismo de acción es triple: por un lado, produce inhibición de la etapa de transglucosilación y de la transpeptidación de la biosíntesis de la pared celular y además provoca una ruptura de la integridad de la membrana bacteriana17,18. Esto le confiere actividad contra microorganismos sensibles y resistentes a la vancomicina así como una rápida actividad bactericida, concentración dependiente, frente a bacterias Gram-positivas en crecimiento activo, en fase estacionaria y productoras de biofilm18.
El grupo GENESIS (Grupo de Evaluación de Novedades, Estandarización e Investigación en Selección de Medicamentos) de la Sociedad Española de Farmacia Hospitalaria (SEFH) dispone de un programa, MADRE, para la elaboración de informes de evaluación de medicamentos que han de ser presentados a las Comisiones de Farmacia y Terapéutica para la toma de decisiones sobre posicionamiento de los medicamentos en la terapéutica y la selección de los mismos en el abordaje terapéutico de los pacientes.
Este programa, MADRE, contiene los apartados correspondientes a los pilares básicos sobre los que se recomienda tomar estas decisiones de posicionamiento de los medicamentos: eficacia, seguridad y eficiencia. Este último apartado incluye los costes, la evaluación económica y el impacto presupuestario.
El objetivo de este trabajo es, por tanto, la evaluación crítica de la oritavancina de acuerdo con la metodología de este grupo de trabajo.
Métodos
Se realizó una revisión exhaustiva de la oritavancina en IPTB según el programa MADRE 4.0 del grupo GENESIS (Grupo de Evaluación de Novedades, Estandarización e Investigación en Selección de Medicamentos) de la Sociedad Española de Farmacia Hospitalaria (SEFH)19.
Según este programa, para la eficacia y seguridad, se realizó una búsqueda en la herramienta Clinical Queries de PubMed, con las siguientes palabras: “oritavancin AND phase III”, en el campo “narrow” y otra búsqueda con “oritavancin AND trial”, en el campo “narrow”. Se lleva a cabo una búsqueda en la página www.clinicaltrials.gov con las palabras “oritavancin”.
También se utilizan el informe EPAR de la EMA (2015) y el informe CDER de la FDA (2014). En los mismos se describen dos ensayos pivotales fase III y un ensayo fase II (en el informe CDER también se mencionan dos ensayos clínicos pivotales fase III que fueron descritos en el informe CDER del año 2008).
También se llevó a cabo una búsqueda en PubMed y Embase con el descriptor “oritavancin” que se limitó a “systematic reviews” OR “meta-analysis.
Para la evaluación económica, se realizaron búsquedas en Pubmed y Embase con los descriptores “oritavancin” y “economic”. Los datos se analizaron de acuerdo con la Guía20.
Resultados
Con fecha de 16 de diciembre de 2015 se realizó una búsqueda en la herramienta Clinical Queries de PubMed, con las siguientes palabras: “oritavancin AND phase III”, en el campo “narrow”, no obteniéndose resultados. Con fecha de 16/12/2015 se realizó una búsqueda en la herramienta Clinical Queries de PubMed, con las siguientes palabras: “oritavancin AND trial”, en el campo “narrow”, obteniéndose cinco resultados: cuatro ensayos clínicos (2 fase III, 1 fase II y 1 fase I) y un artículo de opinión.
Con fecha de 15/12/2015 se lleva a cabo una búsqueda en la página www.clinicaltrials.gov con las palabras “oritavancin” y se obtuvieron 10 ensayos en adultos (dos de fase III conocidos como TMC-ORI-10-01 y TMC-ORI-10-02, uno de fase II denominado TAR-ORI-SD001 y siete de fase I), así como un ensayo en fase de reclutamiento en población pediátrica (fase I).
Se dispone de cuatro ensayos clínicos pivotales publicados y otro ensayo de interés. De los ensayos encontrados, dos comparan el fármaco evaluado con vancomicina más cefalexina, dos con vancomicina y uno con oritavancina a distintas dosis y frecuencias.
También se llevó a cabo una búsqueda en PubMed y Embase con el descriptor “oritavancin” que se limitó a “systematic reviews” OR “meta-analysis”. Se obtuvieron respectivamente siete y 21 resultados que, tras eliminar duplicados y artículos que no cumplían los criterios requeridos, quedaron reducidos a un único metaanálisis en red.
Para la evaluación económica, se llevó a cabo una búsqueda en Pubmed y Embase con los descriptores “oritavancin” and “economic”. Se obtuvieron cuatro artículos.
1. Eficacia
Se han analizado para llevar a cabo la evaluación tres ensayos clínicos. Otros ensayos no se han tenido en cuenta por haber sido evaluados en una anterior solicitud de comercialización (que la compañía decidió retirar al concluir el Comité de productos medicinales para uso humano de la EMA que no había suficiente evidencia para su uso), utilizar poblaciones de pacientes con un diagnóstico menos estricto de IPTB o utilizar dosis y frecuencias diferentes a las estudiadas en la actualidad.
En el informe EPAR de la EMA15 (2015) y en el informe CDER16 de la FDA (2014) se hace referencia a tres ensayos clínicos:
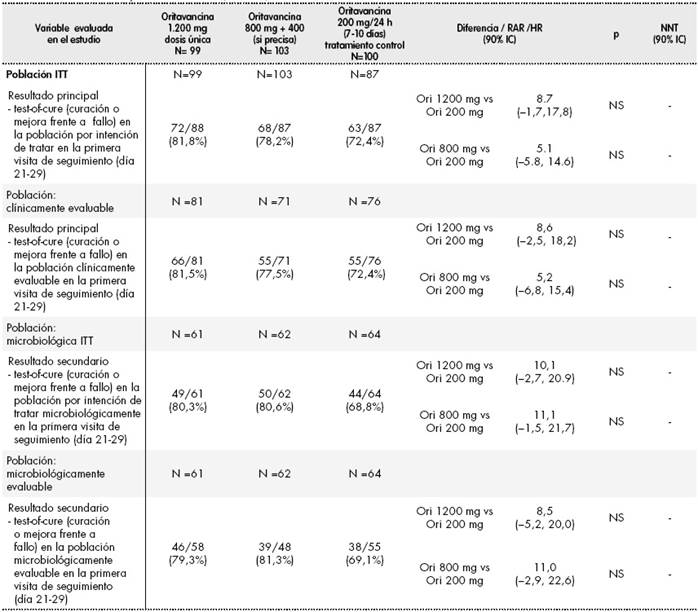
SIMPLIFI (TAR-ORI-SD001)21: estudio fase 2, multicéntrico, aleatorizado, doble ciego, de no inferioridad, paralelo y con comparador activo en pacientes con infección complicada de la piel y tejidos blandos ocasionada presunta o probadamente por patógenos Gram-positivos. Se incluyeron 311 pacientes y un total de 302 recibieron medicación del estudio: 100 pacientes en el grupo de dosis diaria de oritavancina (grupo control), 99 en el grupo de 1.200 mg dosis única y 103 en el grupo de 800 mg (+ 400 mg opcionales). Es un estudio de búsqueda de dosis que comparó tres dosificaciones distintas de oritavancina. Los resultados se muestran en la Tabla 1.
ENSAYOS SOLO I (TMC-ORI-10-01) Y SOLO II (TMC-ORI-10-02): son estudios pivotales que tienen el mismo diseño, fase III, multicéntricos, doble ciego, de no inferioridad, aleatorizados y que compararon una dosis única de 1.200 mg de oritavancina IV frente a vancomicina 1 g o 15 mg/kg/12 h durante 7-10 días. Los criterios de inclusión eran pacientes ≥ 18 años, con consentimiento informado, diagnóstico de IPTB con una superficie mínima de 75 cm2 y con sospecha o conocimiento de ser producida por un patógeno Gram-positivo que requiriera al menos siete días de terapia IV. Entre los criterios de exclusión destacaron: tratamiento previo sistémico o tópico con agentes que tuvieran actividad frente a patógenos Gram-positivos 14 días antes de la aleatorización, infecciones asociadas con dispositivos protésicos, sepsis grave o shock refractario, bacteriemia conocida o sospechada en el momento del screening, CD4 < 200 cels/μL en pacientes VIH, neutropenia con un recuento absoluto de neutrófilos (ANC) < 500 cels/μL, contraindicación de administración de vancomicina, pruebas de función hepática ≥ 3x límite superior de la normalidad (ULN) o bilirrubina total ≥ 2x ULN; presencia de hiperuricemia o artritis gotosa, o pacientes no dispuestos a abstenerse del uso crónico de cualquier medicación con propiedades antipiréticas.
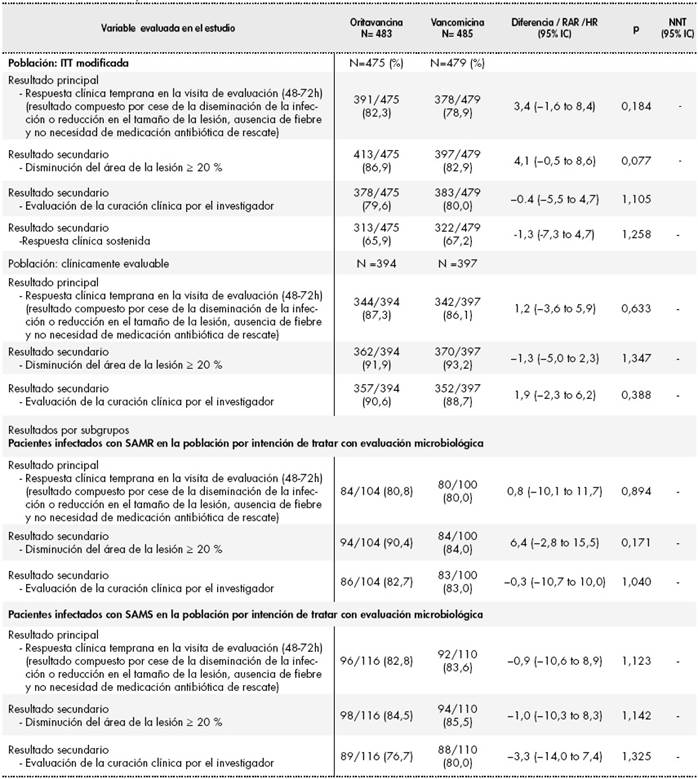
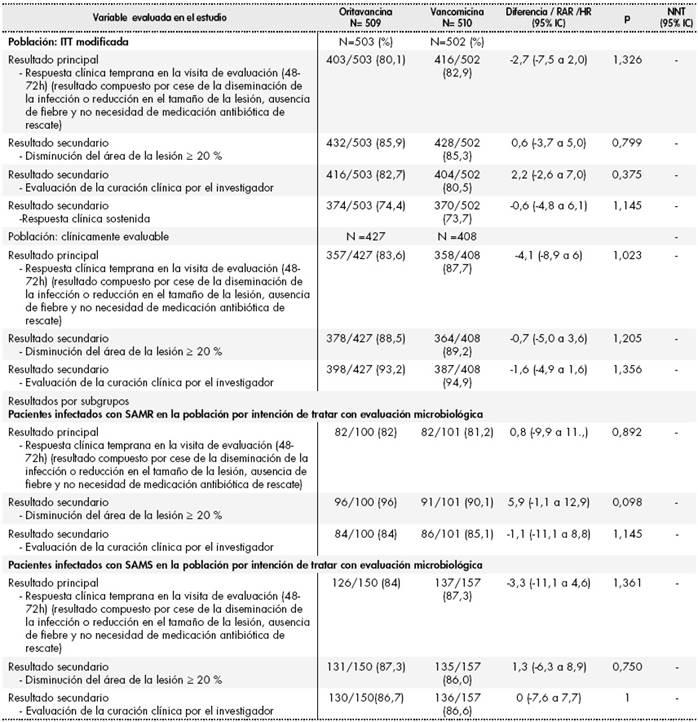
Los resultados de ambos estudios han sido publicados por Corey et al. en dos artículos22,23 y se resumen en las Tabla 2 y Tabla 3 respectivamente En cuanto a la validez de los ensayos clínicos, se ha analizado únicamente el riesgo de sesgo de los ensayos pivotales SOLO I y SOLO II, ya que el ensayo SIMPLIFI es un estudio de escalada y determinación de dosis.
Tabla 2 Resultados ensayo SOLO I22
ITT: intención de tratar; SAMS: Staphylococcus aureus sensible a meticilina; SAMR: Staphyloccocus aureus resistente a meticilina.
Tabla 3 Resultados ensayo SOLO II23
ITT: intención de tratar; SAMS: Staphylococcus aureus sensible a meticilina; SAMR: Staphyloccocus aureus resistente a meticilina.
Además, se dispone de una comparación indirecta publicada, en la que la “prueba de curación” (curación a 1-2 semanas de finalizado el tratamiento) combinada para la población clínicamente evaluable incluyó 14 tratamientos en 20 estudios. Solamente los estudios SOLO I y SOLO II fueron incluidos para evaluar la respuesta clínica temprana en la población clínicamente evaluable. La “prueba de curación” combinada para la población por intención de tratar según los estándares de la FDA incluyó cinco tratamientos en cuatro estudios, mientras que para población clínicamente evaluable incluyó ocho tratamientos en siete estudios. Como conclusiones de este metaanálisis en red, la oritavancina 1.200 mg se consideró equivalente a vancomicina. La evidencia indirecta también sugiere que la oritavancina 1.200 mg demuestra equivalencia con linezolid (OR 1,55; CrI 95% 0,91-2,57), teicoplanina (OR 0,72; CrI 95% 0,61-1,26), tedizolid (1,51; CrI 95% 0,82-2,73) y daptomicina (OR = 2,18; 95% CrI = 0,90-5,42)24.
2. Seguridad
En general, la oritavancina es un fármaco bien tolerado y con una toxicidad controlable. En los estudios realizados hasta la comercialización, los efectos adversos más frecuentes fueron náuseas, dolor de cabeza y vómitos y los más graves celulitis y osteomielitis22,23.
La base de datos de seguridad consistió en 3.017 pacientes tratados con oritavancina procedentes de 22 ensayos clínicos, incluyendo cuatro estudios fase III, cuatro fase II y 14 fase I. Los efectos adversos de interés en los ensayos SOLO que ocurrieron en mayor medida en el brazo de la oritavancina que en el de la vancomicina incluyeron fundamentalmente infección e infestación. Hubo 40 casos (4%) frente a 31 (3%) respectivamente. Estos casos incluyeron cuatro pacientes en el brazo de la oritavancina que desarrollaron osteomielitis (en la revisión posterior se propuso que podía ser por la falta de eficacia de la oritavancina en osteomielitis o por fallo de diagnóstico de os teomielitis al screening). Los casos de abscesos subcutáneos eran ligeramente más altos en el brazo de la oritavancina, lo que representa fallo de eficacia ya que la infección se produjo en el sitio de la infección índice. Los casos de celulitis estaban equilibrados en ambos brazos, lo que podría significar falta de eficacia, falta de incisión y drenaje oportunos para el control de la infección o infección recurrente debido a comorbilidades subyacentes.
Para los sujetos aleatorizados a cualquiera de los brazos la incidencia más alta de reacciones adversas relacionadas con la medicación (RARM) que llevaron a la interrupción del tratamiento fueron las Infecciones e infestaciones (1,6% frente a 1,9% respectivamente). Veintiún pacientes (2,2%) en el brazo de la oritavancina y 19 (1,9%) en el brazo de la vancomicina tuvieron un evento adverso (EA) grave que condujo a la interrupción del tratamiento. Los RARM más comunes tanto en los brazos de la oritavancina como de la vancomicina fueron náuseas (17,7% y 18,3%), cefalea (12,6% y 11,7%), vómitos (8,2% y 8,2%), diarrea (6,6% y 5,7%), celulitis (6,8% y 5,7%), estreñimiento (6% y 6,7%), y la extravasación en el sitio de infusión (6% y 5,9%). La incidencia en la elevación de ALT y AST, celulitis, abscesos, abscesos subcutáneos, la integridad física de abscesos e infección en las infecciones e infestación, taquicardia y mialgia fueron algo mayores en los pacientes tratados con oritavancina. Hubo 24 sujetos (4,4%) en el brazo de la oritavancina y 11 sujetos (1,9%) en el de la vancomicina en el conjunto de los ensayos SOLO (SOLO pool) con el evento adverso de taquicardia. No se pueden sacar conclusiones específicas de este análisis. Hubo 27 (2,8%) y 16 (1,6%) pacientes con ALT elevada en el brazo de oritavancina y vancomicina respectivamente. Hubo 18 (1,8%) y 16 (1,6%) pacientes con AST elevada en el brazo de oritavancina y vancomicina respectivamente. Aunque la historia de hepatitis o enfermedad hepática (9 sujetos) o el uso de drogas intravenosas (12 sujetos) podrían tener predispuesto a los sujetos a la elevación de las transaminasas, hubo sujetos sin tales antecedentes en la historia en los que se produjeron anomalías en las pruebas de función hepática. Los casos no parecen ser el resultado de sepsis grave o shock séptico. Ninguno de los sujetos cumplió los criterios de la ley de Hy25. Hubo ligeramente mayor incidencia de graves RARM en los sujetos diabéticos 23/138 (16,7%) en el brazo oritavancina versus 18/141 (12,8%) en el brazo de la vancomicina. Sin embargo, el número total de sujetos con más de un RARM fue similar en ambos grupos. En los sujetos con aclaramiento de creatinina de 30-60 ml/ min, 12/70 en el brazo de la oritavancina frente a 3/54 en el brazo de vancomicina, presentaron un efecto adverso grave.
En el conjunto de pacientes de los estudios SOLO I y II murieron cinco pacientes (dos en el brazo de la oritavancina y tres en el de la vancomicina). Hubo 5/302 (1,7%) muertes en el estudio SIMPLIFI (tres en el brazo de la oritavancina dosis diaria, dos en el brazo de dosis infrecuente y ninguna en el brazo de dosis única). Ninguna de las muertes parecía estar relacionada con el medicamento en investigación.
La oritavancina no requiere ajustes en pacientes con insuficiencia renal o hepática leve o moderada y no se ha investigado en pacientes pediátricos.
3. Área económica
Se dispone de cuatro estudios farmacoeconómicos publicados. De estos, tres son estudios de impacto presupuestario y uno un estudio de minimización de costes.
El estudio de Wu26 analizó un modelo teórico sobre el impacto económico que supondría la inclusión de oritavancina en un hospital de EE. UU. para el tratamiento de la IPTB. Diseñaron un modelo analítico de decisión basado en las actuales guías de práctica clínica, limitando el uso de la oritavancina a pacientes con IPTB moderada-grave (Clase II y III de Eron) con riesgo de SARM. El modelo simula una cohorte de 1.000 pacientes con IPTB. El caso base refleja la media de uso nacional de antibióticos activos frente a SARM (vancomicina 92%, linezolid 2%, daptomicina 6 %, oritavancina 0%). En el caso supuesto, se asume que la oritavancina será usada en el 25,75% de los pacientes (5% en pacientes ingresados, 15% en urgencias/ambulatorio y 80% en unidades de observación), desplazando a la vancomicina pero no al resto de antibióticos. Como resultado de ese cambio, menos pacientes fueron tratados ingresados y se incrementó el uso de las unidades de observación. Se tuvieron en cuenta costes directos: medicación, administración, monitorización, estancia y otros. De acuerdo con este modelo, el ahorro sería de 2.752 dólares por paciente. La mayoría del ahorro provendría de la reducción en el número de hospitalizaciones y la utilización en unidades de observación, más baratas que las unidades de hospitalización convencionales.
El estudio de Jensen27 analizó un modelo teórico sobre el impacto económico que supondría la inclusión de la oritavancina en un hospital de EE. UU. para el tratamiento de la IPTB idéntico al estudio anterior27, pero valoró dos supuestos: hospital con servicios ambulatorios y sin ellos. Como resultado, el uso de la oritavancina en el 26% de los pacientes, en lugar de vancomicina supondría un ahorro total del 13% desde la perspectiva hospitalaria o aproximadamente 1.235 dólares por paciente. En el modelo de impacto económico en un hospital sin servicios ambulatorios, el empleo de oritavancina en el 26% de los pacientes también supondría ahorro, aunque menor (un 9% o aproximadamente 634 dólares por paciente).
Otro estudio de Wu28 repitió el modelo de los dos estudios anteriores, pero aplicado a un hospital del Reino Unido. En este caso se asume que la oritavancina será usada en el 3,6% de los pacientes y se concluyó que su uso supondría un ahorro total del 0,63% desde la perspectiva hospitalaria o 29,23 libras por paciente.
El estudio de Lodise29 desarrolló un modelo de minimización de costes para comparar los costes de los pacientes en tratamiento con vancomicina ingresados frente a los de oritavancina administrada en régimen ambulatorio en pacientes con IPTB con pocas o ninguna comorbilidad (índice de comorbilidad de Charlson (CCI) 0 o 1). Los costes asociados al uso de la oritavancina en urgencias (3.409,46 dólares) y en la unidad de observación (4.220,27 dólares) eran inferiores a los de la vancomicina en los pacientes ingresados (5.972,73-9.885,33 dólares). Cambiar un paciente ingresado con vancomicina a paciente ambulatorio con oritavancina podría ahorrar 1.752,46 - 6.475,87 dólares dependiendo del CCI, presencia de síntomas sistémicos y del uso de la unidad de observación. Si todos los pacientes ingresados con vancomicina fueran tratados con oritavancina en urgencias, los ahorros por paciente podrían ser de 3.102,43 dólares. Asumiendo que algunos pacientes pueden ser admitidos en el hospital después del tratamiento con oritavancina en urgencias, se espera que el ahorro de oritavancina en la unidad de observación comparado con el tratamiento ingresado con vancomicina sea de 2.291,62 dólares.
Las limitaciones de estos estudios residen fundamentalmente en: a) la dificultad de extrapolar datos de modelos basados en datos de EE. UU. a nuestro país e incluso a Europa; b) la menor prevalencia de SARM en Europa; c) el menor impacto de los costes de hospitalización y administración de fármacos en España que en otros países; y d) la arriesgada asunción de que todos los pacientes tratados con oritavancina pueden serlo en el medio ambulatorio y los tratados con las alternativas (vancomicina, linezolid, teicoplanina, etc.) deben ser hospitalizados.
Se ha realizado una comparación propia de costes del tratamiento evaluado frente a las alternativas disponibles actualmente en España (Tabla 4). Dado que se trata de tratamientos equivalentes, no procede el análisis de coste-eficacia incremental y habría que ir a un análisis de minimización de costes, considerando a la oritavancina una alternativa terapéutica al resto de fármacos considerados para la indicación estudiada.
Tabla 4 Comparación de costes del tratamiento evaluado frente a otra/s alternativa/s
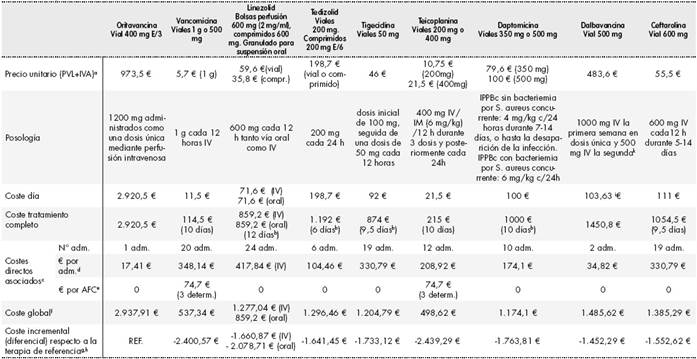
aSe ha tomado como precio para oritavancina el precio del tratamiento en EEUU (1 vial= 1035$ = 973,5€)
bDosis estimada de daptomicina para un paciente de 70-80 kg (6 mg/Kg).
cCostes directos asociados: Son costes que podemos considerar además del coste del medicamento estudiado. Por ejemplo otros medicamentos adicionales requeridos, pruebas de monitorización y laboratorio, pruebas de cribado (farmacogenética, biomarcadores…), material de infusión o manejo de complicaciones. Se tendrán en cuenta cuando sean relevantes.
dCoste de la administración de las dosis IV señaladas (de acuerdo con las tasas públicas de la Comunidad Valenciana, DOCV 5166 de 30.12.2005 actualizado a 24-5-2013, a las que se ha aplicado una tasa de descuento del 3% anual para su actualización a 2016).
eAFC = análisis farmacocinético. Coste de la monitorización de niveles plasmáticos (de acuerdo con las tasas públicas de la Comunidad Valenciana, DOCV 5166 de 30.12.2005 actualizado a 24-5-2013, a las que se ha aplicado una tasa de descuento del 3% anual para su actualización a 2016 = 24,9 € por determinación).
fSuma del coste del tratamiento completo + costes directos asociados.
gDiferencia de coste global respecto al fármaco evaluado
hNo se ha considerado el coste de la hospitalización porque se asume equivalente para todos los tratamientos.
iSe considera la duración del tratamiento de 14 días a efectos del coste por día.
kUn reciente ensayo (Dunne MW et al. Clin Infect Dis. (2015)doi: 10.1093/cid/civ982First published online: November 26, 2015) ha demostrado la no inferioridad entre la pauta habitual de dalbavancina (1000 mg IV + 500 mg IV a la semana siguiente) y la dosis única de 1500 mg. Dado que esta última pauta no se encuentra recogida en ficha técnica no se ha tenido en consideración en la tabla, pero la diferencia de costes se vería reducida en una administración, es decir, 17,41 € menos. PVL: Precio venta laboratorio; IM: intramuscular; IV: intravenoso; IPPBc. Infecciones complicadas de piel y partes blandas; adm: administraciones.
Con fecha 1 de septiembre de 2016, la oritavancina no se encontraba aprobado por la AEMPS, por lo que se ha utilizado para la evaluación económica el precio en EE. UU.: 1 vial 400 mg = 1.035 dólares = 973,5 euros.
Para la estimación del impacto económico global a nivel estatal, no se dispone de datos acerca de la prevalencia de la IPPB en España. Se sabe que en EE. UU. se producen 500 episodios por 10.000 personas y por año30. De acuerdo con el censo del Instituto Nacional de Estadística correspondiente al mes de enero de 2015, en España había 46.449.565 habitantes, lo que arrojaría, aplicando la prevalencia americana, una cifra de 2.322.478 episodios por año. Si tomamos el porcentaje de pacientes que necesitaron ser ingresados para tratamiento del EC SOLO I (19%)22, tendríamos 441.270 pacientes. Para una tasa de introducción de oritavancina del 2,5% anual (11.032 pacientes), el primer año tendríamos unos costes de 32.411.023 €.
Discusión
La oritavancina es un derivado semisintético del antibiótico glucopéptido cloroeremomicina que ha sido aprobado por la FDA y la EMA para el tratamiento de IPTB causada por bacterias Gram-positivas susceptibles. Este nuevo antibiótico lipoglicopéptido de segunda generación, tiene actividad contra un amplio espectro de bacterias Gram-positivas, incluyendo SAMR. Su mecanismo de acción mediante tres mecanismos diferentes le hace, al menos teóricamente, especialmente inmune a las resistencias microbianas. Sin embargo, los datos in vitro indican que muy pocos Staphylococcus con susceptibilidad intermedia o resistentes a glicopéptidos serían tratables con oritavancina y que no hay datos clínicos de uso de oritavancina cuando la CMI > 1 mg/l. Parece improbable que pueda ser utilizada para tratar Staphylococcus aureus con resistencia intermedia a vancomicina o Staphylococcus aureus con resistencia a vancomicina y hay muy pocos datos para concluir su utilidad en hetero-VISA. La oritavancina todavía presenta datos limitados en cuanto al desarrollo de resistencias, pero se observó resistencia in vitro en aislados de Staphylococcus aureus resistentes a vancomicina. No se conoce ninguna resistencia cruzada entre la oritavancina y las clases de antibióticos no glucopéptidos y presenta una actividad in vitro reducida frente a ciertos organismos Gram-positivos de los géneros Lactobacillus, Leuconostoc y Pediococcus que son intrínsecamente resistentes a los glucopéptidos17.
Desde un punto de vista clínico, la oritavancina en dosis única ha demostrado su no inferioridad en estudios controlados frente a la vancomicina en infección de piel y partes blandas, con un perfil de seguridad similar al del comparador. Por su menor desarrollo, existe una experiencia limitada en los ensayos clínicos en pacientes con bacteriemia, enfermedad vascular periférica, inmunodeprimidos, mayores de 65 años y en infecciones debidas a S. pyogenes. No se ha establecido su seguridad en mujeres embarazadas ni en población pediátrica.
La oritavancina se incorpora a un grupo terapéutico ya bien provisto y en el que es difícil encontrar lagunas. Su ventaja potencial frente a otras alternativas terapéuticas disponibles se basaría en su administración única y en la no necesidad de monitorización de niveles plasmáticos, lo que al menos en teoría hace posible que pudiera administrarse de manera ambulatoria, reduciendo costes directos del tratamiento, disminuyendo la duración de la estancia hospitalaria y, de manera indirecta, minimizando el riesgo de complicaciones nosocomiales. Con respecto a las posibilidades alternativas de tratamiento por vía oral (linezolid, tedizolid), eliminaría la posibilidad de falta de adherencia al tratamiento.
Sin embargo, su mayor duración de acción podría llegar a ser un problema de seguridad en casos de reacciones de intolerancia o hipersensibilidad. La larga semivida de eliminación también plantea preocupaciones sobre la aparición de resistencias, particularmente cuando la concentración del fármaco cae por debajo de la CMI para el patógeno causante. Por otro lado, se espera que los múltiples mecanismos de acción de la oritavancina protejan contra el desarrollo de la resistencia durante el tratamiento.
Finalmente, dada su prolongada vida media debe anticiparse el empleo “fuera de indicación” en situaciones específicas como, por ejemplo, completar el tratamiento de osteomielitis y otras infecciones osteoarticulares.
En cuanto a la evaluación económica, aunque carecemos por el momento de precio oficial de la oritavancina en España, sí lo conocemos en EE. UU. (973,5 dólares). Se trata de un coste en general mucho más elevado que el del resto de antibióticos con los que se compara (vancomicina, linezolid, teicoplanina, tedizolid, etc.) y de los que saca ventaja por su dosis única. Este aspecto podría propiciar una mayor eficiencia en determinados escenarios (tratamiento ambulatorio con oritavancina frente a tratamiento hospitalario con las alternativas) pero hasta el momento no hay estudios convincentes ni suficientemente detallados en este sentido. Por otra parte, ciertos fármacos alternativos (linezolid, tedizolid o teicoplanina) pueden permitir también el tratamiento ambulatorio (oral o IM) a partir de cierto momento del proceso clínico, lo que reduciría las ventajas de oritavancina y agrandaría aún más las diferencias de coste.
Posicionamiento terapéutico y condiciones de uso
Dado que en las indicaciones evaluadas el medicamento es de una eficacia y seguridad comparables a las alternativas existentes, y que su perfil de eficiencia no aporta mejoras en la relación coste-efectividad, el posicionamiento propuesto es el de considerarlo Categoría D-1. Se incluye en la Guía Farmacoterapéutica con recomendaciones específicas: tratamiento de la infección por enterococo resistente a vancomicina en pacientes adultos cuando esté contraindicado el uso de linezolid o tedizolid.
Bibliography
FDA Guideline ABSSSI 2013 (Internet). (Consultado diciembre 2015). Disponible en: http://www.fda.gov/downloads/Drugs/.../Guidances/ucm071185.pdf [ Links ]
EMA Guideline on the evaluation of medicinal products indicated for treatment of bacterial infections (Internet). (Consultado diciembre 2015). Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003417.pdf [ Links ]
EMA Addendum to the guideline on the evaluation of medicinal products indicated for treatment of bacterial infections (Internet). (Consultado diciembre 2015). Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2013/11/WC500153953.pdf [ Links ]
Cardona AF, Wilson SE. Skin and soft-tissue infections: a critical review and the role of telavancin in their treatment. Clin Infect Dis Off Publ Infect Dis Soc Am. 2015;61(Supl. 2): S69-78. [ Links ]
Edelsberg J, Taneja C, Zervos M, Haque N, Moore C, Reyes K, et al. Trends in US Hospital Admissions for Skin and Soft Tissue Infections. Emerg Infect Dis. 2009;15(9):1516-8. [ Links ]
Lima ALLM. Parte II - Infecciones de tejidos blandos: Epidemiologia y clasificacion. Rev Panam Infectol. 2013;15(Supl. 1):S39-41 (Internet). (Consultado diciembre 2015). Disponible en: http://www.revistaapi.com/artigo/epidemiologia-y-clasificacion/ [ Links ]
Llopis F, Gonzalez-Castillo J, Julian-Jimenez A, Ferre C, Gamazo-Rio JJ, Martinez M, et al. Review of 1.250 episodes of skin and soft tissue infections attended at 49 hospital emergency departments. Rev Esp Quimioter Publ Of Soc Esp Quimioter. 2014;27(2):115-21. [ Links ]
Montejo Baranda M, Onate Adrian J, Basterretxea Ozamiz A. Organizacion y tratamiento de la infeccion de piel y partes blandas. Protocolos de actuacion 2013. Hospital de Cruces (Osakidetza) (Internet). (Consultado diciembre 2015). Disponible en: http://www.hospitalcruces.com/documentos/protocolosHospitalarios/Infecci%C3%B3nPielPartesBlandas_mayo_2013(1).pdf [ Links ]
Sartelli M, Malangoni MA, May AK, Viale P, Kao LS, Catena F, et al. World Society of Emergency Surgery (WSES) guidelines for management of skin and soft tissue infections. World J Emerg Surg. 2014;18(9):57. [ Links ]
Porras Leal L, Saenz Gutierrez A, Calderon Jimenez P, Gijon Rodriguez J. Protocolos SEMI infeccion de piel y partes blandas capitulo 5, 2009 (Internet). (Consultado diciembre 2015). Disponible en: https://www.fesemi.org/sites/default/files/documentos/publicaciones/capitulo-5_5.pdf [ Links ]
Garau J, Ostermann H, Medina J, Avila M, McBride K, Blasi F, et al. Current management of patients hospitalized with complicated skin and soft tissue infections across Europe (2010-2011): assessment of clinical practice patterns and real-life effectiveness of antibiotics from the REACH study. Clin Microbiol Infect Off Publ Eur Soc Clin Microbiol Infect Dis. 2013;19(9):E377-85. [ Links ]
Salgado Ordonez F, Arroyo Nieto A, Lozano Serrano AB, Hidalgo Conde A, Verdugo Carballeda J. Infecciones de piel y partes blandas. Med Clinica. 2009;133(14):552-64. [ Links ]
Currie CJ, Berni E, Jenkins-Jones S, Poole CD, Ouwens M, Driessen S, et al. Antibiotic treatment failure in four common infections in UK primary care 1991-2012: longitudinal analysis. BMJ. 2014; 23;349:g5493. [ Links ]
European Centre for Disease Prevention and Control. Antimicrobial resistance surveillance in Europe 2014. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). Stockholm: ECDC. (Consultado 2015). Disponible en: http://ecdc.europa.eu/en/publications/publications/antimicrobialresistance-europe-2014.pdf [ Links ]
European Medicines Agency. OrbactivR. Assessment report. (Consultado diciembre 2015). Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003785/WC500186347.pdf [ Links ]
FDA Center For Drug Evaluation And Research- Clinical Review Orbactiv (NDA 206334). (Consultado diciembre 2015). Disponible en: http://www.accessdata.fda.gov/drugsatfda_docs/nda/2014/206334Orig1s000MedR.pdf [ Links ]
European Medicines Agency. OrbactivR. Summary of product characteristics (Internet). (Consultado diciembre 2015). Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/003785/WC500186343.pdf [ Links ]
Zhanel GG, Schweizer F, Karlowsky JA. Oritavancin: Mechanism of Action. Clin Infect Dis. 2012; 15;54(Supl. 3):S214-9. [ Links ]
Marin R, Puigventos F, Fraga MD, Ortega A, Lopez-Briz E, Arocas V, et al. Group for Innovation, Assessment, Standardisation and Research in the Selection of Drugs (GENESIS) of the Spanish Society of Hospital Pharmacy (SEFH). Support method for decision making in assessment and appraisal of medicines (MADRE). Version 4.0. Madrid: SEFH (ed.); 2013. (Consultado diciembre 2015). Disponible en: http://gruposdetrabajo.sefh.es/genesis/genesis/Documents/MADRE%204_0_Procedures%20manual_Dec_2013.pdf [ Links ]
Ortega Eslava A, Marin Gil R, Fraga Fuentes MD, Lopez-Briz E, Puigventos Latorre F (GENESIS-SEFH). Guia de evaluacion economica e impacto presupuestario en los informes de evaluacion de medicamentos. Guia practica asociada al programa MADRE v 4.0. (Internet). SEFH. Madrid; 2016 (Consultado 20/03/2017). Disponible en: http://gruposdetrabajo.sefh.es/genesis/genesis/Documents/GUIA_EE_IP_GENESIS-SEFH_19_01_2017.pdf [ Links ]
Dunbar LM, Milata J, McClure T, Wasilewski MM, SIMPLIFI Study Team. Comparison of the efficacy and safety of oritavancin front-loaded dosing regimens to daily dosing: an analysis of the SIMPLIFI trial. Antimicrob Agents Chemother.2011;55(7):3476-84. [ Links ]
Corey GR, Kabler H, Mehra P, Gupta S, Overcash JS, Porwal A, et al. Single-Dose Oritavancin in the Treatment of Acute Bacterial Skin Infections. N Engl J Med. 2014;370(23):2180-90. [ Links ]
Corey GR, Good S, Jiang H, Moeck G, Wikler M, Green S, et al. Single-dose oritavancin versus 7-10 days of vancomycin in the treatment of gram-positive acute bacterial skin and skin structure infections: the SOLO II noninferiority study. Clin Infect Dis Off Publ Infect Dis Soc Am. 2015;60(2):254-62. [ Links ]
Thom H, Thompson JC, Scott DA, Halfpenny N, Sulham K, Corey GR. Comparative efficacy of antibiotics for the treatment of acute bacterial skin and skin structure infections (ABSSSI): a systematic review and network meta-analysis. Curr Med Res Opin. 2015;31(8):1539-51. [ Links ]
Bjornsson E. Drug-induced liver injury: Hy’s rule revisited. Clin Pharmacol Ther. 2006;79(6):521-8. [ Links ]
Wu KJF. A US Hospital Economic Impact Model for Oritavancin In ABSSSI Patients With Risk of MRSA Infections. Value Health. 2014;17(7):A605. [ Links ]
Jensen IS, Lodise TP, Fan W, Wu C, Cyr PL, Nicolau DP, et al. Use of Oritavancin in Acute Bacterial Skin and Skin Structure Infections Patients Receiving Intravenous Antibiotics: A US Hospital Budget Impact Analysis. Clin Drug Investig.2016;36(2):157-68. [ Links ]
Wu C, Jensen IS, Cyr PL, Fan W, Mitchell M, Sulham K, et al. Use of Oritavancin for the Treatment of Skin and soft Tissue Infections: A Uk Hospital Budget Impact Analysis. Value Health. 2015;18(3):A233. [ Links ]
Lodise TP, Fan W, Sulham KA. Economic Impact of Oritavancin for the Treatment of Acute Bacterial Skin and Skin Structure Infections in the Emergency Department or Observation Setting: Cost Savings Associated with Avoidable Hospitalizations. Clin Ther. (Internet). (Consultado 13/01/2016). Disponible en: http://www.clinicaltherapeutics.com/article/S0149291815012989/abstract [ Links ]
Ray GT, Suaya JA, Baxter R. Incidence, microbiology, and patient characteristics of skin and soft-tissue infections in a U.S. population: a retrospective population-based study. BMC Infect Dis. 2013;30(13):252. [ Links ]
Recibido: 12 de Abril de 2017; Aprobado: 28 de Agosto de 2017











 texto en
texto en