Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.42 no.2 Toledo Mar./Abr. 2018
https://dx.doi.org/10.7399/fh.10943
ARTÍCULO ESPECIAL
Consenso SEO-SEFH sobre recomendaciones de utilización y elaboración de preparaciones oftálmicas
1Servicio de Farmacia, Hospital Central de la Cruz Roja San José y Santa Adela, Madrid. España.
2Servicio de Farmacia, Hospital Fundación de Alcorcón, Madrid. España.
3Servicio de Farmacia, Instituto Oftalmológico Fernández-Vega, Oviedo. España.
4Servicio de Farmacia, Hospital Universitario y Politécnico de La Fe, Valencia. España.
5Servicio de Farmacia, Complejo Hospitalario Universitario de Pontevedra, Pontevedra. España.
6Servicio de Farmacia, Hospital General Universitario Los Arcos del Mar Menor, San Javier, Murcia. España.
7Servicio de Farmacia, Hospital Clinic de Barcelona, Barcelona. España.
8Servicio de Farmacia, Hospital Universitario Vall d’Hebron, Barcelona. España.
9Servicio de Farmacia, Hospital General Universitario Gregorio Marañón, Madrid. España.
10Servicio de Farmacia, Hospital Virgen de la Salud, Toledo. España.
11Servicio de Oftalmología, Hospital Universitario Clínico San Carlos, Madrid. España.
12Servicio de Oftalmología, Hospital General Universitario Gregorio Marañón, Madrid. España.
Introducción
En la actualidad, la industria farmacéutica no ofrece presentaciones que cubran todas las necesidades de la terapéutica oftalmológica. Por ello, es necesaria la preparación centralizada de medicamentos en el Servicio de Farmacia (SF) de los hospitales para su aplicación terapéutica en el ojo partiendo de medicamentos autorizados para otras indicaciones o vías de administración.
La utilización de medicamentos en estas condiciones, distintas a las descritas en ficha técnica, se regula por el Real Decreto 1015/20091, que las define como “Uso de medicamentos en condiciones diferentes de las autorizadas” (UMCDA). En el capítulo III, art. 13 del citado Real Decreto se establecen los requisitos para poder recurrir a estos usos, que entre otros son:
El médico deberá justificar convenientemente en la historia clínica la necesidad de uso del medicamento.
El médico responsable deberá obtener el consentimiento del paciente conforme a la Ley 41/2002 de Autonomía del paciente.
Se notificarán las sospechas de reacciones adversas de acuerdo a lo previsto en el Real Decreto 1344/2007 por el que se regula la Farmacovigilancia de Medicamentos de Uso Humano.
Se respetarán las restricciones que se hayan establecido ligadas a la prescripción y/o dispensación del medicamento y el protocolo terapéutico asistencial del centro.
El hecho de que el UMCDA pueda estar ligado a un protocolo elaborado por el centro sanitario que atiende al paciente implica la necesidad de valorar cuidadosamente la evidencia disponible de cada fármaco en cada una de las indicaciones en que se desea usar.
Por otro lado, en el año 2011 el Consejo de Europa en su resolución CM/ResAP (2011)12 con el objetivo de armonizar la calidad en la preparación de medicamentos recomienda la elaboración de unas directrices prácticas sobre preparación de medicamentos con el fin de evitar diferencias de calidad y seguridad entre las preparaciones de medicamentos realizadas en las farmacias y los medicamentos fabricados a escala industrial. Por lo que en el año 2012, en su adaptación a la normativa española, se publica el Real Decreto Ley 16/2012 de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones3, en cuyo artículo 7 se establece que los SF donde se lleven a cabo estas operaciones deben garantizar el cumplimiento de las guías técnicas de buena práctica. Por tanto, la calidad en la preparación de medicamentos debe cumplir los criterios reflejados en la Guía de Buenas Prácticas de Preparación de Medicamentos (GBPP)4 para poder ser dispensados en un formato listo para administrar con las condiciones exigidas tras la evaluación del riesgo y la asignación de los criterios de calidad necesarios. El fraccionamiento se incluye como una de las operaciones de manipulación y adecuación de preparaciones3. Concretamente, el fraccionamiento de sustancias terapéuticas de muy alto coste en múltiples dosis individuales a partir de un vial comercializado de un solo uso es una práctica llevada a cabo de forma extensa por los Servicios de Farmacia Hospitalaria para tratar de minimizar el alto impacto económico que suponen estas terapias.
En base a la evaluación de los riesgos, las preparaciones para vía intraocular deben prepararse de forma centralizada en los SF en cabina de flujo laminar con entorno controlado dadas las consecuencias negativas para el paciente que puede tener una contaminación de este tipo de preparaciones4. Sin embargo, aunque hay numerosas recomendaciones generales para la elaboración de este tipo de productos, hasta la fecha no existía un consenso unánime sobre la técnica concreta que maximice los beneficios, obteniendo el mayor número de jeringas individuales posible, asegurando al mismo tiempo la esterilidad, estabilidad y efectividad de las dosis preparadas.
Los objetivos de este documento son: 1) establecer qué medicamentos y en qué condiciones tienen suficiente evidencia, tanto galénica como clínica, para ser utilizados fuera de ficha técnica cubriendo las lagunas terapéuticas más frecuentes en el campo de la oftalmología, y así facilitar la elaboración de protocolos asistenciales en los centros sanitarios; y 2) establecer una serie de recomendaciones generales para la elaboración de inyecciones intraoculares que sean de utilidad para el personal sanitario implicado en su preparación y que aumenten la seguridad del paciente.
Métodos
Este documento se ha desarrollado en el seno de un grupo de trabajo compuesto por miembros del Grupo de Farmacotecnia de la Sociedad Española de Farmacia Hospitalaria (SEFH) y miembros designados por la dirección de la Sociedad Española de Oftalmología (SEO).
Se desarrolló en varias fases:
Inicialmente los miembros del Grupo de Farmacotecnia pusieron en común las preparaciones oftalmológicas que realizaban con más frecuencia en sus propios centros y para qué indicaciones, así como la evidencia, tanto galénica como clínica, en la que se basaban.
Tras unificar un primer listado se pasó a revisión por parte del grupo evaluador de la SEO para que propusiesen correcciones o nuevas preparaciones.
Sobre el listado revisado por la SEO, se realizó una última revisión bibliográfica en Pubmed sobre la evidencia galénica de las preparaciones seleccionadas. Para ello se usaron las siguientes palabras claves junto a cada principio activo seleccionado: ophtalmic solutions, drug stability, keratitis, endophthamitis terapy, intravitreal inyections, intraocular inyections y drug compounding.
Por otra parte, los miembros del Grupo de Farmacotecnia utilizaron como referencia la GBPP4 para establecer las recomendaciones sobre la preparación de inyecciones intraoculares. Además, llevaron a cabo una búsqueda bibliográfica en Pubmed y otras fuentes bibliográficas electrónicas utilizando las siguientes palabras clave: intraocular injections, intravitreal Injections, pharmaceutical preparations, drug compounding, drug stability. Así, se realizó un borrador de recomendaciones sobre las características del entorno, el material necesario, la técnica de preparación, el periodo de validez y el control de calidad de las preparaciones intraoculares. Este borrador fue puesto en común entre los miembros para su revisión y realización de aportaciones teniendo en cuenta la experiencia de cada profesional en cada uno de los apartados mencionados. En esta fase se decidieron incluir los aspectos referidos al envasado de las jeringas, prescripción y trazabilidad de las muestras.
Por último, el trabajo fue revisado por los miembros evaluadores de la SEO y avalado por esta sociedad (documento firmado por su dirección con fecha 16 de noviembre de 2017), en el marco del acuerdo de colaboración SEO-SEFH.
Resultados
Recomendaciones de utilización de medicamentos por vía oftálmica
Como se ha mencionado, la utilización de medicamentos en condiciones diferentes a las autorizadas requiere respetar las restricciones que se hayan establecido ligadas a la prescripción y/o dispensación del medicamento y el protocolo terapéutico asistencial del centro. Este protocolo (o protocolos si se decide hacer de forma individual por cada principio activo) debe ser consensuado entre los servicios implicados en la utilización del medicamento y aprobado por la Comisión de Farmacia y Terapéutica y por la Dirección del centro.
En la Tabla 1 se propone un esquema de protocolo para la utilización de medicamentos por vía oftálmica en condiciones diferentes a las autorizadas.
Tabla 1 Propuesta de protocolo para la utilización de medicamentos por vía oftálmica en condiciones diferentes a las autorizadas

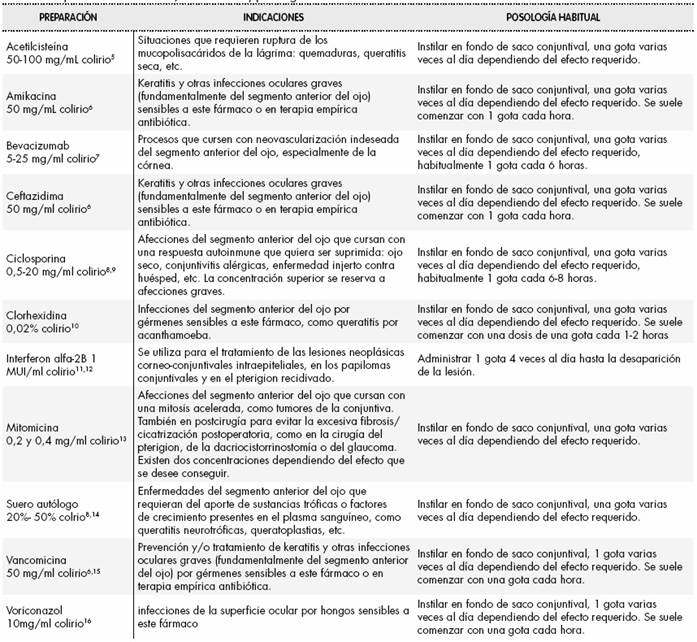
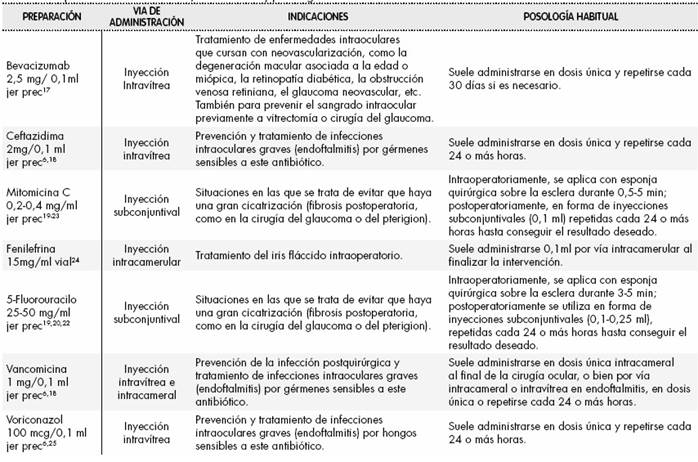
En cada solicitud, el médico prescriptor debe justificar en la historia clínica la necesidad de uso del medicamento e informar al paciente de los posibles beneficios y riesgos potenciales, obteniendo su consentimiento informado. En las Tabla 2 y Tabla 3 se describen algunos ejemplos de colirios e inyecciones intraoculares respectivamente y sus indicaciones (no autorizadas) y posología más frecuentes.
Recomendaciones generales de elaboración de preparaciones intraoculares
En el Anexo 1 y Anexo 1(cont.) se presentan las recomendaciones para la elaboración de preparaciones intraoculares. Se recogen los siguientes aspectos: lugar de preparación, características del material, técnica de preparación, envasado, periodo de validez, control de calidad, prescripción y trazabilidad.
En función del tipo de preparación, se tendrán en cuenta los requisitos especiales para la preparación de productos de esterilización terminal o los requisitos especiales para la preparación aséptica de la GBPP4.
Conclusiones
Existe una amplia evidencia clínica que avala la utilización de los medicamentos seleccionados en este trabajo para su uso oftálmico, aunque tal uso no esté reconocido para todos ellos por las autoridades sanitarias.
Legalmente, estas preparaciones se encuadrarían en lo que se denomina utilización de medicamentos en condiciones diferentes a las autorizadas y su uso debería incorporase a los protocolos asistenciales consensuados con los Servicios de Oftalmología y aprobados por la Comisión de Farmacia y Terapéutica y por la Dirección del centro.
Existe también evidencia galénica que permite la preparación de esos medicamentos de forma que puedan ser administrados por vía oftálmica, en forma de colirios o en forma de inyecciones intraoculares. La preparación de medicamentos oftálmicos se debe hacer respetando las directrices establecidas en la GBPP. Además, las recomendaciones específicas sobre la preparación de intraoculares establecidas en este documento ayudarán a armonizar y facilitarán la preparación de estos medicamentos en los SF hospitalaria contribuyendo a la equidad en el acceso de todos los pacientes a este tipo de preparaciones.
Bibliography
Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales. Boletín Oficial del Estado, nº 174, (20 de julio de 2009). [ Links ]
Resolution CM/ResAP (2011)1 on quality and safety assurance requirements for medicinal products prepared in pharmacies for the special needs of patients. Council of Europe. (Adopted by the Committee of Ministers on 19 January 2011 at the 1103rd meeting of the Ministers’ Deputies). [ Links ]
Real Decreto Ley 16/2012, de 20 de abril, de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones. Boletín Oficial del Estado, nº 98, (24 de abril de 2014). [ Links ]
Guía de Buenas Prácticas de Preparación de Medicamentos en los Servicios de Farmacia Hospitalaria. Ministerio de Sanidad, Servicios Sociales e Igualdad. Junio 2014. [ Links ]
Grupo de Farmacotecnia SEFH. Procedimiento normalizado de elaboración de acetilcisteína 50 mg/ml colirio 10 ml (Base de datos en Internet). Madrid: Sociedad Española de Farmacia Hospitalaria; 18/10/2017 (18/10/2017; 03/11/2017). Disponible en: http://gruposdetrabajo.sefh.es/farmacotecnia/images/stories/PN_Formulas/A/ACETILCISTENA_5_COLIRIO_PNT.pdf [ Links ]
López-Cabezas C, Muner DS, Massa MR, Mensa Pueyo JM. Antibiotics in endophthalmitis: microbiological and pharmacokinetic considerations. Curr Clin Pharmacol. 2010;5(1):47-54. [ Links ]
Grupo de Farmacotecnia SEFH. Procedimiento normalizado de elaboración de bevacizumab 5 mg/ml colirio 5 ml (Base de datos en Internet). Madrid: Sociedad Española de Farmacia Hospitalaria; 13/10/2017 (13/10/2017; 03/11/2017). Disponible en: http://gruposdetrabajo.sefh.es/farmacotecnia/images/stories/PN_Formulas/B/BEVACIZUMAB_5MG_ML_COLIRIO_PNT.pdf [ Links ]
Dogru M, Tsubota K. Pharmacotherapy of dry eye. Expert Opin Pharmacother. 2011;12(3):325-34. DOI: 10.1517/14656566.2010.518612 [ Links ]
Malta JB, Soong HK, Shtein RM, Musch DC, Rhoades W, Sugar A, et al. Treatment of ocular graft-versus-host disease with topical cyclosporine 0.05%. Cornea. 2010;29(12):1392-6. DOI:10.1097/ICO.0b013e3181e456f0 [ Links ]
Grupo de Farmacotecnia SEFH. Procedimiento normalizado de elaboración de clorhexidina digluconato 0,02% colirio 10 ml (Base de datos en Internet). Madrid: Sociedad Española de Farmacia Hospitalaria; 15/09/2017 (15/09/2017; 03/11/2017). Disponible en: http://gruposdetrabajo.sefh.es/farmacotecnia/images/stories/PN_Formulas/C/CLORHEXIDINA_DIGLUCONATO_002_COLIRIO_PNT.pdf [ Links ]
Esquenazi S. Treatment of early pterygium recurrence with topical administration of interferon alpha-2b. Can J Ophthalmol. 2005;40(2):185-7. DOI:10.1016/S0008-4182(05)80031-6 [ Links ]
Galor A, Karp CL, Chhabra S, Barnes S, Alfonso EC. Topical interferon alpha 2b eye drops for treatment of ocular surface squamous neoplasia: A dose comparison study. Br J Ophthalmol. 2010;94(5):551-4. DOI: 10.1136/bjo.2008.153197 [ Links ]
Grupo de Farmacotecnia SEFH. Procedimiento normalizado de elaboración de mitomicina 0,2mg/ml (0,02%) colirio 5 ml (Base de datos en Internet). Madrid: Sociedad Española de Farmacia Hospitalaria; 16/09/2017 (16/09/2017; 03/11/2017). Disponible en: http://gruposdetrabajo.sefh.es/farmacotecnia/images/stories/PN_Formulas/M/MITOMICINA_02MG_ML_002_COLIRIO_PNT.pdf [ Links ]
Geerling G, Maclennan S, Hartwig D. Autologous serum eye drops for ocular surface disorders. Br J Ophthalmol. 2004;88(11):1467-74. DOI:10.1136/bjo.2004.044347 [ Links ]
Robert MC, Moussally K, Harissi-Dagher M. Review of endophthalmitis following Boston keratoprosthesis type 1. Br J Ophthalmol. 2012;96(6):776-80. DOI:10.1136/bjophthalmol-2011-301263 [ Links ]
Grupo de Farmacotecnia SEFH. Procedimiento normalizado de elaboración de voriconazol 10 mg/ml colirio 5 ml (Base de datos en Internet). Madrid: Sociedad Española de Farmacia Hospitalaria; 17/09/2017 (17/09/2017; 03/11/2017). Disponible en: http://gruposdetrabajo.sefh.es/farmacotecnia/images/stories/PN_Formulas/V/VORICONAZOL_10MG_ML_COLIRIO_PNT.pdf [ Links ]
Grupo de Farmacotecnia SEFH. Procedimiento normalizado de elaboración de bevacizumab 25 mg/ml inyección intravítrea (Base de datos en Internet). Madrid: Sociedad Española de Farmacia Hospitalaria; 13/10/2017 (13/10/2017; 03/11/2017). Disponible en: http://gruposdetrabajo.sefh.es/farmacotecnia/images/stories/PN_Formulas/B/BEVACIZUMAB_25MG_ML_INYECCIN_INTRAVTREA_PNT.pdf [ Links ]
Ahmed Y, Schimel AM, Pathengay A, Colyer MH, Flynn HW Jr. Endophthalmitis following open-globe injuries. Eye (Lond). 2012;26(2):212-7. DOI: 10.1038/eye.2011.313. [ Links ]
Salim S. Current variation of glaucoma filtration surgery. Curr Opin Ophthalmol. 2012;23(2):89-95. DOI: 10.1097/ICU.0b013e32834ff401 [ Links ]
Lama PJ, Fechtner RD. Antifibrotics and wound healing in glaucoma surgery. Surv Ophthalmol. 2003;48(3):314-46. [ Links ]
Ang LP, Chua JL, Tan DT. Current concepts and techniques in pterygium treatment. Curr Opin Ophthalmol. 2007;18(4):308-13. DOI:10.1097/ICU.0b013e3281a7ecbb [ Links ]
Yoon PS, Singh K. Update on antifibrotic use in glaucoma surgery, including use in trabeculectomy and glaucoma drainage implants and combined cataract and glaucoma surgery. Curr Opin Ophthalmol. 2004;15(2):141-6. [ Links ]
Wilkins M, Indar A, Wormald R. Intra-operative mitomycin C for glaucoma surgery. Cochrane Database Syst Rev. 2005 Oct; 19(4):CD002897. DOI:10.1002/14651858.CD002897.pub2 [ Links ]
Lorente R, de Rojas V, Vázquez de Parga P, Moreno C, Varela J, Landaluce MA, et al. Intracameral phenylephrine 1.5% for prophylaxis against intraoperative floppy iris syndrome: prospective, randomized fellow eye study. Ophthalmology. 2012;119(10):2053-8. DOI: 10.1016/j.ophtha.2012.04.028 [ Links ]
Grupo de Farmacotecnia SEFH. Procedimiento normalizado de elaboración de voriconazol 100 mcg/0,1ml inyección intravítrea (Base de datos en Internet). Madrid: Sociedad Española de Farmacia Hospitalaria; 17/09/2017 (17/09/2017; 03/11/2017). Disponible en: http://gruposdetrabajo.sefh.es/farmacotecnia/images/stories/PN_Formulas/V/VORICONAZOL_100MCG_01ML_INYECCIN_INTRAVTREA_PNT.pdf [ Links ]
Astier A. Practical stability studies of therapeutic proteins in oncology (monografía en internet). London: Hospital Pharmacy Europe; 2012 (citado 17/09/2017). Disponible en: http://www.hospitalpharmacyeurope.com/featured-articles/practicalstability-studies-therapeutic-proteins-oncology [ Links ]
Dávila Pousa C, Vázquez Blanco S. Ensayo de esterilidad en la elaboración de preparaciones estériles. Boletín Informativo Farmacotecnia del Grupo de Trabajo de Farmacotecnia de la SEFH (revista en internet). 2014 (citado 17/09/2017);4(2): 5-9. Disponible en: http://gruposdetrabajo.sefh.es/farmacotecnia/images/stories/Boletines/BOLETIN_2_2014_final.pdf [ Links ]
PiC/S guide to good practices for the preparation of medicinal products in healthcare establishments PE 010-4, 1 March 2014. Disponible en: http://academy.gmp-compliance.org/guidemgr/files/PICS/PE-010-4-GUIDE-TO-GOOD-PRACTICES-1.PDF [ Links ]
Malmstrom RA, Meier JL, Carmichael JM. Method of preparing multiple doses of a pharmaceutical solution from a single-dose. U.S Patent H2251H (Monografía en internet). 04/01/2011 (Citado 17/09/2017). Disponible en: https://www.google.ch/patents/USH2251 [ Links ]
Recibido: 22 de Noviembre de 2017; Aprobado: 03 de Marzo de 2018











 texto em
texto em