My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.42 n.3 Toledo May./Jun. 2018
https://dx.doi.org/10.7399/fh.10920
ORIGINALES
Estrategia multidisciplinar para reducir errores en el uso de los gases medicinales
1Servicio de Farmacia Hospitalaria, Hospital General Universitario Gregorio Marañón, Madrid. Instituto de Investigación Sanitaria del Hospital Gregorio Marañón, Madrid. España.
2Servicio de Medicina Preventiva, Hospital General Universitario Gregorio Marañón, Madrid. España.
Introducción
Hasta la reciente aprobación de los gases medicinales (GM) como medicamentos (Real Decreto 1800/2003, de 26 de diciembre)1 existía una falta de concienciación de los riesgos asociados a su uso. Por ello, numerosas organizaciones sanitarias han desarrollado estrategias dirigidas a aumentar la seguridad en el uso de los medicamentos dado que la aplicación de estrategias específicas para garantizar el uso seguro de los GM ha sido muy limitada. Algunos autores han emitido recomendaciones puntuales dirigidas al correcto almacenamiento y a fomentar, de forma general, el uso seguro de los GM en el ámbito hospitalario2-7. Solo existe una publicación que detalla cada una de las etapas del procedimiento de gestión de GM en el ámbito hospitalario, elaborada por la Sociedad Española de Farmacia Hospitalaria8. Sin embargo, esta no incluye la fase de prescripción ni la formación y difusión a los profesionales sanitarios, y no establece la aplicación práctica del proceso completo.
Numerosos estudios han revelado que la utilización de los medicamentos constituye la causa mayoritaria por la que se producen eventos adversos en la provisión de la asistencia sanitaria9-14. Según un informe emitido por la Food and Drug Administration, en el periodo comprendido entre los años 1997-2001, los errores producidos en EE. UU. en relación al uso de los GM derivaron en un total de 7 muertes y 15 daños irreversibles en los pacientes15. Por ello, es de vital importancia la consideración de los mismos como medicamentos y concienciar a los profesionales implicados en su manejo de las consecuencias que puede conllevar una mala utilización de los mismos.
El objetivo de este trabajo es, a partir del análisis de un evento centinela, redefinir el proceso completo de la utilización de los GM en el ámbito hospitalario, incluyendo tanto aspectos logísticos como formativos.
Métodos
Este trabajo se ha realizado en un hospital terciario universitario de 1.300 camas, en el que trabajan más de 8.000 profesionales responsables de prestar asistencia sanitaria a una población de aproximadamente 350.000 personas.
En una unidad de hospitalización pediátrica tuvo lugar un evento centinela que desembocó en la administración incorrecta de un GM a un paciente ingresado. Como consecuencia de ello, el paciente presentó una parada respiratoria que supuso su ingreso en la Unidad de Cuidados Intensivos y su monitorización neurológica posterior para confirmar la ausencia de daño. Tras su detección, fue notificado a la Unidad Funcional de Gestión de Riesgos (UFGR) del centro, cuya presidenta es la jefa del Servicio de Farmacia y en el que participan referentes de seguridad de distintos servicios entre los que se incluyen otras dos farmacéuticas del centro. El objetivo general de la UFGR es incrementar la calidad de la asistencia sanitaria y la seguridad de los pacientes, por lo que en este caso tomó la decisión de realizar un análisis causa-raíz (ACR) del evento.
Análisis causa-raíz
1.Se constituyó un equipo multidisciplinar formado por el jefe de Área del Hospital Materno-Infantil, un médico adjunto de la Unidad de Cuidados Intensivos Pediátrica, un médico adjunto de Hospitalización Pediátrica, un médico adjunto de Medicina Preventiva y Gestión de Calidad que además era miembro de la UFGR y la farmacéutica de la Unidad
Materno-Infantil.
Este equipo, siguiendo la metodología clásica del ACR16, estableció la línea de los hechos a partir de la cual evaluó los posibles fallos y/o desviaciones del procedimiento establecido, y las causas de los mismos. La identificación de las posibles causas de los fallos se realizó mediante un proceso secuencial de preguntas estructuradas para descubrir los errores latentes subyacentes en el evento centinela.
Se propusieron áreas de mejora encaminadas a actuar sobre los errores latentes detectados y así definir un programa que garantizara la seguridad y calidad en el uso de los GM. Estas mejoras fueron priorizadas teniendo en cuenta la magnitud y las consecuencias de los fallos y la factibilidad de las medidas propuestas. Las medidas, a las que se asignó responsable y plazo previsto para su ejecución, fueron desarrolladas para prevenir la reiteración de eventos similares.
Este ACR se realizó entre julio de 2015 y febrero de 2016, tal y como se refleja en la Figura 1.
Resultados
Durante el ACR se identificaron nueve errores a lo largo de la línea del tiempo que desembocaron en la ocurrencia del evento centinela (Figura 2).
Mejoras organizativas
Se definieron acciones de mejora para cada una de las fases del circuito asignando a cada una de ellas responsable y plazo de ejecución (Tabla 1). Todas ellas fueron implantadas al mismo tiempo en todas las unidades clínicas del centro.
Almacenamiento. El centro en el que se realizó este trabajo dispone de cuatro almacenes para la custodia de los GM, en los que coexisten gases de uso clínico y uso industrial. En primer lugar, se ordenaron los cuatro almacenes, llevando a cabo la separación con barreras físicas de los gases de uso clínico (oxígeno, heliox, óxido nitroso, óxido nítrico y aire medicinal) de los gases de uso industrial utilizados para la conservación y funcionamiento de distintas máquinas del hospital (argón, dióxido de carbono, helio, hexafluoruro de azufre, protox y nitrógeno), ubicándolos en un espacio físico independiente.
Se colocaron carteles identificativos en los que se indicaba el nombre del gas y el aspecto que debía tener la botella según la legislación vigente (Real Decreto 1800/2003)17, para favorecer la correcta identificación por parte del personal responsable de su traslado a las unidades clínicas.
Prescripción. Se incluyeron los GM como medicamentos para que estos pudieran ser prescritos a través del programa de prescripción electrónica del hospital, además se crearon seis protocolos para su prescripción en este programa: neonatología-gases medicinales (oxígeno, heliox, óxido nitroso y óxido nítrico); pediatría-gases medicinales (oxígeno, heliox y óxido nitroso); uci pediátrica-gases medicinales (oxígeno, heliox, óxido nítrico y óxido nitroso); pediatría urgencias broncoespasmo (oxígeno); pediatría urgencias bronquiolitis (oxígeno); y pediatría urgencias laringitis (heliox). En la Figura 3 se muestra la inclusión de uno de estos protocolos en el programa de prescripción electrónica asistida. Estos protocolos se acompañaron de recomendaciones relativas a la forma de administración, así como advertencias relativas a la monitorización del paciente. De este modo, conseguimos evitar su prescripción manual, y el riesgo de error que esta conlleva, además de disminuir la variabilidad de dicha prescripción entre los profesionales del centro. Para ello fue necesario comunicar a todos los profesionales sanitarios la acción realizada.
Validación. La inclusión de estos medicamentos en el programa de prescripción asistida permite a los farmacéuticos, tal como realiza con el resto de la medicación prescrita, revisar la prescripción y utilización adecuada de los GM con objeto de que se cumplan los requisitos específicos para cada gas medicinal y así obtener los beneficios adecuados, es decir, indicación correcta, flujo adecuado y duración del tratamiento.
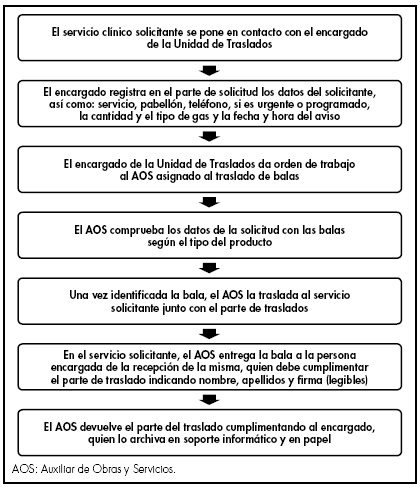
Dispensación. Para garantizar la seguridad en la fase de dispensación se llevó a cabo el desarrollo e implantación de un protocolo de traslados que incluye la identificación de todas las personas con acceso al almacén de gases, formación continuada de las mismas y el uso de un albarán de entrega de pedidos que tendrá que ser firmado por la persona que realiza la entrega, así como por la que recepciona el pedido. El proceso se recoge en la Figura 4.
Administración. Se solicitó a la empresa suministradora de los GM información sobre los manómetros utilizados para la administración de cada gas. Cada uno de los gases de uso clínico dispone de un sistema de acoplamiento diferente, aunque puede coincidir con el utilizado para gases de tipo industrial, por lo que antes de la administración del medicamento es necesario comprobar que el acoplamiento es el correcto para el gas que se va a utilizar.
Formación. En primer lugar, con el fin de promover el uso seguro de los GM se colocaron en las unidades clínicas 72 pósteres con recomendaciones para su correcta identificación y administración. La Figura 5 muestra el modelo de póster utilizado.
En el póster se indicó cómo deben estar identificadas las botellas de uso clínico de acuerdo a la legislación vigente (RD 1800/2003)17:
- Etiqueta que indica nombre del medicamento, lote/sublote y fecha de caducidad.
- Etiqueta “banana” que indica las características de riesgo y seguridad aplicables a cada producto, así como las recomendaciones de uso, pictogramas de peligro y composición del gas envasado.
- Código de colores: oxígeno con la ojiva y el cuerpo blanco, aire medicinal con la ojiva blanca, una franja negra y el cuerpo blanco, óxido nítrico con la ojiva de color verde aguamarina y el cuerpo blanco, óxido nitroso con la ojiva azul oscuro y el cuerpo blanco y el heliox con la ojiva blanca, una franja marrón y el cuerpo blanco.
- Cruz de ginebra, que indica que es un gas de uso clínico.
- Letra “N” marcada dos veces en puntos diametralmente opuestos sobre la ojiva y de un color distinto al de los colores de la misma, que indica que la botella cumple la última legislación vigente.
Por otro lado, en nuestro hospital se imparten habitualmente dos ediciones de un curso de seguridad de pacientes de veinte horas dirigido a todos los profesionales del centro. En el programa del mismo se ha reforzado el apartado específico que hace alusión al uso correcto de los medicamentos, incluyendo los GM, así como productos sanitarios. En esta formación se insiste en la necesidad de cumplir los siete correctos (paciente correcto, hora correcta, medicamento correcto, dosis correcta, vía de administración correcta, registro correcto e información correcta).
Además, se complementó el material de acogida al personal de nueva incorporación con toda la documentación relativa al uso seguro de los GM, asegurando que el personal de las unidades de hospitalización conoce los gases de uso en la unidad y el protocolo a seguir para la utilización de estos medicamentos.
Discusión
Tras el análisis causa-raíz de un evento centinela, hemos redefinido el circuito para garantizar la seguridad en la utilización de los GM en el ámbito hospitalario. Se han implantado distintas acciones de mejora incluyendo todas las fases del proceso de utilización del medicamento: almacenamiento, prescripción, validación, dispensación, administración y formación. Una de las farmacéuticas del centro pertenecientes a la UFGR fue nombrada la responsable de garantizar el cumplimiento de todas las medidas de mejora implantadas y notificar de forma semestral a la UFGR el seguimiento de las mismas. Del mismo modo, en el futuro se monitorizarán los incidentes relacionados para comprobar la efectividad de las medidas implantadas y el posible ajuste de las mismas.
En los trabajos publicados que han reportado errores en el uso de GM se incidía fundamentalmente en aspectos a mejorar en el almacenamiento y la formación del personal de enfermería puesto que es el profesional sanitario responsable de la administración8,12. Sin embargo, al haber utilizado la metodología ACR, en la que se analizan todas las fases del proceso, en nuestro trabajo, hemos conseguido integrar todas las fases de utilización de estos medicamentos incluyendo también prescripción, validación y dispensación. Así, hemos conseguido implicar a todos los profesionales involucrados en la utilización de estos medicamentos y así consolidar en nuestro centro una cultura de seguridad en relación a los GM que contribuirá a una mayor seguridad en su utilización.
Existen varias publicaciones internacionales en las que se lleva a cabo una revisión de la legislación vigente relativa a la manipulación y etiquetado de los gases tanto de uso industrial como medicinal, haciendo especial hincapié en las diferencias que existen entre ambos9-12,14. En línea con estos trabajos, hemos realizado la difusión de la normativa aplicable en nuestro ámbito (RD 1800/2003)17 para garantizar así su cumplimiento y evitar que se produzcan errores por una mala identificación de los mismos.
En el trabajo realizado por M. Herve-Bazin et al.6 analizaron los errores de medicación reportados por los profesionales sanitarios de Francia en relación con el uso de los GM. La mayor parte de los errores eran debidos a la confusión de oxígeno con la mezcla oxígeno/óxido nítrico,
provocando efectos adversos serios en los pacientes e incluso la muerte en algunos casos. En nuestro trabajo no hemos podido realizar un análisis de los errores reportados en nuestro centro, ya que, como hemos comentado anteriormente existía, hasta la implantación de las medidas comentadas, una falta de concienciación de la peligrosidad del uso de los GM que derivaba en una infranotificación de los errores relacionados con los mismos. En el trabajo francés se concluye con la realización de un póster con recomendaciones generales para informar a los profesionales sanitarios de la peligrosidad que supone el uso de los GM/13) de manera análoga a lo realizado en nuestro trabajo. Sin embargo, no se establecen medidas concretas que garanticen la seguridad a lo largo de todo el proceso tal como se ha realizado en nuestro centro.
El circuito para la utilización de los gases medicinales definido en este trabajo es aplicable a cualquier institución sanitaria sin suponer un coste significativo para la misma. No obstante, se requiere conocer la situación de cada una de las fases del proceso y el responsable de cada una de ellas para implantar las medidas de mejora aplicables en cada caso.
Una de las principales limitaciones convenientes a la aplicabilidad de nuestro trabajo en otros centros es la necesidad de disponer de un sistema de prescripción electrónica asistida que permita incorporar los protocolos para la correcta utilización de los GM. Aunque no todos los hospitales del ámbito nacional disponen de este tipo de sistemas, una encuesta realizada en el año 2015 por el Grupo de Trabajo 2020 de la Sociedad Española de Farmacia Hospitalaria revelaba que el 94% de los hospitales ya disponían de este tipo de sistemas.
Por otro lado, cabe destacar la necesidad de personal para realizar una correcta formación. Sin embargo, en la actualidad se dispone de sistemas de formación online tipo e-learning que permitirá el acceso de cualquier profesional a la misma.
Una vez consolidado el circuito, en el plazo de los dos próximos años, se ha programado la realización de AMFE que nos permita analizar los riesgos que entraña cada una de las fases del circuito implantado y así mejorar las medidas implantadas.
En conclusión, los GM deben ser considerados como medicamentos que son y debe tenerse en cuenta el riesgo que conlleva su uso. Por ello, es necesario implantar un circuito adecuado de utilización de estos medicamentos en el ámbito hospitalario que garantice la seguridad de los pacientes, así como promover una adecuada formación a los profesionales implicados en su utilización.
Bibliography
Domínguez-Gil A. Gases medicinales, nuevos medicamentos. Farm Hosp. 2005;29:300-2. [ Links ]
Peate I, Lancaster J. Safe use of medical gases in the clinical setting: practical tips. Br J Nurs. 2000;9:231-6. DOI: 10.12968/bjon.2000.9.4.6382 [ Links ]
Medical Gas Container Closure Rule - Questions and Answers. A Guidance for Industry: U.S. Department of Health and Human Services. FDA; 2017. [ Links ]
Storage and Handling of Medical Gas Cilinders. FireNet: UCDavis Health System; 2013. [ Links ]
Becker S, Zaidi K, Curry P. USP Initiatives for the Safe Use of Medical Gases. Pharm Tech (revista en Internet). 2005 (consultado el 30/06/2017): 29(11). Disponible en: http://www.pharmtech.com/usp-initiatives-safe-use-medical-gases?id=&sk=&date=&pageID=3 [ Links ]
Herve-Bazin M, Durand D, Cardona F, Maison P. Medication errors related to the administration of medicinal gases in France: one of the 12 french never events. Congreso de la Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) 2016. [ Links ]
Medical gases: tips for safe use and storage. Jt Comm Perspect. 2012;32:9-11 [ Links ]
Procedimiento de gestión de gases medicinales: estándares de calidad de gases medicinales en el ámbito hospitalario. Sociedad Española de Farmacia Hospitalaria (SEFH), Asociación Española de Ingeniería Hospitalaria, Asociación de Fabricantes de Gases Medicinales (AFGIM); 2012 [ Links ]
Reason J. Human error: models and management. BMJ. 2000;320(7237):768-70. [ Links ]
Estudio ENEAS: Estudio nacional sobre los efectos adversos ligados a la hospitalización. Agencia de Calidad del Sistema Nacional de Salud, Ministerio de Sanidad y Consumo. Madrid; 2006. [ Links ]
Estudio APEAS: Estudio sobre la seguridad de los pacientes en atención primaria de salud. Agencia de Calidad del Sistema Nacional de Salud, Ministerio de Sanidad y Consumo. Madrid; 2008. [ Links ]
Estudio EARCAS: Estudio sobre eventos adversos en residencias y centros asistenciales sociosanitarios. Agencia de Calidad del Sistema Nacional de Salud, Ministerio de Sanidad y Consumo. Madrid; 2011. [ Links ]
Estudio SYREC: Estudio sobre incidentes y eventos adversos en medicina intensiva. Agencia de Calidad del Sistema Nacional de Salud, Ministerio de Sanidad y Consumo. Madrid; 2009. [ Links ]
Tomás S, Chanovas M, Roqueta F, Alcaraz J, Toranzo T y Grupo de Trabajo EVADUR - SEMES. EVADUR: Eventos adversos ligados a la asistencia en los servicios de urgencias de hospitales españoles. Emergencias. 2010;22:415-28. [ Links ]
Medical Gas Errors: Community Hospital Files Report Concerning Medical Gas Tanks That Were Mislabeled (monografía en Internet). Nurses.com (consultado el 15/06/2017). Disponible en: http://www.nurses.com/doc/medical-gas-errorscommunity-hospital-files-r-0001 [ Links ]
Ruiz-López P, González C, Alcalde-Escribano J. Análisis de causas raíz. Una herramienta útil para la prevención de errores. Rev Calidad Asistencial. 2005;20:71-8. [ Links ]
Real Decreto 1800/2003, de 26 de diciembre, por el que se regulan los gases medicinales. Boletín Oficial del Estado, n.º 11, (13 de enero de 2004). [ Links ]
Recibido: 17 de Octubre de 2017; Aprobado: 28 de Noviembre de 2017











 text in
text in