My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.43 n.1 Toledo Jan./Feb. 2019
https://dx.doi.org/10.7399/fh.11041
ORIGINALES
Medicamentos sujetos a seguimiento adicional en la Unión Europea
1Departamento de Medicina, Área de Farmacología, Universidad de Oviedo, Oviedo. Spain.
2Centro de Estudios sobre Seguridad de Medicamentos (CESME), Universidad de Valladolid, Valladolid. Spain.
Introducción
El seguimiento adicional de algunos medicamentos es una medida introducida en la legislación europea sobre farmacovigilancia en el año 20121,2. Afecta a los medicamentos autorizados en la Unión Europea por la Agencia Europea de Medicamentos (EMA, European Medicines Agency) que requieren un seguimiento particularmente riguroso e intensivo por parte de las autoridades sanitarias.
Los medicamentos sujetos a seguimiento adicional (MSSA) se identifican con un triángulo negro invertido ( ) e incluyen medicamentos3: 1) que contienen nuevas sustancias activas, autorizados en la Unión Europea a partir del 1 de enero de 2011; 2) biológicos, autorizados en la Unión Europea a partir del 1 de enero de 2011; 3) con una autorización condicional, para los que el titular de autorización de comercialización debe aportar datos adicionales; 4) aprobados en circunstancias excepcionales, cuando hay razones por las que el titular de autorización de comercialización no puede facilitar datos exhaustivos y debe completar la información tras la comercialización, y 5) para los que el titular de autorización de comercialización debe realizar estudios postautorización (EPA) de seguridad. Actualmente, estos medicamentos permanecen sujetos a seguimiento adicional durante cinco años tras su comercialización o hasta que el Comité para la Evaluación de Riesgos en Farmacovigilancia de la EMA (PRAC, Pharmacovigilance Risk Assessment Committee) considere segura la retirada de su seguimiento.
) e incluyen medicamentos3: 1) que contienen nuevas sustancias activas, autorizados en la Unión Europea a partir del 1 de enero de 2011; 2) biológicos, autorizados en la Unión Europea a partir del 1 de enero de 2011; 3) con una autorización condicional, para los que el titular de autorización de comercialización debe aportar datos adicionales; 4) aprobados en circunstancias excepcionales, cuando hay razones por las que el titular de autorización de comercialización no puede facilitar datos exhaustivos y debe completar la información tras la comercialización, y 5) para los que el titular de autorización de comercialización debe realizar estudios postautorización (EPA) de seguridad. Actualmente, estos medicamentos permanecen sujetos a seguimiento adicional durante cinco años tras su comercialización o hasta que el Comité para la Evaluación de Riesgos en Farmacovigilancia de la EMA (PRAC, Pharmacovigilance Risk Assessment Committee) considere segura la retirada de su seguimiento.
En abril de 2013, la EMA publicó la primera lista de MSSA, que es revisada mensualmente por el PRAC3. En España, en el año 2013, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) publicó dos notas informativas sobre esta medida, una dirigida a los profesionales sanitarios4 y otra a los ciudadanos5. Además, algunos boletines terapéuticos y de farmacovigilancia han informado sobre el concepto y procedimiento de los MSSA6-8 y se han publicado diferentes artículos sobre la seguridad y otros aspectos relacionados con la utilización de algunos de ellos9-13.
El objetivo de nuestro estudio fue analizar las características de los MSSA. Para ello, como objetivos específicos estudiamos: 1) los criterios aplicados para la designación de los MSSA; 2) los criterios de dispensación asignados a estos medicamentos; 3) los grupos farmacológicos a los que pertenecen, y 4) su seguridad postcomercialización.
Métodos
Se realizó un análisis descriptivo utilizando la lista de los MSSA publicada por la EMA y actualizada hasta el 23 de enero de 201714, excluyendo los medicamentos cuya autorización había sido revocada o suspendida. Se consideraron como nuevos principios activos los autorizados entre el 23/01/2012 y el 23/01/2017. La información necesaria para el análisis se obtuvo de las páginas web de: 1) la EMA14 (lista de MSSA, fechas de autorización y fichas técnicas de los medicamentos, e información relativa a los criterios de autorización), 2) el Centro de Información de Medicamentos de la AEMPS15 (condiciones de dispensación de los medicamentos) y 3) the Norwegian Institute of Public Health, WHO Collaborating Centre for Drug Statistics Methodology16 (código de la clasificación Anatómica-Terapéutica-Química (ATC), correspondiente a cada principio activo).
Para cada MSSA se analizó si se trataba de: 1) un nuevo principio activo; 2) un medicamento biológico, biosimilar o no, excluyendo los ya incluidos como nuevo principio activo, u 3) otros criterios aplicados para la designación del medicamento como MSSA (autorización condicional, autorización en circunstancias excepcionales, EPA de seguridad). Además, se analizaron: 1) la evolución temporal (años 2013-2016) de los criterios de designación de los MSSA; 2) la designación como “medicamento huérfano” o no; 3) las condiciones de dispensación autorizadas, clasificadas como “no restringidas” (MSPM: medicamentos sujetos a prescripción médica) y “restringidas” (DH: diagnóstico hospitalario y H: uso hospitalario), y 4) el grupo farmacológico al que pertenecían: niveles 1 (órgano y sistema) y 2 (subgrupo terapéutico), de la clasificación ATC cada principio activo.
Para el estudio de la seguridad postcomercialización se realizó una revisión de las notas informativas sobre seguridad referidas a los MSSA, publicadas por la AEMPS hasta el 23 de enero de 2017, analizando las causas objeto de la publicación de la nota informativa. Para ello, la información se clasificó, de acuerdo con su contenido, en: 1) BBR: resultados del análisis del balance beneficio/riesgo del medicamento; 2) CD: cambios en los criterios de dispensación; 3) CNT: nuevas contraindicaciones; 4) RU: restricciones de uso, y 5) SEG: información sobre seguridad.
La depuración de los datos correspondientes a cada una de las variables definidas en el estudio y el análisis estadístico se llevó a cabo con el programa IBM SPSS Statistics versión 24.0 (Armonk, NY: IBM Corp.). La mayoría de los resultados se expresaron como frecuencias absolutas y relativas (n, %).
Resultados
La lista de MSSA (EMA/245297/2013 Rev.41), actualizada hasta el 23 de enero de 2017, incluía 320 medicamentos. De ellos se excluyeron 4 por haber sido revocada o suspendida su autorización de comercialización, con posterioridad a su inclusión en la lista. De los 316 MSSA restantes, 197 (62,3%) contenían nuevas sustancias activas (Tabla 1). Otros criterios aislados de inclusión frecuentes fueron: la necesidad de un EPA de seguridad (n = 52 (16,5%)) y el ser un medicamento biológico, aunque no una nueva sustancia activa (n = 49 (15,5%)). Del total de los 197 MSSA que contenían nuevos principios activos, en 55 (24,9%) se sumaba al menos un criterio adicional. Considerados globalmente, casi dos tercios de los MSSA (n = 207 (65,3%)) se autorizaron con condiciones de dispensación restringidas, siendo el uso hospitalario el criterio de dispensación más común (n = 143 (45,1%)).
Tabla 1 Características de los medicamentos sujetos a seguimiento adicional (lista EMA/245297/2013 Rev.41)
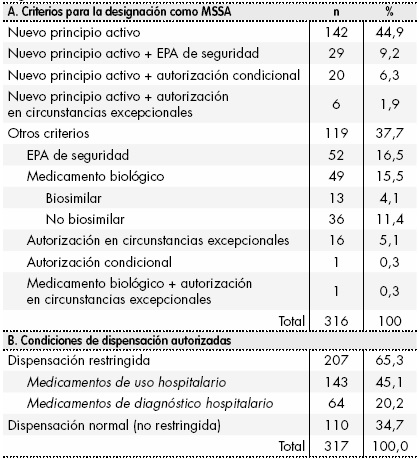
EPA: estudio postautorización; MSSA: medicamentos sujetos a seguimiento adicional.
De los 197 MSSA que contenían nuevos principios activos, 53 (26,9%) eran nuevos principios activos biológicos y 47 (23,9%) medicamentos huérfanos (18 medicamentos huérfanos biológicos y 29 medicamentos huérfanos no biológicos). Los nuevos principios activos de los MSSA analizados pertenecían preferentemente a los grupos principales anatómicos (Figura 1): agentes antineoplásicos e inmunomoduladores (L) (n = 59 (29,9%)), antiinfecciosos para uso sistémico (J) (n = 32 (16,2%)) y medicamentos para el metabolismo y tracto alimentario (A) (n = 30 (15,2%)). Dentro del grupo de los agentes antineoplásicos e inmunomoduladores, el grupo farmacológico más frecuente eran los inhibidores de tirosina-cinasa (n = 24 (12,2%)).

Figura 1 Clasificación anatómica-terapéutica-química (ATC) de los medicamentos sujetos a seguimiento adicional, con nuevos principios activos en su composición.
Al analizar la evolución temporal en los años 2013-2016 de los criterios de designación de los MSSA, observamos: 1) en todos los años, el criterio “nuevo principio activo” supuso al menos la mitad de los MSSA designados en el año; 2) el criterio “medicamento biológico”, no nuevo principio activo, alcanzó su valor más alto, un 32,3% de los MSSA designados, en 2016; 3) los criterios “autorización condicional” y “autorización en circunstancias excepcionales” fueron muy poco frecuentes (valores inferiores al 3%) en los años 2014-2016, y 4) el criterio “EPA de seguridad” se redujo en los años 2015 y 2016, suponiendo en este último año únicamente el 3,2% de los MSSA (Tabla 2).
Tabla 2 Evolución temporal de los criterios de designación de los medicamentos sujetos a seguimiento adicional
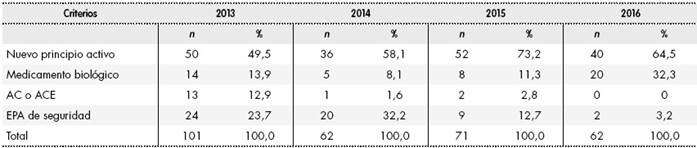
AC: autorización condicional; ACE: autorización en circunstancias excepcionales; EPA: estudio postautorización.
Desde la publicación de la primera nota informativa de seguridad sobre MSSA, el 3 de junio de 2013 (MUH (FV), 13/2013), hasta el 23 de enero de 2017, la AEMPS publicó 68 notas informativas de seguridad, de las cuales 2 explicaban el concepto de MSSA a profesionales sanitarios y ciudadanos, y 14 (20,6%) se referian a algún aspecto vinculado a la seguridad de los MSSA implicados (Tabla 3). De estas 14 notas informativas, 7 se referían a nueva información sobre seguridad, 3 a restricciones en la utilización del medicamento, 2 a resultados de la evaluación de la relación beneficio/riesgo, 1 a cambios en las condiciones de dispensación del medicamento y 1 a nuevas contraindicaciones. Con respecto a los principios activos implicados con más frecuencia, 3 se referían al ranelato de estroncio, la última de ellas informando del cambio en sus condiciones de dispensación a diagnóstico hospitalario, y 2 a idelalisib, informando de las medidas para prevenir el riesgo de infecciones graves.
Tabla 3 Notas de seguridad, referidas a medicamentos sujetos a seguimiento adicional, emitidas por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), hasta el 23/01/2017

BBR: balance beneficio/riesgo; CD: criterios de dispensación; CNT: contraindicaciones; FV: farmacovigilancia; MUH: medicamentos de uso humano; RU: restricciones de uso; SEG: seguridad. *Año de autorización.
Discusión
El triángulo negro invertido ( ), utilizado en el Reino Unido para identificar los nuevos principios activos17, fue el símbolo adoptado por la EMA para identificar los MSSA. Para evitar confusiones, y tras la adopción de la normativa europea, la AEMPS eliminó el triángulo amarillo (
), utilizado en el Reino Unido para identificar los nuevos principios activos17, fue el símbolo adoptado por la EMA para identificar los MSSA. Para evitar confusiones, y tras la adopción de la normativa europea, la AEMPS eliminó el triángulo amarillo ( ) con el que se señalaban hasta entonces en España los nuevos principios activos. La identificación de un medicamento con el triángulo negro invertido (
) con el que se señalaban hasta entonces en España los nuevos principios activos. La identificación de un medicamento con el triángulo negro invertido ( ) no significa que el medicamento no sea seguro. Su finalidad es estimular a los profesionales sanitarios18 y a los ciudadanos19 a que notifiquen las sospechas de reacciones adversas asociadas al medicamento, facilitando así la evaluación de su relación beneficio/riesgo.
) no significa que el medicamento no sea seguro. Su finalidad es estimular a los profesionales sanitarios18 y a los ciudadanos19 a que notifiquen las sospechas de reacciones adversas asociadas al medicamento, facilitando así la evaluación de su relación beneficio/riesgo.
En nuestro estudio, casi dos tercios de los MSSA contenían nuevas sustancias activas, mostrando la necesidad de completar la información sobre su seguridad20. Valorados anualmente, el porcentaje de MSSA con nuevos principios activos se mantuvo en niveles iguales o superiores al 50% en todos los años de estudio. Estos nuevos principios activos pertenecían mayoritariamente al grupo de los fármacos antineoplásicos e inmunomoduladores, y, dentro de ellos, merecen especial mención, por su frecuencia, los fármacos inhibidores de tirosina-cinasa21,22.
Un tercio de los MSSA eran medicamentos biológicos, la mitad de ellos nuevos principios activos y la otra mitad, entre otros, incluía 13 medicamentos biosimilares. Los medicamentos biológicos se componen de proteínas tales como las hormonas peptídicas, enzimas producidas naturalmente por el cuerpo humano o anticuerpos monoclonales, productos sanguíneos, medicamentos inmunológicos como sueros y vacunas, alérgenos y productos tecnológicos avanzados como los productos de terapia génica y celular(23 -25). Debido a sus características químicas y a sus perfiles de seguridad26,27, la farmacovigilancia adquiere un papel incluso más importante con los medicamentos biológicos28.
Un alto porcentaje de MSSA estaba sujeto a dispensación restringida, principalmente de uso hospitalario, y casi la totalidad de los medicamentos huérfanos eran de dispensación restringida. Los medicamentos huérfanos son aquellos destinados al tratamiento de enfermedades raras, que afectan sólo a un pequeño número de pacientes (< 5 en 10.000 individuos en la Unión Europea o < 200.000 individuos en Estados Unidos)29. Aproximadamente el 20% de los MSSA estaban autorizados como medicamentos huérfanos, de los cuales más de la mitad eran nuevas sustancias activas, principalmente de agentes antineoplásicos e inmunomoduladores.
Hasta comienzos de 2017, la AEMPS había publicado 14 notas informativas de seguridad sobre medicamentos identificados con el triángulo negro invertido ( )30. Todas ellas ponen de manifiesto la importancia del seguimiento adicional de estos medicamentos y de la notificación prioritaria de las sospechas de reacciones adversas.
)30. Todas ellas ponen de manifiesto la importancia del seguimiento adicional de estos medicamentos y de la notificación prioritaria de las sospechas de reacciones adversas.
La principal limitación de nuestro estudio es la dinámica de cambio de la lista de MSSA publicada por la EMA, actualizada mensualmente. Esta limitación está compensada por el elevado número de MSSA estudiados, al haberse analizado todos los MSSA autorizados desde el inicio de este procedimiento en 2013 hasta enero de 2017. La principal fortaleza de este estudio es su utilidad para dar a conocer los MSSA entre los profesionales sanitarios. Nuestra propuesta de mejora es que el triángulo negro invertido ( ) que identifica a los MSSA, se incorpore a los sistemas de prescripción y dispensación electrónica para facilitar su identificación por los profesionales sanitarios.
) que identifica a los MSSA, se incorpore a los sistemas de prescripción y dispensación electrónica para facilitar su identificación por los profesionales sanitarios.
En conclusión, los MSSA incluyen mayoritariamente nuevas sustancias activas que por razones de seguridad o por sus condiciones de autorización requieren un estrecho y cuidadoso seguimiento postcomercialización. El grupo farmacológico al que con más frecuencia pertenecen es el de los fármacos antineoplásicos e inmunomoduladores. La actualización postcomercialización de su seguridad ha generado ya alguna información publicada en notas informativas de la AEMPS.
El conocimiento de estos medicamentos, y del símbolo con el que se reconocen ( ), debería facilitar la evaluación precoz de su relación beneficio/riesgo.
), debería facilitar la evaluación precoz de su relación beneficio/riesgo.
Aportación a la literatura científica
La novedad del principio activo, requerir un estudio postcomercialización de seguridad o ser un medicamento biológico, son criterios de designación comunes en los medicamentos sometidos a seguimiento adicional. Se trata mayoritariamente de medicamentos utilizados en neoplasias y procesos inmunes y sus criterios de dispensación son, con frecuencia, restringidos. El seguimiento postcomercialización ha producido ya alguna información adicional para garantizar un uso más seguro.
Bibliography
Regulation (EU) No 1235/2010 of the European Parliament and of the Council of 15 December 2010 amending, as regards pharmacovigilance of medicinal products for human use, Regulation (EC) No 726/2004 laying down Community procedures for the authorisation and supervision of medicinal products for human and veterinary use and establishing a European Medicines Agency, and Regulation (EC) No 1394/2007 on advanced therapy medicinal products. Text with EEA relevance Official Journal European Union, 348/1, (31 december 2010) (citado 13/06/2018); Disponible en: https://ec.europa.eu/health/sites/health/files/files/eudralex/vol-1/reg_2010_1235/reg_2010_1235_en.pdf [ Links ]
Directive 2010/84/EU of the European Parliament and of the Council of 15 December 2010 amending, as regards pharmacovigilance, Directive 2001/83/EC on the Community code relating to medicinal products for human use. Text with EEA relevance Official Journal European Union, 348/74, (31 december 2010) (citado 13/06/2018); Disponible en: https://ec.europa.eu/health//sites/health/files/files/eudralex/vol-1/dir_2010_84/dir_2010_84_en.pdf [ Links ]
European Medicines Agency. Medicines under additional monitoring 2013 (citado 13/06/2018). Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/Other/2013/04/WC500142430.pdf [ Links ]
Medicamentos sometidos a seguimiento adicional de su seguridad 2013 ( )-NIMUH_FV_25-2013-seguimiento-adicional.pdf (citado 13/06(2018). Disponible en: https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2013/docs/NI- MUH_FV_25-2013-seguimiento-adicional.pdf [ Links ]
Medicamentos sometidos a seguimiento adicional de su seguridad 2013 ( )-NIMUH_FV_26-2013- seguimiento_adicional.pdf (citado 13/06/2018). Disponible en: https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/ciudadanos/2013/docs/NI-MUH_FV_26-2013-seguimiento_adicional.pdf [ Links ]
CADIME (Centro Andaluz de Documentación e Información de Medicamentos. Primer listado de medicamentos sujetos a seguimiento adicional. 2017 (citado 13/06/2018). Disponible en: http://www.cadime.es/generate_pdf.cfm [ Links ]
Boletín de Farmacovigilancia del País Vasco. Medicamentos sujetos a seguimiento adicional: Triángulo negro. 2013 (citado 13/06/2018). Disponible en: https://www.osakidetza.euskadi.eus/contenidos/informacion/boletines_farmacovigilancia/es_def/adjuntos/Boletin_36.pdf [ Links ]
Butlletí de Farmacovigilancia de Cataluña. 2013 (citado 13/06/2018). Disponible en: http://medicaments.gencat.cat/web/.content/minisite/medicaments/professionals/6_publicacions/butlletins/boletin_farm acovigilancia/documents/arxius/bfv_v11_n5e.pdf [ Links ]
Carter NJ. Inhaled glycopyrronium bromide: a review of its use in patients with moderate to severe chronic obstructive pulmonary disease. Drugs. 2013;73:741-53. DOI: 10.1007/s40265-013-0058-7 [ Links ]
Sportiello L, Rafaniello C, Scavone C, Vitale C, Rossi F, Capuano A. The importance of Pharmacovigilance for the drug safety: Focus on cardiovascular profile of incretinbased therapy. Int J Cardiol. 2016;202:731-5. DOI:10.1016/j.ijcard.2015.10.002 [ Links ]
Caraci F, Leggio GM, Salomone S, Drago F. New drugs in psychiatry: focus on new pharmacological targets. F1000Research 2017;6:397. DOI: 10.12688/f1000rese arch.10233.1.eCollection 2017 [ Links ]
Cejalvo MJ, de la Rubia J. Which therapies will move to the front line for multiple myeloma? Expert Rev Hematol. 2017;10:383-92. DOI: 10.1186/s13054-017-1678-1 [ Links ]
Kroschinsky F, Stölzel F, von-Bonin S, Beutel G, Kochanek M, Kiehl M, et al. New drugs, new toxicities: severe side effects of modern targeted and immunotherapy of cancer and their management. Crit Care. 2017;21:89. DOI: 10.1186/s13054-017-1678-1 [ Links ]
European Medicines Agency. List of medicines under additional monitoring (citado 13/06/2018). Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/document_listing/document_listing_000366.jsp&mid=WC0b01ac058067c852 [ Links ]
AEMPS. Centro de Información online de Medicamentos de la AEMPS (CIMA). Buscador principal (citado 13/06/2018). Disponible en: https://www.aemps.gob.es/cima/fichasTecnicas.do?metodo=detalleForm [ Links ]
Norwegian Institute for Public Health. WHO Collaborating Centre for Drugs Statistics Methodology. ATC Classification (citado 13/06/2018). Disponible en: https://www.whocc.no/atc_ddd_index/ [ Links ]
Martin RM, Kapoor KV, Wilton LV, Mann RD. Underreporting of suspected adverse drug reactions to newly marketed (“black triangle”) drugs in general practice: observational study. BMJ. 1998;317(7151):119-20. [ Links ]
Carvajal A. Los nuevos desafíos de la farmacovigilancia en España. En Manso G, Hidalgo A, Carvajal A, de Bajo FJ (eds.). Los primeros 25 años del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano. Universidad de Oviedo; 2010 p.81-92 (citado 13/06/2018). Disponible en: https://www.unioviedo.es/gaife/documentos/libro25aniversario/Capitulos/Capitulo_06.pdf [ Links ]
Salgueiro ME, Jimeno FJ, Aguirre C, García M, Ordóñez L, Manso G. (Direct reporting by patients of adverse drug reactions in Spain). Farm Hosp. 2013;37:65-71. DOI: 10.7399/FH.2013.37.1.121 [ Links ]
Plessis L, Gómez A, García N, Cereza G, Figueras A. Lack of essential information in spontaneous reports of adverse drug reactions in Catalonia-a restraint to the potentiality for signal detection. Eur J Clin Pharmacol. 2017;73:751-8. DOI: 10.1007/s00228-017-2223-5 [ Links ]
Ellis LM, Hicklin DJ. Resistance to Targeted Therapies: Refining Anticancer Therapy in the Era of Molecular Oncology. Clin Cancer Res Off J Am Assoc Cancer Res. 2009;15:7471-8. DOI: 10.1158/1078-0432.CCR-09-1070 [ Links ]
Toffalini F, Demoulin JB. New insights into the mechanisms of hematopoietic cell transformation by activated receptor tyrosine kinases. Blood. 2010;116:2429-37. DOI: 10.1182/blood-2010-04-079752 [ Links ]
Boletin Oficial del Estado, nº 177, (25 de julio de 2015). Real Decreto 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios (citado 13/06/2018). Disponible en: https://www.boe.es/boe/dias/2015/07/25/pdfs/BOEA-2015-8343.pdf [ Links ]
Serra López-Matencio JM, Morell Baladrón A, Castañeda S. Biosimilars: A new scenario in biologic therapies. Reumatol Clin. 2017;13(5):287-93. DOI: 10.1016/j.reuma.2016.05.013 [ Links ]
Bennett CL, Chen B, Hermanson T, Wyatt MD, Schulz RM, Georgantopoulos P, et al. Regulatory and clinical considerations for biosimilar oncology drugs. Lancet Oncol. 2014;15:e594-605. DOI: 10.1016/S1470-2045(14)70365-1 [ Links ]
González V, Salgueiro E, Jimeno FJ, Hidalgo A, Rubio T, Manso G. Post-marketing safety of antineoplasic monoclonal antibodies: rituximab and trastuzumab. Pharmacoepidemiol Drug Saf. 2008;17:714-21. DOI: 10.1002/pds.1587 [ Links ]
Calvo B, Zuñiga L. EU’s new pharmacovigilance legislation: considerations for biosimilars. Drug Saf. 2014;37:9-18. DOI: 10.1007/s40264-013-0121-z [ Links ]
Martos-Rosa A, Martínez-de la Plata JE, Morales-Molina JA, Fayet-Pérez A, Acosta-Robles PJ. (Biosimilars, the journey has begun). Farm Hosp. 2015;39:114-7. DOI: 10.7399/fh.2015.39.2.8789 [ Links ]
Franco P. Orphan drugs: the regulatory environment. Drug Discov Today. 2013;18:163-72. DOI: 10.1016/j.drudis.2012.08.009 [ Links ]
Agencia Española de Medicamentos y Productos Sanitarios. Medicamentos de Uso Humano. Notas de seguridad. AEMPS (citado 13/06/2018). Disponible en: https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/home.htm [ Links ]
Recibido: 12 de Abril de 2018; Aprobado: 21 de Julio de 2018











 text in
text in 


