My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.43 n.2 Toledo Mar./Apr. 2019
https://dx.doi.org/10.7399/fh.11156
ORIGINALES BREVES
Calidad de vida en pacientes con carcinoma colorrectal no metastásico tratados con esquema FOLFOX o XELOX
1Pharmacy Department, Hospital Virgen de la Luz, Cuenca. Spain.
2Pharmacy and Food Technology Department, Universidad Complutense de Madrid, Madrid. Spain.
3Industrial Pharmacy Institute, Universidad Complutense de Madrid, Madrid. Spain.
Introducción
El cáncer colorrectal (CCR) es la neoplasia más frecuente del aparato digestivo y su control es actualmente una de las prioridades en salud pública, dadas la mortalidad y morbilidad que produce. El tratamiento farmacológico ha evolucionado mucho en los últimos años y 5-fluorouracilo (5-FU) ha sido la base del tratamiento para pacientes con CCR no metastásico (CCRnm). 5-FU se ha combinado con otros agentes para aumentar la supervivencia, concretamente con ácido folínico o leucovorina (LV)1 y posteriormente con oxaliplatino2.
Otro fármaco empleado en estos pacientes es capecitabina, precursor del 5-FU3. Numerosos estudios han demostrado que cuando capecitabina se usa en pacientes con CCRnm, es una alternativa tan eficaz y bien tolerada como 5-FU/LV4, de manera que 5-FU intravenoso puede ser sustituido por capecitabina oral. La asociación de capecitabina y oxaliplatino (esquema XELOX) también ha demostrado mejorar la supervivencia comparándose con 5-FU/LV5. Al comparar los esquemas FOLFOX y XELOX, el estudio de Schmoll HJ et al. demuestra que el tratamiento adyuvante con 5-FU/LV o capecitabina con o sin oxaliplatino proporciona resultados óptimos, concluyendo que ambos esquemas presentan eficacias equivalentes6.
Sin embargo, también es importante analizar la calidad de vida (CdV) de los pacientes para conocer la experiencia del paciente con la enfermedad y el tratamiento y poder elegir un esquema quimioterápico sobre otro7. Por tanto, el objetivo del estudio es evaluar y comparar la CdV de pacientes diagnosticados de CCRnm tratados con el esquema FOLFOX o XELOX, sobre la base del cuestionario EORTC QLQ-C30 versión 3.0.
Métodos
Estudio descriptivo prospectivo de pacientes diagnosticados de CCR-nm en tratamiento quimioterápico adyuvante con los esquemas FOLFOX y XELOX. El esquema adyuvante FOLFOX (oxaliplatino intravenoso más 5 - FU/ LV intravenoso) consiste en 12 ciclos de 14 días durante 24 semanas y el esquema adyuvante XELOX (oxaliplatino intravenoso más capecitabina oral) en 8 ciclos de 21 días durante 24 semanas8. En los pacientes con cáncer de recto se podría administrar un número inferior de ciclos en caso de existir quimiorradioterapia previa a la cirugía8.
El estudio fue llevado a cabo en un hospital de segundo nivel durante 24 meses (octubre 2015-octubre 2017) previa autorización del Comité Ético de Investigación Clínica. Se incluyeron todos los pacientes que iniciaron y completaron el tratamiento quimioterápico adyuvante y que firmaron el consentimiento informado para participar en el estudio. Se excluyeron pacientes cuyo deterioro cognitivo les impidiese entender y responder a los cuestionarios, pacientes con incapacidad de entender el castellano y pacientes que no accediesen a participar.
Los pacientes fueron seleccionados en el momento de la validación farmacéutica de los tratamientos quimioterápicos y a continuación, tras la firma del consentimiento informado, se les facilitaba el cuestionario EORTC QLQ-C30 versión 3.0 en ese momento y a la semana 12 del tratamiento adyuvante. Se trata de un cuestionario validado y desarrollado por la European Organisation for Research and Treatment of Cancer quality of Life para medir la CdV de pacientes oncológicos. Consta de 30 preguntas repartidas en tres escalas: funcional, sintomática y estado global de salud9,10. Posteriormente, se revisaban la historia clínica informatizada (Mambrino XXI®) y las historias fármacoterapéuticas (Farmatools-Dominion® y Farhos-Oncología® v. 5.0).
Se recogieron variables de exposición (esquema quimioterápico administrado), variables de control (edad, sexo, localización y estadio de la enfermedad, escala ECOG, existencia o no de quimiorradiación previa, número de ciclos recibidos, meses desde el diagnóstico hasta el inicio del tratamiento adyuvante, dosis de inicio, reducciones de dosis y sus motivos y suspensiones de tratamientos y sus motivos) y variables de respuesta (puntuaciones del cuestionario). En cuanto a los cuestionarios, las puntuaciones se estandarizaron: valores altos en la escala funcional y escala de estado global de salud indicaban una mejor CdV, y valores altos en la escala de síntomas indicaban una peor CdV11. Cambios en los ítems y/o escalas superiores a 10 puntos de las puntuaciones basales se consideraron clínicamente relevantes. Alteraciones de 5 a 10 puntos conllevaban un “pequeño” cambio, alteraciones de 10 a 20 puntos informaban de cambios “moderados” y más de 20 puntos de diferencia implicaban “mucho” cambio12; de esta manera, sólo los cambios “moderados” y “mucho” implicaban relevancia clínica.
Respecto al análisis estadístico de los datos, éste se efectuó con el programa SPSS® 15.0 (versión para Windows®). Se realizó un análisis descriptivo de las variables continuas o numéricas utilizando medidas de tendencia central y de dispersión, y para las variables categóricas o cualitativas se emplearon frecuencias absolutas y relativas.
En cuanto a la evaluación de la CdV, el valor medio de cada uno de los ítems del cuestionario se obtuvo a partir de la media de las preguntas que los componían. La comparación de medias de una variable cuantitativa por otra cualitativa dicotómica se realizó con la prueba T para muestras independientes. Se consideró estadísticamente significativa la p < 0,05.
Resultados
Se seleccionaron 36 pacientes, de los cuales uno fue excluido del estudio por incapacidad para entender el castellano. De los 35 pacientes inicialmente incluidos en el estudio, cinco abandonaron el estudio una vez iniciado el tratamiento adyuvante: un paciente suspendió el tratamiento tras el primer ciclo por cardiotoxicidad, dos pacientes por progresión de la enfermedad y otros dos pacientes por no completar la adyuvancia con el mismo esquema quimioterápico, alternando esquema FOLFOX y XELOX.
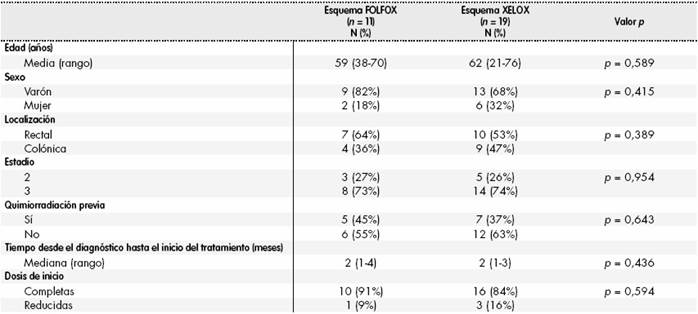
Por tanto, 30 pacientes fueron incluidos en el análisis y sus características en función del esquema quimioterápico recibido quedan recogidas en la Tabla 1, sin encontrarse diferencias estadísticamente significativas entre las distintas variables.
Respecto a las reducciones de dosis o suspensiones al final del tratamiento adyuvante, 22 (73%) pacientes habían reducido dosis y cinco (17%) pacientes habían suspendido el tratamiento. El principal motivo fue la aparición de reacciones adversas, mayoritariamente neurotoxicidad (11 pacientes; 37%), trombopenia (9 pacientes; 30%), neutropenia (9 pacientes; 30%) y mucositis (3 pacientes; 10%).
Los resultados del análisis de los distintos ítems del cuestionario de CdV EORTC QLQ-C30 quedan recogidos en la Tabla 2, sin encontrarse diferencias estadísticamente significativas en la mayoría de los ítems. Se observaron diferencias estadísticamente significativas en el ítem rol emocional a las 12 semanas del tratamiento, punto en el que los pacientes tratados con FOLFOX se encontraban mejor emocionalmente que los tratados con XELOX (FOLFOX 92 puntos versus XELOX 82 puntos; p = 0,036).
Tabla 2. Análisis de los distintos ítems del cuestionario de calidad de vida EORTC QLQ-C30
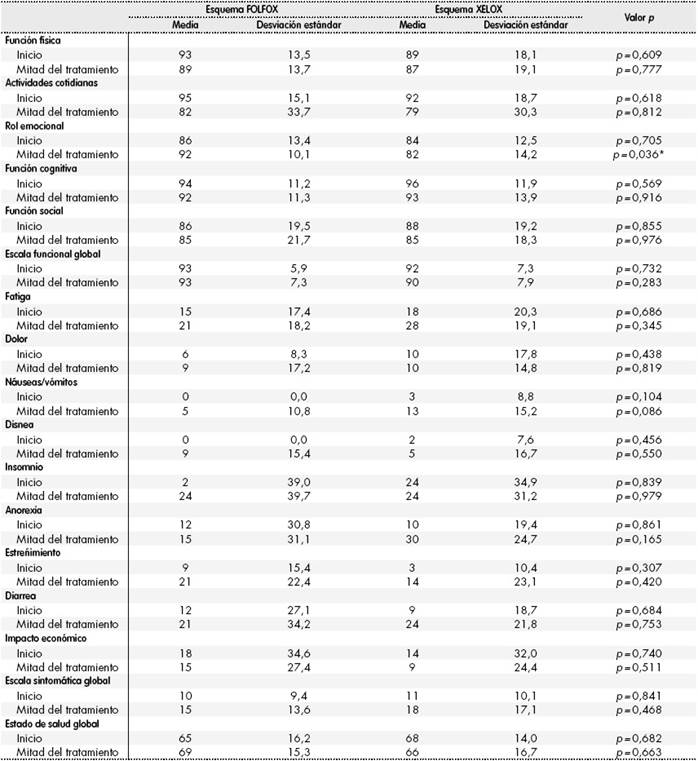
*p < 0,05.
Al analizar los cambios que perciben los pacientes a lo largo del tratamiento sí se encontraron diferencias clínicamente relevantes respecto al valor basal en ambos grupos de pacientes. Los pacientes tratados con FOLFOX presentaron un empeoramiento clínicamente relevante en las actividades cotidianas, estreñimiento e insomnio. El empeoramiento para los dos primeros ítems se consideró “moderado” y para el último “mucho”. También se halló un empeoramiento considerado “pequeño”, y por tanto no clínicamente relevante, para los ítems fatiga, náuseas, vómitos, disnea y diarrea. Al analizar los pacientes tratados con XELOX, se observó un empeoramiento clínicamente relevante y “moderado” en las actividades cotidianas, estreñimiento, fatiga, náuseas, vómitos, anorexia y diarrea. También se halló un empeoramiento considerado “pequeño” para el impacto económico y por tanto no clínicamente relevante.
En los ítems de función física, función cognitiva, función social y dolor no se encontraron diferencias en ninguno de los grupos de pacientes. Respecto a la escala funcional, escala sintomática y escala de salud global, la segunda de ellas empeoró en ambos grupos, sin ser en ninguno clínicamente relevante, considerándose el cambio “pequeño”, y las dos últimas no variaron, sin encontrarse diferencias en ninguno de los grupos de pacientes a lo largo del tratamiento adyuvante.
Discusión
En este estudio se observa que los pacientes tratados con XELOX se encontraron peor emocionalmente en la semana 12 del tratamiento adyuvante que los tratados con FOLFOX y presentaron empeoramiento en fatiga, náuseas, vómitos, anorexia y diarrea.
En comparación con otros estudios ya publicados, éstos han demostrado que los pacientes con FOLFOX presentan mayor incidencia de insomnio y disnea frente a XELOX4,13. El trabajo de Comella P et al. en pacientes con CCR metastásico (CCRm) muestran una mejora del insomnio a lo largo del tratamiento en los pacientes con FOLFOX y un empeoramiento de la disnea con XELOX14. En cuanto a los trabajos de Lin JK et al. y Comella P et al., hay que destacar que, en el primero, los pacientes con FOLFOX presentan mejoría de la función social y con XELOX mejoría de la función cognitiva y dolor, y en el segundo estudio, se observa una mejora en el ítem estreñimiento de los pacientes con CCRm y XELOX4,14.
Respecto a la anorexia, el estudio de Chen HH et al. halló diferencias entre ambos esquemas, pues los pacientes tratados con FOLFOX presentan mayor incidencia de anorexia, tanto al inicio como a las 12 semanas de tratamiento15. En nuestro estudio, se observa que en los pacientes tratados con FOLFOX no empeora dicho ítem a lo largo de la adyuvancia y sí empeora en los tratados con XELOX. Esta diferencia puede deberse al perfil de pacientes que constituye cada estudio, pues el estudio de Chen HH et al. analizó pacientes diagnosticados de CCRm, los cuales presentan de base una mayor incidencia de anorexia que los pacientes con CCRnm15.
Finalmente, la principal limitación del estudio es el tamaño muestral, hecho que limita el poder sacar conclusiones estadísticamente significativas. Un mayor estudio aleatorizado podría realizarse para confirmar estos resultados.
Aportación a la literatura científica
El cáncer colorrectal es la neoplasia más frecuente del aparato digestivo y su control es actualmente una de las prioridades en salud pública dada la mortalidad y morbilidad que produce. La calidad de vida en Oncología está cada vez cobrando un mayor auge y es importante analizarla para tener una mejor perspectiva de cómo el tratamiento quimioterápico influye en los resultados de los pacientes y por tanto, elegir un esquema quimioterápico sobre otro. Por ello, resulta innovador comparar la calidad de vida asociada a los esquemas FOLFOX y XELOX en los pacientes con carcinoma colorrectal no metastático. La calidad de vida de los pacientes tratados con XELOX parece ser peor que la de los tratados con FOLFOX. El mayor empeoramiento que presentaron de su estado emocional los pacientes tratados con XELOX a lo largo del tratamiento fue consecuencia de su mayor percepción de fatiga, náuseas, vómitos, anorexia y diarrea. Por ello, a la hora de elegir un esquema quimioterápico sobre otro hay que tener en cuenta a parte del estado general del paciente, su estilo de vida, edad y nivel de formación, la calidad de vida asociada a cada esquema quimioterápico.
Bibliography
Piedbois P, Buyse M, Rustum Y, Machover D, Erlichman C, Carlson RW, et al. Modulation of fluorouracil by leucovorin in patients with advanced colorectal cancer: evidence in terms of response rate. Advanced Colorectal Cancer Meta-Analysis Project. J Clin Oncol. 1992;10(6):896-903. DOI: 10.1200/JCO.1992.10.6.896 [ Links ]
André T, Boni C, Navarro M, Tabernero J, Hickish T, Topham C, et al. Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial. J Clin Oncol. 2009;27(19):3109-16. DOI: 10.1200/JCO.2008.20.6771 [ Links ]
Yothers G, O’Connell MJ, Allegra CJ, Kuebler JP, Colangelo LH, Petrelli NJ, et al. Oxaliplatin as adjuvant therapy for colon cancer: updated results of NSABP C-07 trial, including survival and subset analyses. J Clin Oncol. 2011;29(28):3768-74. DOI: 10.1200/JCO.2011.36.4539 [ Links ]
Lin JK, Tan EC, Yang MC. Comparing the effectiveness of capecitabine versus 5-fluorouracil/leucovorin therapy for elderly Taiwanese stage III colorectal cancer patients based on quality-of-life measures (QLQ-C30 and QLQ-CR38) and a new cost assessment tool. Health Qual Life Outcomes. 2015;13:61. DOI: 10.1186/s12955-015-0261-1 [ Links ]
Haller DG, Tabernero J, Maroun J, de Braud F, Price T, Van Cutsem E, et al. Capecitabine plus oxaliplatin compared with fluorouracil and folinic acid as adjuvant therapy for stage III colon cancer. J Clin Oncol. 2011;29(11):1465-71. DOI: 10.1200/JCO.2010.33.6297 [ Links ]
Schmoll HJ, Twelves C, Sun W, O’Connell MJ, Cartwright T, McKenna E, et al. Effect of adjuvant capecitabine or fluorouracil, with or without oxaliplatin, on survival outcomes in stage III colon cancer and the effect of oxaliplatin on post-relapse survival: a pooled analysis of individual patient data from four randomised controlled trials. Lancet Oncol. 2014;15(13):1481-92. DOI: 10.1016/S1470-2045(14)70486-3 [ Links ]
Argyriou AA, Velasco R, Briani C, Cavaletti G, Bruna J, Alberti P, et al. Peripheral neurotoxicity of oxaliplatin in combination with 5-fluorouracil (FOLFOX) or capecitabine (XELOX): a prospective evaluation of 150 colorectal cancer patients. Ann Oncol. 2012;23(12):3116-22. DOI: 10.1093/annonc/mds208 [ Links ]
National Comprehensive Cancer Network guidelines (web page). Plymouth: National Comprehensive Cancer Network (1/7/2018; 26/7/2018). Available at: https://www.nccn.org/professionals/physician_gls/default.aspx [ Links ]
Aaronson NK, Ahmedzai S, Bergman B, Bullinger M, Cull A, Duez NJ, et al. The European Organization for Research and Treatment of Cancer QLQ-C30: a qualityof-life instrument for use in international clinical trials in oncology. J Natl Cancer Inst. 1993;85(5):365-76. [ Links ]
Sprangers MA, Cull A, Bjordal K, Groenvold M, Aaronson NK. The European Organization for Research and Treatment of Cancer. Approach to quality of life assessment: guidelines for developing questionnaire modules. EORTC Study Group on Quality of Life. Qual Life Res. 1993;2(4):287-95. [ Links ]
Fayers PM, Aaronson NK, Bjordal K, Groenvold M, Curran D, Bottomley A, on behalf of the EORTC Quality of Life Group. The EORTC QLQ-C30 Scoring Manual, 3.ª ed. Brussels: European Organisation for Research and Treatment of Cancer; 2001. [ Links ]
Osoba D, Rodrigues G, Myles J, Zee B, Pater J. Interpreting the significance of changes in health-related quality- of-life scores. J Clin Oncol. 1998;16(1):139-44. DOI: 10.1200/JCO.1998.16.1.139 [ Links ]
Conroy T, Hebbar M, Bennouna J, Ducreux M, Ychou M, Llédo G, et al. Quality-oflife findings from a randomised phase-III study of XELOX vs FOLFOX-6 in metastatic colorectal cancer. Br J Cancer. 2010;102(1):59-67. DOI: 10.1038/sj.bjc.6605442 [ Links ]
Comella P, Massidda B, Filippelli G, Farris A, Natale D, Barberis G, et al. Randomised trial comparing biweekly oxaliplatin plus oral capecitabine versus oxaliplatin plus i.v. bolus flourouracil/leucovorin in metastasic colorectal cancer patients: results of the Southern Italy Cooperative Oncology study 0401. J Cancer Res Clin Oncol. 2009;135(2):217-26. DOI: 10.1007/s00432-008-0454-7 [ Links ]
Chen HH, Chen WT, Lee HC, Lin JK, Fang CY, Chou YH, et al. Health-related quality of life and cost comparison of adjuvant capecitabine versus 5-fluorouracil/leucovorin in stage III colorectal cancer patients. Qual Life Res. 2015;24(2):473-84. DOI: 10.1007/s11136-014-0773-x [ Links ]
Recibido: 01 de Octubre de 2018; Aprobado: 17 de Diciembre de 2018











 text in
text in