Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.43 no.4 Toledo Jul./Ago. 2019 Epub 14-Out-2019
https://dx.doi.org/10.7399/fh.11169
ORIGINALES
Integración de la farmacovigilancia en la rutina del servicio de farmacia: nueve años de experiencia
2Servicio de Farmacia, Hospital Nostra Senyora de Meritxell, Escaldes-Engordany. Principat d’Andorra.
Objetivo
Describir un programa de farmacovigilancia llevado a cabo por un servicio de farmacia y analizar las sospechas de reacciones adversas a medicamentos recogidas.
Método
Estudio observacional, longitudinal, de nueve años de duración (2008-2016). El programa de farmacovigilancia está liderado por el servicio de farmacia, que realiza farmacovigilancia prospectiva, retrospectiva, intensiva y voluntaria en el paciente hospitalizado y ambulatorio (urgencias, hospital de día, consultas externas y centros sociosanitarios). Las reacciones adversas se incorporan en la historia clínica electrónica del paciente y se añade una alerta que indica su presencia.
Resultados
Se recogieron 2.631 reacciones adversas a medicamentos en 2.436 pacientes (52% varones) con una media (rango) de edad de 63,3 (0-98) años. El 92,8% de las reacciones fueron notificadas por el farmacéutico y el 7,2% por médicos, enfermería y técnicos. El 63,7% se notificaron en hospitalización, el 19,2% en urgencias, el 10,6% en consultas externas, el 6,2% en hospital de día y el 0,3% en radiología. Se observó un incremento de notificación por farmacovigilancia prospectiva e intensiva. Los grupos terapéuticos mayoritariamente implicados fueron: antineoplásicos (21,3%), antibacterianos (12,3%), antitrombóticos (7,7%), analgésicos (6,7%), corticosteroides (5,2%), psicolépticos (5,2%), diuréticos (4,9%), antivirales (4,9%), antiinflamatorios y antirreumáticos (4,2%) e inmunosupresores (3,3%). Las reacciones adversas detectadas afectaron mayoritariamente a la piel y anejos (19,7%) y al tracto gastrointestinal (19,1%). Respecto a su gravedad, el 38,7% fueron leves, el 30,8% graves y el 30,5% moderadas. El 60,9% de los pacientes se recuperaron de las reacciones adversas y el 31,7% se encontraban en proceso de recuperación. Se interrumpió el tratamiento en el 65% de los casos y el 56% de los pacientes recibieron tratamiento específico.
Conclusiones
La incorporación del programa de farmacovigilancia en la rutina diaria del farmacéutico de hospital aporta un valor añadido a la seguridad de la farmacoterapia del paciente.
PALABRAS CLAVE: Farmacovigilancia; Reacción adversa al medicamento; Monitorización de fármacos; Farmacia hospitalaria; Efecto adverso por medicamentos; Sistemas de detección de efectos adversos
Introducción
A los medicamentos se les exige eficacia, seguridad y calidad para que puedan ser comercializados y utilizados por la población. Los estudios realizados durante la investigación y el desarrollo de un medicamento proporcionan un buen conocimiento de su eficacia; sin embargo, hay limitaciones para conocer bien su seguridad. Sólo su utilización en la población general y las condiciones de la práctica habitual permiten conocerla con mayor precisión. A este último aspecto se dedica la farmacovigilancia1, actividad de salud pública que tiene como finalidad la identificación, cuantificación, evaluación y prevención de las reacciones adversas a los medicamentos (RAM) o cualquier otro problema relacionado con los fármacos una vez comercializados2,3, para asegurar que la relación beneficio/riesgo es favorable1.
El objetivo de la farmacovigilancia es detectar tempranamente las RAM e interacciones desconocidas hasta ese momento, registrar el aumento de la frecuencia de una RAM ya conocida e identificar factores de riesgo, comunicar los riesgos y beneficios de los mismos y difundir esta información a la comunidad científica y a la población general para lograr un uso más seguro de los medicamentos4.
Una RAM es cualquier respuesta perjudicial e involuntaria a un medicamento que se presente a las dosis utilizadas normalmente en el ser humano como profilaxis, diagnóstico o tratamiento de enfermedades o para la modificación de una función fisiológica5. Las RAM son causa de muchas complicaciones que pueden derivar en asistencia a urgencias, hospitalización e incluso la muerte. Se estima que el 5% de todos los ingresos hospitalarios se deben a una RAM, siendo la quinta causa más común de muerte hospitalaria en la Unión Europea, con aproximadamente 197.000 muertes/año y un coste total para la sociedad de 79.000 millones de euros. Por eso, evitarlas debe ser un objetivo prioritario en los protocolos asistenciales6.
Actualmente, el Principado de Andorra forma parte del Programa de Vigilancia Farmacéutica Internacional de la Organización Mundial de la Salud (OMS)7. Además, el Hospital Nostra Senyora de Meritxell (HNSM) dispone desde el año 2004 de un programa de farmacovigilancia que facilita la detección, registro y notificación de las RAM producidas en el hospital.
El objetivo de este artículo es describir el programa de farmacovigilancia del HNSM, que se encuentra integrado en la actividad diaria del farmacéutico hospitalario, y analizar las sospechas de RAM recogidas durante 9 años que se utilizaron para establecer programas de seguridad específicos.
Métodos
El HNSM es un hospital de agudos, el único hospital del Principado de Andorra, que da cobertura a 78.264 habitantes, según datos de 20168. Anualmente, se realizan una media de 6.800 ingresos hospitalarios, 37.700 visitas en urgencias, 1.600 sesiones de quimioterapia intravenosa y 3.400 dispensaciones de medicamentos a pacientes externos.
El programa de farmacovigilancia está liderado por el servicio de farmacia, que lo integra como un elemento más de la actividad diaria, realizando farmacovigilancia voluntaria, prospectiva, retrospectiva e intensiva7,9,10.
La farmacovigilancia voluntaria implica la notificación espontánea de RAM por parte del personal sanitario. La farmacovigilancia prospectiva consiste en la detección de RAM mediante la historia clínica electrónica (HCE) y la prescripción electrónica asistida (PEA), tanto en pacientes hospitalizados (unidad de cuidados intensivos, pediatría, ginecología, cirugía general y traumatológica, medicina interna y psiquiatría) como en el centro sociosanitario adscrito al hospital. La farmacovigilancia retrospectiva supone la identificación de las RAM a través de la revisión de las HCE al alta mediante el conjunto mínimo básico de datos (CMBD), y la farmacovigilancia intensiva consiste en la detección proactiva de las RAM en las áreas de urgencias, consultas externas y hospital de día, incluyendo oncología. Además, se encuentran establecidos programas específicos, como la detección de RAM en la administración de inmunoglobulinas intravenosas y de medios de contraste en la unidad de radiodiagnóstico.
Las sospechas de RAM en los métodos de tipo prospectivo, retrospectivo e intensivo se detectan mediante la utilización de un listado de señales de alerta (Anexo 1) que recoge diagnósticos, prescripción de ciertos medicamentos/antídotos o situaciones clínicas, como es la suspensión brusca de un medicamento activo, asociados con posibles daños por medicamentos. Para el registro de las notificaciones se utiliza una tarjeta amarilla propia y específica del servicio de farmacia. Posteriormente, la notificación de RAM se introduce como documento en la HCE del paciente en formato PDF, permitiendo que pueda ser consultada en todos sus ingresos. A cada paciente con RAM incorporada se le añade una alerta que indica su presencia antes de entrar dentro de la HCE7. Las RAM se registran en una base de datos propia. Finalmente, cada año se realizan sesiones generales de seguridad farmacológica y de farmacovigilancia para reforzar los conceptos sobre las RAM. Todas las notificaciones se remiten al Sistema Nacional de Farmacovigilancia Andorrana.
El estudio que se presenta es de carácter observacional, longitudinal y está aprobado por el comité ético del HNSM, en el que se analizan las sospechas de RAM notificadas durante los años 2008 a 2016 en el programa de farmacovigilancia del HNSM.
Los datos recogidos fueron los consignados en la tarjeta amarilla: fecha de notificación, sistema de notificación, personal notificador (farmacéutico, médico, enfermería, técnicos), datos biodemográficos del paciente, servicio clínico del ingreso y médico responsable, fecha de la RAM, medicamento/s sospechoso/s y grupo/s terapéutico/s, manifestación clínica y órganos afectados, actuación ante la RAM, necesidad o no de tratamiento farmacológico, gravedad, causalidad y desenlace. Dispone de un campo de observaciones adicionales para datos analíticos, alergias conocidas, factores de riesgo o exposición previa al medicamento.
El método de detección se clasificó en voluntario, intensivo, prospectivo y retrospectivo. Los medicamentos sospechosos y los grupos terapéuticos a los que pertenecían se clasificaron con la Clasificación Anatomo-Clínica11, y las manifestaciones clínicas y órganos afectados con la clasificación System and Organ Class12. La gravedad de las RAM fue clasificada en leve, moderada y grave, considerando grave la definición de la OMS13. La causalidad se estableció mediante el algoritmo de Karch-Lasagna14, agrupada en probable (definida y probable), no probable y dudosa. El desenlace de la RAM se clasificó como: paciente recuperado, en recuperación, recuperado con secuelas y muerte.
Análisis estadístico de los datos
Se realizó un análisis estadístico descriptivo de todas las variables recogidas. Para las variables cuantitativas continuas se estimó la media y el rango intercuartílico. Para las variables cualitativas se realizó una tabla de frecuencias, con frecuencias absolutas y relativas. Para el cálculo de los datos se utilizó el software estadístico G-Stat 2.0.
Resultados
Se analizaron 2.631 RAM en 2.436 pacientes (52% varones) con una media (rango) de edad de 63,3 (0-98) años. En el 7,4% de los pacientes se detectó más de una RAM.
Las RAM fueron notificadas en un 92,8% de los casos por el farmacéutico y en un 7,2% mediante notificación espontánea por personal médico, de enfermería y técnicos. En el 25,9% de las RAM se consideró implicado más de un principio activo. El 63,7% de las RAM se detectaron en pacientes hospitalizados, mientras que el 19,2% fueron detectadas en urgencias, el 10,6% en consultas externas, el 6,2% en el hospital de día y el 0,3% en la unidad de radiodiagnóstico.
Se observó un cambio de tendencia según el método de detección de las RAM desde el año 2008 al 2016. A partir del quinto año, las RAM identificadas mediante CMBD disminuyeron, incrementándose las detectadas mediante farmacovigilancia prospectiva (PEA) o intensiva (Figura 1).

Figure 1. Evolución del número de reacciones adversas a medicamentos detectadas según el método de detección durante los años 2008 a 2016.
Las RAM se detectaron mayoritariamente en pacientes asignados a medicina interna (50%), oncología (10%), neumología (9%), urgencias (4,4%) y reumatología (2,8%).
El grupo farmacológico implicado con más frecuencia fue el de los antineoplásicos, responsable del 21,3% de las RAM, correspondiendo el 17,4% a tratamientos por vía oral. Determinados principios activos destacaron como responsables de las RAM de su grupo terapéutico (Figura 2), aunque en algunos grupos se observó una gran variabilidad en los principios activos implicados.

Figure 2. Grupos terapéuticos implicados en las reacciones adversas por medicamentos y principios activos mayoritarios. Para cada grupo terapéutico de la figura se indica el principio activo más frecuente.
Las RAM detectadas afectaron mayoritariamente a la piel y anejos y al sistema gastrointestinal, mientras que las infecciones y las afectaciones musculoesqueléticas fueron las menos notificadas (Figura 3).

Figura 3. Distribución de las manifestaciones clínicas causadas por las reacciones adversas a medicamentos.
El 92,8% de las RAM se consideraron probables, el 6,7% dudosas y el 0,5% no probables. En cuanto a la gravedad, el 38,7% de las RAM fueron leves, el 30,5% moderadas y el 30,8% graves. Por grupos terapéuticos (Tabla 1), se observó cómo los antineoplásicos y los antitrombóticos presentaron principalmente manifestaciones clínicas sanguíneas y causaron un alto porcentaje de reacciones adversas graves. Por otra parte, los antibacterianos y los analgésicos afectaron con más frecuencia a la piel y anejos, y causaron en una mayor proporción reacciones adversas leves. En ambos casos, las RAM llevaron a la interrupción del tratamiento.
Tabla 1. Manifestaciones clínicas, gravedad y actuación seguida en las reacciones adversas detectadas para los grupos terapéuticos implicados con mayor frecuencia
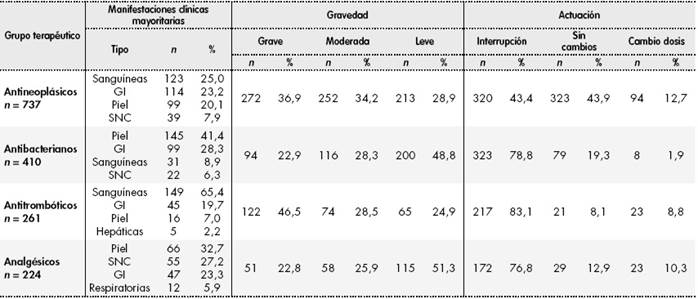
GI: tracto gastrointestinal; SNC: sistema nervioso central.
La actuación más frecuente fue la interrupción del tratamiento (65%), en el 25,2% de los casos no hubo cambios y en el 9,8% se modificó la dosis. En el 56% de los casos, los pacientes recibieron tratamiento específico adicional.
Mayoritariamente los pacientes se recuperaron de las RAM (60,9%) o se encontraban en recuperación en el momento de la notificación (31,7%). Sólo sufrieron secuelas el 1,8%. El resultado fue desconocido en un 3,7%. En el 1,9% se consideró la RAM causante de la muerte del paciente. Las RAM mortales afectaron a pacientes con 70 (49-97) años. El principal grupo terapéutico implicado fue el de los antineoplásicos (40%).
Los diferentes métodos de detección identificaron RAM graves en un porcentaje similar (retrospectivo CMBD: 34%; prospectivo PEA: 29%; intensivo: 28%; notificación voluntaria 23%). El perfil de RAM detectadas fue diferente para cada método. Por CMBD y por notificación voluntaria se detectaron principalmente RAM por antineoplásicos (17% y 32%) y antibacterianos (12% y 16%). Por vía intensiva, antineoplásicos (48%) y antivirales (18%), mientras que prospectivamente mediante la PEA fueron antibacterianos (17%) y antitrombóticos (12%).
Discusión
El presente estudio muestra los resultados del programa de farmacovigilancia instaurado en nuestro centro, liderado por el servicio de farmacia. Consecuentemente, la gran mayoría de las RAM, casi el 93%, fueron detectadas por el farmacéutico, siendo la participación de otros profesionales aparentemente baja. Sin embargo, la concienciación de la importancia de la notificación de las RAM por parte del colectivo médico contribuye a que incluyan en lenguaje natural las sospechas de RAM en la HCE y los informes de alta, sabiendo que serán recogidas, registradas y notificadas por el farmacéutico hospitalario7.
Existe una elevada variabilidad en la incidencia de las RAM, siendo el método de detección uno de los principales factores a considerar. La notificación espontánea se considera el método más eficiente para la identificación de RAM previamente no conocidas, aunque está asociada a una elevada infranotificación, y sólo el 6-10% de las RAM se detectan por esta vía. La farmacovigilancia retrospectiva permite una revisión sistemática de las HCE, pero está sujeta a la calidad de los datos, filtros y sistemas informáticos utilizados. Por otra parte, la farmacovigilancia prospectiva permite la detección de las RAM en el momento que se producen y puede incluir entrevistas con el paciente o los profesionales sanitarios, incrementando la probabilidad de detección y contextualización, requiriendo, sin embargo, elevados recursos de tiempo y de personal entrenado. La farmacovigilancia intensiva comparte ventajas e inconvenientes de la farmacovigilancia prospectiva, pero de manera más acusada, e implica una búsqueda específica de RAM15.
En nuestro centro se combina más de un método de detección de RAM para maximizar su identificación, como en el 55,2% de los estudios16. En su metaanálisis, Martins et al.15 estimaron que la farmacovigilancia prospectiva fue el método más útil, detectando el 4,7-57,3% de las RAM en los diferentes estudios, seguida de la retrospectiva (1,7-5,6%) y de la intensiva (1,6-4,4%)15. En nuestro estudio, la mitad de las RAM se detectaron por farmacovigilancia retrospectiva, aunque perdió fuerza a partir de 2012 paralelamente a un incremento de la farmacovigilancia prospectiva e intensiva. Esto podría deberse a una mayor implicación, sensibilidad y experiencia de los farmacéuticos en la detección de RAM, que fueron capaces de incorporar esta actividad en su rutina diaria, tal y como recomienda la OMS17.
A diferencia de la gran mayoría de los estudios de farmacovigilancia15,16, en nuestro caso se incluyen datos de todas las áreas del hospital, las producidas durante el ingreso hospitalario, antes de la hospitalización, consultas externas y hospital de día, al ser un programa global del hospital enmarcado dentro de la política de seguridad del paciente. En áreas específicas, como consultas externas y hospital de día, las RAM correspondieron a fármacos biológicos, antirretrovirales, antineoplásicos orales e intravenosos, antivirales e inmunoglobulinas, fármacos con capacidad de producir RAM graves y, muchas veces, fármacos novedosos, en los que la farmacovigilancia cobra especial importancia17. Asimismo, la farmacovigilancia intensiva por el farmacéutico de hospital en urgencias ofrece una oportunidad en la detección de RAM comunitarias que requieren asistencia hospitalaria.
En este estudio, el 50% de las RAM detectadas correspondieron a pacientes asignados en medicina interna. Miguel et al.18 observaron diferencias significativas en la detección de RAM en función del servicio médico, analizando RAM de medicina, cirugía, unidad de cuidados intensivos, pediatría y obstetricia18. La edad, el número y tipo de fármacos prescritos, las comorbilidades, la gravedad de la enfermedad y la duración de la estancia hospitalaria también son factores de riesgo para desarrollar RAM. Así, con cada fármaco adicional, el riesgo de padecer una RAM se multiplica por 1,1 (95% intervalo de confianza 1,06-1,14), por interacciones fármaco-fármaco y efectos aditivos19. Estos datos explicarían nuestros resultados, ya que en unidades médicas es más frecuente el ingreso de pacientes con edad avanzada y, presumiblemente, con más comorbilidades y polimedicados. Además, la estancia media suele ser más larga que en unidades quirúrgicas.
Los principales grupos terapéuticos responsables de RAM fueron, por orden de frecuencia, los antineoplásicos, antiinfecciosos, antitrombóticos, analgésicos, corticosteroides sistémicos y psicolépticos. Existe una elevada variabilidad entre los estudios, pero se estima que antibióticos, anticoagulantes, digoxina, diuréticos, agentes hipoglucemiantes y antiinflamatorios no esteroideos son responsables del 60-70% de las RAM20,21. En aquellos estudios que los incorporan, los agentes antineoplásicos se encuentran entre los tres o cinco grupos de fármacos que causan RAM16. Esta disparidad podría atribuirse al ámbito en que se realizó el estudio y los métodos de detección utilizados, la política de medicamentos de cada hospital y la experiencia del personal. También se observó que no todos los medicamentos contribuyen por igual en las RAM en sus respectivos grupos terapéuticos. Por ejemplo, acenocumarol, metamizol y metilprednisolona fueron responsables de más del 40% de las RAM de sus grupos. Estos datos ayudan a focalizar sobre qué fármacos establecer especial vigilancia en nuestro entorno.
Los órganos más afectados por las RAM fueron la piel y anejos y el tracto gastrointestinal, así como las alteraciones sanguíneas y del sistema nervioso central. En la literatura especializada existe disparidad de hallazgos, siendo el tracto gastrointestinal y el sistema nervioso central los más frecuentes, juntamente con las RAM cutáneas. Las RAM cutáneas son las más fáciles y rápidas de detectar tanto por los pacientes como por el personal sanitario por sus manifestaciones, así como las que afectan al tracto gastrointestinal22. En general, la detección de la RAM depende de la experiencia del personal sanitario, ya que éstas pueden manifestarse de manera insidiosa y ser fácilmente confundidas por manifestaciones clínicas de la propia enfermedad16.
Es importante destacar el elevado porcentaje de RAM graves notificadas. En un estudio previo del mismo centro durante 2004-2007, el 50% de las RAM fueron leves, el 28% graves y el 24% moderadas10. En el período 2008-2016, más amplio, la proporción de leves, graves y moderadas fue muy parecido, del 38,7%, 30,8% y 30,5%, respectivamente, denotando un especial énfasis y priorización en la comunicación de las RAM graves. Además, más de la mitad de las RAM recibieron tratamiento específico adicional, lo que podría estar relacionado con el incremento de detección de RAM graves.
Se observó un diferente patrón en las RAM de los cuatro grupos terapéuticos mayoritarios. Los antineoplásicos y los antitrombóticos, considerados de riesgo, son causantes de RAM mayoritariamente graves y relacionadas con su mecanismo de acción, razón por la cual, la medida terapéutica inmediata es la interrupción del tratamiento. Por otro lado, los antibacterianos y los analgésicos causaron un mayor porcentaje de RAM inesperadas, moderadas y leves, que afectaron a la piel y anejos. No obstante, la actuación en estas RAM fue igualmente la suspensión del tratamiento, posiblemente por disponer de un mayor arsenal terapéutico alternativo o por tratarse de alergias. Finalmente, se observó un 1,9% de muertes, causadas en el 40% de los casos por antineoplásicos. En estas situaciones hay que considerar la complejidad de determinar el grado de implicación directa del medicamento versus la enfermedad subyacente.
Este estudio presenta como limitaciones que no analiza factores relacionados con el desarrollo y duración de la RAM, como el número y el tipo de medicamentos concomitantes, el número de comorbilidades de los pacientes y la estancia hospitalaria. Tampoco determina la presencia de asociaciones entre los factores de riesgo y las RAM detectadas. Por otro lado, es difícil evaluar la incidencia global, dado que se analizan conjuntamente los resultados en diferentes áreas. Sin embargo, se analizan factores poco conocidos, como la actuación ante la RAM, el porcentaje de RAM tratadas, la implicación de más de un principio activo y los resultados por grupo terapéutico.
En resumen, el análisis de las RAM detectadas permite tener un conocimiento más exhaustivo de la seguridad del medicamento en nuestro entorno. Estos nueve años nos han mostrado que la incorporación del programa de farmacovigilancia en la rutina diaria del farmacéutico de hospital aporta un valor añadido en la seguridad y en la farmacoterapia del paciente.
Cómo citar este trabajo:Pérez-Ricart A, Gea-Rodríguez E, Roca-Montañana A, Gil-Máñez E, Pérez-Feliu A. Integrating pharmacovigilance into the routine of pharmacy department: experience of nine years. Farm Hosp. 2019;43(4):128-133.
Presentación en Congresos:"Integración de la farmacovigilancia en un servicio de farmacia: nueve años de experiencia”: 62.º Congreso de la Sociedad Española de Farmacia Hospitalaria, Madrid, 18-21 de octubre de 2017.
Aportación a la literatura científica:
Existen contadas unidades activas de farmacovigilancia en los servicios de farmacia hospitalarios españoles. Además, la mayoría de la bibliografía constituye estudios específicos de estimación de reacciones adversas en diferentes contextos y en períodos acotados en el tiempo. Nuestro programa de farmacovigilancia permite aportar un valor añadido a la seguridad del paciente, ya que se encuentra integrado en el trabajo diario de los farmacéuticos hospitalarios de manera continuada y exhaustiva en todos sus ámbitos de actuación, lo que permite analizar las reacciones adversas globalmente o por variables seleccionadas de interés. Conocer los medicamentos mayormente implicados en las reacciones adversas permite establecer programas de seguridad específicos, tanto hospitalarios como en la población general
Este programa de farmacovigilancia, por la magnitud y diversidad de los datos recogidos por el farmacéutico de hospital, representa una innovación en el ámbito de la farmacia hospitalaria
REFERENCIAS
1. Montpart E, Martín MP. El sistema español de farmacovigilancia. Offarm. 2003;22(2):120-8. [ Links ]
2. Esteban C, Gil A, Ibáñez C. 25 años de farmacovigilancia en Madrid. Boletín informativo del centro de farmacovigilancia de la Comunidad de Madrid. Boletín RAM. 2017;24(1):1-8. [ Links ]
3. World Health Organization. Pharmacovigilance (Web page) (accessed 1/1/2018). Available at:https://www.who.int/medicines/areas/quality_safety/safety_efficacy/pharmvigi/en/ [ Links ]
4. Vasen W, Florentino RML. Farmacovigilancia: una herramienta poco utilizada. Medicina (Buenos Aires). 2006;66:257-62. [ Links ]
5. World Health Organization. Formulario modelo de la OMS 2004 (Web page) (accessed 1/1/2018). Available at:http://apps.who.int/medicinedocs/pdf/s5422s/s5422s.pdf [ Links ]
6. European Commission. Memo/08/782. Strengthening pharmacovigilance to reduce adverse effects of medicines (monograph on Internet) (accessed 1/2/2018). Available at:http://europa.eu/rapid/press-release_MEMO-08-782_es.htm?locale=EN [ Links ]
7. Pérez-Ricart A, Gea Rodríguez E, Gil Máñez E, Pérez-Feliu A, Roca Montañana A, Pascual Martínez O. Implicación del farmacéutico de hospital en la farmacovigilancia. El Farmacéutico Hospitales. 2017;211:10-4. [ Links ]
8. Hospital Nostra Senyora de Meritxell. Memòria Hospital Nostra Senyora de Meritxell (monograph on Internet) (accessed 1/1/2018). Available at: http://www.saas.ad [ Links ]
9. Pérez-Ricart A, Roca Montañana A, Gil Máñez E, Pascual Martínez O, Pérez-Feliu A, Gea Rodríguez E. Integración de la farmacovigilancia en un servicio de farmacia: nueve años de experiencia. En: Libro de comunicaciones. 62 Congreso de la Sociedad Española de Farmacia Hospitalaria. Madrid: 2017 (monograph on Internet) (accessed 1/1/2018). Available at:https://www.sefh.es/eventos/62congreso/img/libro-comunicaciones-62-congreso-sefh.pdf [ Links ]
10. Nadal Llover M, Gea Rodríguez E, Gil Máñez E, García Fernández M, Barral Viñals N. Cuatro años de experiencia del servicio de farmacia como responsable del servicio de farmacovigilancia. Farm Hosp. 2008;32(Espec Congr):217-8. [ Links ]
11. World Health Organization. ATC/DDD Index 2019 (Web page) (accessed 1/4/2019). Available at:https://www.whocc.no/atc_ddd_index/ [ Links ]
12. World Health Organization. The WHO Adverse Reaction Terminology-WHO-ART (Web page) (accessed 1/4/2019). Available at:https://www.who-umc.org/whodrug/whodrug-portfolio/ [ Links ]
13. Organización Mundial de la Salud. Vigilancia de la Seguridad de los medicamentos. Guía para la instalación y puesta en funcionamiento de un Centro de Farmacovigilancia. Uppsala: UMCHWO, 2001 (monograph on Internet) (accessed 1/4/2019). Available at:http://www.essalud.gob.pe/ietsi/pdfs/informacion_tecnica/OMS_guia_farmacovigilancia.pdf [ Links ]
14. Karch FE, Lasagna L. Adverse drug reactions. JAMA. 1975;234:1236-9. [ Links ]
15. Martins ACM, Giordani F, Rozenfeld S. Adverse drug events among adult inpatients: a meta-analysis of observational studies. J Clin Pharm Ther. 2014;39:609-21. [ Links ]
16. Giordani F, Rozenfeld S. Adverse drug events in hospitals: a systematic review. Cad Saude Publica. 2009;25(Supl 3):S360-72. [ Links ]
17. World Health Organization. Quality Assurance and Safety of Medicines Team. Safety of medicines. A guide to detecting and reporting adverse drug reactions. Why health professionals need to take action. Geneva: World Health Organization; 2002 (monograph on Internet) (accessed 1/4/2019). Available at: http://www.who.int/iris/handle/10665/67378 [ Links ]
18. Miguel A, Azevedo LF, Araújo M, Costa A. Frequency of adverse drug reactions in hospitalized patients: a systematic review and meta-analysis. Pharmacoepidemiol Drug Saf. 2012;21:1139-54. [ Links ]
19. Berihum D, Yenet W, Tiwari P. Prevalence and assessment of factors contributing to adverse drug reactions in wards of a tertiary care hospital, India. Ethiop J Health Sci. 2013;23(1):39-48. [ Links ]
20. Walsh D, Lava A, Cushen A-M, Williams D. Adverse drug reactions as a cause of admission to a Dublin-based university teaching hospital. Ir J Med Sci. 2015;184:441-7. [ Links ]
21. Wiffen P, Gill M, Edwards J, Moore A. Adverse drug reactions in hospital patients: a systematic review of the prospective and retrospective studies. Bandolier. 2002;1-14. [ Links ]
22. Doshi MS, Patel PP, Shan SP, Dikshit RK. Intensive monitoring of adverse drug reactions in hospitalised patients. J Pharmacol Pharmacother. 2012;3(4):308-13. [ Links ]
Recibido: 26 de Octubre de 2018; Aprobado: 18 de Abril de 2019











 texto em
texto em 




