Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.43 no.5 Toledo Set./Out. 2019 Epub 14-Out-2019
https://dx.doi.org/10.7399/fh.11170
ORIGINALES
OTAC: Optimización de la Terapia Antibiótica en el paciente Crítico. Antibióticos betalactámicos en perfusión continua
1Servicio de Farmacia. Hospital Universitari de Bellvitge- IDIBELL. Hospitalet de Llobregat, Barcelona. Spain.
2Servicio de Medicina intensiva. Hospital Universitari de Bellvitge-IDIBELL . Hospitalet de Llobregat, Barcelona, Spain.
4Departamento de Farmacia y Tecnología Farmacéutica, Facultad de Farmacia (Universidad de Barcelona).
4Hospital Universitari de Bellvitge-IDIBELL. L’Hospitalet de Llobregat. Spain.
Objetivo
Determinar el porcentaje de pacientes, a los que se les administró dosis estándar de piperacilina/tazobactam o meropenem en perfusión continua, que alcanzaban el índice farmacocinético/farmacodinámico diana definido como el 100% del intervalo de administración en que las concentraciones de antibiótico libre fueron cuatro veces iguales o superiores a la concentración mínima inhibitoria (100% fT≥ 4 x CMI).
Método
Datos preliminares obtenidos de un estudio clínico prospectivo que analiza el comportamiento farmacocinético/farmacodinámico de los antibióticos betalactámicos administrados en perfusión continua en pacientes críticos. Se realizó en unidades de cuidados intensivos de un hospital universitario de tercer nivel, desde junio de 2015 a mayo de 2017. Criterios de inclusión: adultos con función renal correcta (filtrado glomerular según la fórmula CKD-EPI ≥ 60 ml/min/1,73 m2) y tratados con dosis estándar de antibióticos betalactámicos en perfusión continua. Las concentraciones en estado de equilibrio estacionario fueron determinadas mediante cromatografía líquida acoplada a espectrometría de masas (UHPLC-MS/MS). Se utilizaron valores de concentración mínima inhibitoria teóricos para microorganismos más resistentes (piperacilina/ tazobactam: 16 mg/l para Pseudomonas aeruginosa y 8 mg/l para Enterobacteriaceae; meropenem: 2 mg/l, independientemente del microorganismo). Además, se realizó un subanálisis de los pacientes con aislamiento microbiológico (concentraciones mínimas inhibitorias reales).
Resultados
Se incluyeron 61 pacientes (25 meropenem y 36 piperacilina/tazobactam). Edad media 59 años (15), mediana de filtrado glomerular 95 ml/min/1,73 m2 (83-115). Mediana de concentraciones en estado de equilibrio estacionario libre: 16 mg/l (11-29) meropenem y 40 mg/l (21-51) piperacilina. El 88% de los pacientes tratados con meropenem alcanzaron el objetivo farmacocinético/farmacodinámico, sin diferencias entre Enterobacteriaceae y Pseudomonas. En el caso de piperacilina/tazobactam, el 61% y el 11% de los pacientes alcanzaron la diana, considerando Enterobacteriaceae y Pseudomonas como microorganismo sospechoso. Un total de 35 (57%) pacientes presentaron aislamiento microbiológico. El 94% de ellos alcanzaron la diana, sin diferencias entre los dos antibióticos.
Conclusiones
Ante la sospecha de infecciones por microorganismos con concentraciones mínimas inhibitorias elevadas (Pseudomonas aeruginosa o enterobacterias), se observa que dosis convencionales de meropenem en perfusión continua son suficientes para lograr la diana 100% fT≥ 4 x MIC. Sin embargo, se requerirían dosis superiores de piperacilina/tazobactam. En casos de aislamiento microbiológico, dosis estándar de ambos antibióticos fueron suficientes para lograr la diana. La monitorización farmacocinética es altamente recomendable para la optimización terapéutica.
PALABRAS CLAVE: Betalactámicos; Cuidados intensivos; Farmacocinética; Monitorización de fármacos; Piperacilina; Meropenem
Introducción
La sepsis es una de las principales causas de mortalidad en las unidades de cuidados intensivos (UCI) y afecta a 19 millones de pacientes en el mundo1. El inicio rápido y precoz de una adecuada terapia antibiótica dentro de la primera hora del diagnóstico de sepsis o shock séptico es primordial para reducir la mortalidad y la morbilidad2. Sin embargo, el abordaje terapéutico de estos pacientes viene condicionado por su particular fisiopatología3.
Los antibióticos más utilizados en UCI son los betalactámicos (ABL) (penicilinas, cefalosporinas, carbapenémicos), especialmente para combatir infecciones por gramnegativos. El último informe del Estudio Nacional de Vigilancia de Infección Nosocomial en Servicios de Medicina Intensiva (ENVIN-HELICS) sobre la evolución de estas infecciones en 205 UCI españolas confirma el dominio de los bacilos gramnegativos, siendo Escherichia coli (13%), Pseudomonas aeruginosa (13%) y Klebsiella pneumoniae (11%) los primeros responsables4.
Los ABL son antibióticos dependientes del tiempo5 y su índice farmacocinético/farmacodinámico (PK/PD) relacionado con la eficiencia bactericida viene determinado por el porcentaje de tiempo del intervalo de administración en que la concentración de antibiótico libre (f Css) supera la concentración mínima inhibitoria (CMI) del microorganismo sospechoso o causante de la infección (%fT> CMI)6.
Todavía existe controversia en la definición, tanto del valor del porcentaje de tiempo, como en el número de veces en que las fCss deben mantenerse por encima de la CMI (ratio Css/CMI)3. Inicialmente se estableció que el %fT> CMI debería ser del 50% para penicilinas y del 40% para carbapenémicos3. Sin embargo, en pacientes críticos se postula la necesidad de establecer un objetivo PK/PD más estricto, de manera que se incrementa hasta alcanzar fCss por encima de la CMI durante el 100% del intervalo de administración. Incluso existen autores que proponen f Css hasta cuatro veces la CMI durante todo el intervalo de administración (100% fT≥ 4 x CMI ) asegurando la actividad bactericida y minimizando la emergencia de resistencias7,8.
La administración clásica mediante infusión intermitente (PI) puede comprometer el alcance del índice PK/PD a pesar de ser el modo de administración más empleado9. La PI implica oscilaciones de concentraciones plasmáticas que pueden llevar a niveles insuficientes10. Esta situación se ve agravada en pacientes críticos que presentan alteraciones farmacocinéticas (incremento del volumen de distribución y aclaramiento del fármaco, sobre todo en aquellos con función renal incrementada) y muestran una elevada probabilidad de sufrir infecciones por microorganismos con CMI elevadas11. Publicaciones previas indican que la perfusión continua (PC), como forma de administración alternativa, sería superior a la PI, ya que garantizaría Css superiores a la CMI durante más tiempo y, como consecuencia, mejores resultados clínicos12 13-14.
Dichas premisas avalan la hipótesis de que la PC permitiría mantener fCss superiores a la CMI y constantes durante todo el intervalo de administración y se podrían conseguir beneficios clínicos.
El objetivo principal fue determinar el porcentaje de pacientes críticos, tratados con piperacilina/tazobactam (PTZ) o meropenem (MER), administrados en PC, que alcanzarían el 100% fT≥ 4 CMI . Los objetivos secundarios fueron: 1) determinar el porcentaje de pacientes que alcanzarían una diana PK/PD menos exigente (100% fT≥ CMI), y 2) evaluar si existen diferencias en el índice PK/PD alcanzado según la función renal.
Métodos
Diseño
Estudio prospectivo y PK en pacientes adultos ingresados en UCI de un hospital de tercer nivel, en tratamiento antibiótico empírico o dirigido con ABL por sospecha de infección por gramnegativos. Los ABL estudiados fueron PTZ, MER, aztreonam, cefepime y ceftazidima. En este artículo se presentan datos de PTZ y MER por ser fármacos con mayor número de casos en el momento del análisis intermedio. Actualmente el estudio sigue abierto, en fase de reclutamiento, procesamiento y análisis de muestras, pero se presentan resultados preliminares de los dos primeros años (junio de 2015-mayo de 2017).
El protocolo de estudio fue aprobado por el Comité de Ética local previamente al inicio, de acuerdo con la Declaración de Helsinki. Se solicitó consentimiento informado al paciente o familiar antes de su inclusión.
Población de estudio
Criterios de inclusión: i) pacientes ingresados en UCI; ii) tratados con ABL o susceptibles de recibirlos; iii) ≥ 18 años y iv) función renal conservada, definida como filtrado glomerular (GFR) ≥ 60 ml/min/1,73 m2, según la fórmula CKD-EPI15. Se excluyeron pacientes embarazadas.
Datos recogidos
Los datos demográficos, clínicos y analíticos fueron obtenidos del registro electrónico del hospital.
Se recogió además información farmacológica sobre el antibiótico administrado, la dosis, el momento y frecuencia de administración, la duración de infusión y el tiempo de muestreo.
Dosis y administración de fármacos
Los antibióticos fueron administrados en PC, a dosis estándar. Los pacientes recibieron una dosis de choque seguida de la dosis total diaria en PC; aquellos ya tratados con PI durante más de 24 horas podían iniciar PC sin necesidad de dosis de choque, puesto que estaban en equilibrio estacionario. Las infusiones de PTZ se cambiaron cada 24 horas (concentración: 80 mg/ml en suero fisiológico (SF) al 0,9%; estabilidad: 24 horas a 25 °C)16 y las de MER cada 12 horas (concentración: 22 mg/ml SF al 0,9%; estabilidad: 17 horas a 25 °C)16. La dosis máxima protocolizada fue 12/1,5 g/día para piperacilina (PIP)/tazobactam y 6 g/día para MER.
Determinación de concentraciones plasmáticas
Se extrajeron muestras (5 ml) de sangre 30 minutos postadministración de la dosis de choque (o tras la administración de mínimo cuatro dosis de la terapia PI) y a las 24 horas postinicio de la PC (Css). Se midieron las concentraciones totales de los ABL de las muestras obtenidas mediante UHPLC-MS/MS, utilizando un procedimiento previamente desarrollado y validado17. Brevemente, después de una precipitación de proteínas de las muestras con acetonitrilo y posterior dilución con agua, los eluatos obtenidos fueron introducidos en una columna C18 de fase inversa usando un gradiente agua/acetonitrilo con ácido fórmico. Posteriormente, los ABL fueron detectados mediante un espectrómetro de masas de triple cuadrupolo trabajando en las modalidades de ionización por electroespray en modo positivo (ESI+) y monitorización de reacción múltiple (MRM). Los tiempos de retención obtenidos fueron: 1,08 minutos para el MER y 1,91 minutos para la PIP. El tiempo de procesamiento por muestra fue de 3,5 minutos. Los límites de cuantificación obtenidos fueron 0,58 y 0,54 mg/l para PIP y MER, y los valores de imprecisión y sesgo inferiores a 13,3% y 14,7%, respectivamente.
Diana farmacocinética/farmacodinámica
El índice PK/PD se calculó mediante el cociente f Css/CMI. La magnitud del índice PK/PD diferenció la diana empleada como objetivo principal (100% fT≥ 4 x CMI) y secundario (100% f T≥ CMI). Sólo se analizaron las Css. Se asumió 30% de unión a proteínas plasmáticas para PIP18 y 2% para MER18.
Se consideraron CMI teóricas para bacterias menos sensibles según el European Commitee on Antimicrobial Susceptibility Testing’s (EUCAST)19: Pseudomonas aeruginosa (PA), 2 mg/l para MER y 16 mg/l para PTZ y Enterobacteriaceae, 2 mg/l para MER y 8 mg/l para PTZ. Se realizó un subanálisis de los pacientes con aislamiento microbiológico empleando CMI reales (método E-test).
Análisis estadístico
Se usó una base de datos anonimizada. El análisis estadístico se realizó mediante el paquete estadístico SPSS v.22.0 (SPSS Inc., Chicago, IL). Los datos y resultados se expresan como medianas (IQR) o medias (SD) para variables continuas y como frecuencias y porcentajes para variables categóricas. El análisis de las diferencias en el alcance de la diana PK/PD según la función renal se realizó mediante la prueba de la χ2.
Resultados
Datos demográficos y clínicos
Se reclutaron 77 pacientes. De ellos, 16 pacientes fueron excluidos por desviaciones en el protocolo: 12 por falta de muestras para determinar la Css, 2 por falta de información sobre el tiempo de muestreo y 2 por errores en la extracción de muestras. Finalmente, se incluyeron 61 pacientes (25 MER y 36 PTZ). Las características basales se muestran en la Tabla 1.
Tabla 1. Características demográficas y clínicas de la población de estudio

APACHE: Acute Physiology and Chronic Health Evaluation; IQR: rango intercuartílico; MER: meropenem; Md: mediana; PTZ: piperacilina/tazobactam; sd: desviación estándar; SNC: sistema nervioso central; SOFA: Sequential Organ Failure Assessment; VM: ventilación mecánica; x: media.
Datos farmacocinéticos/farmacodinámicos
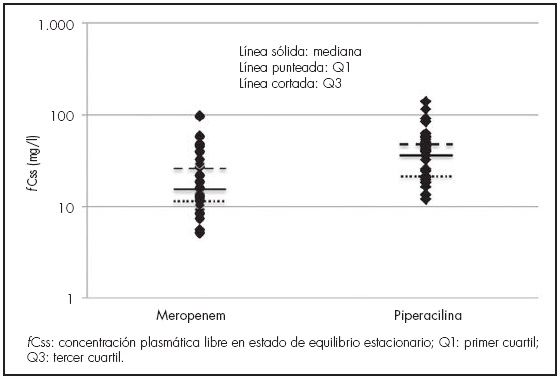
Se analizaron las muestras de todos los pacientes, aunque sólo las Css fueron utilizadas para la obtención de resultados. La mediana de la fCss para MER fue 16 mg/l (11-29) y 40 mg/l (21-51) para PIP (Figura 1).
Objetivo primario (100% f T≥ 4 x CMI)
Asumiendo valores de CMI teóricas para todos los pacientes, el 43% (PA) y el 72% (Enterobacteriaceae) de los pacientes alcanzarían diana PK/PD. De forma global, 36 pacientes presentaron aislamiento microbiológico y en 35 de ellos se conoció la CMI exacta. Más del 90% alcanzaron el objetivo PK/PD primario (95% en el caso de PTZ y 94% en MER) (Tabla 2).
Tabla 2. Distribución de pacientes en función del alcance del objetivo farmacocinético/farmacodinámico principal y secundario y en función de los intervalos de filtrado glomerular calculados

CMI: concentración mínima inhibitoria; fCss: concentración plasmática de fármaco libre en estado estacionario; GFR: filtrado glomerular; MER: meropenem; PIP: piperacilina; PK/PD: farmacocinética/farmacodinámica.
*Valor p: prueba de la χ2.
¥Los porcentajes de pacientes que alcanzaron diana en cada grupo de GFR se calcularon a partir de la totalidad de pacientes pertenecientes a cada estrato GFR.
°La descriptiva de los microorganismos se detalla en la tabla 1.
Objetivos secundarios
Más del 90% de los pacientes alcanzarían diana PK/PD 100% fT≥ CMI , tanto en los supuestos teóricos como en los reales (Tabla 2). No se detectaron diferencias entre grupos de GFR establecidos, aunque se observó una tendencia al no alcance de la diana en pacientes con GFR ≥ 120ml/min. En la Figura 2 se muestra el cociente fCss/CMI según el GFR.
Discusión
El presente estudio confirmó los resultados descritos previamente por otros autores9,20,21 en el sentido de que la administración en PC se postula como una alternativa simple a la administración clásica para evitar la infra-exposición en pacientes críticos. Estudios publicados por Dulhunty et al.9 y Abdul-Aziz et al.20,21 incluyen pacientes con características equiparables, a los que se les administra ABL en PI o PC y se analizan las diferencias en el índice PK/PD en ambos grupos. El estudio de Dulhunty et al., que utiliza las mismas dosis de antibiótico que en el presente estudio, muestra que, en el grupo de PC, el 82% de los pacientes logra Css por encima de la CMI para PA (el 100% y el 75% de las fCss de MER y PIP, respectivamente)9. En el estudio de Abdul-Aziz et al. se analiza la exposición alcanzada después de la administración de PTZ 18 g/día, MER 3 g/día y cefepime 6 g/día. Los resultados muestran que el 97% de las f Css del grupo de PC alcanzan el objetivo 100% fT> CMI. Es destacable que dosis superiores de PTZ permiten alcanzar una fCss mediana de 4 CMI en el 100% de los pacientes, a diferencia de los resultados expuestos. Las distintas exposiciones obtenidas tanto con PTZ como MER se podrían explicar por diferencias en la mediana del GFR entre la población objeto de estudio (95 ml/min/1,73 m2) y la de Abdul-Aziz et al. (64 ml/min)20. Se obtuvieron incluso resultados superiores a los publicados por otro estudio de Abdul-Aziz et al., que logra fCss> 4 x CMI en el 31% de los pacientes del grupo de PC (comparado con 43% en nuestro trabajo)21.
En relación con la incertidumbre en la ratio f Css/CMI y el porcentaje de tiempo3,7, estudios in vitro y modelos animales demuestran que las Css en regímenes de PC deben mantenerse 4-5 veces la CMI para conseguir una adecuada tasa de curación. La mayoría de estos estudios se realizan con bacterias gramnegativas resistentes (CMI de 64 mg/l para ceftazidima)22. Por ello se focalizó el objetivo secundario sobre el 100% del tiempo en lugar del 40-50% descrito en estudios previos3, ya que en la cohorte de pacientes críticos se postula que mayor porcentaje de tiempo del intervalo de administración con Css > CMI conlleva mayor probabilidad de supervivencia (odds ratios 1,02 (intervalo de confianza (CI) del 95%; 1,01 a 1,04) para 50% fT > CMI y 1,56 (95% CI; 1,15 a 2,13) para 100% fT> CMI)6. Una limitación fue la determinación de la función renal usando la fórmula CKD-EPI. Dicho cálculo se realizó por imposibilidad de recolectar orina de 8-24 horas y medir la creatinina directa13,23. Además, se consideró que la fórmula CKD-EPI propone un cálculo más preciso y evita infraestimaciones en GFR ≥ 60 ml/min15. Algunos estudios publicados24 demuestran que los pacientes con función renal aumentada tienen menor probabilidad de alcanzar el objetivo PK/PD. En este estudio se observó una falta de significación estadística en el alcance de la diana en aquellos pacientes con GFR elevados que se podría explicar por el pequeño tamaño muestral. En análisis posteriores se incluirán un mayor número de pacientes con el fin de obtener resultados más robustos y poder compararlos con los obtenidos en estudios previos.
En este estudio se consideró realizar dos análisis según el valor de la CMI. Debido a que en el 50% de los casos no se aisló microorganismo, se analizaron el objetivo principal y el secundario asumiendo CMI teóricas, según el valor del punto de corte según el EUCAST. Este aspecto se considera otra limitación, ya que sobreestimó la magnitud de pacientes que no alcanzaron la diana PK/PD. Aun así, la aproximación realizada es representativa de las situaciones clínicas reales en las que raramente se dispone de la CMI en el momento de instaurar tratamiento antibiótico. Otro factor importante que afecta a la PK es la hipoalbuminemia, descrita en el 40% de los pacientes críticos25. Puesto que la porción de fármaco libre es responsable del efecto bactericida, la medida de las concentraciones plasmáticas totales puede conducir a infra o sobreestimación de las fCss. Esta situación queda relegada a ABL con elevada unión a proteínas (superior al 70%, ceftriaxona o ertapenem)26, sin ser considerada una limitación para MER (muy baja unión a proteínas plasmáticas) y PIP (unión moderada)27. Aun así, se analizaron concentraciones no unidas (libres) para ser más precisos en los resultados. Finalmente, cabe destacar que no se pueden definir intervalos terapéuticos, puesto que estos dependen de la CMI del microorganismo, clínica/toxicidad del paciente y fisiopatología que puede comprometer su exposición (volumen de distribución elevado o hiper-filtración)24,28. Dado que no existe un rango establecido para este tipo de antibióticos, se tomaron como referencia valores máximos umbrales considerados concentraciones tóxicas en estudios previos: PIP 150 mg/l (fCss 105 mg/l)29 y MER 64 mg/l (fCss 62 mg/l)30.
Es necesaria la realización de más ensayos clínicos con el objetivo principal de establecer la diana terapéutica y su impacto clínico en la población de pacientes críticos.
Ante la sospecha de infecciones por microorganismos con CMI elevadas (Pseudomonas aeruginosa o enterobacterias, comunes en la UCI) se observó que dosis convencionales de MER en PC son suficientes para lograr las dos dianas establecidas. Sin embargo, se requerirían dosis superiores de PTZ para alcanzar 100% fT≥ 4 x CMI . En cambio, se observó que en los casos con aislamiento microbiológico (CMI conocidas), dosis estándar tanto de MER como de PTZ eran suficientes para obtener ambas dianas PK/PD. Este estudio detectó una ligera tendencia hacia concentraciones subterapéuticas en pacientes con función renal elevada, pero no se consideró concluyente. La monitorización farmacoterapéutica es altamente recomendable para optimizar los tratamientos en pacientes críticos.
Agradecimientos
A todos los participantes en el estudio, por su buena disposición, hacer y compromiso.
Cómo citar este trabajo:Esteve-Pitarch E, Padullés-Zamora A, Maisterra-Santos K, Grupo Multidisciplinar OTAC Hospital Universitari de Bellvitge, Colom-Codina H, Cobo-Sacristán S. OTAC: Optimización de la Terapia Antibiótica en el paciente Crítico. Antibióticos betalactámicos en perfusión continua. Farm Hosp. 2019;43(5):151-7.
Aportación a la literatura científica:Se pretende estudiar el comportamiento farmacocinético de los betalactámicos administrados en perfusión continua con el objetivo de optimizar dicha terapia antibiótica. La perfusión continua, junto con la monitorización de sus concentraciones plasmáticas, permite individualizar las dosis administradas según la situación clínica y la concentración mínima inhibitoria del microorganismo causante o sospechoso de infección. En este contexto, la monitorización terapéutica de fármacos puede ser útil para conocer cómo influye la fisiopatología del paciente crítico en los niveles plasmáticos de dichos fármacos y ser útil para la toma de decisiones clínicas.
Financiación:Este estudio ha sido financiado gracias a la ayuda para proyectos de investigación que nos concedió la Sociedad Española de Farmacia Hospitalaria (Convocatoria de Ayudas a Proyectos de Investigación de la SEFH 2013/2014. EPA056/14 ATB-2014-01).
REFERENCIAS
Angus DC, Van der Poll T. Severe sepsis and septic shock. N Engl J Med. 2013;369(9):840-51. DOI: 10.1056/NEJMra1208623 [ Links ]
Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017;43(3):304-77. DOI: 10.1007/s00134-017-4683-6 [ Links ]
Roberts JA, Abdul-Aziz MH, Lipman J, Mouton JW, Vinks AA, Felton TW, et al. Individualised antibiotic dosing for patients who are critically ill: challenges and potential solutions. Lancet Infect Dis. 2014;14(6):498-509. DOI: 10.1016/S1473-3099(14)70036-2 [ Links ]
Grupo de trabajo de enfermedades infecciosas y sepsis. Estudio nacional de vigilancia de infección nosocomial en servicios de medicina intensiva (EVIN-HELICS). Informe 2017 (monograph on Internet). Barcelona, España: Sociedad Española de Medicina Intensiva y Unidades Coronarias (SEMICYUC); 2017 (accessed 20/2/2018). Available at: http://hws.vhebron.net/envin-helics/ [ Links ]
Roberts JA, Lipman J. Pharmacokinetic issues for antibiotics in the critically ill patient. Crit Care Med. 2009;37(3):840-51. DOI: 10.1097/CCM.0b013e3181961bff [ Links ]
Roberts JA, Paul SK, Akova M, Bassetti M, De Waele JJ, Dimopoulos G, et al. DALI: Defining Antibiotic Levels in Intensive Care Unit Patients: Are Current β-Lactam Antibiotic Doses Sufficient for Critically Ill Patients? Clin Infect Dis. 2014;58(8):1072-83. DOI: 10.1093/cid/ciu027. [ Links ]
Roberts JA, Ulldemolins M, Roberts MS, McWhinney B, Ungerer J, Paterson DL, et al. Therapeutic drug monitoring of β-lactams in critically ill patients: proof of concept. Int J Antimicrob Agents. 2010;36(4):332-9. DOI: 10.1016/j.ijantimicag.2010.06.008 [ Links ]
Delattre IK, Taccone FS, Jacobs F, Hites M, Dugernier T, Spapen H, et al. Optimizing β-lactams treatment in critically-ill patients using pharmacokinetics/pharmacodynamics targets: are first conventional doses effective? Expert Rev Anti Infect Ther. 2017;15(7):677-88. DOI: 10.1080/14787210.2017.1338139 [ Links ]
Dulhunty JM, Roberts JA, Davis JS, Webb SAR, Bellomo R, Gomersall C, et al. Continuous Infusion of Beta-Lactam Antibiotics in Severe Sepsis: A Multicenter Double-Blind, Randomized Controlled Trial. Clin Infect Dis. 2013;56(2):236-44. DOI: 10.1093/cid/cis856 [ Links ]
Abdul-Aziz MH, Dulhunty JM, Bellomo R, Lipman J, Roberts JA. Continuous betalactam infusion in critically ill patients: the clinical evidence. Ann Intensive Care. 2012;2(1):37. DOI: 10.1186/2110-5820-2-37 [ Links ]
Abdul-Aziz MH, Lipman J, Mouton JW, Hope WW, Roberts JA. Applying Pharmacokinetic/Pharmacodynamic Principles in Critically Ill Patients: Optimizing Efficacy and Reducing Resistance Development. Semin Respir Crit Care Med. 2015;36(1):136-53. DOI: 10.1055/s-0034-1398490 [ Links ]
Rhodes NJ, Liu J, O’Donnell JN, Dulhunty JM, Abdul-Aziz MH, Berko PY, et al. Prolonged Infusion Piperacillin-Tazobactam Decreases Mortality and Improves Outcomes in Severely Ill Patients. Crit Care Med. 2018;46(2):236-43. DOI: 10.1097/CCM.0000000000002836 [ Links ]
Dhaese SAM, Roberts JA, Carlier M, Verstraete AG, Stove V, De Waele JJ. Population pharmacokinetics of continuous infusion of piperacillin in critically ill patients. Int J Antimicrob Agents. 2018;51(4):594-600. DOI: 10.1016/j.ijantimicag.2017.12.015 [ Links ]
Frippiat F, Musuamba FT, Seidel L, Albert A, Denooz R, Charlier C, et al. Modelled target attainment after meropenem infusion in patients with severe nosocomial pneumonia: The PROMESSE study. J Antimicrobial Chemother. 2015;70(1):207-16. DOI: 10.1093/jac/dku354 [ Links ]
Florkowski CM, Chew-Harris JSC. Methods of Estimating GFR - Different equations including CKD-EPI. Clin Biochem Rev. 2011;32(2): 75-9. [ Links ]
IBM Watson Health. IBM Micromedex® web applications access (data base on Internet). Greenwood Village, Colorado, USA: ©Copyright IBM Corporation 1/6/1970 (30/6/2019; 12/10/2018). Available at: https://www.micromedexsolutions.com/ [ Links ]
Rigo-Bonnin R, Ribera A, Arbiol-Roca A, Cobo-Sacristán S, Padullés A, Murillo Ò, et al. Development and validation of a measurement procedure based on ultra-high performance liquid chromatography-tandem mass spectrometry for simultaneous measurement of β-lactam antibiotic concentration in human plasma. Clin Chim Acta. 2017;468:215-24. DOI: 10.1016/j.cca.2017.03.009 [ Links ]
Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Centro de información online de medicamentos (CIMA) de la AEMPS (data base on Internet). Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad 30/12/1997 (15/4/2016; 20/7/2018). Available at: https://www.aemps.gob.es/cima/inicial.do [ Links ]
European Society of Clinical Microbiology and Infectious Diseases (ESCMID). Clinical breakpoints-bacteria (v 9.0) (data base on Internet). Sweden: The European Commitee on Antimicrobial Susceptibility Testing (EUCAST) 12/2/1983 (1/1/2019; 20/2/2019). Available at: http://www.eucast.org/clinical_breakpoints/ [ Links ]
Abdul-Aziz MH, Sulaiman H, Mat-Nor MB, Rai V, Wong KK, Hasan MS, et al. Beta-Lactam Infusion in Severe Sepsis (BLISS): a prospective, two-centre, open-labelled randomised controlled trial of continuous versus intermittent beta-lactam infusion in critically ill patients with severe sepsis. Intensive Care Med. 2016;42(10):1535-45. DOI: 10.1007/s00134-015-4188-0 [ Links ]
Abdul-Aziz MH, Lipman J, Akova M, Bassetti M, Waele JJ, Dimopoulos G, et al. Is prolonged infusion of piperacillin/tazobactam and meropenem in critically ill patients associated with improved pharmacokinetic/pharmacodynamic and patient outcomes? An observation from the Defining Antibiotic Levels in Intensive care unit patient (DALI) cohort. J Antimicrob Chemother. 2016;71:196-207. DOI: 10.1093/jac/dkv288 [ Links ]
Mouton JW, den Hollander JG. Killing of Pseudomonas aeruginosa during continuous and intermittent infusion of ceftazidime in an in vitro pharmacokinetic model. Antimicrob Agents Chemother. 1994;38: 931-6. [ Links ]
Aardema H, Nannan Panday P, Wessels M, van Hateren K, Dieperink W, Kosterink JGW, et al. Target attainment with continuous dosing of piperacillin/tazobactam in critical illness: a prospective observational study. Int J Antimicrob Agents. 2017;50(1):68-73. DOI: 10.1016/j.ijantimicag.2017.02.020 [ Links ]
Carrié C, Petit L, d’Houdain N, Sauvage N, Cottenceau V, Lafitte M, et al. Association between augmented renal clearance, antibiotic exposure and clinical outcome in critically ill septic patients receiving high doses of β-lactams administered by continuous infusion: a prospective observational study. Int J Antimicrob Agents. 2018;51(39):443-9. DOI: 10.1016/j.ijantimicag.2017.11.013 [ Links ]
Wong G, Brinkman A, Benefield RJ, Carlier M, De Waele JJ, El Helali N, et al. An international, multicentre survey of β-lactam antibiotic therapeutic drug monitoring practice in intensive care units. J Antimicrob Chemother. 2014;69(5):1416-23. DOI: 10.1093/jac/dkt523 [ Links ]
Wong G, Briscoe S, Adnan S, McWhinney B, Ungerer J, Lipman J, et al. Protein binding of β-lactam antibiotics in critically ill patients: can we successfully predict unbound concentrations? Antimicrob Agents Chemother. 2013;57(12):6165-70. DOI: 10.1128/AAC.00951-13 [ Links ]
Ulldemolins M, Roberts JA, Rello J, Paterson DL, Lipman J. The effects of hypoalbuminaemia on optimizing antibacterial dosing in critically ill patients. Clin Pharmacokinet. 2011;50(2):99-110. DOI: 10.2165/11539220-000000000-00000 [ Links ]
Stevens LA, Coresh J, Greene T, Levey AS. Assessing kidney function: measured and estimated glomerular filtration rate. N Engl J Med. 2006;354(23):2473-83. DOI: 10.1056/NEJMra054415 [ Links ]
Blondiaux N, Wallet F, Favory R, Onimus T, Nseir S, Courcol RJ, et al. Daily serum piperacillin monitoring is advisable in critically ill patients. Int J Antimicrob Agents. 2010;35(5):500-3. DOI: 10.1016/j.ijantimicag.2010.01.018 [ Links ]
Roberts JA, Kirkpatrick CM, Roberts MS, Robertson TA, Dalley AJ, Lipman J. Meropenem dosing in critically ill patients with sepsis and without renal dysfunction: intermittent bolus versus continuous administration? Monte Carlo dosing simulations and subcutaneous tissue distribution. J Antimicrob Chemother. 2009;64(1):142-50. DOI: 10.1093/jac/dkp139 [ Links ]
Anexo 1.
Grupo multidisciplinar PROA-OTAC, Hospital Universitari de Bellvitge
Víctor Daniel Gumucio-Sanguino1, Anna Farré-Estebe1, Laura Anguela-Calvet1, Joan Sabater-Riera1, Xosé Pérez-Fernández1, Mariel Rojas-Lora1, Raúl RigoBonin2, Fe Tubau-Quintano3 y Evelyn Shaw-Perujo4.
1Servicio de Medicina Intensiva, Hospital Universitario Bellvitge-IDIBELL, Hospitalet de Llobregat. España.2Servicio de Bioquímica, Hospital Universitario Bellvitge-IDIBELL, Hospitalet de Llobregat. España.3Servicio de Microbiología, Hospital Universitario Bellvitge, Hospitalet de Llobregat. España.4Servicio de Enfermedades Infecciosas, Hospital Universitario Bellvitge-IDIBELL, Hospitalet de Llobregat. España.
Recibido: 30 de Octubre de 2018; Aprobado: 12 de Mayo de 2019











 texto em
texto em