Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.44 no.2 Toledo Mar./Abr. 2020 Epub 28-Set-2020
https://dx.doi.org/10.7399/fh.11290
Origianales
Consenso para identificar los riesgos de los medicamentos peligrosos en los servicios de farmacia hospitalaria
1Departamento de Salud Pública e Historia de la Ciencia, Universidad Miguel Hernández, Campus de Sant Joan d'Alacant, Alicante. Spain.
2Servicio de Farmacia de Área, Hospital General Universitario de Alicante, Alicante. Spain.
3Servicio de Farmacia, Hospital General Universitario de Alicante, Alicante. Spain.
4Servicio de Farmacia, Hospital General Universitario de Elche, Elche (Alicante). Spain.
5Unidad de Hospitalización a Domicilio, Hospital General Universitario de Alicante, Alicante. Spain.
6Instituto de Investigación Sanitaria y Biomédica de Alicante (ISABIAL-FISABIO), Alicante. Spain.
Objetivo:
Identificar los peligros y definir los riesgos laborales teóricos derivados del proceso de manipulación de los medicamentos peligrosos en los servicios de farmacia hospitalaria mediante un consenso de expertos.
Método:
Se realizó un consenso de expertos (grupo nominal y técnicas documentales) utilizando un método mixto mediante dos rondas presenciales (reunión de los participantes y aprobación de propuestas) y tres rondas en mascaradas (revisión del material de forma individual). El análisis se aplicó al ámbito de la farmacia hospitalaria y las etapas del proceso se diseñaron mediante notación gráfica normalizada Business Process Modeling Notation.
Resultados:
Se obtuvo el diagrama de flujo específico para la gestión y trazabilidad de los medicamentos peligrosos, caracterizándose cada una de las fases del proceso general, recopiladas en un cuadro de gestión de etapas y operaciones de recepción y almacenamiento, elaboración, con servación y dispensación de medicamentos peligrosos en los servicios de farmacia hospitalaria, que sirvió para la posterior descripción de riesgos químicos y vías de exposición.
Conclusiones:
Los medicamentos peligrosos deben integrarse en un sistema normalizado de gestión con el fin de mejorar la seguridad del paciente y de los profesionales sanitarios, a la vez que se maximizan la efi ciencia de los recursos y minimizan los incidentes procesales, garantizando la calidad y la seguridad del proceso de manipulación de medicamentos peligrosos en los servicios de farmacia.
Sería deseable, una vez se han identificado los peligros, llevar a cabo una evaluación de los riesgos siguiendo una metodología sistemática y de abordaje preventivo que permita calibrar la probabilidad de ocurrencia y la gravedad de cualquier suceso adverso.
PALABRAS CLAVE: Sustancias peligrosas; Antineoplásicos; Citostáticos; Salud laboral; Control de calidad; Evaluación del proceso; Gestión de la información
Introducción
La manipulación de medicamentos peligrosos (MP), según la Agencia Europea para la Seguridad y la Salud en el Trabajo (EU-OSHA), es uno de los factores de riesgo más importantes para la salud de los profesionales sanitarios1. El dato es contundente: se estima que en Europa hay más de 12,7 millones de profesionales sanitarios que manipulan MP, lo que implica que en este mismo continente la exposición laboral cause, según estimacio nes, 2.220 nuevos casos de leucemia que dan lugar a 1.467 muertes de profesionales sanitarios2.
El término «medicamento peligroso» es definido por el National Institute for Occupational Safety and Health (NIOSH) como cualquier fármaco que haya demostrado, tanto en estudios animales como en humanos, carcinogenicidad, teratogenia u otra toxicidad para el desarrollo, genotoxicidad, toxicidad reproductiva y/o toxicidad en órganos a dosis bajas, así como aquellos fármacos con estructura o perfiles de toxicidad similares a otros fármacos existentes considerados peligrosos con anterioridad3.
Es evidente, por tanto, que los MP conllevan un riesgo químico para los profesionales implicados en su manipulación, tal y como demuestran numerosos estudios4 5 6 7 8 9 10 11 12-13.
En este sentido, la evaluación de riesgos se torna uno de los puntos clave en la gestión y control del proceso de los MP, dado que sobre sus resultados se sustentan todas las medidas adoptadas para garantizar la seguridad del proceso14. Con este fin, existen múltiples modelos de eva luación de riesgos descritos en la literatura científica15, y aunque cada uno presenta sus peculiaridades, todos ellos tienen como común denominador el primer paso, indispensable para su correcta gestión: la identificación de los peligros asociados al proceso.
No obstante, aunque a nivel normativo así se exige16 y existe concien cia sobre su necesidad, los trabajos que describen un análisis de riesgos aplicado a los MP son escasos: en el año 2009, un equipo francés de farmacéuticos de hospital aplicó la metodología de «análisis de peligros y puntos críticos de control» al proceso de preparación en el servicio de farmacia, limitando su propuesta a los medicamentos antineoplásicos17 y, salvo omisión, hasta la fecha el grupo de consenso americano para los MP, The Hazardous Drug Consensus Group, es el único que ha establecido una propuesta metodológica concreta para llevar a cabo un análisis de riesgos aplicado a los MP18.
Por todo lo mencionado, el objetivo de este trabajo fue identificar los peligros y definir los riesgos laborales teóricos derivados del proceso de manipulación de los MP en los servicios de farmacia hospitalaria mediante un consenso de expertos.
Métodos
Diseño
Se realizó un consenso de expertos (grupo nominal y técnicas docu mentales) utilizando un método mixto mediante dos rondas presenciales (reunión de los participantes y aprobación de propuestas) y tres rondas enmascaradas (revisión del material de forma individual). El desarrollo del trabajo se realizó entre noviembre de 2018 y mayo de 2019.
Grupo de expertos
Para la selección del grupo de expertos se establecieron los siguientes criterios objetivos:
Conocimientos y experiencia previa: experiencia profesional de más de cinco años en un puesto donde se manipulen MP o se realice la evaluación de riesgos.
Ámbito: atención primaria, hospitalaria, domiciliaria o salud pública
Procedimiento
El consenso se desarrolló en siete fases que se detallan a continuación:
Fase 1 (fase previa al consenso de expertos): Revisión bibliográfica de los antecedentes y protocolos relacionados con la vigilancia de peligros (retroalimentación controlada), a través de la identificación, re cogida y análisis de documentos relacionados con el hecho o contexto estudiado. Esta revisión fue publicada en el año 20189.
Fase 2 (noviembre-diciembre 2018): Preparación de la documentación inicial y generación del primer flujograma y su cuadro de gestión.
Fase 3 (enmascarada) (enero 2019): Revisión de este material y aporte de correcciones.
Fase 4 (presencial) (febrero 2019): Puesta en común de las aportaciones realizadas y corrección de los documentos.
Fase 5 (enmascarada) (marzo 2019): Nueva revisión de los documentos y nuevas aportaciones si se consideraba necesario.
Fase 6 (presencial) (abril 2019): Aceptación de las últimas revisiones realizadas y generación del material corregido.
Fase 7 (enmascarada) (mayo 2019): Aprobación final del material por unanimidad: flujograma y cuadro de gestión.
Etapas del proceso
Se diseñó mediante notación gráfica normalizada Business Process Mo deling Notation (BPMN) el flujograma que simboliza el esquema general de la gestión operativa de la cadena logística del MP en los servicios de farmacia hospitalaria. A partir de éste, se efectuó una gestión total de la trazabilidad de cada una de las etapas, realizando para cada una de ellas los diagramas BPMN20, desarrollándose finalmente el cuadro de gestión correspondiente. Este modelo, implementado anteriormente por Bernabeu Soria et al.21, permitió analizar y caracterizar cada uno de los pasos dentro del proceso, lo que facilitó el análisis de cada uno de ellos y la determi nación de los posibles peligros. Además, esta técnica fue implantada y verificada con éxito por Cervera Peris et al22. Esta metodología permitió que los procesos pudieran ser fácilmente escalados (ampliados), si en al gún momento hubiera sido necesario, permitiendo eficiencia y eficacia ante cualquier cambio o nuevo requerimiento. Las etapas a controlar se obtuvie ron a partir de la revisión sistemática llevada a cabo por Bernabeu et al.9: recepción y almacenamiento, elaboración, conservación y dispensación.
Comprobación in situ
A partir de los documentos desarrollados se llevó a cabo la identificación de cada una de las etapas, operaciones y de sus posibles puntos de control. Posteriormente se verificó en el lugar donde se realizan las operaciones, la correspondencia entre los documentos desarrollados (diagrama de flujo y cuadro de gestión) y las etapas que configuran el proceso de manipulación deMP.
Nomenclatura
El léxico aceptado y utilizado en la generación de los documentos fue:
Proceso: conjunto de actividades interrelacionadas que se llevan a cabo de forma ordenada por parte de un grupo de actores para alcan zar un fin predefinido.
Etapa: cada subproceso existente en el flujograma final.
Operación: cada una de las actividades o pasos que conforman una etapa.
-
Peligro: agente con capacidad intrínseca potencial para causar daño a la salud del profesional sanitario15, clasificándose según su naturaleza en:
- Peligro físico: objetos o fragmentos de éstos que puedan causar lesiones al trabajador.
- Peligro biológico: cualquier tipo de microorganismo procedente de un paciente que, bien por contacto directo o indirecto (a través de tejidos y/o fluidos del paciente), puedan producir una infección en el profesional sanitario.
- Peligro químico: agente químico (MP) que por su capacidad intrínse ca tóxica pueda causar daño al personal que lo manipule.
-
Riesgo: posibilidad de que un trabajador sufra un determinado daño derivado de la exposición a un peligro15, categorizándose en:
Riesgo físico: cortes con vidrio y otros materiales, pinchazos con objetos punzantes, etc.
Riesgo biológico: exposición a agentes infecciosos vía parenteral (pinchazos tras administración de un MP a un paciente infectado).
Riesgo químico: exposición al MP por vía inhalatoria, a través de piel o mucosas, contacto con ojos, ingestión y parenteral.
Resultados
El promedio de años de experiencia de los/las expertos/as fue de 22 ± 3,17, mediana igual a 25,50, con máximo de 28 y mínimo de 8 años; en todos los casos el grado de cumplimiento de los criterios ob jetivos de elección fue del 100%. Las características de los expertos que conformaron el grupo se resumen en la Tabla 1.
Diagrama de flujo y cuadro de gestión
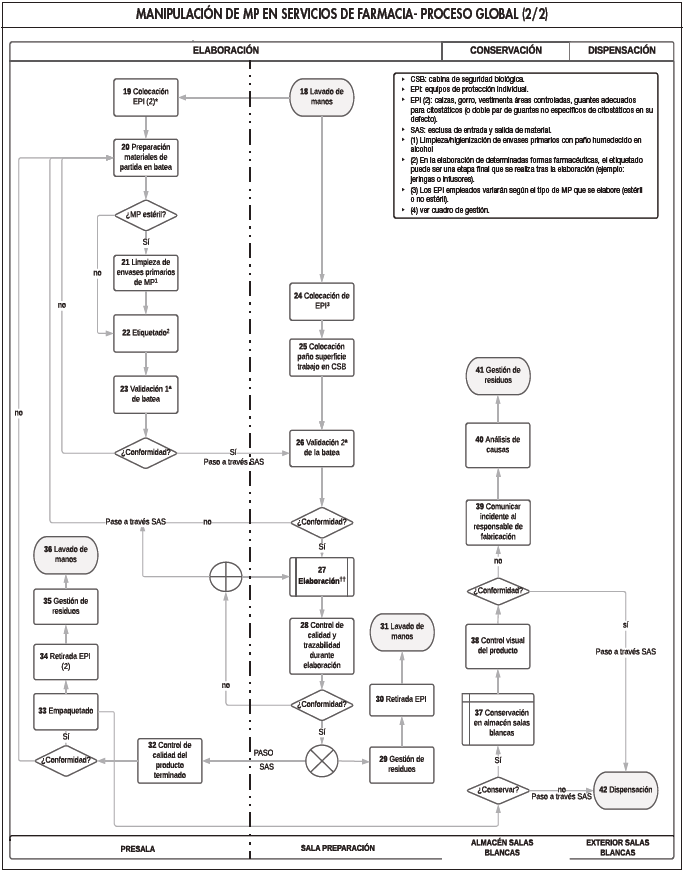
A partir del consenso de expertos se diseñó, como paso previo, el es quema general del proceso (Figura 1), que facilitó el desarrollo del proceso global (Figura 2). En esta figura se describieron todas y cada una de las etapas que integraban el procedimiento de gestión de la trazabilidad del MP en los servicios de farmacia hospitalaria, lo que permitiría su seguimien to y reproducibilidad.
Cada una de las etapas fue recogida en una tabla con el fin de sistema tizar y facilitar la comprensión de los resultados, codificándose para cada etapa del proceso las siguientes variables (Tabla 2): etapa, operación y nú mero de operación (número que aparece en cada una de las operaciones del flujograma y que facilita su identificación en los diferentes documentos), presencia de peligro (sí/no) y tipo de peligro identificado (químico y físico) y vías de exposición a los MP (piel y mucosas, ingestión, vía ocular, inyec ción y vía ocular).
Tabla 2. Cuadro de gestión de riesgos por etapas



†Número que aparece en cada una de las operaciones del flujograma y que facilita su identificación en la tabla.
††Ver flujograma.
1La operación 10 sólo se realizará si la persona responsable de transportar los MP desde el almacén general a las salas blancas no llevaba puesto los EPI previamente en la zona de almacén; 2 el lavado de manos suele consistir en una higienización de éstas con solución antiséptica cuando no se ha de salir de las salas blancas porque el trabajo en ellas no ha finalizado. Si se sale de éstas, el lavado de manos se realiza con agua y jabón; 3los EPI que se utilicen para la elaboración variarán en función del tipo de MP elaborado (estéril o no estéril); 4 en el caso de elaboración de formas farmacéuticas a partir de MP contenido en ampolla, la utilización de agujas se hace necesaria; 5 redosificar formas sólidas íntegras: partir, cortar, triturar comprimidos, abrir cápsulas; 6 la retirada de EPI se realiza paulatinamente, conforme se pasa de salas con diferentes grados de calidad ambiental, siguiendo el procedimiento normalizado de trabajo establecido.EPI: equipos de protección individual; i.m.: intramuscular; i.t.: intratecal; i.v.: intravenoso; MP: medicamento peligroso; s.c: subcutáneo.
Se establecieron 42 operaciones correspondientes a las cuatro eta pas del proceso de manipulación llevadas a cabo en los servicios de farmacia hospitalaria: 17 (40,5%) operaciones en la recepción y alma cenamiento, 19 (45,2%) correspondientes a la etapa de elaboración, 5 (12%) actividades durante la conservación y 1 (2,4%) operación en la dispensación.
Determinación de los posibles peligros
Del estudio del cuadro de gestión, se identificó algún tipo de peligro en 22 operaciones (52,4%). La distribución de estos peligros según su na turaleza fue: 12 operaciones con peligro físico (28,6%) y 22 operaciones con peligro químico (52,4%). No se identificó ningún peligro biológico (Tabla 2).
Grado de consenso
El grado de consenso final entre los expertos fue del 100% para todas las etapas, operaciones y peligros identificados, si bien el desarrollo de la etapa de recepción y almacenamiento fue la que mayor discrepancia inicial suscitó. En los casos en los que hubo desacuerdo, se recurrió a la evidencia científica disponible hasta llegar al 100% de nivel de acuerdo.
Discusión
El riesgo para la salud del manejo de los MP ha sido estudiado y bien argumentado en la literatura científica y constituye una creciente preocupa ción desde el punto de vista de la salud laboral23.
Este trabajo se focalizó en la identificación y análisis de los peligros y riesgos teóricos derivados de éstos, en el proceso logístico de los MP en los servicios de farmacia hospitalaria, como fase inicial de una evaluación de riesgos. Dicho estudio implicó un conocimiento detallado de la totalidad del proceso y de las etapas que lo componen, resultando crucial el desa rrollo de diagramas de flujo, pues, tal y como establecen Ramos-Merino et al.24, éstos condensan mucha información en poco espacio, representan visualmente el flujo de actividades involucradas y facilitan una rápida y eficaz comprensión del proceso.
Las principales discrepancias entre los expertos surgieron en aquellas etapas menos descritas en la literatura, como es el caso de la recepción y almacenamiento, y donde la variabilidad en la práctica asistencial es mayor, principalmente limitada por los recursos humanos, materiales e ins talaciones disponibles en cada centro sanitario. A pesar de ello, y tras combinar las opiniones de los expertos con la evidencia científica, se llegó a un nivel de acuerdo del 100%.
Del estudio del flujograma del proceso general, llamó la atención que prácticamente la mitad de las operaciones que lo componen se condensan en la etapa de elaboración. Este hecho no es de extrañar, teniendo en cuenta el heterogéneo catálogo de MP que se preparan en los servicios de farmacia en la actualidad (bolsas de infusión, jeringas, infusores, formas tópicas, formas orales sólidas y líquidas, colirios, etc.). Además, en los últimos años, este tipo de procesos han aumentado su complejidad con el fin de dar un paso hacia delante en el control de aspectos críticos que influyen en la seguridad del personal sanitario, del paciente y del propio medicamento. Esto explica la existencia de múltiples operaciones de con trol y protección durante la etapa de elaboración (operaciones 19, 23, 24, 25, 26, 28 y 32 (véanse Tabla 2 y/o Figura 2), así como la utilización de dispositivos y equipos sofisticados que permiten reducir al mínimo posible la contaminación del área de trabajo y del medio ambiente y, por ende, garantizar la seguridad de los trabajadores.
El riesgo principal e inherente a la utilización de los MP es el químico, debido a las características intrínsecas de peligrosidad que los definen (carcinogenicidad, teratogenia, genotoxicidad, toxicidad reproductiva o para el desarrollo o en órganos a dosis bajas). No obstante, el hecho de que durante las etapas de recepción y almacenamiento y elaboración se puedan manipular objetos cortantes y punzantes (como envases de vidrio que contienen el MP y agujas para la elaboración), determinó la existencia adicional, aunque en menor medida, de peligros físicos (operaciones 2, 4-7, 11-13, 20, 21, 27 y 29 de la Tabla 2). No se encontraron peligros bio lógicos, al no existir contacto directo con el enfermo y/o fluidos de éste du rante las etapas del proceso llevadas a cabo en los servicios de farmacia.
Por el contrario, si bien es cierto que existe la posibilidad de que los pe ligros físicos se materialicen (cortes con envases de vidrio o fragmentos de éstos y/o pinchazos con agujas), es importante apuntar que, en la práctica, este tipo de riesgos se han minimizado enormemente debido a la expansión de la utilización de dispositivos y equipos sin agujas, conexiones luer-lock y al uso generalizado de envases destinados a contener los MP de materiales plás ticos tipo poliolefinas, siendo anecdótica la utilización del vidrio, que queda relegado a situaciones puntuales por problemas de incompatibilidad del MP14.
Dada la magnitud del problema, no es de extrañar que en los últimos años, múltiples organizaciones gubernamentales y no gubernamentales, socie dades científicas y paneles de expertos, insten a los responsables de las organizaciones sanitarias a la realización de una evaluación de los riesgos asociados al circuito de utilización de los MP16,18,23,25-27. Identificar el peligro, en cualquier caso, supone el primer paso para mejorar la seguridad laboral.
A pesar de la utilidad de este trabajo como base de futuros proyectos, es necesario mencionar varias limitaciones, la primera de ellas relaciona da con la selección de los expertos. Si bien es cierto que hubiese sido deseable y enriquecedor contar con la opinión de otros perfiles de ex pertos, como especialistas en riesgos laborales, preventivistas o técnicos de salud laboral (por su alto grado de conocimiento en la materia), así como enfermeros o técnicos en farmacia (por ser personal que trabaja directamente en las áreas indicadas), la elevada carga de trabajo y la ausencia de incentivos en el desarrollo de este trabajo hizo que no se consiguiese representación de todos los perfiles deseados. No obstante, es importante apuntar que esta es una fase inicial de identificación y descripción del proceso, preámbulo de un análisis de riesgo en el que se contará con la opinión de un abanico de perfiles más amplio. Por otra parte, la descripción del proceso y la identificación de los peligros están limitadas a la práctica asistencial en dos hospitales y a los conocimientos teóricos (para los que no existe una evidencia sólida, debido, por una parte, a la ausencia de publicación de registros sobre eventos adversos que permitan identificar los peligros, y por otra, a la gran heterogeneidad de las guías publicadas a nivel internacional19, lo que puede mermar la validez externa y la aplicabilidad en otros ámbitos. Sin embargo, el elevado nivel de conocimiento de los participantes en manipulación de MP, apo yada por la revisión sistemática realizada como fase inicial al consenso de expertos, hace pensar que el trabajo desarrollado presenta una alta reproducibilidad. En cualquier caso, el análisis de riesgos es un proceso dinámico, que requiere ser reevaluado periódicamente en base a las no conformidades obtenidas, por lo que cualquier sesgo derivado de la sub jetividad de los expertos participantes podrá ser corregido en un futuro.
Por todo lo anteriormente expuesto, se podría concluir que los MP deben integrarse en un sistema normalizado de gestión con el fin de mejorar la seguridad del paciente y de los profesionales sanitarios, a la vez que se maximizan la eficiencia de los recursos y minimizan los incidentes procesales. Con el sistema propuesto, se permite establecer un sistema global cuyas eta pas quedan totalmente caracterizadas con el fin de garantizar la calidad y la seguridad del proceso de manipulación de MP en los servicios de farmacia.
Sería deseable, una vez se han identificado los peligros, llevar a cabo una evaluación de los riesgos siguiendo una metodología sistemática y de abordaje preventivo que permita estimar la probabilidad de ocurrencia y la gravedad de cualquier suceso adverso.
REFERENCIAS
1. De Jong T, Pawlowska-Cyprysiak K, Hildt-Ciupińska K, Bos E, Nicolescu G, Trifu A, et al. Current and emerging occupational safety and health (OSH) issues in the healthcare sector, including home and community care: European Risk Observatory Report. Luxembourg: European Union Publications Office; 2015. [ Links ]
2. Instituto Sindical de Trabajo, Ambiente y Salud. Cuando los medicamentos son un riesgo. Información para el personal sanitario. (Internet). España: Ministerio de Trabajo, Migraciones y Seguridad Social; 2018 (accessed 18/02/2019). Report No: AS2017-0047. Available at: http://istas.net/descargas/guiamedicamentospeligrosos2018.pdf [ Links ]
3. Burroughs GE, Connor TH, McDiarmid MA, Mead KR, Power LA, Reed LD. NIOSH Alert: preventing occupational exposure to antineoplastic and other hazardous drugs in health care settings. Atlanta, USA: National Institute of Occupational Safety and Health (NIOSH), Department of Health and Human Services, Center for Disease Control and Prevention; 2004. Report No: 2004-165. [ Links ]
4. Rogers B, Emmett EA. Handling Antineoplastic Agents: Urine Mutagenicity in Nurses. Image J Nurs Sch. 1987;19:108-13. [ Links ]
5. Fuchs J, Hengstler JG, Jung D, Hiltl G, Konietzko J, Oesch F. DNA damage in nurses handling antineoplastic agents. Mutat Res. 1995;342:17-23. doi: 10.1016/0165-1218(95)90086-1 [ Links ]
6. Undeğer U, Başaran N, Kars A, Güç D. Assessment of DNA damage in nurses handling antineoplastic drugs by the alkaline COMET assay. Mutat Res. 1999;439:277-85. doi: 10.1016/s1383-5718(99)00002-9 [ Links ]
7. Norppa H, Sorsa M, Vainio H, Gröhn P, Heinonen E, Holsti L, et al. Increased sister chromatid exchange frequencies in lymphocytes of nurses handling cytostatic drugs. Scand J Work Environ Health. 1980;6:299-301. doi: 10.5271/sjweh.2605 [ Links ]
8. Nikula E, Kiviniitty K, Leisti J, Taskinen PJ. Chromosome aberrations in lymphocytes of nurses handling cytostatic agents. Scand J Work Environ Health. 1984;10:71-4. doi: 10.5271/sjweh.2355 [ Links ]
9. McDiarmid MA, Kolodner K, Humphrey F, Putman D, Jacobson-Kram D. Baseline and phosphoramide mustard- induced sister-chromatid exchanges in pharmacists handling anti-cancer drugs. Mutat Res. 1992;279:99-204. doi: 10.1016/0165-1218(92)90067-a [ Links ]
10. Burgaz S, Ozdamar YN, Karakaya AE. A signal assay for the detection of genotoxic compounds: application on the urines of cancer patients on chemotherapy and of nurses handling cytotoxic drugs. Hum Toxicol. 1988;7:557-60. [ Links ]
11. Valanis B, Wollmer W, Labuhn K, Glass A. Occupational exposure to antineoplastic agents and self-reported infertility among nurses and pharmacists. J Occup Environ Med. 1997;39:574-80. doi: 10.1097/00043764-199706000-00013 [ Links ]
12. Valanis B, Wollmer WM, Steele P. Occupational exposure to antineoplastic agents: self-reported miscarriages and stillbirths among nurses and pharmacists. J Occup Environ Med. 1999;41:632-8. doi: 10.1097/00043764-199908000- 00004 [ Links ]
13. Falk K, Gröhn P, Sorsa M, Vainio H, Heinonen E, Holsti LR. Mutagenicity in urine of nurses handling cytostatic drugs. Lancet. 1979;1(8128):1250-1. [ Links ]
14. Bernabeu-Martínez MÁ, García Salom P, Burgos San José A, Navarro Ruiz A, Sanz-Valero J, Wanden-Berghe C. Desarrollo de la gestión del proceso general de la manipulación de los medicamentos peligrosos en las unidades de hospitalización a domicilio. Hosp Domic. 2019;3:9-23. [ Links ]
15. Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT). Guía técnica para la evaluación y prevención de los riesgos relacionados con los agentes químicos presentes en los lugares de trabajo. Madrid, España: INSHT; 2013. [ Links ]
16. Real Decreto 665/1997, de 12 de mayo, sobre la protección de los trabajadores contra los riesgos relacionados con la exposición a agentes cancerígenos durante el trabajo. Boletín Oficial del Estado, n.º 124 (24 de mayo de 1997). [ Links ]
17. Bonan B, Martelli N, Berhoune M, Maestroni ML, Havard L, Prognon P. The application of hazard analysis and critical control points and risk management in the preparation of anti-cancer drugs. Int J Qual Health Care J Int Soc Qual Health Care. 2009;21:44-50. doi: 10.1093/intqhc/mzn052 [ Links ]
18. Hazardous Drug Consensus Group (HDGC). Consensus Statement on the Handling of Hazardous Drugs Per USP Chapter <800> (Internet). L Rad Dillon. USA; 2017 (accessed 20/04/2018). Available at: http://compoundingtoday.com/Compliance/HDCS_Consensus_Statement.pdf [ Links ]
19. Bernabeu-Martínez MA, Ramos Merino M, Santos Gago JM, Álvarez Sabucedo LM, Wanden-Berghe C, Sanz- Valero J. Guidelines for safe handling of hazardous drugs: A systematic review. PloS One. 2018;13:e0197172. doi: 10.1371/journal.pone.0197172 [ Links ]
20. Ramos-Merino M, Álvarez-Sabucedo LM, Santos-Gago JM, Sanz-Valero J. A BPMN Based Notation for the Representation of Workflows in Hospital Protocols. J Med Syst. 2018;42:181. doi: 10.1007/s10916-018-1034-2 [ Links ]
21. Bernabeu Soria B, Mateo García M, Wanden-Berghe C, Cervera Peris M, Piñeiro Corrales G, Sanz-Valero J. Development of the management for parenteral nutrition traceability in a standard hospital. Farm Hosp. 2015;39:358-68. doi: 10.7399/fh.2015.39.6.9689 [ Links ]
22. Cervera Peris M, Alonso Roris VM, Santos Gago JM, Álvarez Sabucedo LM, Wanden-Berghe C, Sanz Valero J. Implantación de un sistema mSalud para la gestión y trazabilidad de la nutrición parenteral domiciliaria. Hosp Domic. 2017;1:129-39. [ Links ]
23. Erce A, editor. Preventing occupational exposure to cytotoxic and other hazardous drugs: European Policy Recommendations (Internet). Brussels, Belgium: Rohde Public Policy; 2016 (accessed 16/10/2018). Available at: https://bit.ly/2qXKWHG [ Links ]
24. Ramos Merino M, Santos Gago JM, Álvarez Sabucedo LM. Hacia una normalización de la representación de flujogramas en el ámbito hospitalario. Hosp Domic. 2019;3:37. [ Links ]
25. International Society of Oncology Pharmacy Practicioners Standards Committee. ISOPP Standards of Practice: Safe Handling of Cytotoxics. J Oncol Pharm Pract. 2007;13 Suppl:1-81. [ Links ]
26. Poveda JL, Zamudio A, Cobos JL, Muedra M, Aparicio J, Barragán MB, et al. Documento de Consenso de Sociedades Científicas: Seguridad del paciente y del profesional sanitario en la preparación y administración de medicinas peligrosas. Madrid, España: Sociedades Científicas Españolas; 2015. [ Links ]
27. Real Decreto 374/2001, de 6 de abril, sobre la protección de la salud y seguridad de los trabajadores contra los riesgos relacionados con los agentes químicos durante el trabajo. Boletín Oficial del Estado, n.º 104 (1 de mayo de 2001). [ Links ]
Financiación: Este trabajo cuenta con una ayuda del Instituto de Salud Carlos III de Madrid, España, mediante el Proyecto de Investigación en Salud con referencia PI16/00788.
Aportación a la literatura científica:
Recibido: 14 de Junio de 2019; Aprobado: 23 de Septiembre de 2019











 texto em
texto em