Introducción
El daño tisular relacionado con la extravasación de antineoplásicos es un evento adverso asociado a su administración intravenosa, siendo el riesgo muy variable. La gravedad puede ir desde un simple eritema hasta la necrosis tisular, requiriendo, incluso, desbridamiento quirúrgico1. La incidencia de extravasaciones oscila entre el 0,10% y el 6,00% por vía periférica, siendo menor por vía central, entre el 0,26% y el 4,70%, pero con una mayor gravedad2. Estas cifras se han reducido en los últimos años, situándose entre el 0,05% y el 5,00%, por las mejoras en formación y la implantación de estrategias para minimizar su incidencia3. La prevención es la mejor medida para el manejo de las extravasaciones, pero cuando se producen se requiere una actuación inmediata para evitar o minimizar el daño tisular asociado, que puede comprometer los resultados en salud del paciente, por posibles retrasos de los esquemas antineoplásicos, así como su calidad de vida y su seguridad.
En los hospitales se dispone de protocolos para el manejo de las extravasaciones, institucionales o regionales, aprobados de forma multidisciplinar, que guían en las actuaciones a implantar en función de la clasificación del daño tisular de los antineoplásicos implicados. Por tanto, conocer el riesgo de daño tisular es un aspecto importante para la toma de decisiones en los protocolos y en la práctica asistencial. Sin embargo, existe variabilidad en esta clasificación según la fuente consultada, e incluso en las categorías para clasificar los antineoplásicos según su potencial de daño tisular4-6, el cual suele definirse en base a la máxima toxicidad descrita. En función de la probabilidad de causar daño en caso de extravasación, los antineoplásicos se clasifican en tres categorías (vesicantes, irritantes y no irritantes) o cinco (vesicantes, exfoliantes, irritantes, inflamatorios y neutros), siendo la primera clasificación la más frecuente en la bibliografía. En el potencial de agresión tisular, si bien depende fundamentalmente del mecanismo de daño celular, influyen otras variables como la concentración, el volumen extravasado, el pH y la osmolaridad, entre otras7,8, lo cual añade dificultad a su clasificación.
La información sobre el efecto y evolución de las extravasaciones está basada mayoritariamente en series de casos o casos aislados, con la excepción de dos pequeños ensayos clínicos realizados con dexrazoxano9. Se dispone de escasa información sobre el daño tisular en las fichas técnicas, algunos estudios están realizados en animales, que no son extrapolables al efecto en humanos, y otros son antiguos, con técnicas y métodos de administración que no son práctica habitual en la actualidad. Ante esta situación de escasa evidencia disponible y de diferentes clasificaciones propuestas en diferentes guías, el grupo de trabajo de extravasaciones del Grupo Español de Farmacia Oncológica (GEDEFO) de la Sociedad Española de Farmacia Hospitalaria (SEFH), se planteó utilizar la metodología Delphi para alcanzar un consenso de expertos en relación con la clasificación de daño tisular de los fármacos antineoplásicos.
El método Delphi es una metodología de consenso que se ha utilizado en el ámbito sanitario cuando la evidencia científica disponible es ausente, escasa o de baja calidad; en ese escenario, la experiencia y la calidad del juicio grupal se considera superior a la individual, al integrar conocimientos y experiencias de todos los miembros del grupo10,11. Además, este método presenta una serie de ventajas al preservar el anonimato en la votación de los evaluadores, y por tanto la independencia en las decisiones de los miembros del grupo. Otras ventajas añadidas son que todos los panelistas tienen la misma oportunidad de contribuir a la decisión final, permite descentralizar el procedimiento y agregar la información y decisiones a través del resumen de los resultados12. En el ámbito de la farmacia hospitalaria, esta metodología se ha utilizado para diseñar encuestas de satisfacción, establecer taxonomía de intervenciones farmacéuticas, seleccionar objetivos de formación o definir indicadores de calidad, entre otras13-16.
El objetivo del presente trabajo es realizar un consenso de expertos, utilizando el método Delphi, para la clasificación del potencial de daño tisular para los antineoplásicos que facilite la toma de decisiones ante una extravasación.
Métodos
Se aplicó el método Delphi modificado para realizar una clasificación del potencial de daño tisular por extravasación de los fármacos antineoplásicos, mediante consenso de expertos. El panel de evaluadores expertos estaba formado por siete farmacéuticos con capacitación en oncología que formaban parte del grupo de trabajo de extravasaciones de GEDEFO, con experiencia previa y publicaciones relacionadas con este tema. Otro miembro del grupo actuó como coordinador. El estudio se realizó de octubre a diciembre de 2019.
Para la clasificación del daño tisular de los antineoplásicos se seleccionaron ocho documentos de referencia, en base a un trabajo preliminar del grupo de trabajo: guías clínicas sobre extravasación publicadas por sociedades científicas o instituciones, bases de datos fuente de consulta habitual y artículos de referencia sobre extravasaciones4-6,17-21. Además, se revisó la búsqueda bibliográfica en PubMed utilizada en la Monografía de Prevención y Tratamiento de extravasaciones de fármacos antineoplásicos (términos de búsqueda: “Antineoplastic Agents”[Mesh]) AND “Extravasation of Diagnostic and Therapeutic Materials”[Majr]. Filtros: población: Humans; Idioma: English, French, Spanish; Filtros avanzados: Title “extravasation”. Periodo: 01/01/2010-30/09/2019), para identificar riesgos emergentes o nuevas evidencias de daño tisular22.
En este consenso se ha adoptado la clasificación clásica de toxicidad tisular (vesicantes, irritantes, no irritantes), por ser la más frecuentemente utilizada en los trabajos y guías publicadas, pero con la modificación propuesta por Conde-Estévez et al.18, que distingue entre los antineoplásicos irritantes de alto y bajo riesgo, por las diferencias asociadas a su manejo para prevenir morbilidad en el paciente. Por tanto, se han clasificado los antineoplásicos en cuatro categorías según la probabilidad de daño tisular asociada a su extravasación: vesicantes (V), irritantes de alto riesgo (IAR), irritantes de bajo riesgo (IBR) y no irritantes (NI). La tabla 1 resume la definición de cada categoría. De la clasificación se han excluido los anticuerpos monoclonales conjugados con radiofármacos, al considerar que el daño tisular está asociado fundamentalmente a la radiación y su manejo difiere del resto de antineoplásicos, la hormonoterapia, fármacos no disponibles actualmente en el arsenal terapéutico, como la mecloretamina, y los antineoplásicos en fase de investigación. Los anticuerpos monoclonales no conjugados se consideraron para la clasificación como grupo.
El coordinador elaboró una tabla inicial donde se indicaba para cada antineoplásico la categoría de daño tisular asignada según los distintos documentos de referencia, que se remitió por correo electrónico a cada uno de los miembros del panel de expertos. A partir de la información contenida en este documento y su experiencia profesional cada evaluador emitió su clasificación (primera ronda), que remitió al coordinador. Este analizó el grado de acuerdo (porcentaje de evaluadores en la categoría más votada) y los comentarios de los miembros del grupo, y generó un nuevo documento indicando para cada antineoplásico la categoría con mayor puntuación y comentarios propuestos de forma anónima. Esta nueva información fue remitida de forma individual a cada experto para reevaluar o mantener su clasificación previa (segunda ronda).
Si al final de la segunda ronda, para algún antineoplásico la concordancia en la clasificación fue inferior al 70% (5/7 miembros del panel), se estudió de forma individual, buscando información adicional para la discusión en grupo de forma no anónima y toma de decisiones grupal.
Por último, la clasificación final se remitió a todos los miembros del grupo para la aprobación individual. Esta clasificación ha sido incluida en la Monografía para la Prevención y Tratamiento de extravasaciones de fármacos antineoplásicos, elaborada por el grupo22.
Se analizaron, para cada ronda, la mediana del grado de consenso con su ámbito intercuartílico (AIQ25-75) y, para cada categoría de daño tisular, los antineoplásicos según el grado de concordancia. Se calculó el porcentaje de antineoplásicos con grado de consenso superior al 85% y del 100%. Si el acuerdo es superior al 80% se considera consenso amplio11,23. Se analizó de forma separada el consenso alcanzado considerando solo los fármacos que presentaban discordancias en la clasificación entre las distintas fuentes consultadas y el grado de acuerdo conseguido en estos.
El tratamiento estadístico se ha realizado con el programa estadístico IBM SPSS v23.0 (IBM SPSS Statistics para Windows, IBM Corporation, Armonk, NY).
Resultados
Tras aplicar los criterios de exclusión definidos se seleccionaron 71 antineoplásicos para evaluar su clasificación de riesgo de daño tisular, considerando los anticuerpos monoclonales no conjugados como un único agente. No se encontró, según la estrategia de búsqueda realizada, bibliografía adicional que aportase nueva información sobre el potencial de daño tisular de los antineoplásicos a clasificar. Los anticuerpos monoclonales no conjugados se clasificaron como NI por acuerdo unánime.
En la primera ronda, la mediana de grado de concordancia fue del 100,0% (AIQ25-75: 71,4-100,0%). Del total de antineoplásicos evaluados, 18 fármacos se clasificaron como vesicantes, 13 como IAR, 14 como IBR y 26 como NI. En el 66,7% (48/71) de los antineoplásicos el grado de concordancia fue igual o superior al 85,7%. La concordancia fue del 100,0% para el 52,1% (37/71) de los antineoplásicos.
Treinta antineoplásicos (42,3%) presentaban variabilidad en la clasificación de daño tisular entre los diferentes documentos de referencia; en estos, la mediana del grado de concordancia fue del 71,4% (AIQ25-75: 57,1-87,7%). De ellos, 3 fármacos se clasificaron como vesicantes, 10 como IAR, 8 como IBR y 9 como NI. En el 40,0% (12/30) el grado de concordancia fue igual o superior al 85,7%.
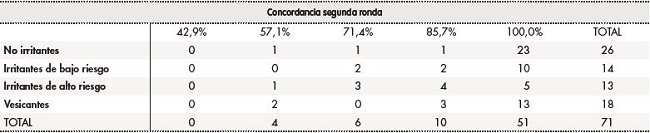
En la segunda ronda, la mediana de grado de concordancia fue del 100,0% (AIQ25-75: 85,7-100,0%). Ninguno de los antineoplásicos modificó su clasificación en la segunda ronda, pero se incrementó el porcentaje de acuerdo. En el 85,9% (61/71) de los antineoplásicos analizados el grado de concordancia entre el grupo de expertos fue igual o superior al 85,7%; en el 71,8% (51/71) se alcanzó el 100,0% de consenso.
El grado de concordancia de los 30 antineoplásicos que presentaban variabilidad en su clasificación entre los documentos de referencia obtuvo una mediana del 100,0% (AIQ25-75: 85,7-100,0%) en la segunda ronda. Ninguno de los antineoplásicos modificó su clasificación. En el 76,7% (23/30) de los antineoplásicos el grado de concordancia fue igual o superior al 85,7%.
Las tablas 2 y 3 resumen el grado de concordancia en la clasificación de daño de riesgo tisular entre la primera y la segunda ronda para cada categoría de daño tisular. El porcentaje de concordancia es menor para las dos categorías de fármacos irritantes.
Tabla 2. Grado de concordancia en la clasificación de antineoplásicos según su capacidad de agresión tisular en caso de extravasación. Primera ronda
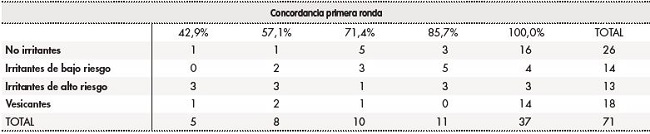
Tabla 3 Grado de concordancia en la clasificación de antineoplásicos según su capacidad de agresión tisular en caso de extravasación. Segunda ronda.
Al final de la segunda ronda, solamente 4 antineoplásicos presentaron un grado de consenso inferior al 70%: busulfán, carmustina, etopósido fosfato y treosulfán. Se discutieron en grupo de forma no anónima. Para carmustina y busulfán se consiguió un acuerdo del 100,0% y para treosulfán del 85,7%. El etopósido fosfato se mantuvo en un grado de acuerdo inferior al 70,0%.
El consenso final de la clasificación de antineoplásicos según capacidad de agresión tisular en caso de extravasación se resume en la tabla 4: 17 antineoplásicos se clasificaron como vesicantes, 15 como IAR, 13 como IBR y 26 como NI. En el 90,1% (64/71) de los antineoplásicos el grado de acuerdo de los revisores en la clasificación de daño tisular fue igual o superior al 85,7%. Para el 74,6% (53/71) de los antineoplásicos la concordancia fue del 100,0%.
Tabla 4. Consenso de clasificación de antineoplásicos según su capacidad de agresión tisular en caso de extravasación.

*Cisplatino: concentraciones mayores de 0,4 mg/ml se clasifican como vesicantes.
**Concentraciones elevadas de carboplatino (≥ 5 mg/ml), etopósido (≥ 10 mg/ml) o fluorouracilo, se asocian a mayor riesgo de daño tisular.
&Las presentaciones liposomales presentan menor riesgo de daño tisular, pero se dispone de escasa información.
Si lo referimos al análisis de los 30 antineoplásicos que presentaban variabilidad en la clasificación en la bibliografía, en el 86,7% (26/30) de los antineoplásicos el grado de concordancia fue igual o superior al 85,7%. En el 60,0% (18/30) el grado de acuerdo fue del 100,0%.
Discusión
El método Delphi es una metodología de consenso que permite tomar decisiones en situaciones de incertidumbre, ampliamente utilizada en el ámbito sanitario en general y de farmacia en particular. En este escenario, las opiniones de los miembros del panel de expertos pueden ayudar en la toma de decisiones y a generar ideas, y se ha utilizado para desarrollar directrices, generar guías, definir indicadores o interacciones clínicamente significativas11,23-26.
No existe un método estándar para calcular el número de expertos necesarios para aplicar el método Delphi, depende del objetivo del estudio y de las fuentes disponibles10. En los trabajos publicados, el número de expertos es variable, oscilando entre 12-1512,14,25, aunque, en general, se considera entre un mínimo de 7 y un máximo de 30 miembros10,13,16. El número del panel de expertos del presente estudio cumple este criterio.
Respecto al número de evaluaciones hasta alcanzar el consenso, la mayoría de los estudios han utilizado dos olas o rondas, aunque también difiere entre los trabajos publicados; en general, en función del grado de consenso alcanzado, se detiene el proceso Delphi cuando se alcanza el consenso predefinido12,14,25,27. En el presente trabajo, tras la segunda ronda, para más del 80% de los antineoplásicos se alcanzó un grado de consenso > 85%. Por categoría de agresión tisular, el grado de consenso alcanzado es menor para los antineoplásicos irritantes, tanto IAR como IBR; este hecho está relacionado con la subclasificación introducida dadas las diferencias en el manejo de la extravasación. Mader propone utilizar la clasificación clásica, por continuar siendo la más empleada, pero indica que otros autores proponen más categorías (cinco grados) en un intento de mejorar la clasificación y el manejo en caso de extravasación6,8, objetivo perseguido en el presente estudio.
El grado de concordancia alcanzado considerado elevado es diferente para los distintos trabajos publicados, del 81,8% al 90,0%12. Algunos autores proponen como umbral de consenso cuando se alcanza al menos el 80% de la concordancia24. Cuando se utilizan valores numéricos (por ejemplo, puntuaciones como la escala de Likert) si la mediana es ≥ 77,77% se considera apropiado11. Se considera desacuerdo o que no se alcanza el consenso cuando al menos un tercio de los evaluadores discrepan del resto11. Si aplicamos las cuatro categorías de recomendación y consenso según los criterios del National Comprehensive Cancer Network (NCCN) (de mayor a menor nivel de evidencia y consenso: 1, 2A, 2B y 3), las recomendaciones del presente panel de expertos se enmarcarían en categoría 2A para la mayoría de los antineoplásicos, al basarse en evidencia de bajo nivel, pero con consenso uniforme de clasificación28.
Aunque el consenso de expertos se considera el nivel más bajo en la pirámide de evidencia, la fortaleza del consenso depende tanto de los inputs disponibles para los expertos (revisión sistemática, experimentos, experiencia personal, estudios cualitativos) como de los métodos utilizados para alcanzar el consenso26. A pesar de sus limitaciones, el presente consenso es un punto de partida que establece una base práctica para realizar recomendaciones de manejo en caso de extravasación de los distintos antineoplásicos, con el objetivo de disminuir la variabilidad de la práctica asistencial.
Es importante destacar que tradicionalmente se ha clasificado en función de la toxicidad de mayor grado publicada, independientemente de su frecuencia real, aunque sea anecdótica o pudiese estar influida por otros factores del paciente o del procedimiento, que podrían condicionar el daño final y los resultados en el paciente. No es posible descartar un sesgo de publicación, de aquellos casos con consecuencias más graves tras la extravasación. Este sesgo puede afectar a la clasificación, sobreestimando el riesgo.
El factor determinante del daño tisular es el mecanismo de acción a nivel celular o molecular propio de cada citotóxico. Sin embargo, otros aspectos también contribuyen al daño tisular, como la concentración, el volumen extravasado, el pH (≤ 5 o ≥ 9), la osmolaridad (> 500 mOsm/l), los excipientes (el polisorbato 80 o el Cremophor EL® aumentan las propiedades irritantes), la formulación (liposomas), o el lugar y tiempo desde que se produce la extravasación hasta que se identifica7. Aunque estas variables no siempre están reflejadas en los casos publicados, pueden afectar al resultado y, por tanto, influir en la clasificación y en la variabilidad encontrada en la bibliografía.
Así, la distinción entre un antineoplásico vesicante o uno irritante no es absoluta, o bien depende de otros factores; por ejemplo, la concentración es una variable que condiciona que el cisplatino se considere IAR si es < 0,4 mg/ml o vesicante en caso contrario, según la mayoría de las guías. Recientemente se ha sugerido que la administración de vincristina diluida reduce su potencial de daño tisular frente a la administración concentrada (1 mg/ml)29. Las presentaciones liposomales se consideran con menor probabilidad de producir lesiones compatibles con daño vesicante, aunque no se distingue habitualmente entre la formulación pegilada frente a la no pegilada. El panel de expertos considera que las presentaciones liposomales presentan menor riesgo de daño tisular, aunque se dispone de escasa información y experiencia publicada. Esta información es todavía más limitada en los antineoplásicos recientemente incorporados en la práctica asistencial. En caso de no disponer de datos del riesgo de agresión tisular de un fármaco, se recomienda clasificarlo como irritante si causa flebitis y/o esclerosis en el lugar de inyección o a lo largo de la vena22. El panel de expertos recomienda incorporar la clasificación de daño tisular cuando se aprueba el uso de un nuevo medicamento antineoplásico en cada institución y actualizarla conforme se disponga de nueva información.
El único fármaco que finalmente mantuvo un consenso < 70% fue el etopósido fosfato, no incluido en muchos de los documentos de referencia revisados (o no diferenciado del etopósido estándar), seguramente por el mayor peso de la experiencia personal de los evaluadores frente a la clasificación de los documentos de referencia, al considerar que el excipiente del etopósido estándar contribuye también al potencial daño tisular.
El presente consenso de clasificación de riesgo tisular presenta diferencias relevantes respecto a las clasificaciones previas de los documentos de referencia: actualiza los fármacos incluidos, distingue los fármacos irritantes en dos categorías, IAR e IBR, en base a su manejo diferenciado, y utiliza una metodología de consenso explícita, ampliamente utilizada en el ámbito sanitario. Así, aplicando los mismos criterios de exclusión de este estudio a los fármacos clasificados en los documentos de referencia revisados, se han clasificado según riesgo de daño tisular 26 fármacos no incluidos en la base de datos Micromedex21 y 30 no incluidos en Uptodate20, así como 15 fármacos más respecto a las guías más recientes o permanentemente actualizadas5,19. La clasificación introducida distingue la gravedad potencial en el caso de extravasación de un agente antineoplásico irritante para orientar su manejo y posterior seguimiento18. Es para los fármacos irritantes donde existen mayores diferencias de clasificación entre las diversas guías, utilizando incluso diferentes terminologías, por ejemplo, irritantes con propiedades vesicantes, inflamatorios y exfoliantes6. Por último, en los documentos revisados no se especifica el método utilizado para realizar la clasificación del riesgo.
En conclusión, en este área de escasa evidencia y variabilidad de clasificación del riesgo de daño tisular entre diferentes documentos, la metodología Delphi de consenso de expertos permite facilitar la toma de decisiones al revisar diferentes fuentes de consulta habitual e incorporar la experiencia de los panelistas. En la clasificación final, aproximadamente para el 90% de los antineoplásicos el grado de concordancia alcanzado por el panel de expertos fue superior al 85%, y para el 74% de los antineoplásicos la concordancia fue del 100%, aportando una base sólida para las decisiones de manejo.















