Introducción
En diciembre de 2019 se notificaron en la ciudad de Wuhan (provincia de Hubei, China) los primeros casos de neumonía por el virus Severe Acute Respiratory Syndrome Coronavirus-2 (SARS-CoV-2), causante de la enfermedad Coronavirus Disease-2019 (COVID-19). Desde entonces, este virus se ha expandido por todo el mundo en forma de pandemia.
Los pacientes COVID-19 suelen presentar fiebre, tos seca, congestión de las vías respiratorias superiores y dificultad para respirar, rara vez dolor de cabeza, hemoptisis y diarrea; igualmente, se ha informado pérdida del olfato (anosmia) y pérdida del gusto (ageusia)1,2.
La pandemia ha provocado una situación sin precedentes, produciendo un número importante de casos notificados, defunciones y, en definitiva, un gran impacto social y económico. La ciencia ha tenido que movilizar todos sus recursos para dar una urgente respuesta a la necesidad de evidencias. A día de hoy hay muchas incógnitas, y la demanda masiva y apremiante de evidencias sobre el tratamiento de la COVID-19. La Sociedad Española de Farmacia Hospitalaria (SEFH) no ha sido ajena a esta situación y puso en marcha el Registro Español de Resultados de Farmacoterapia frente a COVID-19 (RERFAR). Así, este trabajo tiene por el objetivo determinar las características basales que se asocian a una mayor mortalidad a los 42 días en aquellos pacientes hospitalizados por COVID-19 en España.
Métodos
Se realizó un estudio de cohortes prospectivo que incluyó a pacientes hospitalizados con confirmación mediante prueba de reacción en cadena de la polimerasa (PCR) de COVID-19 entre el 20 de marzo y el 15 de julio de 2020 en 174 hospitales españoles. Se fijó un máximo de 200 pacientes por hospital, para evitar una sobrerrepresentación de aquellos hospitales con mayor número de pacientes, realizándose una selección de pacientes mediante un muestreo aleatorio simple. Se alcanzó una muestra de 15.628 pacientes. Se excluyeron aquellos pacientes en los que se registró sospecha de infección nosocomial (n = 227), en caso de que la sintomatología por coronavirus comenzara tras el ingreso.
Variables
La variable dependiente fue la mortalidad a los 42 días. Además, se recogieron los siguientes grupos de variables independientes:
Características demográficas: sexo, edad, índice de masa corporal (peso [kg]/estatura [m2]; inferior < 18,5, normal 18,5-24,9, superior 25-29,9, obesidad > 30), profesional sanitario y estancia previa en residencia sociosanitaria u otro centro asistencial.
Características clínicas previas de los pacientes: hipertensión, diabetes mellitus, enfermedad pulmonar obstructiva crónica (EPOC), asma, insuficiencia cardíaca, cardiopatía isquémica, insuficiencia renal, cirrosis, antecedentes neurológicos, neoplasia activa hematológica/oncológica (tratamiento activo, diagnóstico o recidiva/metástasis hace menos de 5 años, excluyendo diagnóstico de carcinoma espinocelular y basocelular) y virus de la inmunodeficiencia humana (VIH).
Tratamientos previos del paciente: inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de los receptores de angiotensina II (ARA-II), antiinflamatorios no esteroideos (AINE), antihistamínicos H1 (anti-H1) y montelukast.
Situación clínica a la llegada al hospital: frecuencia respiratoria (> 24 rpm), fiebre (≥ 38 °C), saturación de oxígeno (%) y gravedad de la neumonía según la escala CURB-65.
Pruebas analíticas al ingreso: proteína C reactiva (mg/l), transaminasa aspartato aminotransferasa [AST (U/l)], transaminasa alanina aminotransferasa [AST (U/l)], lactato-deshidrogenasa [LDH (U/l)], creatinina (mg/dl), hemoglobina (g/dl), procalcitonina (ng/ml), creatina-quinasa (CPK (U/l), dímero D (ng/ml), ferritina (ng/ml), leucocitos (x 103/mm3), neutrófilos (x 103/mm3), linfocitos (x 103/mm3) y plaquetas (x 103/mm3).
Intervenciones de soporte respiratorio en las primeras 48 horas del ingreso: oxigenoterapia (alto y bajo flujo), ventilación no invasiva y ventilación mecánica.
Tratamientos farmacológicos en las primeras 48 horas del ingreso3: antivirales [lopinavir/ritonavir, remdesivir y otros antivirales (darunavir/cobicistat; darunavir/ritonavir; darunavir/cobicistat/tenofovir/emtricitabina y fosamprenavir)]; inmunosupresores (ciclosporina y tacrolimus), heparinas de bajo peso molecular (dosis profiláctica o de tratamiento), anakinra, tocilizumab, interferón-beta, hidroxicloroquina, cloroquina, azitromicina, antimicrobianos, corticoides y bolo de corticoides.
Instrumentos de medición
La gravedad de la neumonía se evaluó mediante la escala de predicción de mortalidad en pacientes con neumonía adquirida en la comunidad CURB-65. La escala tiene en cuenta las siguientes variables: confusión, urea, frecuencia de la respiración, presión sanguínea y edad. Una puntuación ≥ 2 supone un mayor riesgo de mortalidad4.
Procedimiento
El protocolo del estudio fue aprobado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y resolución de la conformidad de los 174 hospitales participantes. Registro del protocolo en ENCePP® (Registro: EUPAS34343).
El proyecto cuenta con el dictamen favorable del Comité de Ética del Hospital Universitari Mútua Terrassa (23-03-2020). La base de datos está anonimizada, haciendo imposible la identificación de los pacientes. Todas las personas involucradas en el proyecto firmaron un compromiso de confidencialidad con la SEFH. Con objeto de recoger la mortalidad a los 42 días, se consultaron las historias clínicas o se realizó un seguimiento telefónico de los pacientes incluidos para verificar su supervivencia. Si no se logró contactar y en la historia clínica no constaba el exitus, el paciente se registró como vivo.
La información fue extraída por los servicios de farmacia hospitalaria a partir de las historias clínicas de los diferentes hospitales incluidos, y para ello se utilizaron herramientas de captura de datos electrónicos REDCap alojadas en el servidor SEFH5.
Análisis estadístico
Se utilizaron los estadísticos descriptivos habituales (frecuencias, medias, desviación estándar, etc.). En primer lugar, se llevaron a cabo análisis bivariantes entre las diferentes variables independientes y la mortalidad a los 42 días. La medida de asociación utilizada fue la odds ratio (OR) con su intervalo de confianza al 95% (OR IC95%). El control de factores de confusión se realizó mediante regresión logística. Contando con una elevada muestra y un tiempo de observación elevado se prefirió este tipo de análisis sobre la regresión de Cox de tiempo hasta el evento, con el fin de observar el impacto de los diversos factores sobre el resultado final de muerte, diferenciándolo de posibles fenómenos de simple retraso del evento. Se incluyeron en la regresión logística todas las variables que se habían mostrado estadísticamente significativas en el análisis bivariante, forzándose el modelo con aquellas que, a pesar de no mostrar asociación estadísticamente significativa, se sospechó que podían estar asociadas a las variables dependientes o comportarse como factores de confusión. Los modelos se construyeron por el procedimiento “hacia adelante”, donde la bondad del modelo fue comprobada mediante el coeficiente de Hosmer- Lemeshow y se exploró la existencia de interacciones entre las variables. Se estableció un nivel de significación estadística p < 0,05. Todo ello se realizó a través del paquete estadístico R.
Resultados
Un total de 15.628 pacientes fueron incluidos en el estudio; 2.806 pacientes registrados (18,2%) fallecieron en el intervalo de 42 días. En las tablas 1 a 3 se muestran las características basales de los pacientes incluidos en el registro, tanto desde el punto de vista demográfico y clínico, como referente a las comorbilidades previas al ingreso hospitalario, el perfil analítico basal y las diferentes intervenciones iniciadas en las primeras 48 horas de ingreso, tanto farmacológicas como de soporte.
Tabla 1. Características demográficas clínicas y de tratamientos previos y su asociación con la mortalidad a los 42 días

Tabla 1 (cont.). Características demográficas clínicas y de tratamientos previos y su asociación con la mortalidad a los 42 días
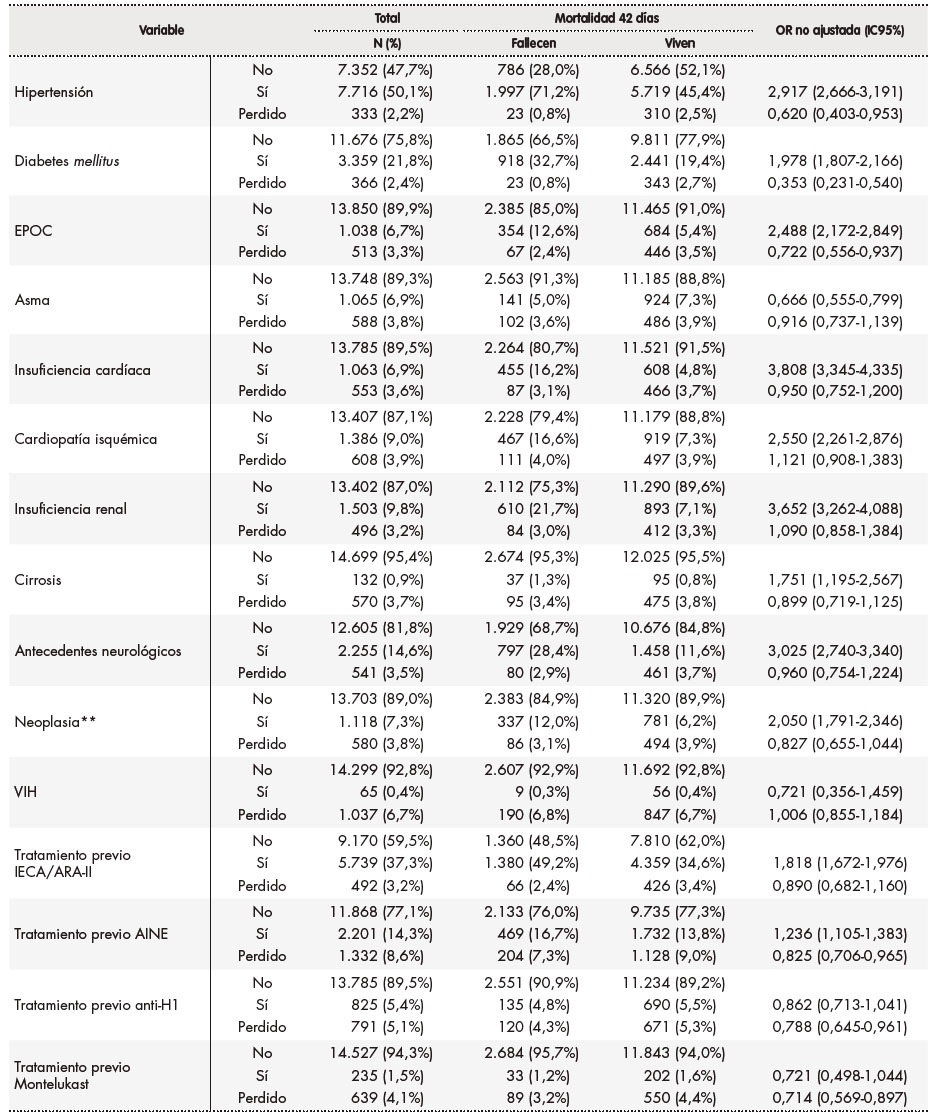
*Frecuencia respiratoria 24 rpm **Neoplasia activa hematológicaoncológica tratamiento activo diagnóstico o recidivametástasis 5 años excluyendo diagnóstico de carcinoma espinocelular y basocelularAINE: antinflamatorio no esteroideo; Anti-H1: antihistamínicos; EPOC: enfermedad pulmonar obstructiva crónica; IC95%: intervalo de confianza al 95%; OR: odds ratio; VIH: virus de la inmunodeficiencia humana.
Tabla 2. Resultados de los parámetros analíticos basales y su asociación con la mortalidad a los 42 días
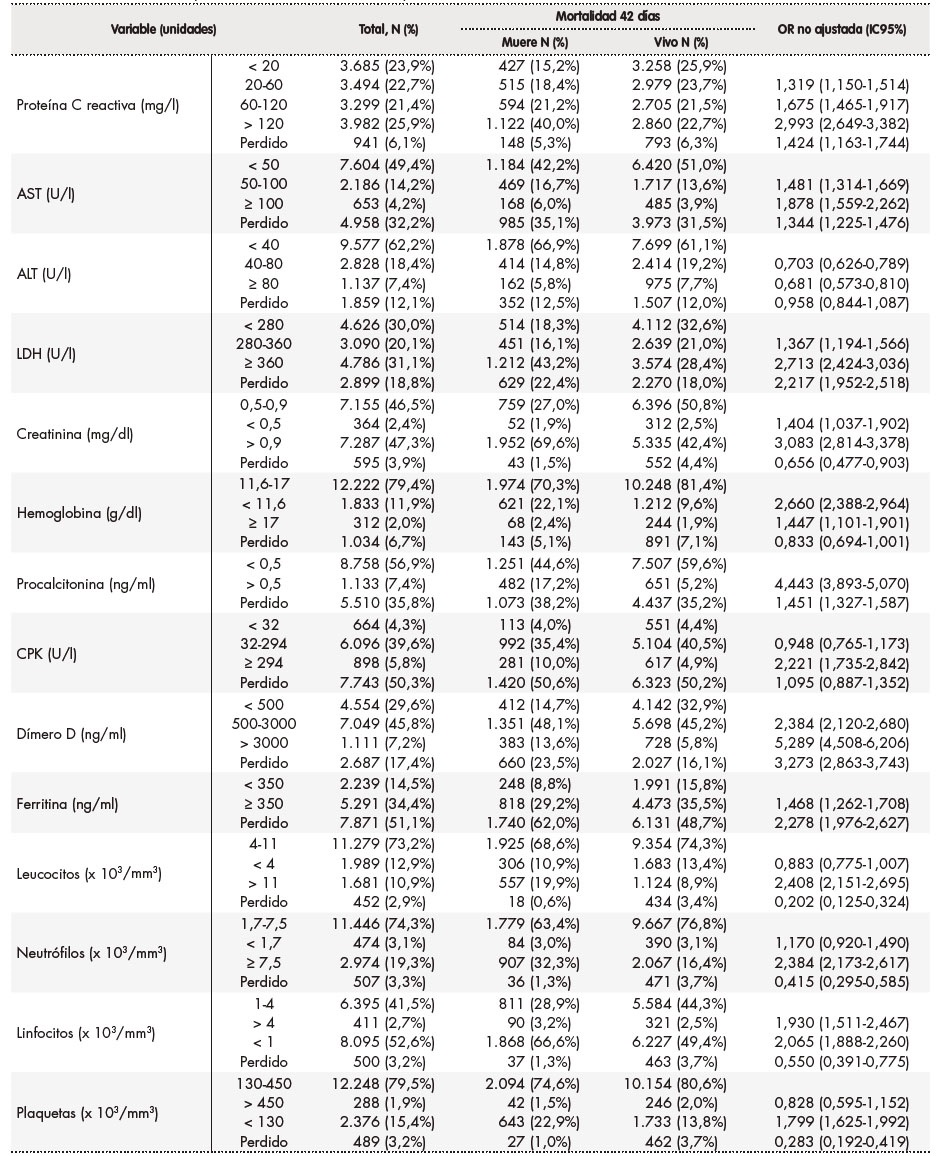
ALT: transaminasa alanina aminotransferasa; AST: transaminasa aspartato aminotransferasa. CPK: creatina-quinasa; IC95%: intervalo de confianza al 95%; LDH: lactato deshidrogenasa; OR: odds ratio.
Tabla 3. Tratamientos instaurados en las primeras 48 horas del ingreso hospitalario
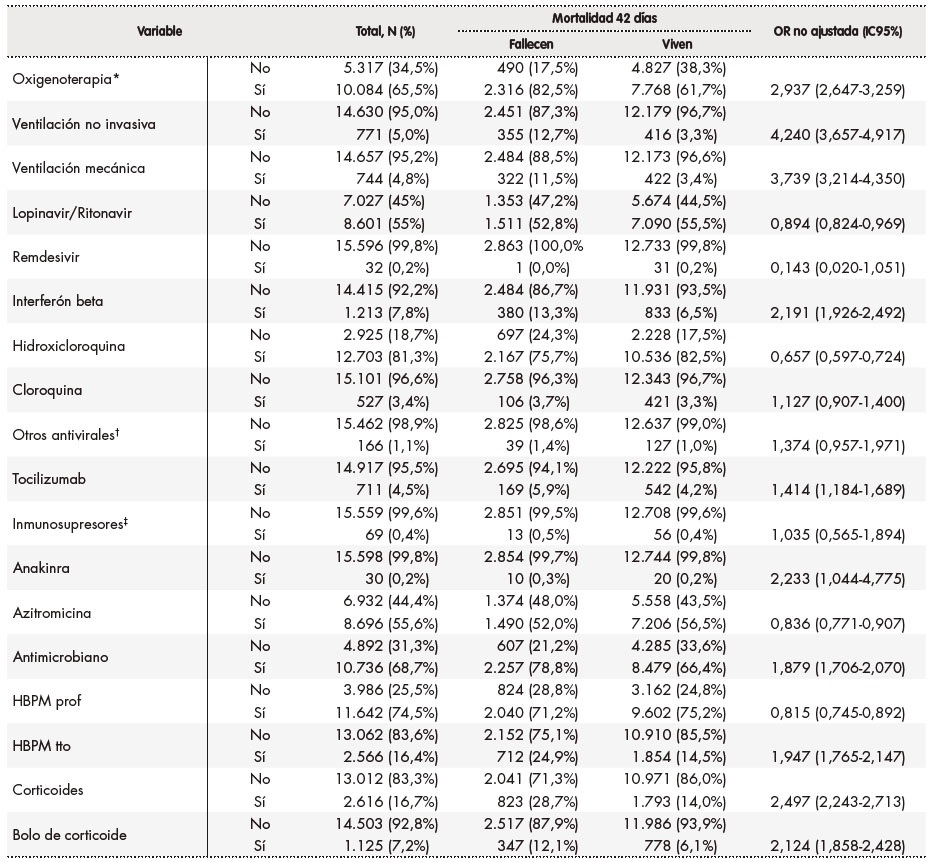
*Oxigenoterapia alto y bajo flujo; †Otros antivirales: darunavir/cobicistat; darunavir/ritonavir; darunavir/cobicistat/tenofovir/emtricitavina y fosamprenavir; ‡: Inmunosupresores: ciclosporina y tacrolimus. HBM tto: heparina de bajo peso molecular a dosis de tratamiento; HBPM prof: heparina de bajo peso molecular a dosis profilácticas; IC95%: intervalo de confianza al 95%; OR: odds ratio.
En cuanto a las características demográficas de la muestra, la edad media fue de 66,29 años (desviacíón estándar 15,74); el 57,2% eran hombres, el 15,5% tenía obesidad, el 11,4% procedía de residencias y el 4,5% eran profesionales sanitarios. El 19,6% presentó una frecuencia respiratoria > 24 rpm, el 47,1% tenía una saturación de oxígeno inferior a 93%, un 40,1% presentó fiebre y para el 11,6% la gravedad de la neumonía (CURB-65) fue alta.
Las enfermedades basales más frecuentes fueron (Tabla 1): hipertensión (50,1%), diabetes mellitus (21,8%), antecedentes de enfermedad neurológica (14,6%), insuficiencia renal (9,8%) y cardiopatía isquémica (9,0%). El 37,3% y el 14,3% recibían tratamiento con IECA/ARA-II y AINE, respectivamente, en el momento del ingreso.
El 65,5% de los pacientes recibieron oxigenoterapia al inicio, mientras que al 5,0% se les aplicó ventilación no invasiva y el 4,8% fueron sometidos a ventilación mecánica. En cuanto a los tratamientos farmacológicos, 664 pacientes (4,3%) no recibieron ningún tratamiento, siendo los medicamentos más frecuentemente pautados en las primeras 48 horas tras el ingreso los siguientes: hidroxicloroquina (81,3%), heparinas de bajo peso molecular a dosis profilácticas (74,5%), antimicrobianos (68,7%), de los cuales el más frecuente fue azitromicina (en el 55,6% del total de pacientes), lopinavir/ritonavir (55,0%) y corticoides (16,7%).
En las tablas 1 a 3 se muestra el resultado del análisis bivariante de la relación de cada una de las variables con la mortalidad a los 42 días. En la tabla 4 se recogen los resultados del análisis multivariante. Así, en cuanto a las características demográficas y clínicas basales, se observó que proceder de una residencia (OR 1,938; IC95%: 1,686‑2,227), mayor frecuencia respiratoria (OR 1,511; IC95%: 1,330-1,717), tener diabetes (OR 1,221; IC95%: 1,089‑1,368), insuficiencia cardíaca (OR 1,477; IC95%: 1,256‑1,736) y gravedad de neumonía media (OR 1,738; IC95%: 1,492‑2,025) o alta (OR 2,940; IC95%: 2,746-3,491) se asociaron a una mayor mortalidad. Por el contrario, ser mujer (OR 0,769; IC95%: 0,684‑0,863), tener una menor edad (18-29 años: OR 0,097; IC95%: 0,039-0,24; 30-64 años OR 0,162; IC95%: 0,136-0,194; 65-79 años: OR 0,428; IC95%: 0,379‑0,483), tener asma (OR 0,770; IC95%: 0,618‑0,961) y ser profesional sanitario (OR 0,433; IC95%: 0,238-0,787) se asociaron a una menor mortalidad. Como puede verse en la tabla 4, las alteraciones basales en diversos valores analíticos (leucocitos, linfocitos, plaquetas, AST, LDH, procalcitonina, CPK, dímero-D, hemoglobina, proteína C reactiva y creatinina) se asociaron a una mayor mortalidad, con valores entre una OR 1,200 (IC95% 1,040-1,384) para un dímero D entre 500-3.000 ng/ml y una OR 2,175 (IC95% 1,601-2,954) para una AST > 100 U/l. Se asociaron a una reducción de mortalidad un recuento de plaquetas > 450 x 10. plaquetas/mm. (OR 0,593; IC95% 0,391-0,897), así como un valor de ALT entre 40-80 U/l (OR 0,726; IC95% 0,617-0,854) y > 80 U/l (OR 0,490; IC95% 0,373-0,643) y valores de creatinina < 0,5 mg/dl (OR 0,676; IC95% 0,468-0,976). Por último, en cuanto a los tratamientos instaurados en las primeras 48 horas del ingreso hospitalario, el soporte respiratorio se mostró asociado a una mayor mortalidad, tanto la oxigenoterapia (OR 1,987; IC95%: 1,739-2,271), como la ventilación no invasiva (OR 2,877; IC95%: 2,348-3,480) y la ventilación mecánica (OR 3,471; IC95%: 2,825-4,266). La farmacoterapia con interferón beta (OR 1,507; IC95%: 1,266-1,794), corticoides, tanto pautados (OR 1,425; IC95%: 1,248-1,627) como en bolos (OR 1,421; IC95%: 1,179-1,712), y lopinavir/ritonavir (OR 1,158; IC95%: 1,033-1,300) se asociaron a una mayor mortalidad; por el contrario, se asociaron a una menor mortalidad los tratamientos con hidroxicloroquina (OR 0,707; IC95%: 0,615-0,813), tocilizumab (OR 0,761; IC95%: 0,603-0,960), heparina de bajo peso molecular a dosis profilácticas (OR 0,836; IC95%: 0,741-0,942) y azitromicina (OR 0,870; IC95%: 0,779-0,970).
Tabla 4. Factores asociados a la mortalidad a los 42 días en pacientes ingresados por COVID-19 con análisis multivariante
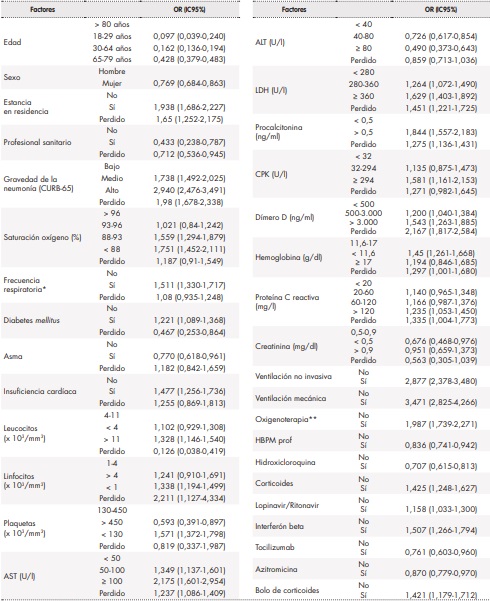
*Frecuencia respiratoria > 24 rpm. **Oxigenoterapia alto y bajo flujo.ALT: transaminasa alanina aminotransferasa; AST: transaminasa aspartato aminotransferasa; CPK: creatina-quinasa; HBPM prof: heparina de bajo peso molecular a dosis profilácticas; IC95%: intervalo de confianza al 95%; LDH: lactato deshidrogenasa; OR: odds ratio.
Discusión
Este artículo analiza la asociación entre la mortalidad a 42 días y un amplio número de variables clínicas, demográficas y de parámetros analíticos recogidos al ingreso hospitalario de pacientes con COVID-19. El estudio de los factores asociados a la mortalidad permite un mejor conocimiento de esta enfermedad y una mejor estratificación de los pacientes para la gestión clínica de los recursos dedicados a su tratamiento. El empleo de la mortalidad a 42 días como variable de resultado va más allá de la mortalidad hospitalaria, y recoge la posible mortalidad tras el alta. El Registro Español de Resultados de la Farmacoterapia frente a la COVID-19 de la SEFH presenta un alto número de pacientes incluidos, el 80% de ellos recogidos en marzo de 2020 (primera ola), lo que ofrece cierta homogeneidad en cuanto a la casuística, e incluye un elevado número de centros hospitalarios representativos de todo el territorio nacional. Por simplificación logística, se limitó el número de pacientes incluidos por centro a 200, lo cual puede inducir a una sobrerrepresentación de hospitales pequeños; mientras que en los hospitales grandes podrían incluirse sólo los primeros pacientes, siendo probablemente menor el nivel de experiencia y evidencia sobre los tratamientos. Buscando reducir el sesgo de esta selección, en todos los hospitales con más de 200 pacientes con hospitalización por COVID-19 que participaron en el registro se realizó un muestreo aleatorio. Además, el trabajo presenta varias limitaciones que deben tenerse en cuenta para la interpretación de los resultados. Al tratarse de un estudio observacional y la recopilación retrospectiva en algunos datos, es posible que las asociaciones descritas entre cada variable y la mortalidad esté afectada por sesgos o factores de confusión. Este diseño no es adecuado para comprobar el efecto de los tratamientos. Por una parte, al tratarse de los inicios de la pandemia, existía una clara falta de evidencia en la elección de los tratamientos, y la mayor parte de los pacientes recibieron múltiples tratamientos a lo largo de su hospitalización. Por otra parte, al incluirse en el análisis la farmacoterapia como una característica basal más, se prefijó un tiempo de 48 horas desde el ingreso para determinar qué paciente había recibido un tratamiento. Esto dificulta la interpretación del resultado del análisis multivariante sobre la farmacoterapia, ya que los pacientes que no recibieron un tratamiento determinado en las primeras 48 horas del ingreso pudieron recibirlo más adelante. En el momento en que estos lo reciben, cabe la posibilidad de que su estado de salud final se modifique, lo que introduce una fuente de sesgo difícil de eliminar.
Al inicio de la pandemia, la escasa evidencia llevó a que el principal tratamiento para la COVID-19 en nuestra cohorte fuese la hidroxicloroquina, empleada en más del 80% de los pacientes6. Esto explica la contradicción con la evidencia disponible actualmente, donde varias revisiones sistemáticas no han encontrado un beneficio sobre la mortalidad7,8 y sí un aumento de eventos adversos. Actualmente, dexametasona es el tratamiento de referencia en pacientes con necesidad de soporte respiratorio9,10, que fueron el 75,3% de los pacientes analizados en este registro. Aun así, sólo el 16,7% recibió tratamiento con corticoides en las primeras 48 horas. En el análisis desarrollado, aquellos pacientes que recibieron corticoterapia tras las primeras 48 horas fueron clasificados en el análisis como pacientes no tratados con corticoterapia. En cambio, y a la luz de la evidencia, resulta verosímil que estos pacientes obtuvieran un beneficio de la corticoterapia y, sin embargo, en el análisis estadístico al recaer en el grupo que no recibió corticoterapia genere una información contradictoria respecto a los resultados de RECOVERY11. Adicionalmente, también resulta probable que aquellos que recibieron corticoides fueran los más graves, implicando un sesgo de selección12. Evidencia posterior ha puesto de manifiesto que el uso de corticoides está indicado en pacientes con estado grave y crítico10, 13, no ofreciendo beneficio en casos leves y moderados14. El otro tratamiento que hasta la fecha ha mostrado algún efecto sobre la reducción de la mortalidad es tocilizumab15. Según los datos de nuestro registro, fue administrado dentro de las primeras 48 horas a un 4,5% de los pacientes. El análisis bivariante inicial mostró una OR 1,414 (IC95% 1,184‑1,689), mientras que el análisis ajustado por el resto de variables mostró un cambio en la asociación de tocilizumab, mostrando un efecto protector sobre la mortalidad a 42 días, con una OR 0,768 (IC95% 0,609-0,969). Esto es consistente con los resultados de ambos estudios15, y podrían ser el reflejo de su uso en pacientes con COVID-19 progresivo (proteína C reactiva ≥ 75 mg/l y Sat O2 < 92%) o en pacientes en estado crítico dentro de las primeras 48 horas de ingreso.
Tras ajustar en el modelo multivariante, padecer diabetes y ser hombre se mostraron como factores asociados a la mortalidad. Según la literatura científica, esta asociación puede estar determinada por al aumento en expresión de la enzima convertidora de angiotensina-peptidasa 2 (ECA2), que es la puerta de entrada del virus SARS-CoV-216. Concretamente, en la hiperglucemia debida a la diabetes, la entrada del virus en las células inmunes se podría ver favorecida al estar aumentada la expresión de ECA217, mientras que aquellos pacientes con asma presentan una menor expresión de esta enzima18. En cuanto a las diferencias según el sexo, además de las diferencias anatómicas, hormonales y de estilos de vida, ya contrastadas en la epidemia SARS del 200319, parece que también existen diferencias en la respuesta del sistema inmune que hace a los hombres más vulnerables a la infección por COVID-1920.
En cuanto a la asociación con los parámetros analíticos de nuestro análisis, es bien sabido que, en el control de la infección viral, los linfocitos desempeñan un papel esencial en la respuesta inflamatoria y en la homeostasis. Así, la linfopenia debida a la destrucción de linfocitos (particularmente linfocitos T) y el agotamiento causado por la invasión del virus, se muestra con consistencia como un factor de mal pronóstico21,22. Los hallazgos de nuestro estudio coinciden con otros parámetros clínicos descritos en la literatura científica que se muestran asociados a una mayor gravedad y mortalidad de la COVID-19, como la elevación de LDH, proteína C reactiva, procalcitonina, CPK, plaquetas y dímero D23,24.
Un resultado esperable fue el aumento de mortalidad en pacientes que requirieron oxígeno suministrado externamente (oxigenoterapia, ventilación no invasiva o ventilación mecánica) para mantener una saturación adecuada, así como en pacientes con mayor puntuación en la escala CURB-65. Estos hallazgos son consistentes con factores identificados previamente25,26.
En cuanto al seguimiento de la mortalidad hasta 42 días, desarrollado para valorar un posible incremento de mortalidad residual tras el alta, supone un seguimiento de mayor madurez en comparación con otros estudios observacionales6,27,28 y ensayos clínicos11,29, que tienen como variable principal la mortalidad a los 28 días. En nuestro estudio, la mortalidad tras el alta hospitalaria fue de un 0,7%, lo que incrementó la mortalidad de un 17,5% a un 18,2%. Esto supone una evidencia de la necesidad de un seguimiento a más largo plazo, y podría suponer un elemento de interés a la hora de valorar la madurez en el seguimiento de los resultados de los diferentes estudios que puedan desarrollarse en COVID-19.
Los resultados del Registro Español de Resultados de la Farmacoterapia frente a la COVID-19 de la SEFH, con una representación amplia de la población que requirió ingreso hospitalario por COVID-19 durante la primera ola, y con un seguimiento prolongado de la mortalidad, ponen de manifiesto la posible utilidad pronóstica de algunos valores basales analíticos, así como de algunas características de la presentación clínica que puede ayudar a mejorar el manejo de una enfermedad.
Protocolo
El protocolo fue publicado en la Red Europea de Centros de Farmacoepidemiología y Farmacovigilancia. Disponible en: http://www.encepp.eu/encepp/viewResource.htm?id=34344
Aportación a la literatura científica
El impacto económico y social de la pandemia por el coronavirus SARS-CoV-2 no tiene precedentes, causando un elevado número de defunciones. Este estudio recoge los resultados del Registro Español de Resultados de la Farmacoterapia frente a la COVID-19 incluyendo más de 15.000 pacientes ingresados. Los resultados son consistentes con otros estudios que muestran la asociación de determinados valores basales analíticos y sociodemográficos con la mortalidad por COVID‑19.