Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.46 no.3 Toledo may./jun. 2022 Epub 11-Jul-2022
https://dx.doi.org/10.7399/fh.11829
ORIGINALES
Análisis coste-utilidad de venetoclax en combinación con obinutuzumab como tratamiento de primera línea de la leucemia linfocítica crónica en España
Servicio de Farmacia, Hospital de la Santa Creu i Sant Pau, Barcelona. España
Servicio de Hematología, Hospital Universitario 12 de Octubre, Madrid. España
Servicio de Farmacia, Hospital Universitario Gregorio Marañón, Madrid. España
Servicio de Hematología, Hospital Universitario Infanta Leonor, Madrid. España
Servicio de Farmacia, Hospital Universitario Ramón y Cajal, Madrid. España
AbbVie Spain S. L. U., Madrid. España
Objetivo:
Venetoclax en combinación con obinutuzumab ha mostrado frente a la inmunoquimioterapia mejoras significativas en términos de eficacia (supervivencia libre de progresión) en pacientes con leucemia linfocítica crónica que no han recibido tratamiento previo. El objetivo de este estudio fue evaluar su eficiencia en España a partir de un análisis de coste-utilidad.
Método:
A partir de un modelo de análisis de la supervivencia adaptado al contexto español y basado en tres estados de salud (supervivencia libre de progresión, supervivencia tras progresión y muerte), se llevó a cabo una simulación de la evolución de los pacientes candidatos a iniciar una primera línea de tratamiento para un horizonte temporal de toda la vida. Venetoclax en combinación con obinutuzumab se comparó frente a las opciones terapéuticas más utilizadas para estos pacientes en el momento del diseño del estudio: clorambucilo en combinación con obinutuzumab, ibrutinib, fludarabina en combinación con ciclofosfamida y rituximab, y bendamustina en combinación con rituximab. Los datos de eficacia para estimar las curvas de supervivencia fueron derivados del estudio CLL14 y de un metaanálisis en red. El análisis consideró la perspectiva del Sistema Nacional de Salud incluyendo los costes sanitarios directos, en concreto los farmacológicos y su administración, y los asociados al manejo de la enfermedad y acontecimientos adversos. El uso de recursos fue validado por un grupo de expertos. Se emplearon datos de calidad de vida para estimar los años de vida ajustados por calidad obtenidos para cada alternativa. Se consideró un umbral de 25.000 €/años de vida ajustados por calidad. La robustez del modelo se evaluó mediante análisis de sensibilidad determinísticos y probabilísticos.
Resultados:
Venetoclax en combinación con obinutuzumab se mostró como una alternativa dominante frente al resto de alternativas de tratamiento, con un menor coste por paciente (–67.869 € frente a clorambucilo en combinación con obinutuzumab, –375.952 € frente a ibrutinib, –61.996 € frente a fludarabina en combinación con ciclofosfamida y rituximab, y –77.398 € frente a bendamustina en combinación con rituximab) y una mayor ganancia en años de vida ajustados por calidad (0,551 años de vida ajustados por calidad ganados frente a clorambucilo en combinación con obinutuzumab e ibrutinib, 1,639 años de vida ajustados por calidad ganados frente a fludarabina en combinación con ciclofosfamida y rituximab, y 1,186 años de vida ajustados por calidad ganados frente a bendamustina en combinación con rituximab). Entre el 68% y el 85% de las simulaciones realizadas en el análisis de sensibilidad mostraban a venetoclax en combinación con obinutuzumab con un menor coste y un mayor número de años de vida ajustados por calidad ganados.
Conclusiones:
Venetoclax en combinación con obinutuzumab se muestra como una alternativa eficiente y dominante como tratamiento de pacientes con leucemia linfocítica crónica no tratados previamente frente a las alternativas disponibles y desde la perspectiva del Sistema Nacional de Salud.
Palabras clave Leucemia linfocítica crónica; Eficiencia; Evaluación económica; Calidad de vida; Venetoclax
Introducción
La leucemia linfocítica crónica (LLC) es un trastorno linfoproliferativo que se caracteriza por la expansión de células B CD5 + de apariencia madura en la sangre periférica, los tejidos linfoides secundarios y la médula ósea1. La LLC es la forma más frecuente de leucemia en los adultos en los países occidentales, con una incidencia estimada en 4-5 casos por 100.000 habitantes-año y una prevalencia especialmente significativa en aquellas zonas donde la población está más envejecida2. Más de la mitad de los pacientes muestran comorbilidades relacionadas con la edad, como hipertensión arterial, diabetes, artrosis o afectaciones cardiorrespiratorias3.
La decisión de tratamiento se basa en la presencia o no de factores pronósticos adversos (deleción[17p], deleción[11q], mutación TP53, estado mutacional de IGHV) y en el estado funcional del paciente2.
Durante los últimos años, se han logrado avances relevantes en la comprensión de la fisiopatología de la LLC y se ha progresado sustancialmente en el manejo clínico de la enfermedad gracias a la identificación de variables genéticas de mal pronóstico, particularmente aquellas asociadas con quimiorresistencia y a la progresión a formas altamente agresivas de LLC4,5. En la actualidad, la quimioinmunoterapia está siendo desplazada por terapias biológicas, como los inhibidores del receptor del linfocito B y los inhibidores de BCL-26,7.
La sobreexpresión de BCL-2 contribuye a la evasión de la apoptosis, lo que hace que las células tumorales sean altamente dependientes de BCL-2 para su supervivencia8. La alta expresión de BCL-2 se observa de manera uniforme en todos los subtipos de LLC9. Venetoclax, el primer inhibidor selectivo de BCL-2, restaura la capacidad de las células tumorales de iniciar el proceso de apoptosis y, administrado junto con obinutuzumab, presenta un mecanismo de acción complementario y sinérgico que proporciona altas tasas de eficacia y respuestas profundas, con una duración fija de un año de tratamiento5,10. En el estudio CLL14, la supervivencia libre de progresión (SLP) a 2 años fue de 88,2% (intervalo de confianza [IC] del 95%: 83,7-92,6%) en los pacientes tratados con venetoclax en combinación con obinutuzumab (VenO) frente al 64,1% (IC 95%: 83,7-92,6%) en el grupo control, tratados con clorambucilo en combinación con obinutuzumab (ClbO)5. Con una mediana de seguimiento de 28,1 meses, estos resultados mostraron un enlentecimiento del riesgo de progresión o muerte con VenO (hazard ratio [HR] = 0,35; IC 95%: 0,23-0,53; p < 0,001). En el momento del corte de datos del estudio, los resultados de supervivencia global (SG) eran inmaduros, no habiéndose alcanzado la mediana en ninguno de los grupos (menos del 10% de eventos en cada uno de los brazos)5. Estos resultados se confirmaron en el momento de corte posterior, con una mediana de seguimiento de 39,6 meses, donde la SLP fue de 81,9% en el brazo de VenO y de 49,5% en el brazo de ClbO. Estos resultados mostraron un enlentecimiento del riesgo de progresión o muerte con VenO (HR = 0,31; IC 95%: 0,22-0,44; p < 0,001)11.
El objetivo de este estudio fue llevar a cabo un análisis de coste-utilidad para determinar si VenO, terapia indicada para pacientes con LLC que no han recibido tratamiento previo, sería una intervención eficiente para el Sistema Nacional de Salud (SNS) en comparación con las alternativas terapéuticas disponibles en España.
Métodos
Sujetos del estudio y comparadores
La población considerada en el análisis reflejó las características de los pacientes incluidos en el estudio clínico de fase 3 CLL145, es decir, pacientes con LLC que no habían recibido tratamiento previo, un 33% mujeres y de 71,1 años de mediana.
Asimismo, se comparó VenO frente a las alternativas más utilizadas en primera línea en pacientes con LLC en el momento del diseño del estudio: ClbO, fludarabina en combinación con ciclofosfamida y rituximab (FCR), bendamustina en combinación con rituximab (BR) e ibrutinib.
Tipo de análisis
Se estimó el coste y la efectividad media por paciente asociados con cada alternativa terapéutica y se calculó la razón de coste-utilidad incremental de VenO frente al resto de comparadores para determinar el coste adicional de VenO para obtener un año de vida ajustado por calidad (AVAC).
El análisis se llevó a cabo desde la perspectiva del SNS, incluyendo los costes directos sanitarios (actualizados a euros del año 2020 empleando el histórico del índice de precios de consumo interanuales). El horizonte temporal se extendió a toda la vida del paciente. Se aplicó una tasa de descuento anual del 3% sobre costes y consecuencias clínicas12. Se consideró como umbral de coste-efectividad 25.000 €/AVAC13.
La adaptación al contexto español se hizo posible tras consultar con un grupo de expertos seleccionados por su experiencia y su conocimiento de la práctica clínica, y que son coautores del presente trabajo. Tras completar cuestionarios individuales, se planteó un caso base para su validación.
Estructura del modelo
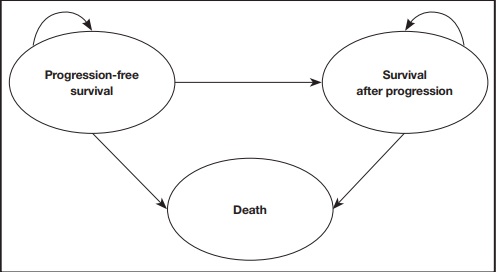
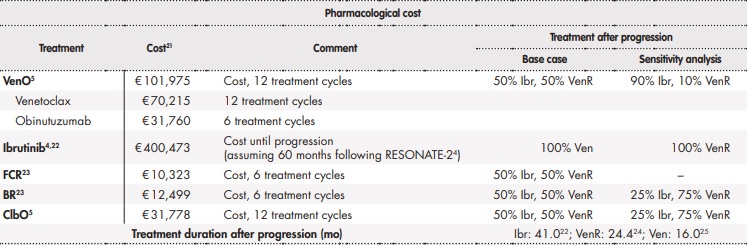
Se adaptó al entorno español un modelo de supervivencia particional14,15, previamente presentado en el National Institute for Health and Clinical Excellence (NICE) que simulaba la evolución de los pacientes con LLC que no han recibido tratamiento previo a través de distintas situaciones clínicas (estados de salud). La figura 1 muestra el esquema simplificado del modelo, con tres estados de salud mutuamente excluyentes: estado de libre progresión, estado tras progresión y muerte. La proporción de pacientes vivos para cada ciclo del modelo (ciclos de 28 días) fue estimada a partir del área bajo la curva de la SG, y la proporción de pacientes vivos libres de progresión fue estimada a partir del área bajo la curva de la SLP. La proporción de pacientes vivos tras progresión fue estimada a partir de la diferencia entre la curva de la SG y de la SLP. Las curvas de SG y SLP fueron estimadas mediante curvas paramétricas a partir de la evidencia clínica. Para calcular lo mejor posible el coste farmacológico, el modelo consideró la información del tiempo en tratamiento para medir la discontinuación, que puede darse por la aparición de acontecimientos adversos (AA) o debido a la progresión de la enfermedad. Cabe destacar que los tratamientos VenO, ClbO, FCR y BR tienen una duración fija en el tiempo, mientras que la duración del tratamiento con ibrutinib es indefinida hasta progresión de a enfermedad o toxicidad inaceptable. Tras discontinuación, se asumió que los pacientes pudieran recibir subsiguientes tratamientos.
Datos clínicos
Los datos de eficacia empleados en el modelo para VenO y ClbO fueron derivados del ensayo CLL145. Dado que el periodo de seguimiento del estudio fue menor que el horizonte considerado en los estudios económicos (horizonte recomendado de toda la vida del paciente), fue necesario extrapolar las curvas de SLP, SG y tiempo en tratamiento mediante funciones de distribución paramétrica ajustadas a las curvas de Kaplan-Meier (KM). Para decidir qué distribución paramétrica se ajustaba mejor, se siguieron criterios de bondad de ajuste, que describen cómo de bien se ajusta una determinada distribución a un conjunto de observaciones (curvas de KM). En concreto, se siguieron el criterio de información de Akaike y bayesiano15 (Anexo 1). Las curvas parametrizadas fueron ajustadas según la mortalidad general de la población española16, evitando así que las curvas de supervivencia estimadas en el modelo estuvieran por encima de la supervivencia de la población general.
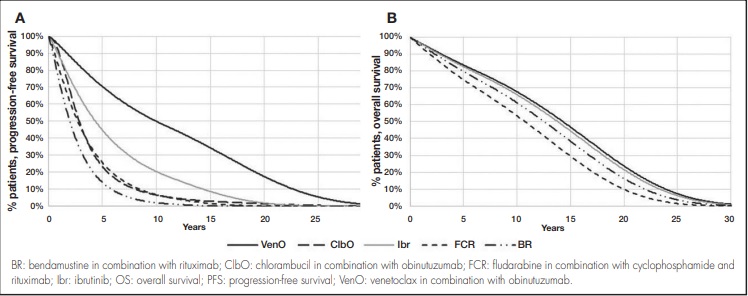
Para ibrutinib, FCR y BR como comparadores, ante la ausencia de evidencia directa frente a VenO, las curvas paramétricas fueron estimadas mediante HR frente a VenO (tratamiento de referencia), las cuales fueron obtenidas a partir de un metaanálisis en red bayesiano de efectos fijos17, lo que permitió realizar una comparación indirecta entre VenO e ibrutinib, FCR o BR. Para derivar la curva de SLP para ibrutinib, FCR y BR, se consideraron las correspondientes HR con respecto a VenO derivadas del metaanálisis en red realizado. En cuanto a la curva de SLP para VenO y ClbO, se consideró una distribución log-logística (Figura 2A).
Para la SG, no se consideraron diferencias entre VenO y ClbO según el ensayo CLL14 y corroborado por la opinión de expertos. Así, se consideró una distribución exponencial para su extrapolación. Para derivar la curva de SG para ibrutinib, FCR y BR, se consideraron las correspondientes HR con respecto a VenO derivadas de metaanálisis en red (Figura 2B).
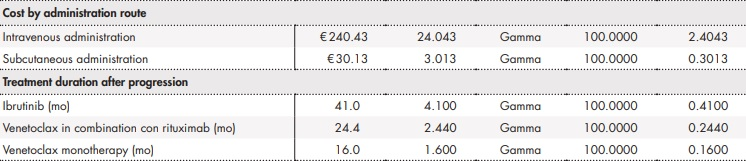
El análisis consideró la información del tiempo en tratamiento para medir la discontinuación. Los tratamientos VenO, ClbO, FCR y BR tienen una duración de tiempo fija (12 ciclos para VenO y ClbO, 6 ciclos para FCR y BR), mientras que la duración de tratamiento con ibrutinib se considera indefinida hasta progresión de la enfermedad o toxicidad inaceptable (se asumió una mediana de 60 meses en base al seguimiento a más largo plazo en el estudio RESONATE-2, en el que no se alcanzó la mediana de SLP4). Tras discontinuación, se asumió que los pacientes pudieran recibir subsiguientes tratamientos. Para ello se consideró una distribución log-logística para VenO y ClbO, mientras que para ibrutinib, FCR y BR se asumió la curva de SLP.
Calidad de vida
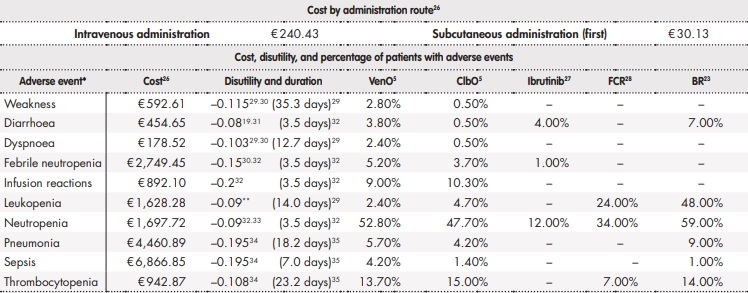
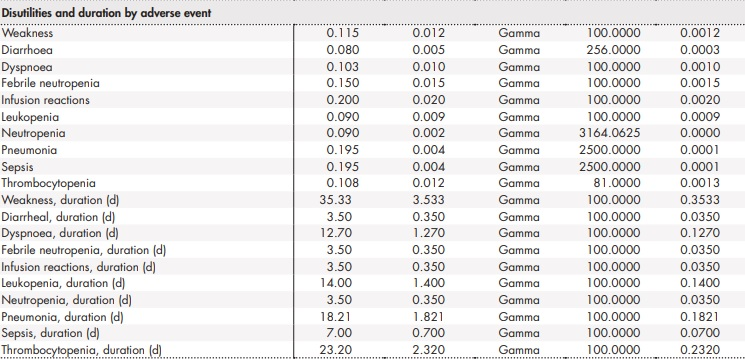
Para la estimación de los AVAC se consideraron diferentes valores de utilidad en función del estado de salud de los pacientes. Los valores de utilidad se emplearon para representar la calidad de vida asociada con un estado de salud concreto en una escala de 0 (muerte) a 1 (salud perfecta). En concreto, se empleó una utilidad de 0,80 para el estado de salud SLP (NICE TA174) y de 0,68 para el estado de supervivencia tras progresión18,19. Para representar la pérdida de utilidad (desutilidad) asociada a la creciente edad de los pacientes, las utilidades definidas se ajustaron por la utilidad según edad de la población general española, derivada de la Encuesta de Salud disponible del Instituto Nacional de Estadística para el año 2011/1220. De forma adicional, el modelo también consideró la desutilidad a causa de los AA asociados a los tratamientos. Se asumió que la ocurrencia de AA, así como sus consecuencias tanto en la calidad de vida como económicas, se producen en el primer ciclo del análisis.
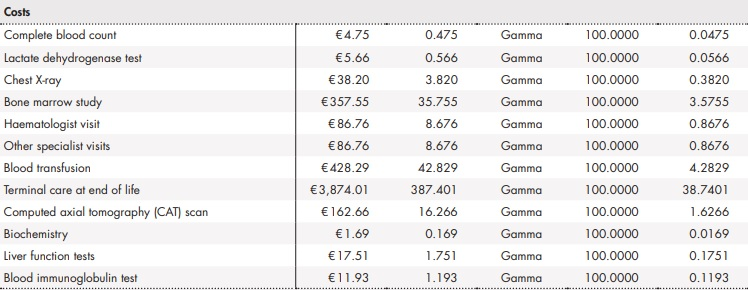
Uso de recursos y costes
El análisis consideró los costes sanitarios directos asociados al manejo de la LLC (Tabla 1). El coste farmacológico, incluyendo los tratamientos tras progresión, fue calculado a partir del precio de venta de laboratorio21. El uso de recursos y las asunciones realizadas fueron validadas mediante la opinión de expertos clínicos.
Tabla 1 (cont.). Uso de recursos y costes del análisis
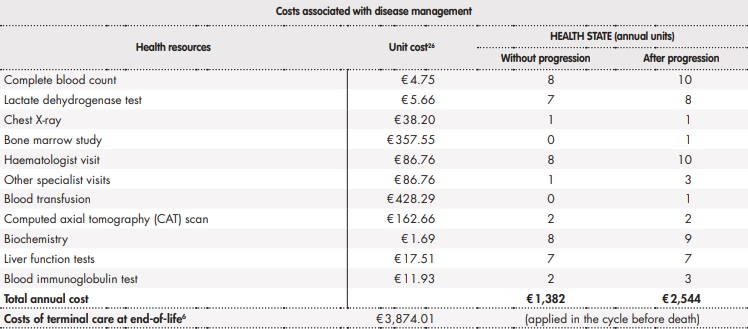
*Considerados acontecimientos adversos graves (neutropenia, neutropenia febril, neumonía, sepsis y trombocitopenia) y de grado 3-4 con al menos un 2% de diferencia entre VenO y ClbO identificados en el estudio CLL14. Se asume que ocurren en el primer ciclo del modelo**Asumido neutropenia.BR: bendamustina en combinación con rituximab; ClbO: clorambucilo en combinación con obinutuzumab; FCR: fludarabina en combinación con ciclofosfamida y rituximab; Ibr: ibrutinib; Ven: venetoclax; VenO: venetoclax en combinación con obinutuzumab; VenR: venetoclax en combinación rituximab.
Análisis de sensibilidad
Con el fin de evaluar la incertidumbre de las variables utilizadas en el modelo y determinar la robustez de los resultados del caso base, se realizaron diversos análisis de sensibilidad.
En primer lugar, se obtuvieron los resultados variando la tasa de descuento del caso base a 0% y el 5%.
Ante las diferencias en cuanto al uso de recursos en el manejo de los pacientes indicadas por los expertos clínicos, se varió un ±20% el coste anual del manejo del paciente tanto en el estado libre de progresión como tras progresión. También se plantearon discrepancias en cuanto a la distribución de los siguientes tratamientos tras progresión de la enfermedad para las diferentes alternativas, excepto en el caso de FCR, para el que se mantuvo igual (Tabla 1).
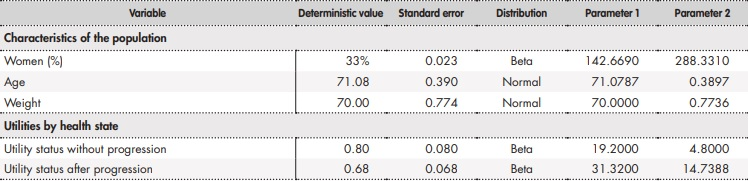
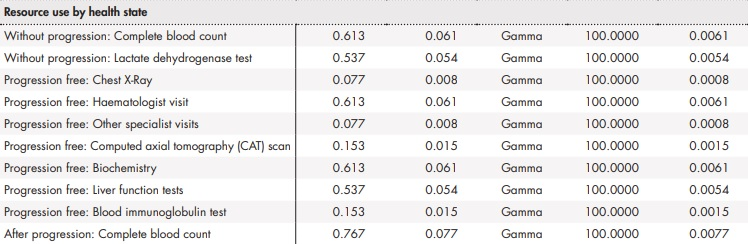
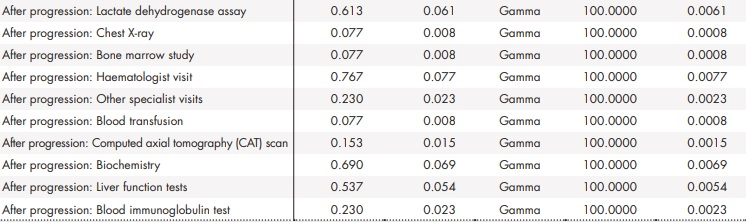
Adicionalmente, se llevó a cabo un análisis de sensibilidad probabilístico modificando de forma simultánea los parámetros del modelo según una distribución establecida (Anexo 2). En concreto, se realizaron 1.000 simulaciones por el método de Monte-Carlo36.
Resultados
Los resultados del caso base mostraron que VenO es una alternativa con un menor coste por paciente y una mayor ganancia en AVAC frente al resto de alternativas de tratamiento (Tabla 2), lo que en términos de evaluación económica se conoce como alternativa dominante.
Tabla 2. Resultados del caso base
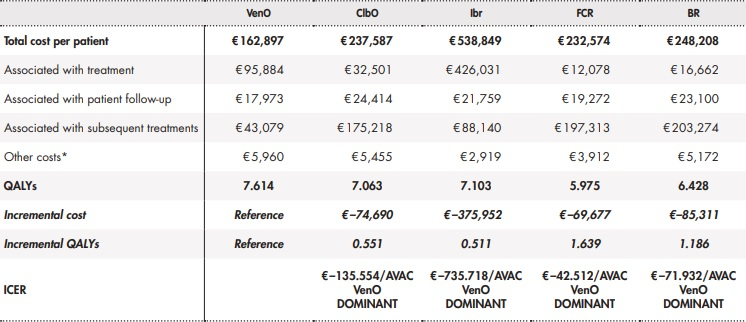
*Acontecimientos adversos, coste al final de la vida, profilaxis del síndrome de lisis tumoralAVAC: año de vida ajustado por calidad; BR: bendamustina en combinación con rituximab; ClbO: clorambucilo en combinación con obinutuzumab; FCR: fludarabina en combinación con ciclofosfamida y rituximab; Ibr: ibrutinib; RCEI: razón de coste-efectividad incremental; VenO: venetoclax en combinación con obinutuzumab.
El menor coste de VenO frente a ClbO, FCR y BR fue debido principalmente a un menor coste farmacológico de los siguientes tratamientos administrados tras progresión. Frente a ibrutinib como comparador, el menor coste de VenO fue debido principalmente al menor coste de tratamiento como consecuencia de un menor tiempo en tratamiento con VenO.
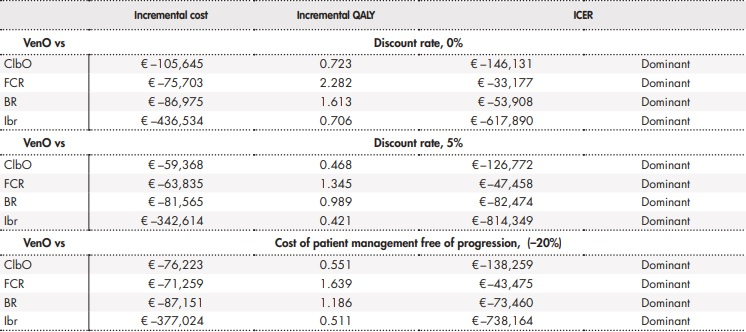
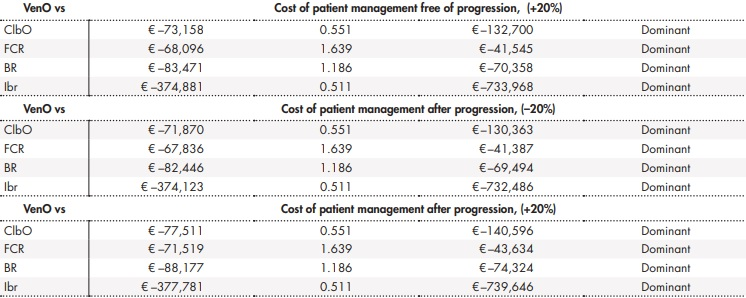
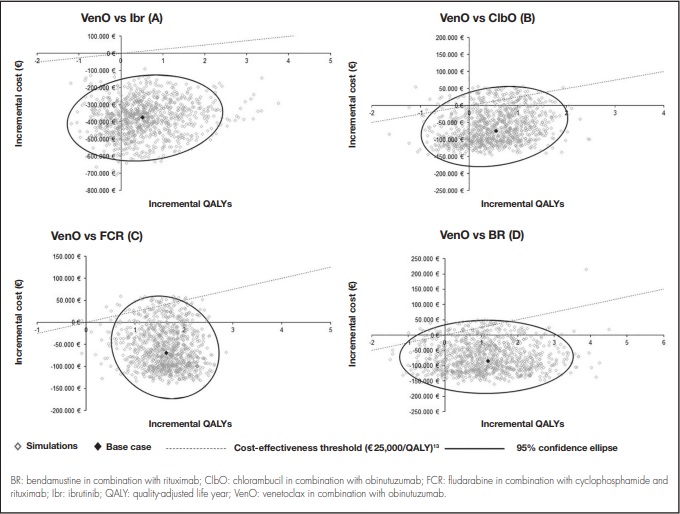
Los análisis de sensibilidad llevados a cabo apoyaron estos resultados. Los resultados de los análisis de sensibilidad determinísticos se muestran en la tabla 3. El análisis de sensibilidad probabilístico mostró cómo entre un 68% y un 85% de las simulaciones realizadas mostraban a VenO como alternativa dominante, con un menor coste y un mayor número de AVAC ganados (Figura 3).
Tabla 3 (cont.). Resultados de los análisis de sensibilidad determinísticos
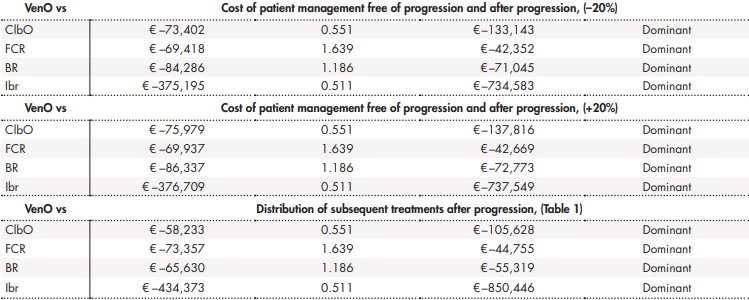
AVAC: año de vida ajustado por calidad; BR: bendamustina en combinación con rituximab; ClbO: clorambucilo en combinación con obinutuzumab; FCR: fludarabina en combinación con ciclofosfamida y rituximab; Ibr: ibrutinib; RCEI: razón de coste-efectividad incremental; VenO: venetoclax en combinación con obinutuzumab.
Discusión
Este estudio evalúa la eficiencia de VenO en el entorno español como tratamiento de la LLC en pacientes no tratados previamente frente a los comparadores que se utilizan habitualmente en la práctica clínica y que tienen indicación para tal uso. Los resultados de este análisis se presentaron en el LXII Congreso Nacional de la Sociedad Española de Hematología y Hemoterapia (SEHH) y en el XXXVI Congreso Nacional de la Sociedad Española de Trombosis y Hemostasia (SETH)37.
Un hecho que a tener en cuenta es que mientras que en el ensayo CLL14 sí se incluyeron pacientes con pronóstico citogenético desfavorable (pacientes con deleción 17p y mutación TP53), lo que puede hacer más representativa la población del ensayo de la de los pacientes en vida real. En el ensayo pivotal de ibrutinib (RESONATE-24) no se incorporó a dicha población, lo que podría considerarse una limitación metodológica del diseño.
En el presente estudio, VenO se considera como una alternativa dominante frente a todos los comparadores por obtener beneficios en AVAC incrementales y suponer un menor coste por paciente. Estos resultados se deben principalmente a la mayor SLP lograda con VenO en cuanto a la mayor efectividad obtenida, y al coste farmacológico en cuanto al menor coste. El coste de uso de VenO es sustancialmente menor al de ibrutinib al tener VenO una duración de tratamiento fija de un año, mientras que la de ibrutinib es indefinida hasta progresión de la enfermedad o toxicidad inaceptable (asumida una mediana de tratamiento de 60 meses en base al estudio RESONATE-24, en el que no se alcanzó la mediana de SLP). Esto también es especialmente relevante desde el punto de vista presupuestario, ya que, además de ser eficiente, la combinación VenO puede generar ahorros en el gasto farmacéutico (un coste farmacológico de tratamiento por paciente de 101.975 € con VenO frente a 400.473 € con ibrutinib)38, a la vez que permite una predictibilidad presupuestaria al tener una duración de tratamiento fija. Con respecto al resto de comparadores, VenO conlleva un menor coste por tratamientos tras la progresión de la enfermedad. Este menor coste se debe a las altas tasas de respuestas profundas de VenO, entendiéndose éstas como el logro de la remisión completa y la negatividad de la enfermedad mínima residual, que evitan o retrasan el inicio de una segunda línea de tratamiento11. El coste relacionado con el seguimiento del paciente también se considera menor para VenO respecto a las demás alternativas debido a que el paciente permanece más tiempo en el estado libre de progresión y libre de tratamiento.
A nivel internacional, se han realizado varios estudios de coste-efectividad para la LLC en pacientes que no han recibido tratamiento previo, pero la mayoría son anteriores a la aprobación de VenO y ninguno contempla esta terapia como comparador.
Soini et al. (2016) estudiaron la relación coste-efectividad de los tratamientos de primera línea para la LLC en pacientes no aptos para recibir dosis completas de fludarabina39. ClbO demostró ser el tratamiento más coste-efectivo frente a las demás alternativas estudiadas, tales como clorambucilo en combinación con ofatumumab, clorambucilo en combinación con rituximab y BR.
Además, después de la aprobación de ibrutinib, diversos estudios internacionales han llevado a cabo análisis económicos sobre la eficiencia de ibrutinib como tratamiento en primera línea de la LLC40-42. Aunque los resultados de estos estudios no son directamente aplicables a España, todos ellos muestran una concordancia asumiendo que ibrutinib ofrece unos resultados satisfactorios en términos de SLP y AVAC, pero no se considera rentable en ninguno de ellos.
El presente estudio tiene como limitación debido al tipo de análisis la necesidad de extrapolar los datos de supervivencia para un horizonte a más largo plazo que el seguimiento del ensayo. Sin embargo, la extrapolación se realizó a partir de las distribuciones con mejor bondad de ajuste a las curvas de KM del estudio CLL14. Sería deseable poder realizar análisis adicionales cuando se obtengan datos del seguimiento del estudio CLL14 a más largo plazo o incluso en estudios de evidencia en el mundo real.
Por otro lado, ante la ausencia de evidencia directa con el resto de comparadores, excepto con ClbO5, se llevó a cabo una comparación indirecta mediante un metaanálisis en red. Este tipo de análisis no están exentos de limitaciones, principalmente a nivel de similitud metodológica (heterogeneidad entre estudios). Pese a ello, es la única alternativa posible para comparar tratamientos que no disponen de ensayos clínicos que los hayan comparado de forma directa. Además, las diferencias metodológicas y la selección de pacientes entre los ensayos clínicos escogidos para cada tratamiento también se han identificado como una limitación del estudio. Para aumentar la validez externa de este análisis, todos los ensayos clínicos pivotales para los tratamientos de la LLC deberían incluir el mismo tipo de pacientes (sin excluir aquellos con pronóstico desfavorable) y mostrar datos de eficacia y seguridad en un mismo horizonte temporal. En el momento del diseño del estudio CLL14, ClbO era el tratamiento estándar para este tipo de pacientes, si bien es cierto que, hoy en día, ibrutinib es considerado como el tratamiento estándar para el subgrupo de pacientes con LLC previamente no tratados y con la mutación del17p o TP53.
En conclusión, este estudio muestra que VenO se perfila como una alternativa eficiente y dominante para el tratamiento de la LLC en pacientes no tratados previamente en España. Según nuestro análisis, la introducción de VenO en el SNS podría reducir tanto los costes de tratamiento como los costes asociados al seguimiento del paciente y a los siguientes tratamientos tras progresión, además de mejorar la esperanza de vida y la calidad de vida de los pacientes españoles con LLC.
Agradecimientos
Los autores agradecen a Ferrán Pérez Alcántara e Irene Ambatlle Jiménez, de Oblikue Consulting, por su apoyo en el diseño del estudio, análisis de los datos y en la redacción del manuscrito. Estos servicios fueron financiados por AbbVie.
REFERENCIAS
1. Kipps TJ, Stevenson FK, Wu CJ, Croce CM, Packham G, Wierda WG, et al. Chronic lymphocytic leukaemia. Nat Rev Dis Prim. 2017;3(1):16096. DOI: 10.1038/ nrdp.2016.96 [ Links ]
2. Sociedad Española de Hematología y Hemoterapia (SEHH). Avances en cáncer hematológico [Internet]. 2020 [accessed 10/19/2021]. Available at: https:// www.sehh.es/images/stories/recursos/2020/01/publicaciones/docs/02/ online/files/basic-html/page4.html [ Links ]
3. Eichhorst B, Robak T, Montserrat E, Ghia P, Hillmen P, Hallek M, et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2015;26(suppl 5):v78-84. DOI: 10.1093/annonc/mdv303 [ Links ]
4. Burger JA, Barr PM, Robak T, Owen C, Ghia P, Tedeschi A, et al. Long-term efficacy and safety of first-line ibrutinib treatment for patients with CLL/SLL: 5 years of follow-up from the phase 3 RESONATE-2 study. Leukemia. 2020;30(3):787-98. DOI: 10.1038/s41375-019-0602-x [ Links ]
5. Fischer K, Al-Sawaf O, Bahlo J, Fink AM, Tandon M, Dixon M, et al. Venetoclax and Obinutuzumab in Patients with CLL and Coexisting Conditions. N Engl J Med. 2019;380(23):2225-36. DOI: 10.1056/NEJMoa1815281 [ Links ]
6. Guías de tratamiento de LLC. Versión diciembre 2021. Grupo Español de Leucemia Linfocítica Crónica (GELLC). Available at: https://www.gellc.es/images/pdf/guias_gellcv1.pdf [ Links ]
7. National Comprehensive Cancer Network (NCCN). NCCN Clinical Practice Guidelines in Oncology. Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma. Version 2.2022. Available at: https://www.nccn.org/guidelines/guidelines-detail?category=1&id=1478 [ Links ]
8. Leverson JD, Sampath D, Souers AJ, Rosenberg SH, Fairbrother WJ, Amiot M, et al. Found in Translation: How Preclinical Research Is Guiding the Clinical Development of the BCL2-Selective Inhibitor Venetoclax. Cancer Discov. 2017;7(12):1376-93. DOI: 10.1158/2159-8290.CD-17-0797 [ Links ]
9. Del Gaizo Moore V, Brown JR, Certo M, Love TM, Novina CD, Letai A. Chronic lymphocytic leukemia requires BCL2 to sequester prodeath BIM, explaining sensitivity to BCL2 antagonist ABT-737. J Clin Invest. 2007;117(1):112-21. DOI: 10.1172/JCI28281 [ Links ]
10. Flinn IW, Gribben JG, Dyer MJS, Wierda W, Maris MB, Furman RR, et al. Phase 1b study of venetoclax-obinutuzumab in previously untreated and relapsed/refractory chronic lymphocytic leukemia. Blood. 2019;133(26):2765-75. DOI: 10.1182/ blood-2019-01-896290 [ Links ]
11. Al-Sawaf O, Lilienweiss E, Bahlo J, Robrecht S, Fink AM, Patz M, et al. High efficacy of venetoclax plus obinutuzumab in patients with complex karyotype and chronic lymphocytic leukemia. Blood. 2020;135(11):866-70. DOI: 10.1182/ blood.2019003451 [ Links ]
12. López Bastida J, Oliva J, Antoñanzas F, García-Altés A, Gisbert R, Mar J, et al. Propuesta de guía para la evaluación económica aplicada a las tecnologías sanitarias. Gac Sanit. 2010;24(2):154-70. DOI: 10.1016/j.gaceta.2009.07.011 [ Links ]
13. Vallejo-Torres L, García-Lorenzo B, Serrano-Aguilar P. Estimating a cost-effectiveness threshold for the Spanish NHS. Health Econ. 2018;27(4):746-61. DOI: 10.1002/hec.3633 [ Links ]
14. Bagust A, Beale S. Survival Analysis and Extrapolation Modeling of Time-to-Event Clinical Trial Data for Economic Evaluation. Med Decis Mak. 2014;34(3):343-51. DOI: 10.1177/0272989X13497998 [ Links ]
15. Latimer NR. Response to “Survival Analysis and Extrapolation Modeling of Time-to-Event Clinical Trial Data for Economic Evaluation: An Alternative Approach” by Bagust and Beale. Med Decis Mak. 2014;34(3):279-82. DOI: 10.1177/0272989X13511302 [ Links ]
16. Instituto Nacional de Estadística (INE). Tablas de mortalidad por año, sexo, edad y funciones [Internet]. 2020 [accessed 05/05/2020]. Available at: https://www.ine.es/jaxiT3/Tabla.htm?t=27153 [ Links ]
17. Sudhapalli P, Piena M, Palaka A, Mato A, Van de Wetering G, Manzoor B, et al. Systematic literature review and network meta-analysis comparing therapies for treatment-naive patients with chronic lymphocytic leukemia. Póster presentado de forma virtual en el XXV Congreso de la European Hematology Association, junio-octubre 2020 [Internet]. 2020 [accessed 12/02/2021]. Available at: https://library.ehaweb.org/eha/2020/eha25th/294643/kavita.sail.systematic.literature.review.and.network.meta-analysis.comparing.html [ Links ]
18. Hornberger J, Reyes C, Shewade A, Lerner S, Friedmann M, Han L, et al. Costeffectiveness of adding rituximab to fludarabine and cyclophosphamide for the treatment of previously untreated chronic lymphocytic leukemia. Leuk Lymphoma. 2012;53(2):225-34. DOI: 10.3109/10428194.2011.605918 [ Links ]
19. Beusterien KM, Davies J, Leach M, Meiklejohn D, Grinspan JL, O'Toole A, et al. Population preference values for treatment outcomes in chronic lymphocytic leukaemia: a cross-sectional utility study. Health Qual Life Outcomes. 2010;8(1):50. DOI: 10.1186/1477-7525-8-50 [ Links ]
20. Instituto Nacional de Estadística (INE). Encuesta Nacional de Salud (ENSE) 2011/12 [Internet]. [accessed 05/08/2021]. Available at: https://www.mscbs.gob.es/estadEstudios/estadisticas/encuestaNacional/encuesta2011.htm [ Links ]
21. Consejo General de Colegios Oficiales de Farmacéuticos. Portal Farma. BotPLUS [Internet]. 2020 [accessed 05/28/2020]. Available at: https://botplusweb.portalfarma.com/ [ Links ]
22. Byrd JC, Furman RR, Coutre S, Flinn IW, Burger JA, Blum KA, et al. Up to 7 Years of Follow-up of Single-Agent Ibrutinib in the Phase 1b/2 PCYC-1102 Trial of First Line and Relapsed/Refractory Patients with Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma. Blood. 2018;132(Suppl 1):3133. DOI: 10.1182/blood2018-99-110847 [ Links ]
23. Eichhorst B, Fink AM, Bahlo J, Busch R, Kovacs G, Maurer C, et al. First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukaemia (CLL10): an international, open-label, randomised, phase 3, non-inferiority trial. Lancet Oncol. 2016;17(7):928-42. DOI: 10.1016/S1470-2045(16)30051-1 [ Links ]
24. Kater AP, Seymour JF, Hillmen P, Eichhorst B, Langerak AW, Owen C, et al. Fixed Duration of Venetoclax-Rituximab in Relapsed/Refractory Chronic Lymphocytic Leukemia Eradicates Minimal Residual Disease and Prolongs Survival: Post-Treatment Follow-Up of the MURANO Phase III Study. J Clin Oncol. 2019;37(4):269-77. DOI: 10.1200/JCO.18.01580 [ Links ]
25. Davids MS, Hallek M, Wierda W, Roberts AW, Stilgenbauer S, Jones JA, et al. Comprehensive Safety Analysis of Venetoclax Monotherapy for Patients with Relapsed/ Refractory Chronic Lymphocytic Leukemia. Clin Cancer Res. 2018;24(18):4371-9. DOI: 10.1158/1078-0432.CCR-17-3761 [ Links ]
26. Gisbert R, Brosa M. Healthcare cost database eSalud. Barcelona: Oblikue Consulting, SL. Información económica del sector sanitario [Internet]. 2020 [accessed 05/30/2020]. Available at: http://esalud.oblikue.com/ [ Links ]
27. Barr PM, Robak T, Owen C, Tedeschi A, Bairey O, Bartlett NL, et al. Sustained efficacy and detailed clinical follow-up of first-line ibrutinib treatment in older patients with chronic lymphocytic leukemia: extended phase 3 results from RESONATE-2. Haematologica. 2018;103(9):1502-10. DOI: 10.3324/haematol.2018.192328 [ Links ]
28. Hallek M, Fischer K, Fingerle-Rowson G, Fink A, Busch R, Mayer J, et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. Lancet. 2010;376(9747):1164-74. DOI: 10.1016/S0140-6736(10)61381-5 [ Links ]
29. National Institute for Health and Care Excellence. TA306: Pixantrone monotherapy for treating multiply relapsed or refractory aggressive non-Hodgkin's B-cell lymphoma [Internet]. 2014 [accessed 11/09/2021]. Available at: https://www.nice.org.uk/guidance/ta306 [ Links ]
30. Lloyd A, Nafees B, Narewska J, Dewilde S, Watkins J. Health state utilities for metastatic breast cancer. Br J Cancer. 2006;95(6):683-90. DOI: 10.1038/sj.bjc.6603326 [ Links ]
31. National Institute for Health and Care Excellence. TA216: Bendamustine for the first-line treatment of chronic lymphocytic leukaemia [Internet]. 2011 [accessed 11/09/2021]. Available at: https://www.nice.org.uk/guidance/ta216. [ Links ]
32. National Institute for Health and Care Excellence. TA344: Ofatumumab in combination with chlorambucil or bendamustine for untreated chronic lymphocytic leukaemia [Internet]. 2015 [accessed 11/09/2021]. Available at: https://www.nice.org.uk/guidance/ta344 [ Links ]
33. Nafees B, Stafford M, Gavriel S, Bhalla S, Watkins J. Health state utilities for non small cell lung cancer. Health Qual Life Outcomes. 2008;6(1):84. DOI: 10.1186/1477-7525-6-84 [ Links ]
34. Tolley K, Goad C, Yi Y, Maroudas P, Haiderali A, Thompson G. Utility elicitation study in the UK general public for late-stage chronic lymphocytic leukaemia. Eur J Health Econ. 2013;14(5):749-59. DOI: 10.1007/s10198-012-0419-2 [ Links ]
35. National Institute for Health and Care Excellence. TA359: Idelalisib for treating chronic lymphocytic leukaemia [Internet]. 2015 [accessed 11/09/2021]. Available at: https://www.nice.org.uk/guidance/ta359/documents/leukaemia-chroniclymphocytic-previously-treated-idelalisib [ Links ]
36. Briggs AH. Handling Uncertainty in Cost-Effectiveness Models. Pharmacoeconomics. 2000;17(5):479-500. DOI: 10.2165/00019053-200017050-0 [ Links ]
37. Moreno Martínez E, De la Serna Torroba J, Escudero Vilaplana V, Hernández Rivas J, Sánchez Cuervo M, Sánchez Hernández R. Eficiencia de Venetoclax en combinación con obinutuzumab en el tratamiento de pacientes con LLC que no hayan recibido tratamiento previo en España. Haematologica. 2020;(Supl 3):S221. [ Links ]
38. Moreno Martínez E, De la Serna Torroba J, Escudero Vilaplana V, Hernández Rivas J, Sánchez Cuervo M, Sánchez Hernández R. Análisis del impacto presupuestario de venetoclax en combinación con obinutuzumab como tratamiento de pacientes con LLC que no hayan recibido tratamiento previo. Haematologica. 2020; 105(Supl 3):S214. [ Links ]
39. Soini E, Hautala A, Poikonen E, Becker U, Kyttälä M, Martikainen J. Cost-effectiveness of First-line Chronic Lymphocytic Leukemia Treatments When Full-dose Fludarabine Is Unsuitable. Clin Ther. 2016;38(4):889-904.e14. DOI: 10.1016/ j.clinthera.2016.02.005 [ Links ]
40. Sinha R, Redekop WK. Cost-Effectiveness of Ibrutinib Compared With Obinutuzumab With Chlorambucil in Untreated Chronic Lymphocytic Leukemia Patients With Comorbidities in the United Kingdom. Clin Lymphoma Myeloma Leuk. 2018;18(2):e131-42. DOI: 10.1016/j.clml.2017.12.005 [ Links ]
41. Patel KK, Isufi I, Kothari S, Davidoff AJ, Gross CP, Huntington SF. Cost-effectiveness of first-line vs third-line ibrutinib in patients with untreated chronic lymphocytic leukemia. Blood. 2020;136(17):1946-55. DOI: 10.1182/blood.2020004922 [ Links ]
42. Barnes JI, Divi V, Begaye A, Wong R, Coutre S, Owens DK, et al. Cost-effectiveness of ibrutinib as first-line therapy for chronic lymphocytic leukemia in older adults without deletion 17p. Blood Adv. 2018;2(15):1946-56. DOI: 10.1182/bloodadvances.2017015461 [ Links ]
FinanciaciónEl estudio se llevó a cabo con financiación de AbbVie España. No se realizaron honorarios ni pagos por autoría
Presentación en congresosLXII Congreso Nacional de la Sociedad Española de Hematología y Hemoterapia y XXXVI Congreso Nacional de la Sociedad Española de Trombosis y Hemostasia. Congresos virtuales; 26 al 30 de octubre de 2020
Aportación a la literatura científicaEs el primer estudio de coste-utilidad que evalúa la potencial eficiencia de la inclusión de venetoclax en combinación con obinutuzumab en la prestación farmacéutica del Sistema Nacional de Salud como una alternativa para el tratamiento de la leucemia linfocítica crónica en pacientes no tratados previamente en España
Cómo citar este trabajoMoreno-Martínez E, De la Serna-Torroba J, Escudero-Vilaplana V, Hernández-Rivas JA, Sánchez-Cuervo M, Sánchez-Hernández R. Análisis coste-utilidad de venetoclax en combinación con obinutuzumab como tratamiento de primera línea de la leucemia linfocítica crónica en España. Farm Hosp. 2022;46(3):121-32.
Anexo 1.
Distribuciones paramétricas evaluadas para la extrapolación de las curvas de supervivencia libre de progresión y supervivencia global de VenO y ClbO, así como los criterios de información de Akaike y bayesiano
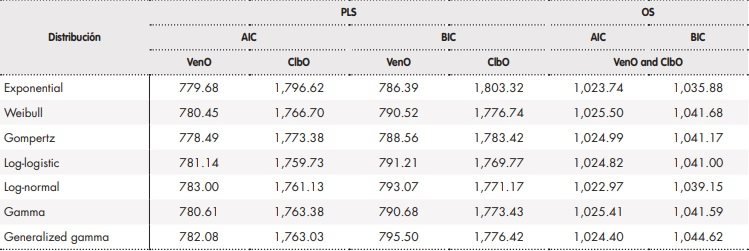
AIC: criterios de información de Akaike; BIC: criterios de información bayesiano; ClbO: clorambucilo en combinación con obinutuzumab; SG: supervivencia global; SLP: supervivencia libre de progresión; VenO: venetoclax en combinación con obinutuzumab.
Anexo 2.
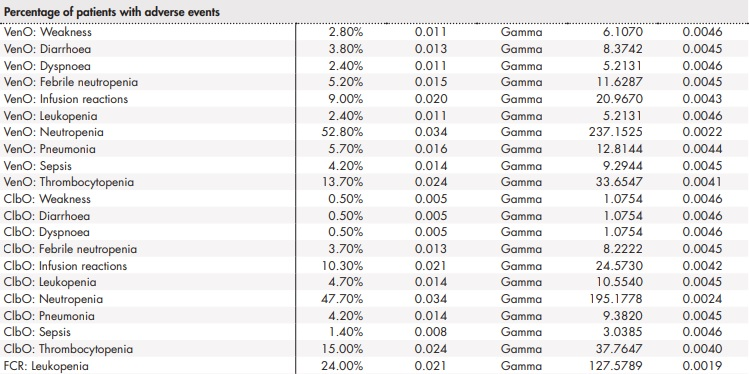
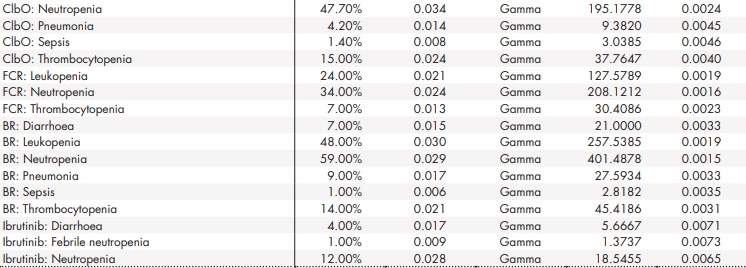
Anexo 2 (cont.). Parámetros y distribuciones del análisis de sensibilidad probabilístico
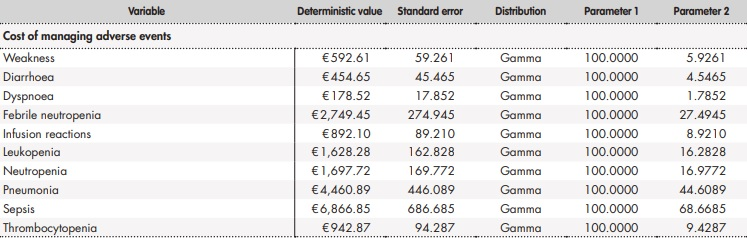
BR: bendamustina en combinación con rituximab; ClbO: clorambucilo en combinación con obinutuzumab; FCR: fludarabina en combinación con ciclofosfamida y rituximab; VenO: venetoclax en combinación con obinutuzumab.
Recibido: 26 de Agosto de 2021; Aprobado: 28 de Enero de 2022; : 19 de Abril de 2022











 texto en
texto en