Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.46 no.3 Toledo Mai./Jun. 2022 Epub 25-Jul-2022
https://dx.doi.org/10.7399/fh.11854
ORIGINALES
Medicamentos en situaciones especiales para tumores sólidos: profundizando en la evidencia y los perfiles de efectividad y toxicidad
1Departamento de Urología, Hospital Universitario Ramón y Cajal, Instituto Ramón y Cajal de Investigación Sanitaria (IRYCIS), Universidad de Alcalá de Henares (UAH), Madrid. España
2Departamento de Farmacia Hospitalaria, Hospital Universitario Ramón y Cajal, Madrid. España.
3Departamento de Farmacología, Universidad de La Laguna, Santa Cruz de Tenerife
Servicio de Farmacología Clínica, Hospital Universitario de Canarias, Santa Cruz de Tenerife. España
Objetivo:
Analizar las solicitudes de medicamentos en situaciones especiales (uso compasivo, uso fuera de indicación y medicamentos extranjeros) para tumores sólidos, y evaluar el nivel de evidencia que avala dichas solicitudes, así como la efectividad y seguridad de los medicamentos más frecuentes.
Método:
Estudio transversal que incluyó las solicitudes de medicamentos en situaciones especiales durante el período 2018-2019 en un centro representativo español de tercer nivel. Se recogieron datos sobre principios activos, indicaciones clínicas y nivel de evidencia aportado en la solicitud. Asimismo, la respuesta tumoral fue evaluada mediante criterios Response Evaluation Criteria in Solid Tumours versión 1.1, supervivencia libre de progresión y supervivencia global. La seguridad fue evaluada con la versión 5.0 de los criterios de toxicidad Common Terminology Criteria for Adverse Events del National Cancer Institute de Estados Unidos.
Resultados:
Un total de 2.273 medicamentos en situaciones especiales fueron aprobados entre enero de 2018 y diciembre de 2019. El 19% (431) se aprobaron para el tratamiento de tumores sólidos. De estos 431, 291 (67,5%) solicitudes fueron de medicamentos fuera de indicación, 76 (18%) extranjeros y 64 (15%) en uso compasivo. La mayoría son avaladas por estudios clínicos aleatorizados en fase III (47%) o fase II (33%). La mayor parte de los efectos adversos fueron de grado 1 y solo en 6/67 casos el tratamiento fue interrumpido por toxicidad.
Conclusiones:
Un porcentaje importante de medicamentos en usos especiales se prescriben a pacientes oncológicos. La mayoría de las solicitudes fueron avaladas por algún estudio clínico aleatorizado. La experiencia en vida real mostró un perfil de efectividad y tolerancia similar al descrito en los estudios clínicos aleatorizados.
PALABRAS CLAVE Medicina basada en la evidencia; Ensayos clínicos; Uso compasivo; Acceso ampliado; Medicamentos en investigación; Uso fuera de indicación
Introducción
La demora en la aprobación y comercialización de nuevos productos farmacéuticos, especialmente en el ámbito de la oncología médica, puede suponer que algunos medicamentos prometedores no se autoricen, a pesar de que existan pruebas que avalan su uso. Por este motivo ha surgido la categoría de los medicamentos en situaciones especiales, que constituyen una opción de tratamiento que permite el uso de medicamentos que aún no cuentan con la autorización de las agencias reguladoras1. No obstante, no existe demasiada literatura especializada que aborde en detalle el grado de evidencia clínica aportado para avalar el uso de medicamentos fuera de indicación en la práctica clínica2.
A lo largo de los años, el uso compasivo de medicamentos ha evolucionado mucho y se ha convertido en un proceso muy complejo en el que participan compañías farmacéuticas, agencias reguladoras, médicos, pacientes y grupos de defensa de pacientes3. Los medicamentos en situaciones especiales engloban el uso de medicamentos no autorizados y el uso de medicamentos fuera de las indicaciones autorizadas. Dichos usos incluyen los siguientes:
Uso fuera de indicación (UFI): el uso de un medicamento autorizado para una indicación diferente de las que figuran en la ficha técnica del producto.
Uso compasivo (UC): el uso de medicamentos en investigación (no autorizados aún) en pacientes para los que no existe otro tratamiento autorizado satisfactorio y no pueden participar en ensayos clínicos aleatorizados (ECA).
Medicamentos extranjeros (ME): el uso de medicamentos no autorizados en España, pero autorizados en otros países4
La legislación española limita el uso de cada uno de estos medicamentos a circunstancias excepcionales en las que no existe otra alternativa terapéutica en el mercado. En España, el proceso de aprobación de medicamentos no autorizados (UC o ME) como medicamento en situaciones especiales requiere una serie de pasos que deben realizarse secuencialmente: a) el consentimiento informado del paciente; b) la solicitud por parte del médico especialista; c) la aprobación del director médico del centro sanitario, y d) la autorización de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)4. En algunos casos, también se requiere la aprobación del promotor o de la empresa farmacéutica. En el caso de los medicamentos con UFI, la autorización de la AEMPS no es necesaria. El médico debe justificar y registrar la necesidad de su uso en la historia clínica, e informar al paciente de los posibles riesgos y beneficios.
La Directiva 2001/83/CE1 (artículo 6) exige que, antes de poder comercializar un medicamento en la Comunidad Europea, éste debe estar autorizado por la agencia reguladora5. El artículo 6 únicamente describe dos requisitos generales para el uso compasivo de medicamentos: 1) enfermedad crónica, gravemente debilitante, o enfermedad potencialmente mortal en pacientes que no pueden ser tratados satisfactoriamente con un medicamento autorizado, y 2) el medicamento debe estar en proceso de solicitud de autorización de comercialización centralizada o estar en fase de investigación en algún estudio clínico3. Los programas de uso compasivo (PUC) están coordinados por los estados miembros de la Unión Europea, que establecen sus propias normas y procedimientos6.
Una revisión de la literatura que investigó el uso compasivo de medicamentos en 28 países de la Unión Europea concluyó que 20 disponían de un PUC (71%). De los 28 estados miembros, 18 contaban con normativas nacionales y los procesos estaban bien definidos7.
Antes de ofrecer un PUC, se debe considerar la inclusión del paciente en un ECA. Dichos estudios son el mejor modo de obtener datos fiables e interpretables sobre la eficacia y la seguridad de un medicamento5.
En 2014, el número de solicitudes de acceso ampliado para nuevos medicamentos en investigación recibido por la Food and Drug Administration (FDA) de los Estados Unidos se había duplicado respecto a 2005, y el 99,7% de ellas fueron aceptadas8. Los medicamentos antineoplásicos representaron aproximadamente una cuarta parte de dichas solicitudes. Los objetivos de este estudio son los siguientes:
– Analizar las solicitudes de medicamentos en situaciones especiales para tumores sólidos en un hospital terciario español de referencia y describir aquellos aprobados (nombres genéricos) y sus indicaciones.
– Evaluar el nivel de evidencia clínica que avalaba dichas solicitudes.
– Evaluar la efectividad y seguridad de los medicamentos más utilizados.
Métodos
Diseño del estudio
Se realizó un estudio transversal de todas las solicitudes de medicamentos en situaciones especiales tramitadas en un hospital terciario representativo en 2018 y 2019. En primer lugar, se identificaron todos los medicamentos en situaciones especiales utilizados y, de ellos, se seleccionaron aquellos empleados para tumores sólidos.
Variables
Se recogieron datos sobre los nombres genéricos de los medicamentos, las indicaciones y el nivel de evidencia aportado, basado en el tipo de estudio, y su correlación con los niveles de evidencia clínica establecidos por el National Health and Medical Research Council (NHMRC) y el National Institute for Clinical Excellence (NICE): estudios en animales y experimentales, informe de casos o series de casos, estudios observacionales y ECA divididos por fases.
Se analizaron determinadas características de los pacientes, como la dad y el estado funcional según la escala del Eastern Cooperative Oncology Group (ECOG). La respuesta tumoral se evaluó mediante la versión 1.1 de los criterios RECIST (Response Evaluation Criteria in Solid Tumours), la supervivencia libre de progresión (SLP) y la supervivencia global (SG). La seguridad se evaluó mediante la versión 5.0 del CTCAE (Common Terminology Criteria for Adverse Events) del Instituto Nacional del Cáncer de los Estados Unidos. También se recogieron datos sobre el tiempo transcurrido hasta la aparición de un efecto adverso y la necesidad de cambio de tratamiento. Por último, se compararon los datos procedentes de nuestro estudio en vida real con los datos publicados en diversos ECA.
Recogida de datos y aprobación de medicamentos
Los datos se obtuvieron de la base de datos de medicamentos en situaciones especiales registrada por el centro de información de medicamentos del departamento de farmacia del hospital (software PKusos: https://www.pksiam.com/service/pkusos/)9.
Antes de autorizar un medicamento para su uso en situaciones especiales, un equipo multidisciplinar evaluó la evidencia disponible sobre su uso en dicha situación. Cada solicitud presentada se estudió individualmente. Un comité hospitalario evaluó cada caso para determinar si la solicitud cumplía los requisitos para medicamento en situaciones especiales. Por último, se recopilaron los datos de los medicamentos antineoplásicos que el comité hospitalario había aprobado.
Análisis estadístico
El análisis estadístico se realizó con el programa Stata (StataCorp, Texas). Las figuras y los gráficos se crearon con Microsoft Excel (Microsoft, Washington). Las variables categóricas se expresan como frecuencias y porcentajes, y las variables continuas se expresan como medias (desviación estándar [DE]) o medianas (rangos intercuartílicos [IQR]), dependiendo la distribución de la variable. La supervivencia se analizó mediante las curvas de Kaplan-Meier.
Resultados
Entre enero de 2018 y diciembre de 2019 se aprobaron un total de 2.273 medicamentos en situaciones especiales (el 99,5% de todas las solicitudes). Un total de 431 (19%) solicitudes estaban destinadas a tratar tumores sólidos.
En cuanto a la distribución de los servicios peticionarios, el departamento que solicitó medicamentos en situaciones especiales con más frecuencia fue el de oftalmología (440 solicitudes; 19,3%), seguido de oncología (431 solicitudes; 18,9%) y hematología (289 solicitudes; 12,7%).
La tabla 1 muestra las indicaciones clínicas de los medicamentos en situaciones especiales para tumores sólidos y el nivel de evidencia aportado en el momento de la solicitud.
Tabla 1. Frecuencia de las indicaciones clínicas (tipos de tumores) de los medicamentos en situaciones especiales aprobados y nivel de evidencia aportado en el momento de solicitud

Las patologías tratadas con más frecuencia con este tipo de medicamentos fueron el carcinoma hepatocelular (13,4%), el cáncer de pulmón (13,2%) y el cáncer de mama (12%). En 365 casos (84,9%) fue posible obtener información sobre el nivel de evidencia que avalaba la solicitud. La mayoría de los medicamentos en situaciones especiales estaban avalados por ensayos en fase III (47%) o en fase II (33%) (Tabla 1).
De las 431 solicitudes, 291 (67,5%) fueron para UFI, 76 (18%) para ME y 64 (15%) para UC. La tabla 2 resume los datos de los medicamentos empleados para tumores sólidos.
Tabla 2. Medicamentos extranjeros, fuera de indicación y en uso compasivo aprobados para el tratamiento de tumores sólidos entre 2018 y 2019

Tabla 2 (cont.). Medicamentos extranjeros, fuera de indicación y en uso compasivo aprobados para el tratamiento de tumores sólidos entre 2018 y 2019

Tabla 2 (cont.). Medicamentos extranjeros, fuera de indicación y en uso compasivo aprobados para el tratamiento de tumores sólidos entre 2018 y 2019

Tabla 2 (cont.). Medicamentos extranjeros, fuera de indicación y en uso compasivo aprobados para el tratamiento de tumores sólidos entre 2018 y 2019

CCR: cáncer colorrectal; CNMP: carcinoma no microcítico de pulmón; CPM: cáncer microcítico de pulmón; CPRC: cáncer de próstata resistente a la castración; GIST: tumor del estroma gastrointestinal; ME: medicamentos extranjeros; TNE: tumor neuroendocrino; UC: medicamentos para uso compasivo; UFI: uso fuera de indicación.Los casos marcados con un asterisco (*) indican que se analizaron los perfiles de eficacia y toxicidad (véase la Tabla 3). Se detectó la ausencia de algunos valores (por ejemplo, seguimiento en otros centros, fallecimiento antes de la evaluación con tomografía computarizada, etc.).
La figura 1 muestra los medicamentos más utilizados (nombres genéricos) para tumores sólidos durante el periodo de 2018 y 2019. El etiodol, el oxaliplatino y el durvalumab fueron los medicamentos más prescritos como ME, UFI y UC, respectivamente.

Figura 1. Frecuencia de los medicamentos en situaciones especiales aprobados para el tratamiento de tumores sólidos.
La tabla 3 muestra los datos de efectividad y seguridad de los medicamento en situaciones especiales más prescritos durante el periodo de estudio.
Tabla 3. Experiencia “en vida real” sobre la eficacia y seguridad de los medicamentos en situaciones especiales prescritos con más frecuencia

Tabla 3 (cont.). Experiencia “en vida real” sobre la eficacia y seguridad de los medicamentos en situaciones especiales prescritos con más frecuencia
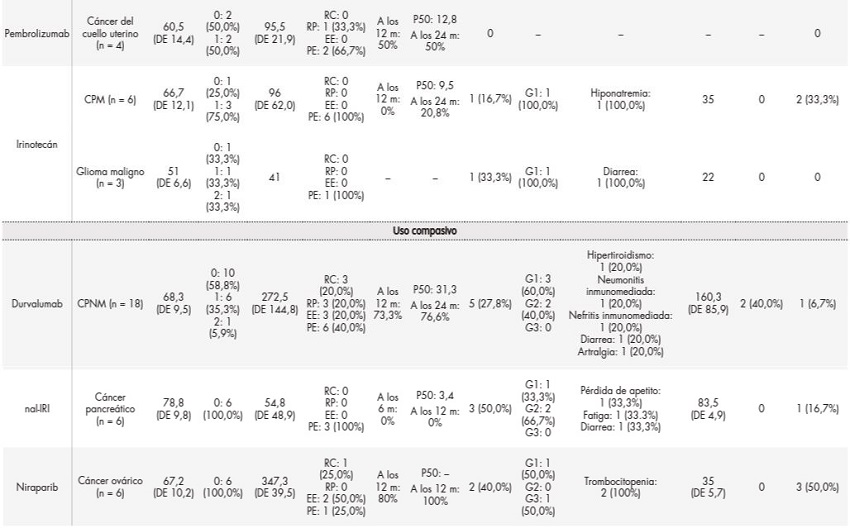
Tabla 3 (cont.). Experiencia “en vida real” sobre la eficacia y seguridad de los medicamentos en situaciones especiales prescritos con más frecuencia

2CPM: carcinoma microcítico de pulmón; CTCAE: Common Terminology Criteria for Adverse Events; DE: desviación estándar; ECOG: Eastern Cooperative Oncology Group; EE: enfermedad estable; G1: grado 1; G2: grado 2; G3: grado 3; ME: medicamentos extranjeros; P50: mediana de la supervivencia (supervivencia global en meses); PE: progresión de la enfermedad; RC: respuesta completa; RECIST: criterios de evaluación de la respuesta en tumores sólidos; RP: respuesta parcial; SLP: supervivencia libre de progresión; UC: uso compasivo; UFI: uso fuera de indicación.
Se detectaron datos o valores perdidos (seguimiento en otros hospitales, fallecimiento antes de la tomografía computarizada de reevaluación, etc.). Según los criterios RECIST, presentaron respuestas completas o parciales el 28,6% de los pacientes con cáncer gástrico tratados con oxaliplatino, el 40% de los pacientes diagnosticados de carcinoma de células escamosas tratados con paclitaxel, el 7,7% de los pacientes con cáncer de mama tratados con palbociclib, y el 33,33% de los pacientes con cáncer de cérvix tratados con pembrolizumab. La mayoría de los efectos tóxicos se clasificaron como grado 1 según la escala de CTCAE 5.0, y solo en 6 de los 67 casos se interrumpió el tratamiento debido a los efectos adversos.
Discusión
Evidencia para avalar el uso de medicamentos en situaciones especiales
Conocer el nivel de evidencia clínica que avala el uso de medicamentos en situaciones especiales es importante, ya que está estrechamente relacionado con la efectividad y la seguridad esperada del tratamiento. Nuestro estudio puede servir para evaluar el papel que tiene el nivel de evidencia clínica sobre la decisión de solicitar medicamentos no autorizados para tumores sólidos.
A pesar de que la evidencia científica se considera un factor importante para el uso y aprobación de medicamentos en situaciones especiales, el número de trabajos que han investigado dicho factor es limitado10. Existen algunos estudios que han analizado medicamentos concretos aprobados para uso en “situaciones especiales”. Por otra parte, no existen a disposición de los profesionales sanitarios directrices específicas que les ayuden a evaluar la idoneidad de una prescripción fuera de indicación. Gazarian et al. propusieron para los medicamentos UFI la siguiente clasificación para intentar asegurar una prescripción adecuada: UFI con uso avalado por un nivel de evidencia alto, uso en el contexto de una propuesta oficial de investigación, y uso excepcional justificado por circunstancias clínicas individuales11.
En 2015, la Sociedad Española de Farmacia Hospitalaria (SEFH) publicó una encuesta sobre el uso de medicamentos UFI en pacientes oncohematológicos en los hospitales españoles10. Dicha encuesta puso de manifiesto que el factor que más influye en el proceso de autorización prescripción es la evidencia disponible mediante ECA. No obstante, se suele aceptar un nivel de evidencia menor cuando no existen alternativas terapéuticas, o en pacientes con tumores de baja prevalencia4. También en España, Blanco-Reina et al. realizaron durante 2010 un estudio transversal para determinar el nivel de evidencia (según los criterios del SIGN-NICE) que avalaban la prescripción de medicamentos UFI en un hospital terciario. De las 190 solicitudes de medicamentos UFI, el 52,4% estaba avalado por algún ECA, mientras que el resto presentaban un nivel de evidencia más bajo (estudios observacionales e informes de casos)12. En contraste, el 83,1% de los medicamentos para uso en situaciones especiales en nuestro hospital estaban avalados por un ECA. Podrían ser muchas las razones para explicar estos datos, entre ellas: la buena implantación de los programas de medicamentos para uso en situaciones especiales en nuestro contexto, o la existencia de necesidades terapéuticas no cubiertas y el aumento reciente de evidencia más sólida gracias al incremento de los estudios controlados y con un diseño adecuado. De hecho, la propuesta y aceptación de solicitudes avaladas por un nivel de evidencia alto podría considerarse una señal de que estos programas están funcionando bien.
Un estudio realizado por investigadores del MD Anderson Cancer Centre señalaba que un tercio de las pacientes con cáncer de mama metastásico había recibido en algún momento un tratamiento con un medicamento UFI13. Además, un estudio multicéntrico italiano demostró que casi el 20% de las prescripciones en oncología eran medicamentos UFI, y la mayoría se basaba en evidencia sobre su eficacia (descrita en un ECA como mínimo, o en varios estudios en fase II publicados en alguna reconocida revista de oncología). Los medicamentos son utilizados para otro tipo de cáncer (46,2%) o para una neoplasia infrecuente (13,6%)14.
Uso de medicamentos en situaciones especiales en pacientes con cáncer
En la actualidad, el 20% de los medicamentos se utilizan fuera de indicación, y el porcentaje es mayor en los pacientes con cáncer. Las razones para el uso de medicamentos UFI en pacientes con cáncer son las siguientes: la extensa variedad de subtipos de cáncer, la baja prevalencia de algunos tumores, la ausencia de opciones de tratamiento alternativas, las dificultades para incluir a los pacientes en ensayos clínicos, la rápida difusión de los resultados preliminares de los ECA, y el retraso en la aprobación de nuevos medicamentos por parte de las agencias reguladoras4,15.
Solo el 8% de las directrices establecidas por la Red Nacional Integral del Cáncer (NCCN) de Estados Unidos se basan en evidencia de nivel I. Por tanto, a pesar de la falta de evidencia robusta, los oncólogos tienen que realizar recomendaciones terapéuticas16. Esto es especialmente importante cuando solicitan el uso de un medicamento en investigación.
En una revisión sistemática, Saiyed et al. observaron que entre el 13% y el 71% de los pacientes adultos con cáncer recibieron como mínimo un medicamento quimioterápico fuera de indicación, y que las razones principales fueron la falta de indicaciones aprobadas para tumores concretos y las modificaciones en la administración del medicamento. Los pacientes que recibieron medicamentos UFI con más frecuencia fueron aquellos con cáncer metastásico o en cuidados paliativos. Además, el uso de medicamentos UFI no respaldados por las guías clínicas de tratamiento se situó entre el 7% y el 31% 17.
En el estudio de Joerger et al., que incluía 985 pacientes consecutivos a los que se les administró 1.737 tratamientos farmacológicos contra el cáncer, el 32,4% recibió como mínimo un medicamento UFI. El UFI se debió a que el medicamento no estaba autorizado para esa enfermedad concreta (15,7%) o a que se aplicaron modificaciones en la administración del medicamento antineoplásico (10%)18. Conti et al. investigaron la prevalencia del uso de medicamentos antineoplásicos UFI en una base de datos poblacional con una cohorte de oncólogos. El 30% de los tratamientos empleados fueron con medicamentos UFI, de los cuales el 14% se ajustaba a indicaciones fuera de la ficha técnica recomendadas por la NCCN. El gasto total en dichos tratamientos quimioterápicos ascendió a 12.000 millones de dólares19.
En otro estudio previo realizado en nuestro hospital entre 2005 y 200820, la mayoría de las solicitudes de medicamentos en situaciones especiales fueron emitidas por los servicios de oncología médica, gastroenterología y reumatología. Además, Montero et al. informaron que la mayoría de los medicamentos eran prescritos por oncólogos (aproximadamente el 50%)21.
Un estudio realizado en Francia en 2002 señaló que el 6,7% de las prescripciones correspondían a medicamentos UFI. Las prescripciones para indicaciones no incluidas en la ficha técnica fueron frecuentes en pacientes con cáncer de próstata resistente a la castración (57,6%) y en pacientes con cáncer de vejiga (37,6%). Los medicamentos más utilizados fuera de indicación fueron el docetaxel (29%), el oxaliplatino (24%), la fludarabina (8%) y el carboplatino (8%)22. En nuestro hospital, los medicamentos en situaciones especiales más solicitados fueron el etiodol (58 solicitudes), utilizado para la quimioembolización transarterial en carcinomas hepatocelulares de gran tamaño, el oxaliplatino sin combinación (21) y el durvalumab (20). Además, en nuestro entorno, los medicamentos en situaciones especiales fueron más comúnmente prescritos para el carcinoma hepatocelular (13,4%), el cáncer de pulmón (13,2%) y el cáncer de mama (12%).
Desde que se realizó este estudio, algunos de los medicamentos incluidos en el mismo han cambiado de categoría. Algunos de ellos han sido aprobados, revisados y cambiados de categoría debido a que el nivel de evidencia sobre su efectividad ha aumentado lo suficiente como para avalar su uso.
Resultados en vida real
En pacientes con una esperanza de vida corta, es importante evitar tratamientos fútiles y, por tanto, es esencial determinar la efectividad y el grado de toxicidad de dichos medicamentos en la experiencia cotidiana. Sánchez-Cuervo et al. realizaron un estudio observacional retrospectivo para evaluar el uso de la quimioterapia durante los últimos 30 días de vida. El 35,2% de los tratamientos administrados a pacientes que iniciaron una nueva pauta de quimioterapia durante los 30 días previos a su muerte fue con medicamentos en situaciones especiales23.
Por lo tanto, estudiamos la evidencia en vida real sobre efectividad y seguridad de los medicamentos utilizados en situaciones especiales. Es crucial analizar la correlación entre la evidencia en mundo real y la evidencia previa disponible. A continuación, analizamos la efectividad y seguridad de los medicamentos UFI, UC y ME más frecuentes en nuestro entorno. No obstante, este estudio presenta dos limitaciones: el tamaño de la muestra para algunos medicamentos es pequeño, y existen valores perdidos.
Por ejemplo, respecto a la efectividad y la seguridad del oxaliplatino en el tratamiento del cáncer gástrico avanzado, los resultados muestran que la edad media de los pacientes fue de 69,4 (DE 12,3) años y que la mayoría de ellos (66,7%) presentaban un estado funcional ECOG 1. La SG fue de 10,5 meses y el 35,7% de los pacientes experimentaron una progresión de la enfermedad. El efecto adverso más frecuente fue la fatiga (78,5%). Dichos resultados son coherentes con los obtenidos en estudios anteriores. Por ejemplo, el estudio de Kawada et al.24 obtuvo una SG de 7,1 meses (intervalo de confianza [IC] del 95%, 2,3-10,1) y los efectos adversos (grado 3-4) notificados con mayor frecuencia fueron la fatiga (20%) y la hipopotasemia (20%).
El palbociclib, combinado con terapia hormonal, podría ser una nueva alternativa valiosa para pacientes con cáncer de mama avanzado o metastásico HR+/HER2–. En España, este medicamento se comercializó en noviembre de 2017, pero está incluido en un PUC desde 2015. Existen algunos estudios del mundo real con él en pacientes con cáncer de mama avanzado. Du Rusquec et al.25 notificaron unas tasas de enfermedad estable (EE) del 45%, de progresión de la enfermedad (PE) del 28,3% y de respuesta parcial (RP) del 26,7%. Masuda et al. obtuvieron una SG y una SLP al año del 92,9% y del 75%, respectivamente26. En nuestro estudio, la tasa de SLP fue del 21,2% a los 12 meses, y la mediana de SG de 17,3 meses para pacientes con enfermedad muy avanzada que no cumplían las indicaciones autorizadas para pacientes con progresión de la enfermedad tras la terapia hormonal. Observamos que la tasa de progresión de la enfermedad fue mayor (92,3%), lo que puede deberse a las características de las pacientes incluidas (estadio más avanzado, más líneas previas de quimioterapia, etc.); no obstante, el pequeño tamaño de la muestra (n = 17) es una limitación.
Algunos estudios han abordado el uso compasivo de durvalumab en el cáncer pulmonar no microcítico localmente avanzado e irresecable. Según Gil-Sierra et al.27, la SLP media fue de 20,8 (13,6-28,1) meses, pero no se pudo calcular la SG media porque no hubo muertes. Los autores identificaron 17 efectos adversos. Los efectos adversos más frecuentes fueron infecciones respiratorias (4 casos; 23,5%), tos (3 casos; 17,6%) y lesiones eritematosas (2 casos; 11,7%). Se produjeron 16 (94,1%) efectos adversos de grado 1, y se interrumpió el tratamiento en 8 casos, sin llegar a suspenderse. En nuestro estudio, la SG media fue de 31,3 meses. La tasa de efectos adversos de grado 1 fue del 60%. Durvalumab se suspendió en 2 pacientes debido a los efectos adversos (40%).
El etiodol (o lipiodol) es distribuido por Guerbet (Nueva Jersey) y su uso está aprobado en más de 47 países de todo el mundo28. Una revisión sistemática que incluía a 10.108 pacientes tratados con etiodol en quimioembolización transarterial obtuvo una tasa de respuesta (TR) del 52,5% (IC 43,6-61,5) y una SG del 51,8% a los 2 años29. En nuestro estudio, la TR fue similar (60%), pero la SG fue del 77% a los 2 años.
Nuestros datos coinciden con los de Arroyo-Álvarez et al., que analizaron entre 2005 y 2015 el uso de los antineoplásicos orales (ANEO) fuera de indicación y los resultados clínicos. La mediana de la SLP de los pacientes tratados con ANEO fuera de indicación fue de 5 meses (4,0-21,3) y la de la SG de 11 meses (9,2-20,6). Además, los efectos secundarios más frecuentes notificados fueron astenia (19%), neutropenia (10,7%), y náuseas y vómitos (8,9%)30. En la misma línea, García-Muñoz et al. Realizaron un estudio retrospectivo de todos los pacientes atendidos en el servicio de oncología médica que iniciaron tratamiento con un ANEO en 2016. Compararon los resultados obtenidos con la evidencia utilizada para su autorización y también concluyeron que la efectividad del uso de ANEO fuera de indicación era similar a la evidencia disponible en los ECA15. Dichos datos sugieren que existen similitudes en los perfiles de efectividad y toxicidad de los medicamentos aprobados para usos especiales.
En conclusión, en los hospitales españoles se prescribe un número considerable de medicamentos en situaciones especiales a los pacientes oncológicos. Además, la mayoría de las solicitudes de dichos medicamentos están avaladas por los resultados obtenidos en algún ECA. La experiencia en la vida real demostró que los perfiles de efectividad y tolerancia de los medicamentos utilizados en situaciones especiales son similares a los descritos en los ECA.
REFERENCIAS
1. Gupta SK, Nayak RP. Off-label use of medicine: Perspective of physicians, patients, pharmaceutical companies and regulatory authorities. J Pharmacol Pharmacother. 2014; 5(2): 88-92. DOI: 10.4103/0976-500X.130046 [ Links ]
2. Herbrand AK, Schmitt AM, Briel M, Diem S, Ewald H, Hoogkamer A, et al. Contrasting evidence to reimbursement reality for off-label use (UFI) of drug treatments in cancer care: Rationale and design of the CEIT-OLU project. ESMO Open. 2019; 4(6). DOI: 10.1136/esmoopen-2019-000596 [ Links ]
3. Borysowski J, Górski A. Compassionate use of unauthorized drugs: Legal regulations and ethical challenges. Eur J Intern Med. 2019; 65: 12-6. DOI: 10.1016/j.ejim.2019.04.008 [ Links ]
4. Frutos Pérez-Surio A, Lozano Ortiz JR. The use of medicines in exceptional circumstances in Spain: adding perspective to early access. Drugs Ther Perspect. 2019; 35(2): 86-92. DOI: 10.1007/s40267-018-0590-3 [ Links ]
5. Committee for Medicinal Products for Human Use (CHMP). Guideline on Compassionate Use of Medicinal Products [Internet]. 2006 [accessed 07/26/2020]. Available at: https://www.ema.europa.eu/en/documents/regulatory-proceduralguideline/guideline-compassionate-use-medicinal-products-pursuant-article-83-regulation-ec-no-726/2004_en.pdf [ Links ]
6. European Medicines Agency. Compassionate use [Internet]. 2020 [accessed 07/26/2020]. Available at: https://www.ema.europa.eu/en/human-regulatory/research-development/compassionate-use [ Links ]
7. Balasubramanian G, Morampudi S, Chhabra P, Gowda A, Zomorodi B. An overview of compassionate use programs in the European Union member states. Intractable Rare Dis Res. 2016; 5(4): 244-54. DOI: 10.5582/irdr.2016.01054 [ Links ]
8. Fountzilas E, Said R, Tsimberidou AM. Expanded access to investigational drugs: balancing patient safety with potential therapeutic benefits. Expert Opin Investig Drugs. 2018; 27(2): 155-62. DOI: 10.1080/13543784.2018.1430137 [ Links ]
9. Sánchez Cuervo M, Muñoz García M, Gómez de Salazar López de Silanes ME, Bermejo Vicedo T. Designing a software for drug management in special situations at a hospital's drug administration service. Farm Hosp. 2015; 39(2): 102-8. DOI: 10.7399/fh.2015.39.2.8491 [ Links ]
10. González-Haba Peña E, Agustín Ferrández MJ, Mangues Bafalluy I, Alfredo López N, Fraga Fuentes MD, Marín Gil R, et al. Off-label use of oncology drugs: National survey results. Farm Hosp. 2015; 39(5): 275-87. DOI: 10.7399/fh.2015.39.5.8979 [ Links ]
11. Gazarian M, Kelly M, McPhee JR, Graudins LV, Ward RL, Campbell TJ. Off-label use of medicines: consensus recommendations for evaluating appropriateness. Med J Aust. 2006; 185(10): 544-8. DOI: 10.5694/j.1326-5377.2006.tb00689.x [ Links ]
12. Blanco-Reina E, Muñoz-García A, Cárdenas-Aranzana MJ, Ocaña-Riola R, Del Prado-Llergo JR. Assessment of off-label prescribing: Profile, evidence and evolution. Farm Hosp. 2017; 41(4): 458-69. DOI: 10.7399/fh.2017.41.4.10562 [ Links ]
13. Dean-Colomb W, Fang S, Smith W, Michaud L, Hortabagyi GN, Giordano S, et al. Off-label drug use in women with breast cancer. J Clin Oncol. 2009; 27(15): 1016‑1016. DOI: 10.1200/jco.2009.27.15_suppl.1016 [ Links ]
14. Lerose R, Musto P, Aieta M, Papa C, Tartarone A. Off-label use of anti-cancer drugs between clinical practice and research: The Italian experience. Eur J Clin Pharmacol. 2012; 68(5): 505-12. DOI: 10.1007/s00228-011-1173-6 [ Links ]
15. García-Muñoz C, Rodríguez-Quesada PP, Ferrari-Piquero JM. Use of oral antineoplastic in special situations in a third level hospital: Real life results. Farm Hosp. 2018; 42(1): 5-9. DOI: 10.7399/fh.10856 [ Links ]
16. Mailankody S, Prasad V. Thinking Systematically About the Off-Label Use of Cancer Drugs and Combinations for Patients Who Have Exhausted Proven Therapies. Oncologist. 2016; 21(9): 1031-2. DOI: 10.1634/theoncologist.2016-0086 [ Links ]
17. Saiyed MM, Ong PS, Chew L. Off-label drug use in oncology: a systematic review of literature. J Clin Pharm Ther. 2017; 42(3): 251-8. DOI: 10.1111/jcpt.12507 [ Links ]
18. Joerger M, Schaer-Thuer C, Koeberle D, Matter-Walstra K, Gibbons-Marsico J, Diem S, et al. Off-label use of anticancer drugs in eastern Switzerland: A population-based prospective cohort study. Eur J Clin Pharmacol. 2014; 70(6): 719-25. DOI: 10.1007/s00228-014-1662-5 [ Links ]
19. Conti RM, Bernstein AC, Villaflor VM, Schilsky RL, Rosenthal MB, Bach PB. Prevalence of off-label use and spending in 2010 among patent-protected chemotherapies in a population-based cohort of medical oncologists. J Clin Oncol. 2013; 31(9): 1134-9. DOI: 10.1200/JCO.2012.42.7252 [ Links ]
20. Vélez-Díaz M, Pérez Menéndez-Conde C, Sánchez-Cuervo M, Bermejo Vicedo T. Consumo de medicamentos de uso compasivo en un hospital general. Rev OFIL. 2009; 19(3). [ Links ]
21. Montero D, Vargas E, La Cruz CD, De Andrés-Trelles F. New regulation on drug Access under special circumstances in Spain. Med Clin (Barc). 2009; 133(11): 427‑32. DOI: 10.1016/j.medcli.2009.07.004 [ Links ]
22. Levêque D, Michallat AC, Schaller C, Ranc M. Evaluation des indications hors AMM chez des patients adultes traités par chimiothérapie anticancéreuse. Off label drug use in adult patients treated by anticancer chemotherapy. Bull Cancer. 2005; 92(5): 498-500. [ Links ]
23. Sánchez-Cuervo M, García-Basas L, Gómez de Salazar-López de Silanes E, Pueyo-López C, Bermejo-Vicedo T. Chemotherapy Near the End of Life in Onco–Hematological Adult Patients. Am J Hosp Palliat Med. 2020; 37(8): 641-7. DOI: 10.1177/1049909119901133 [ Links ]
24. Kawada J, Sugimoto N, Hirokazu T, Ueda S, Murakami K, Nishikawa K, et al. A phase 2 study of capecitabine plus oxaliplatin therapy (XELOX) for patients with inoperable/advanced gastric cancer who were resistant/intolerable to fluoropyrimidine, CDDP, taxane, and CPT-11 (OGSG1403). Ann Oncol. 2019; 30: iv49. DOI: 10.1093/annonc/mdz155.179 [ Links ]
25. DuRusquec P, Palpacuer C, Campion L, et al. Efficacy of palbociclib plus fulvestrant after everolimus in hormone receptor-positive metastatic breast cancer. Breast Cancer Res Treat. 2018; 168: 559-66. DOI: 10.1007/s10549-017-4623-8 [ Links ]
26. Masuda N, Nishimura R, Takahashi M, et al. Palbociclib in combination with letrozole as first-line treatment for advanced breast cancer: a Japanese phase II study. Cancer Sci. 2018; 109: 803-13. DOI: 10.1111/cas.13507 [ Links ]
27. Gil-Sierra MD, Martín-Rodríguez S, Briceño-Casado MP. Uso compasivo de durvalumab en cáncer de pulmón no microcítico: resultados en vida real. Rev OFIL. 2021; 31; 2: 196-200. [ Links ]
28. Guerbet: FDA Approves Lipiodol(r) (Ethiodized Oil) Injection for Imaging of Tumors in Adults with Known Hepatocellular Carcinoma (HCC) Paris Stock Exchange: GBT [Internet]. 2021 [accessed 03/20/2021]. Available at: https://www.globenewswire.com/news-release/2014/04/10/626260/10076316/en/Guerbet-FDA-Approves-Lipiodol-r-Ethiodized-Oil-Injection-for-Imaging-of-Tumors-in-Adults-with-Known-Hepatocellular-Carcinoma-HCC.html [ Links ]
29. Lencioni R, De Baere T, Soulen MC, Rilling WS, Geschwind JFH. Lipiodol transarterial chemoembolization for hepatocellular carcinoma: A systematic review of efficacy and safety data. Hepatology. 2016; 64(1): 106-16. DOI: 10.1002/hep.28453 [ Links ]
30. Arroyo Álvarez C, Rodríguez Pérez L, Rodríguez Mateos ME, Martínez Bautista MJ, Benítez Rodríguez E, Baena-Cañada JM. Off-label antineoplastic drugs. An effectiveness and safety study. Farm Hosp. 2017; 41(3): 382-90. DOI: 10.7399/fh.2017.41.3.10745 [ Links ]
Aportación a la literatura científica:
Hasta la fecha, el nivel de evidencia que avala el uso de medicamentos en situaciones especiales ha sido escasamente estudiado, pese a que está estrechamente relacionado con la efectividad y toxicidad esperados de dichos tratamientos.
En este artículo se presenta un análisis detallado de las solicitudes de medicamentos en situaciones especiales para tumores sólidos en un centro español representativo de tercer nivel, profundizando en la evidencia que respalda dichas solicitudes, así como en la efectividad y la seguridad de estos medicamentos.
Recibido: 07 de Octubre de 2021; Aprobado: 13 de Enero de 2022; : 10 de Mayo de 2022











 texto em
texto em 


