My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.46 n.3 Toledo May./Jun. 2022 Epub July 25, 2022
https://dx.doi.org/10.7399/fh.13050
ORIGINALES
Concordancia entre las expectativas y preferencias de los pacientes y los criterios de evaluación de la Agencia Europea del Medicamento
1Servicio de Farmacia, Hospital Universitario de Puerto Real, Puerto Real. España
2Servicio de Farmacia, Hospital General Nuestra Señora del Prado, Talavera de la Reina (Toledo). España
3Departamento de Investigación, Hospital General La Mancha Centro, Ciudad Real. España
4Servicio de Farmacia, Hospital Doctor José Molina Orosa, Las Palmas. España
Objetivo:
Los criterios de autorización de comercialización de medicamentos de la Agencia Europea del Medicamento se reflejan en los European Public Assessment Reports. El objetivo es describir las expectativas y preferencias de nuestros pacientes externos oncohematológicos con respecto a sus tratamientos orales, y evaluar la concordancia con los resultados de los European Public Assessment Reports.
Método:
Se elaboró una encuesta sobre las expectativas y preferencias de los pacientes oncohematológicos respecto a la supervivencia global y calidad de vida, con tres ítems: expectativas sobre el tratamiento, preferencias de beneficio y disposición a recibir tratamientos novedosos con resultados inmaduros. Se revisaron los European Public Assessment Reports de los fármacos indicados. Se utilizó el índice kappa (κ) para evaluar la concordancia entre las expectativas y preferencias de los pacientes respecto al beneficio en supervivencia global y calidad de vida descrito en el European Public Assessment Report correspondiente. La concordancia entre la disposición de los pacientes a recibir nuevos tratamientos y los resultados de los European Public Assessment Reports se evaluó mediante la concordancia absoluta (Ao).
Resultados:
Se incluyeron 29 participantes y se consultaron 19 European Public Assessment Reports diferentes. Expectativas de los pacientes sobre su tratamiento: el 82,1% esperaba una mejora de la supervivencia global y calidad de vida; el valor κ entre las expectativas y los resultados de los European Public Assessment Reports fue de 0,091 (intervalo de confianza 95%: –0,025 a 0,207). Preferencias de los pacientes sobre el beneficio de su tratamiento: el 92,6% prefirió la calidad de vida; el valor κ fue de 0,016 (intervalo de confianza 95%: –0,127 a 0,160). Disposición a recibir tratamientos novedosos: el 82,1% de los participantes exigió un beneficio en la supervivencia global o en la calidad de vida; las exigencias se cumplieron en Ao = 53,6% de los pacientes.
Conclusiones:
Se observó poca concordancia entre las expectativas y preferencias de nuestros pacientes oncohematológicos y los European Public Assessment Reports, según la supervivencia global y la calidad de vida. La mayoría de los pacientes preferían una mejora de la calidad de vida, pero también esperaban un aumento de la supervivencia global con su tratamiento. Casi la mitad de los pacientes no cumpliría con sus requisitos para recibir su medicación cuando ésta fuera autorizada.
PALABRAS CLAVE Medicina basada en la evidencia; Hematología; Oncología médica; Calidad de la atención sanitaria; Normativa sanitaria internacional
Introducción
El empoderamiento del paciente se ha convertido en una importante prioridad en los últimos años. No obstante, la falta de claridad conceptual y de una metodología específica dificultan la inclusión del paciente en el proceso de toma de decisiones clínicas1,2. Por otro lado, la escasez de recursos que padecen los sistemas sanitarios y la creciente necesidad de asistencia sanitaria por parte de la población hacen que la fijación de prioridades en la práctica clínica sea algo esencial3. Asimismo, la Organización Mundial de la Salud ha publicado informes que apuntan a un gasto sanitario excesivo en determinadas áreas clínicas como oncología y hematología4.
En este contexto, ¿cómo podemos tener en cuenta la opinión de los pacientes y establecer prioridades? La respuesta a esta pregunta podría encontrarse en los estudios dedicados a evaluar las preferencias de los pacientes y en la evidencia científica que avala el uso de medicamentos. Las preferencias de los pacientes oncohematológicos están claras: incrementar la supervivencia y la calidad de vida (CdV), una buena muerte y preservar la propia dignidad5-8. En lo relativo a la evidencia científica sobre los medicamentos, la supervivencia global (SG) y la CdV se consideran las variables más apropiadas para evaluar el beneficio obtenido por los pacientes oncohematológicos9,10. Aunque la supervivencia libre de progresión (SLP) es una variable subrogada de considerable relevancia clínica, debe ser cuidadosamente analizada en función de cada contexto clínico, no estando exenta de controversia en muchos casos11,12.
La Agencia Europea del Medicamento (EMA) es la institución encargada de la regulación y control de los medicamentos en la Unión Europea (UE)13. Se ocupa, entre otras cosas, de evaluar los beneficios aportados por los nuevos fármacos. En la UE, los medicamentos deben ser autorizados antes de su comercialización. El sistema vigente contempla diversos procedimientos para solicitar dicha autorización. La mayoría de los medicamentos no se autorizan en la UE mediante un proceso centralizado, sino que son autorizados por las autoridades nacionales competentes de los estados miembros. Este procedimiento descentralizado permite a las empresas farmacéuticas solicitar autorización para comercializar un fármaco simultáneamente en varios países sin autorización previa en ninguno de ellos. Existe un procedimiento de reconocimiento mutuo que permite a empresas que tienen un fármaco autorizado en un estado reconocer esta autorización en otros países.
Por otro lado, el procedimiento centralizado permite comercializar un medicamento en base a una única evaluación, ya que la autorización concedida es válida en toda la UE. Las empresas farmacéuticas sólo deben presentar una única solicitud de autorización ante la EMA. El Comité de Medicamentos para Uso Humano lleva a cabo una evaluación científica y formula una recomendación a la Comisión Europea en cuanto a la autorización de un producto farmacológico. La autorización de comercialización centralizada de la Comisión Europea es válida en todos los estados de la UE. El uso del procedimiento centralizado es obligatorio para algunos medicamentos, tales como los utilizados para el tratamiento de enfermedades raras y de tumores. El procedimiento centralizado es un requisito legal que garantiza la eficacia y seguridad de los fármacos. La transparencia es una característica importante del sistema europeo de regulación de medicamentos. Se publica un Informe Público Europeo de Evaluación (European Public Assessment Report, EPAR) para cada medicamento cuya autorización de comercialización se concede o deniega tras la evaluación de la EMA.
Los ensayos clínicos aleatorizados (ECA) son los estudios con mayor nivel de evidencia científica, lo que los convierte en la herramienta más robusta para analizar intervenciones en salud14,15. Sin embargo, las agencias evaluadoras a menudo se ven obligadas a posicionar alternativas terapéuticas o autorizarlas con investigaciones menores, como estudios descriptivos retrospectivos16. La demanda por la industria farmacéutica y las asociaciones de pacientes de una mayor rapidez en la aprobación de nuevos fármacos podría favorecer la toma de decisiones basadas en datos prematuros, incrementando el grado de incertidumbre en torno a ellos. Esto podría tener importantes consecuencias para la eficacia, seguridad y eficiencia de los tratamientos autorizados, especialmente en el ámbito de las patologías oncohematológicas.
Teniendo en cuenta lo anterior, puede deducirse que no es fácil satisfacer las necesidades de los pacientes en el actual contexto económicosanitario. Los profesionales de la salud e instituciones gubernamentales tienen una responsabilidad común: poner a disposición de los ciudadanos la mejor asistencia sanitaria disponible optimizando los recursos. Por este motivo, los estudios que analizan las demandas de los pacientes son una fuente enriquecedora de información para los sistemas sanitarios y podrían ayudar a mejorar la selección de los medicamentos más idóneos. Existen numerosas herramientas validadas destinadas a conocer las expectativas de los pacientes oncológicos. Trask et al. desarrollaron un cuestionario de 16 preguntas encaminado a evaluar la experiencia de los pacientes oncológicos17. Esta encuesta contiene información sobre las expectativas del efecto del tratamiento antitumoral en el aumento de la SG. No obstante, dicho trabajo no ofrece información acerca de si los pacientes esperan que su tratamiento mejore su CdV o sus preferencias entre la SG y la CdV. Rose et al. utilizaron un cuestionario para evaluar las preferencias asistenciales de los pacientes y las opiniones del personal facultativo18, analizando si los pacientes priorizaban más la SG o la CdV. Por otro lado, aunque los autores analizaron la perspectiva del médico en relación con la SG y la CdV de los pacientes, no preguntaron a los pacientes sobre sus expectativas en relación con las terapias recibidas. Gleason et al. analizaron la relación entre las expectativas de curación de los pacientes oncológicos antes de interactuar con su oncólogo y su decisión de seguir las recomendaciones de tratamiento19. Este estudio evaluó las expectativas de los pacientes acerca del efecto del tratamiento en sus posibilidades de curación, que no es exactamente lo mismo que aumentar su SG, o de mejorar su CdV. Sin embargo, este cuestionario no aportaba datos sobre las preferencias de los pacientes en la elección de la SG o la CdV.
El desarrollo de un estudio dirigido que englobe los datos ofrecidos por las citadas herramientas podría aportar información de gran interés. El objetivo de nuestro estudio es describir las expectativas y preferencias de nuestros pacientes oncohematológicos externos tratados con fármacos orales, y evaluar la concordancia con los resultados descritos en los EPAR.
Métodos
Basada en la literatura previa sobre las preferencias de los pacientes oncohematológicos5-8, se desarrolló una encuesta para recoger datos sobre pacientes externos de nuestro centro con diagnóstico oncológico. La herramienta se diseñó para registrar las expectativas y preferencias de los pacientes en relación con su tratamiento y posteriormente compararlas con los resultados de las variables finales —SG y CdV— recogidas en los EPAR13. El cuestionario, que comenzaba con una explicación inicial en la que se informaba a los pacientes sobre la garantía de anonimidad y el carácter voluntario de su participación, estaba dividido en dos partes. En la primera, se registraban las variables clínicas y sociodemográficas (edad, sexo y contexto clínico) de los participantes. La segunda constaba de tres ítems: (I) las expectativas de los pacientes sobre el beneficio obtenido por su tratamiento; (II) las preferencias de los pacientes sobre los posibles beneficios que puede aportar un tratamiento, y (III) la disposición de los pacientes a recibir tratamientos novedosos con resultados no definitivos. La selección de los pacientes estuvo a cargo de dos farmacéuticos hospitalarios en el área de dispensación a pacientes externos, entre enero y marzo de 2020. La herramienta fue entregada a los pacientes, quienes durante el proceso podían solicitar las explicaciones que consideraran necesarias en caso de duda. Posteriormente, se llevó a cabo la encuesta con el tiempo necesario y garantizándose la intimidad de los encuestados. La figura 1 muestra el cuestionario aplicado a los pacientes externos seleccionados.

Figura 1. Cuestionario sobre las expectativas y preferencias de los pacientes externos oncohematológicos en relación con el tratamiento de su patología
Por otro lado, se llevó a cabo una búsqueda del primer EPAR publicado sobre el fármaco recibido por cada paciente para analizar los resultados de SG y CdV en la indicación correspondiente, registrándose los siguientes datos: fecha del informe, diseño del estudio, comparadores, magnitud del efecto de los tratamientos, hazard ratio (HR), intervalos de confianza (IC) y significación estadística (p). Se consideró que el fármaco era beneficioso en materia de SG con respecto al comparador cuando se observaba una diferencia estadísticamente significativa en las medianas de SG. A su vez, se estimó que existía un beneficio en CdV cuando se objetivaba una diferencia estadísticamente significativa en cualquiera de las escalas analizadas respecto al comparador. Se excluyeron los estudios no aleatorizados sin brazo control debido a sus importantes sesgos. La principal limitación de estos estudios es la dificultad de establecer una inferencia causal del defecto de los tratamientos14,15. La revisión de los informes fue realizada por tres farmacéuticos hospitalarios.
Posteriormente, se realizó un análisis para determinar la concordancia entre las preguntas I y II (expectativas y preferencias en relación con el beneficio de los tratamientos) y los resultados recogidos en los EPAR en términos de SG y CdV. Para ello, se utilizó el índice kappa (κ) con un intervalo de confianza del 95% (IC 95%), de acuerdo con la siguiente fórmula: κ = [concordancia observada (Ao) – concordancia esperada (Ae)] / (1 – Ae). La Ao se definió como la respuesta más consensuada, y la Ae como la concordancia esperada de acuerdo con el número de respuestas posibles para cada pregunta. Se siguieron los criterios de Landis y Koch para interpretar la fuerza de concordancia de los valores κ20: se interpretó que un valor < 0,0 indicaba falta de concordancia, < 0,2 concordancia insignificante, 0,21-0,4 concordancia leve, 0,41-0,6 concordancia moderada, 0,61-0,8 concordancia significativa, y 0,81-1 concordancia casi perfecta. Las respuestas a la pregunta III se compararon con los resultados de los EPAR a fin de evaluar la disposición y la exigencia de los pacientes de recibir tratamientos novedosos con resultados preliminares que mostraran un beneficio incierto en la SG o la CdV. En este caso, el parámetro Ao se utilizó para determinar la concordancia, ya que no fue posible calcular el valor κ. Se presumió que los pacientes que estaban dispuestos a recibir estos nuevos tratamientos, independientemente de los datos del EPAR, no tenían exigencias y que los pacientes que no estaban dispuestos a someterse a estos tratamientos en cambio sí tenían exigencias. En este grupo de pacientes, se consideró que aquellos tratados con medicamentos asociados con un beneficio en SG o CdV habían visto satisfechas sus exigencias, mientras que aquellos tratados con fármacos no beneficiosos desde el punto de vista de la SG o la CdV no las habían visto satisfechas. Todos los cálculos se realizaron con el programa estadístico SPSS® v.18, considerándose un valor de p < 0,05 como estadísticamente significativo.
Resultados
La encuesta fue cumplimentada por 29 participantes, 15 (51,7%) mujeres y 14 (48,3%) hombres. La mediana de edad de los pacientes fue de 64 (28-75) años. Los tratamientos registrados se distribuyeron de la siguiente forma: 4 (13,8%) pacientes con nilotinib, 3 (10,3%) con sunitinib, 3 (10,3%) con lenalidomida, 3 (10,3%) con capecitabina, 2 (6,9%) con abiraterona, 2 (6,9%) con enzalutamida y 12 (41,4%) con otros fármacos. Los contextos clínicos de los encuestados fueron los siguientes: 4 (13,8%) presentaban carcinoma renal de células claras de nueva aparición, 4 (13,8%) cáncer de próstata resistente a la castración metastásico, 3 (10,3%) mieloma múltiple refractario, 3 (10,3%) leucemia mieloide crónica de reciente diagnóstico, 2 (6,9%) cáncer de mama de reciente aparición, 2 (6,9%) cáncer de mama refractario, y 13 (37,9 %) otras neoplasias. Los datos de los pacientes se detallan en la tabla 1.
Se registraron un total de 19 indicaciones diferentes, recibiendo algunos pacientes el mismo tratamiento para la misma indicación. Los EPAR evaluaron los siguientes fármacos21: abemaciclib, abiraterona, capecitabina, dabrafenib en combinación con trametinib, enzalutamida, everolimus, ibrutinib, lenalidomida, lenvatinib, nilotinib, osimertinib, ribociclib, sorafenib, sunitinib, imatinib y vismodegib. Los informes consultados habían sido publicados entre 2006 y 2018. Los diseños de los estudios recogidos en los informes fueron de los siguientes tipos: ECA de superioridad en 12 casos (63,2%), ECA de no inferioridad en 3 (15,8%) y 4 estudios no aleatorizados sin brazo control (21%). En 8 estudios (42,1%) se utilizó placebo como comparador. Para 15 indicaciones (78,9%) se disponía de datos comparativos de SG, mientras que para 6 indicaciones (31,6%) existían datos comparativos relativos a CdV. La tabla 2 contiene los resultados individuales de los EPAR consultados.
Tabla 2. Resultados individuales de los Informes Públicos Europeos de Evaluación (European Public Assessment Report, EPAR) consultados

Tabla 2 (cont.). Resultados individuales de los Informes Públicos Europeos de Evaluación (European Public Assessment Report, EPAR) consultados
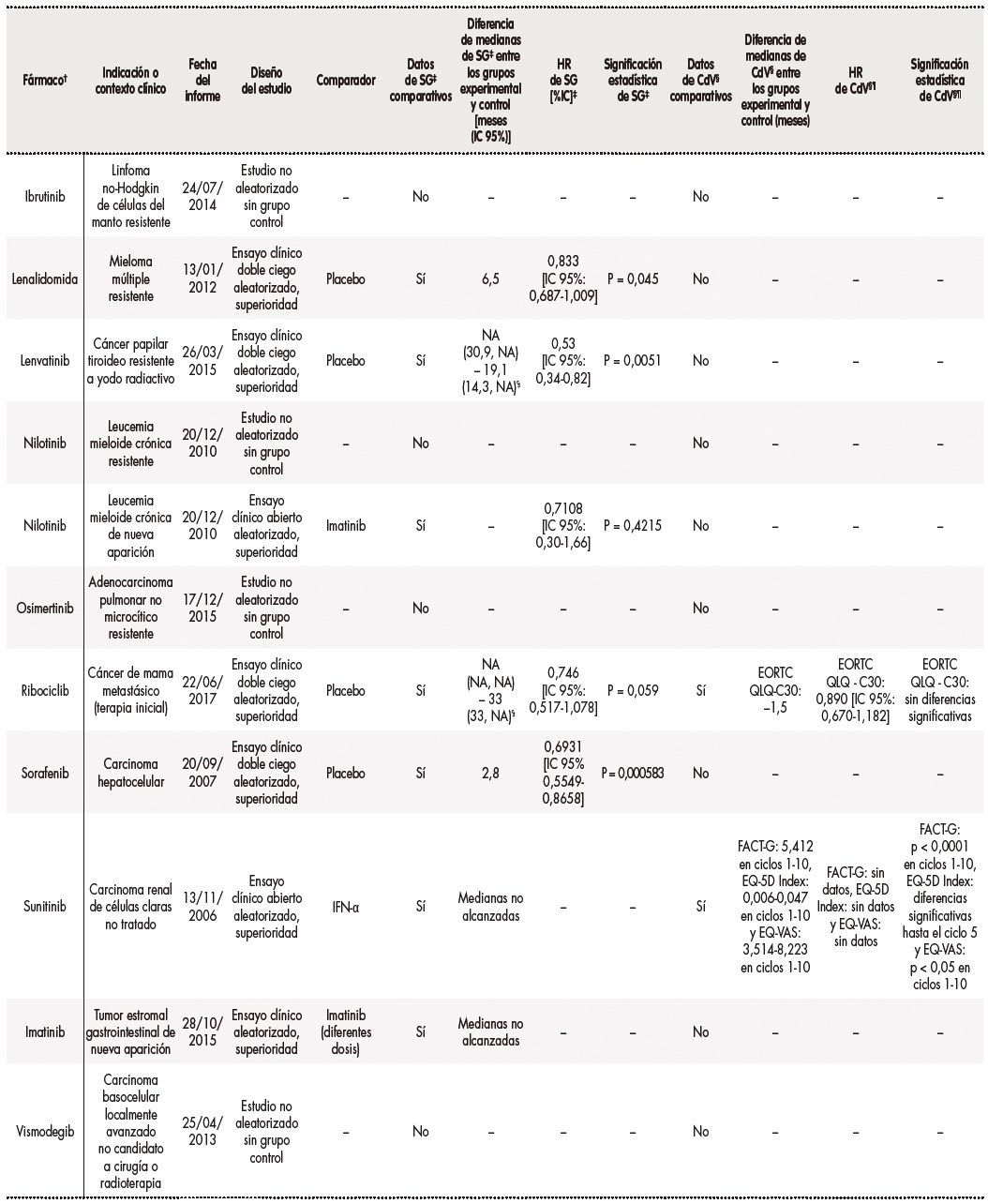
†Los esquemas estándar asociados con el nuevo fármaco y su comparador no se detallan para simplificar la información en la tabla.
‡HR: hazard ratio.
SG: supervivencia global.
%IC: porcentaje del intervalo de confianza.
§CdV: calidad de vida.
¶Las siglas que figuran en esta columna corresponden a los nombres de las distintas escalas analizadas en la bibliografía;
ꝢNA: no alcanzado.
¥Porcentaje del intervalo de confianza = 97,5%.
La tabla 3 proporciona información sobre las expectativas de los pacientes en cuanto a su medicación (pregunta I), sus preferencias sobre el beneficio proporcionado por el tratamiento (pregunta II) y su disposición a recibir un tratamiento novedoso con una mejora incierta de la SG o la CdV (pregunta III). Un paciente no contestó la pregunta II. Otro fue tratado con una combinación de fármacos —capecitabina con temozolomida— sin indicación autorizada por la EMA, por lo que las respuestas a las preguntas I, II y III no pudieron incluirse en el análisis en este caso. Las respuestas individuales de cada paciente se recogen en la tabla 1.
Tabla 3 Resultados del análisis estadístico
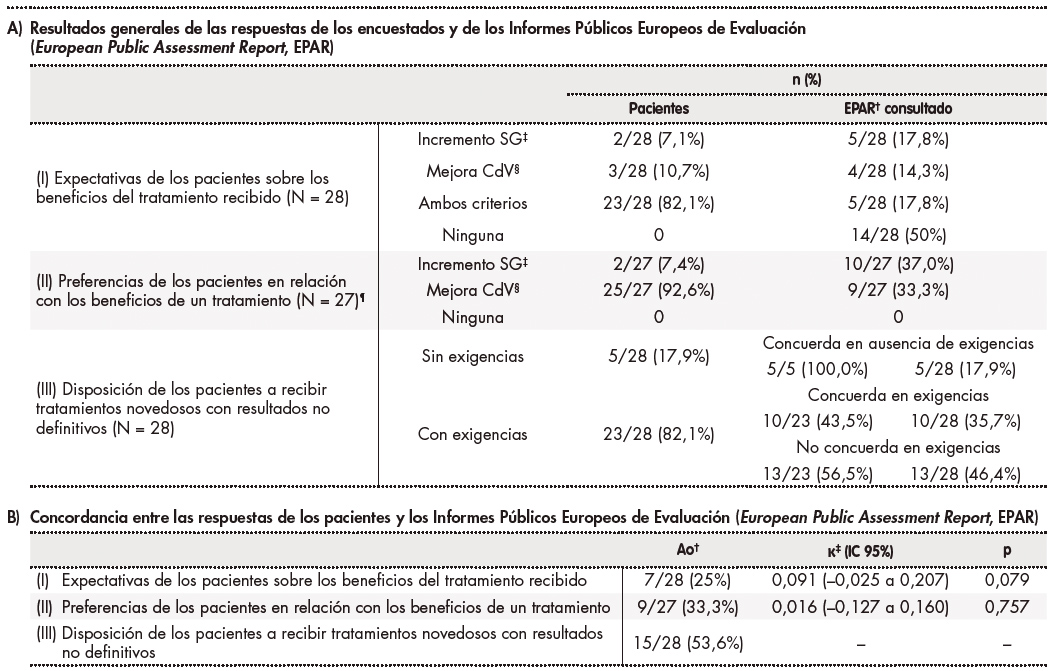
A) †EPAR: Informe público europeo de evaluación. El número total de EPAR consultados se consideró igual al número de pacientes (N) que respondieron a cada pregunta: 28 EPAR para las preguntas I y III y 27 para la pregunta II. Hay pacientes con la misma indicación terapéutica y que, por tanto, comparten el mismo EPAR (19 indicaciones diferentes en total).
‡SG: supervivencia global.
§CdV: calidad de vida.
¶Los resultados de los EPAR fueron: 5 aumento de SG, 4 mejora de la CdV, 5 aumento de ambos criterios, y 13 casos en los que no mejoró ninguno de los dos. Este es el motivo por el que la suma de los porcentajes de los EPAR no es igual al 100%.
B) †Ao: concordancia observada.
‡κ: valor kappa.
Atendiendo a la disposición de los pacientes a recibir un tratamiento novedoso cuyos beneficios en SG o CdV son aún inciertos (pregunta III), los resultados de los EPAR cumplieron los requisitos de 10 (43,5%) participantes con exigencias, pero no las de otros 13 (56,5%) de estos pacientes. Tomando en consideración el número total de pacientes (N = 28), en 13 (46,4%) de ellos no se cumplieron sus requisitos para acceder a un tratamiento nuevo sin datos confirmatorios de mejorar la SG y la CdV. La tabla 3A describe los resultados generales de las respuestas de los participantes y de los EPAR en relación con las preguntas y respuestas de la encuesta.
Atendiendo a los valores κ estimados, se observó una concordancia insignificante entre los resultados reflejados en los EPAR y las respuestas de los pacientes sobre sus expectativas en cuanto a su medicación (pregunta I) y sus preferencias sobre el beneficio proporcionado por un tratamiento (pregunta II). Se calculó un Ao = 53,6% entre las respuestas de los pacientes y los resultados de los EPAR en cuanto a su disposición a recibir un tratamiento nuevo cuya capacidad de mejorar la SG o la CdV es aún incierta (pregunta III). Los valores de Ao y las concordancias entre las respuestas de los pacientes y los EPAR se recogen en la tabla 3B.
Discusión
Los criterios empleados para la concesión de autorizaciones de comercialización de medicamentos por la EMA se describen a través de los EPAR. En el presente estudio, los resultados de las variables finales descritas en los EPAR (SG y CdV) no cumplían plenamente las expectativas y preferencias de nuestros pacientes externos oncohematológicos. La opinión de los pacientes sobre su tratamiento debería constituir uno de los pilares más importantes a la hora de elegir un tratamiento. De esta manera, se favorecería el empoderamiento de los pacientes en la toma de decisiones clínicas.
En este trabajo, las variables seleccionadas para evaluar la eficacia de los tratamientos descritos en los EPAR, de acuerdo con las preferencias de los participantes, fueron la SG y CdV5-8. Se trata de las variables más relevantes para pacientes oncohematológicos9,10. La SLP también es importante, ya que podría constituir un buen indicador de la respuesta al tratamiento. Sin embargo, la excluimos del estudio ya que su interpretación podría entrañar un nivel más alto de subjetividad que las variables seleccionadas, al depender de múltiples factores tales como el centro de investigación donde se realice el análisis, los criterios de progresión, etc. De igual manera, se han descrito contextos clínicos con una correlación dudosa entre SG y SLP, que requerían un análisis en mayor profundidad. Un ejemplo serían los casos de cáncer de pulmón o de ovario12,22. Por último, los pacientes mayores o de bajo nivel sociocultural podrían tener dificultades para interpretar el concepto de SLP al completar la encuesta.
El criterio elegido para considerar el beneficio obtenido tanto en SG como CdV fue la diferencia estadísticamente significativa entre los brazos experimental y control. Para el desarrollo de este estudio hubiera sido razonable evaluar la relevancia clínica del efecto del tratamiento. No obstante, se decidió no tomar en cuenta la relevancia clínica debido a la heterogeneidad de las patologías analizadas, la controversia en torno a establecer un umbral de relevancia clínica y la falta de consenso en ciertos contextos clínicos. La incorporación del concepto de relevancia clínica podría reducir el número de tratamientos evaluados positivamente en términos de SG y/o CdV, dando lugar a una menor correspondencia entre las opiniones de los pacientes y los resultados de los EPAR. Además, el uso de tratamientos subóptimos o de placebo como brazo control en los ECA, en lugar de tratamientos activos, podría influir en los resultados23,24. La ausencia de comparaciones directas o indirectas en los ensayos incluidos en los EPAR supuso una limitación adicional a la hora de evaluar el beneficio de los nuevos tratamientos frente al gold standard. Por otro lado, no se asumió que los estudios no aleatorizados pudieran demostrar el beneficio asociado a un determinado tratamiento. En estudios con este diseño es difícil determinar la influencia de la patología, de las características basales de la población y de otras variables en los resultados14,15.
A pesar de no haber aplicado el criterio de relevancia clínica, casi la mitad de nuestros pacientes externos oncohematológicos recibió un tratamiento que no había demostrado beneficio en SG o CdV según los EPAR de la EMA. La ausencia de diferencias estadísticamente significativas en SG entre los nuevos fármacos respecto a sus comparadores es comprensible en contextos clínicos tempranos o en pacientes con seguimiento insuficiente25. Sin embargo, la ausencia de beneficio en la CdV de los tratamientos autorizados por la EMA es difícil de justificar considerando la importancia de esta variable26. Casi todos nuestros pacientes prefirieron conseguir mejoras en CdV que un incremento en su SG. Este hallazgo ya había sido publicado por otros autores6.
A pesar de su enorme impacto económico4, la EMA no evalúa los costes asociados con los tratamientos oncohematológicos. Por este motivo, parece razonable que los EPAR delimiten con precisión los beneficios de los fármacos de reciente aparición frente a sus alternativas terapéuticas en un contexto clínico determinado. En este sentido, el diseño de ensayos clínicos que evalúan los medicamentos es de fundamental importancia. El acceso acelerado a los medicamentos considerando resultados prematuros, estudios no aleatorizados o cuya validez no está clara, podría aumentar la incertidumbre de la relación beneficio-riesgo. Este hecho se ha comprobado en la revocación de la autorización concedida para la comercialización de olaratumab en combinación con doxorrubicina para el sarcoma de tejidos blandos27 o en la autorización de osimertinib para cáncer de pulmón basada en estudios no aleatorizados, cuando ya existían alternativas autorizadas fundamentadas en ECA28.
Un análisis crítico de la evidencia científica por distintos profesionales de la salud a través de su participación en comités científicos multidisciplinares, considerando también la opinión de los pacientes, podría favorecer la optimización de la selección de los fármacos. Asimismo, hemos observado que casi la mitad de nuestros pacientes externos oncohematológicos no hubieran estado dispuestos a recibir su tratamiento, puesto que sus exigencias no habían sido cubiertas por los criterios de autorización de la EMA. Finalmente, tomar toda esta información en consideración durante el proceso de selección del tratamiento podría contribuir al empoderamiento de los pacientes.
Nuestro estudio presenta ciertas limitaciones. En primer lugar, el cuestionario utilizado no era una herramienta validada. Esto se debe a que no encontramos ningún cuestionario estándar que permitiera recoger toda la información requerida para desarrollar el estudio. Seleccionar preguntas individuales de distintos cuestionarios no nos pareció una alternativa aceptable17-19. Por ello, fue necesario diseñar un nuevo cuestionario. Otra limitación de nuestro trabajo fue el tamaño de la muestra. Los resultados obtenidos deberán ser confirmados mediante estudios que incluyan a un número mayor de pacientes. La selección de los pacientes, el tiempo transcurrido desde el diagnóstico, la duración del tratamiento actual y la línea de tratamiento son factores que influyen sobre los resultados29. Nuestro estudio recoge datos individuales sobre la situación de los pacientes (naive o refractarios). Sin embargo, no se pudieron obtener datos relativos a línea de tratamiento ni al tiempo transcurrido desde el diagnóstico debido a la irrupción de la pandemia de la COVID-19, la anonimización de los pacientes y problemas logísticos. Este trabajo podría considerarse un estudio piloto con resultados preliminares y podría utilizarse como material de apoyo para futuros estudios multicéntricos en los que se validen las herramientas utilizadas, con mayor tamaño muestral, y mejor selección de los pacientes con criterios según estadios de la enfermedad, tipo de neoplasias, tiempo transcurrido desde el diagnóstico, y las líneas de tratamiento recibidas.
En conclusión, este estudio encontró escasa concordancia entre las expectativas y preferencias de nuestros pacientes externos oncohematológicos respecto a su tratamiento oncológico y los resultados descritos en los informes EPAR de la EMA en cuanto a SG y CdV. Casi la mitad de nuestros pacientes oncohematológicos no verían cumplidos sus requisitos mínimos para recibir su medicamento en el momento en que éste fue autorizado. Deberían llevarse a cabo estudios adicionales para corroborar los resultados presentados en este trabajo.
REFERENCIAS
1. Risling T, Martinez J, Young J, Thorp-Froslie N. Evaluating patient empowerment in association with eHealth technology: scoping review. J Med Internet Res. 2017;19(9):e329. DOI: 10.2196/jmir.7809 [ Links ]
2. Castro EM, Van Regenmortel T, Vanhaecht K, Sermeus W, Van Hecke A. Patient empowerment, patient participation and patient-centeredness in hospital care: A concept analysis based on a literature review. Patient Educ Couns. 2016;99(12):1923-39. DOI: 10.1016/j.pec.2016.07.026 [ Links ]
3. Sandman L, Hofmann B, Bognar G. Rethinking patient involvement in healthcare priority setting. Bioethics. 2020;34(4):403-11. DOI: 10.1111/bioe.12730 [ Links ]
4. World Health Organization. Technical report: pricing of cancer medicines and its impacts [Internet]. 2018 [accessed 11/17/2021]. Available at: https://apps.who.int/iris/bitstream/handle/10665/277190/9789241515115-eng.pdf?ua=1&msclkid=daf85fd1acd311ecb3b0f3e2ba8428ab [ Links ]
5. Bröckelmann PJ, McMullen S, Wilson JB, Mueller K, Goring S, Stamatoullas A, et al. Patient and physician preferences for first-line treatment of classical Hodgkin lymphoma in Germany, France and the United Kingdom. Br J Haematol. 2019;184(2):202-14. DOI: 10.1111/bjh.15566 [ Links ]
6. Laryionava K, Winkler EC. Patients' Preferences in Non-Curable Cancer Disease. Oncol Res Treat. 2019;42(1-2):31-4. DOI: 10.1159/000496120 [ Links ]
7. Kastbom L, Milberg A, Karlsson M. A good death from the perspective of palliative cancer patients. Support Care Cancer. 2017;25(3):933-9. DOI: 10.1007/s00520-016-3483-9 [ Links ]
8. Li T, Pei X, Chen X, Zhang S. Identifying end-of-life preferences among Chinese patients with cancer using the heart to heart card game. Am J Hosp Palliat Care. 2020;1049909120917361. DOI: 10.1177/1049909120917361 [ Links ]
9. Gotay CC, Kawamoto CT, Bottomley A, Efficace F. The prognostic significance of patient-reported outcomes in cancer clinical trials. J Clin Oncol. 2008;26(8):1355-63. DOI: 10.1200/JCO.2007.13.3439 [ Links ]
10. Quinten C, Coens C, Mauer M, Comte S, Sprangers MA, Cleeland C, et al. Baseline quality of life as a prognostic indicator of survival: a meta-analysis of individual patient data from EORTC clinical trials. Lancet Oncol. 2009;10(9):865-71. DOI: 10.1016/S1470-2045(09)70200-1 [ Links ]
11. Cheema PK, Burkes RL. Overall survival should be the primary endpoint in clinical trials for advanced non-small-cell lung cancer. Curr Oncol. 2013;20(2):e150-60. DOI: 10.3747/co.20.1226 [ Links ]
12. Paoletti X, Lewsley LA, Daniele G, Cook A, Yanaihara N, Tinker A, et al. Assessment of progression-free survival as a surrogate end point of overall survival in first-line treatment of ovarian cancer: A systematic review and meta-analysis. JAMA Netw Open. 2020;3(1):e1918939-e1918939. DOI: 10.1001/jamanetworkopen. 2019.18939 [ Links ]
13. European Medicines Agency. El sistema europeo de regulación de medicamentos [Internet]. 2016 [accessed 11/23/2021]. Available at: https://www.ema.europa.eu/en/documents/leaflet/european-regulatory-system-medicines-uropeanmedicines-agency-consistent-approach-medicines_es.pdf [ Links ]
14. European Medicines Agency. Guideline on clinical trials in small populations [Internet]. 2006 [accessed 11/20/2021]. Available at: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-clinical-trials-smallpopulations_en.pdf [ Links ]
15. Burns PB, Rohrich RJ, Chung KC. The levels of evidence and their role in evidence based medicine. Plast Reconstr Surg. 2011;128(1):305-10. DOI: 10.1097/PRS.0b013e318219c171 [ Links ]
16. European Medicines Agency. Erivedge [Internet]. 2016 [accessed 11/22/2021]. Available at: https://www.ema.europa.eu/en/medicines/human/EPAR/erivedge [ Links ]
17. Trask PC, Tellefsen C, Espindle D, Getter C, Hsu MA. Psychometric validation of the cancer therapy satisfaction questionnaire. Value Health. 2008;11(4):669-79. DOI: 10.1111/j.1524-4733.2007.00310.x [ Links ]
18. Rose JH, O'Toole EE, Dawson NV, Lawrence R, Gurley D, Thomas C, et al. Perspectives, preferences, care practices, and outcomes among older and middleaged patients with late-stage cancer. J Clin Oncol. 2004;22(24):4907-17. DOI: 10.1200/JCO.2004.06.050 [ Links ]
19. Gleason MEJ, Harper FWK, Eggly S, Ruckdeschel JC, Albrecht TL. The influence of patient expectations regarding cure on treatment decisions. Patient Educ Couns. 2009;75(2):263-9. DOI: 10.1016/j.pec.2008.10.015 [ Links ]
20. Landis JR, Koch GG. The measurement of observer agreement for categorical data. Biometrics. 1977;33(1):159-74. DOI: 10.1097/PRS.0b013e318219c171 [ Links ]
21. European Medicines Agency [Internet] [accessed 11/22/2021]. Available at: https://www.ema.europa.eu/en [ Links ]
22. NICE. Crizotinib for previously treated non-small-cell lung cancer associated with an anaplastic lymphoma kinase fusion gene. [Internet]. 2013 [accessed 11/20/2021]. Available at: https://www.nice.org.uk/guidance/ta296/documents/lung-cancernonsmallcell-anaplastic-lymphoma-kinase-fusion-gene-previously-treated-crizotinibfinal-appraisal-determination3 [ Links ]
23. European Medicines Agency. Zytiga [Internet]. 2017 [accessed 11/22/2021]. Available at: https://www.ema.europa.eu/en/documents/variation-report/zytigah-c-2321-ii-0047-epar-assessment-report-variation_en.pdf [ Links ]
24. European Medicines Agency. Xtandi [Internet]. 2014 [accessed 11/22/2021]. Available at: https://www.ema.europa.eu/en/documents/variation-report/xtandih-c-2639-ii-0008-epar-assessment-report-variation_en.pdf [ Links ]
25. European Medicines Agency. Verzenios [Internet]. 2018 [accessed 11/22/2021]. Available at: https://www.ema.europa.eu/en/documents/assessment-report/verzenios-epar-public-assessment-report_en.pdf [ Links ]
26. Roila F, Cortesi E. Quality of life as a primary end point in oncology. Ann Oncol. 2001;12 Suppl 3:S3-6. DOI: 10.1093/annonc/12.suppl_3.s3 [ Links ]
27. European Medicines Agency. Lartruvo [Internet]. 2019 [accessed 11/22/2021]. Available at: https://www.ema.europa.eu/en/medicines/human/referrals/lartruvo [ Links ]
28. European Medicines Agency. Tagrisso [Internet]. 2015 [accessed 11/22/2021]. Available at: https://www.ema.europa.eu/en/documents/assessment-report/tagrisso-epar-public-assessment-report_en.pdf [ Links ]
29. Alessy SA, Davies EA, Rawlinson J, Baker M, Lüchtenborg M. How representative are colorectal, lung, breast and prostate cancer patients responding to the National Cancer Patient Experience Survey (CPES) of the cancer registry population in England? A population-based case control study. BMJ Open. 2019;9(12):e034344. DOI: 10.1136/bmjopen-2019-034344 [ Links ]
Cómo citar este trabajoGil-Sierra MD, Briceño-Casado MP, Arias-Arias AJ, Martín-Rodríguez S. Concordancia entre las expectativas y preferencias de los pacientes y los criterios de evaluación de la Agencia Europea del Medicamento. Farm Hosp. 2022;46(3):157-65.
Presentación en congresosSe presentaron datos preliminares de una parte del trabajo como comunicación bajo el nombre de: “Concordancia entre expectativas y preferencias de pacientes con los criterios de evaluación de la agencia europea de medicamentos”. 65.º Congreso Nacional de Sociedad Española de Farmacia Hospitalaria (SEFH) (virtual); 20-22 de octubre 2020.
Aportación a la literatura científicaSe encontró escasa concordancia entre las preferencias y expectativas de los pacientes oncohematológicos y los criterios de evaluación de medicamentos de la Agencia Europea del Medicamento. Este tipo de estudios evidencian la necesidad de mejorar el proceso de autorización para la comercialización de tratamientos oncohematológicos en Europa.
Recibido: 28 de Octubre de 2021; Aprobado: 20 de Diciembre de 2021; : 29 de Marzo de 2022











 text in
text in 



