Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.46 no.3 Toledo Mai./Jun. 2022 Epub 25-Jul-2022
https://dx.doi.org/10.7399/fh.13170
REVISIONES
Farmacocinética y farmacodinámica de los antibióticos betalactámicos en pacientes críticos
1Departmento de Medicina, Faculty of Medicine, University of Malaya, Kuala Lumpur. Malasia
2University of Queensland Centre for Clinical Research (UQCCR), Faculty of Medicine, The University of Queensland, Brisbane, Australia
3Departamento de Medicina de Cuidados Intensivos, Royal Brisbane and Women's Hospital, Brisbane, Australia
4Departmento de Farmacia, Royal Brisbane and Women's Hospital, Brisbane, Australia
5Servicio de Anestesiología, Reanimación y Terapia del Dolor, Nîmes University Hospital, University of Montpellier, Nîmes. Francia
La terapia antibiótica óptima en los pacientes en estado crítico puede complicarse por la alteración de la fisiología asociada a esta etapa de la enfermedad. La farmacocinética y la exposición a los antibióticos pueden verse alteradas por la enfermedad crítica subyacente y las intervenciones médicas que reciben estos pacientes en la unidad de cuidados intensivos. Además, las cepas que suelen encontrarse en la unidad de cuidados intensivos suelen ser menos susceptibles y “resistentes” a los antibióticos más habituales. De hecho, una dosificación de antibióticos que no tenga en cuenta estas diferencias únicas, probablemente fracasará y dará lugar a resultados clínicos deficientes y a la aparición de resistencia a los antibióticos en la unidad de cuidados intensivos. Los objetivos de esta revisión son describir la farmacocinética de los antibióticos betalactámicos en pacientes críticos, destacar los objetivos farmacocinéticos/farmacodinámicos para los pacientes y exponer algunas estrategias importantes que pueden optimizar la dosificación de los antibióticos betalactámicos en pacientes críticos en la unidad de cuidados intensivos.
PALABRAS CLAVE Antibióticos; Beta-lactámicos; Paciente crítico; Farmacocinética clínica
Descripción general
La sepsis se define como una disfunción orgánica potencialmente mortal debida a una respuesta fisiológica desregulada tras una infección1. Una revisión a gran escala, con 10.069 pacientes en estado crítico tratados en las unidades de cuidados intensivos (UCI) de todo el mundo, reveló que entre el 13,6% y el 39,3% de los pacientes de la UCI presentaron sepsis2. Las tasas de mortalidad debidas a la sepsis pueden oscilar entre el 15% y el 20%3-5, con tasas de mortalidad intrahospitalaria que alcanzan el 50,9% en Alemania y el 58,6% en Italia cuando se produce shock séptico6,7. Según las recomendaciones internacionales para el manejo de la sepsis y el shock séptico de la Campaña para Sobrevivir a la Sepsis, está indicada una reanimación agresiva, la identificación y el control de la fuente de infección, la optimización del control glucémico, así como la administración oportuna de una terapia antibiótica preliminar durante las primeras horas de la sepsis8. La terapia antibiótica óptima y oportuna (que incluye tanto el espectro de actividad antibiótica como la concentración terapéutica) es un procedimiento importante para los pacientes críticos con sepsis o shock séptico. En un estudio reciente de Seymour et al.9 , la probabilidad de mortalidad intrahospitalaria aumenta en 1,04 por cada hora que se retrasa la administración de un antibiótico adecuado en dichos pacientes. Sin embargo, la terapia antibiótica óptima, que incluye la administración rápida de antibióticos en concentraciones suficientes, puede verse influida y complicada por la alteración fisiológica de los pacientes en estado crítico. La disposición farmacocinética (Pk) de los antibióticos, es decir, su absorción, distribución, metabolismo y eliminación, pueden verse alteradas en estos pacientes, debido a la enfermedad crítica subyacente y a las intervenciones médicas mecánicas o farmacológicas que el paciente haya recibido. Además, los patógenos que suelen aislarse en la UCI suelen ser “resistentes” y menos susceptibles a los antibióticos más habituales10. Una dosificación de antibiótico que no tenga en cuenta estas diferencias únicas probablemente fracasará, lo que dará lugar a resultados clínicos deficientes y a la aparición de resistencia a los antibióticos en la UCI.
Los objetivos de esta revisión son describir la Pk de los antibióticos betalactámicos en pacientes críticos, destacar los objetivos farmacocinéticos/ farmacodinámicos (Pk/Pd) tanto para los pacientes no críticos como para los críticos, y examinar estrategias importantes que pueden llevarse a cabo para optimizar la dosificación de los antibióticos betalactámicos para los pacientes críticos en la UCI.
Cambios farmacocinéticos
Absorción
La cantidad de fármaco que se absorbe desde el lugar de administración (por ejemplo, enteral, subcutánea e intramuscular) a la circulación sistémica está influida por las propiedades fisicoquímicas de los antibióticos betalactámicos (como solubilidad y tamaño molecular), así como por las propiedades del órgano o tejido a través del cual se absorben11. En la sepsis y el shock séptico se ha sugerido que la reducción de la motilidad intestinal, la disminución del flujo sanguíneo regional y el retraso en el vaciado gástrico reducen la absorción del fármaco12. En los pacientes críticos de la UCI, se prefiere la administración intravenosa de antibióticos para compensar por una absorción deficiente del fármaco.
Distribución
El equilibrio anormal de los fluidos que tiene lugar tras una reanimación agresiva y el síndrome de fuga capilar pueden dar lugar al paso de líquido al tercer espacio y a la acumulación de fluidos13. Esto puede producir un aumento del volumen de distribución, especialmente con los antibióticos hidrófilos, incluidos los betalactámicos, los glucopéptidos, los aminoglucósidos, el linezolid y los lipopéptidos14-18. El efecto es más pronunciado con los antibióticos hidrófilos que con los lipofílicos, porque estos últimos ya tienen un mayor volumen de distribución en comparación con los primeros17. Una revisión sistemática de los estudios clínicos que evaluaron la Pk de los antibióticos betalactámicos en pacientes críticos notificó grandes diferencias en el volumen de distribución, y la mayoría de los estudios informaron que la variabilidad en la Pk es el doble comparada con la población en estado no crítico19. Es probable que este fenómeno disminuya las concentraciones de los antibióticos betalactámicos, especialmente en la fase inicial de la enfermedad. Por lo tanto, deben aplicarse dosis de carga iniciales más altas en los pacientes críticos con sepsis o shock séptico para compensar por el mayor volumen de distribución. Numerosos estudios han demostrado que se requieren dosis de carga iniciales más altas de antibióticos betalactámicos y de otros antibióticos (por ejemplo, la amikacina, la colistina, la gentamicina, la teicoplanina y la vancomicina) para alcanzar rápidamente concentraciones eficaces en pacientes con sepsis o shock séptico20-25.
La hipoalbuminemia (albúmina sérica < 25 g/l) también es común en los pacientes críticos, y esto puede conducir a un aumento de la distribución y del aclaramiento de los antibióticos, especialmente en el caso de los antibióticos betalactámicos moderada o altamente ligados a proteínas (por ejemplo, flucloxacilina, ceftriaxona y ertapenem)26-29. El volumen de distribución de los antibióticos betalactámicos altamente ligados a proteínas, como la ceftriaxona y la flucloxacilina, aumenta (hasta un 90%) en los pacientes críticos con hipoalbuminemia. Sin embargo, las concentraciones tisulares siguen siendo bajas debido al paso de líquido al tercer espacio y a la acumulación de fluidos asociada en esta población de pacientes. Además, como estos antibióticos betalactámicos también se eliminan por vía renal, un aumento de la fracción libre de los fármacos también dará lugar a una rápida eliminación del fármaco. La alteración del volumen de distribución y del aclaramiento de los antibióticos betalactámicos puede dar lugar a concentraciones bajas de antibiótico, especialmente hacia final del intervalo de administración. Las dosis de mantenimiento de estos antibióticos deben aumentarse para compensar por este fenómeno y esto es especialmente importante con los antibióticos dependientes del tiempo.
También se ha informado de que algunas intervenciones habituales en la UCI, como la reanimación agresiva con fluidos30, la ventilación mecánica31, el uso de circuitos extracorpóreos32, la presencia de drenajes posquirúrgicos33 y la nutrición parenteral total34, se asocian con un mayor volumen de distribución y, en consecuencia, con una disminución de las concentraciones de antimicrobianos hidrófilos.
Aclaramiento
En pacientes críticos es cada vez más frecuente la notificación35 de un aumento del aclaramiento renal de los antibióticos debido a que la filtración glomerular y la secreción/reabsorción tubular están elevadas, lo que conduce a una concentración de antibióticos insuficiente y al fracaso del tratamiento. Este fenómeno se conoce como aclaramiento renal aumentado, que se define como una tasa de filtración glomerular superior a 130 ml/ min/1,73 m2 (preferiblemente basada en el aclaramiento de creatinina en orina)36. Esta situación se observa con más frecuencia en pacientes con traumas múltiples, en el postoperatorio y/o con traumatismo craneoencefálico, pero también en pacientes más jóvenes, especialmente en aquellos en estado menos grave37,38. El aclaramiento renal aumentado está fuertemente asociado a una exposición por debajo de los niveles óptimos a los antibióticos betalactámicos39,40 y a la vancomicina41-43, lo que puede, en parte, explicar los malos resultados clínicos asociados a los pacientes en estado crítico que reciben dichos antibióticos. Por lo tanto, para estos antibióticos, que presentan propiedades dependientes del tiempo y se eliminan predominantemente por los riñones, las estrategias modificadas de dosificación, como la infusión prolongada o continua, pueden ayudar a mantener una concentración efectiva del fármaco durante más tiempo en los pacientes críticos con aclaramiento renal aumentado.
Por otro lado, tras una hipoperfusión de los órganos, podría producirse una reducción del metabolismo y de la eliminación de antibióticos, lo que podría provocar disfunción renal y/o hepática. A medida que la enfermedad avanza en un paciente en estado crítico, puede producirse una depresión miocárdica que conduzca a una perfusión disminuida en los órganos y a un fallo microcirculatorio. Esto puede causar daños en órganos específicos o, en casos extremos, el síndrome de disfunción multiorgánica32. Este síndrome suele incluir una disfunción renal y/o hepática que provoca una disminución de la eliminación de los antibióticos. La disfunción renal o la lesión renal aguda conducen a una reducción de la tasa de filtración glomerular y del aclaramiento antibiótico por vía renal. No obstante, la reducción de la dosis de antibióticos no es sencilla en pacientes con lesión renal aguda, ya que se debe tener en cuenta la función renal residual del paciente y el estado de los líquidos, el uso de la terapia de reemplazo renal (TRR) y el objetivo de Pk/Pd del antibiótico44. Los requisitos de dosificación de los antibióticos betalactámicos en los pacientes críticos son muy dinámicos, y es probable que haya que revisar y modificarla de manera regular para evitar tanto la dosificación subóptima como el desarrollo de acontecimientos adversos.
Intervención mecánica
Se ha demostrado que la intervención mecánica para el soporte de órganos altera la Pk de los antibióticos45-49. La ventilación mecánica puede alterar la Pk del antibiótico al aumentar la presión intratorácica, lo que conduce a un menor retorno venoso al corazón50. Esto puede acarrear un aumento del volumen de distribución del antibiótico, así como una reducción del aclaramiento debido a la disminución de la tasa de filtración glomerular47,51,52. En un estudio realizado por Medellín-Garibay et al. se demostró que la ventilación mecánica reduce el aclaramiento de la vancomicina en un 20%46. La disminución de dicho aclaramiento se relacionó con cambios hemodinámicos en los pacientes ventilados mecánicamente, que redujeron el flujo sanguíneo renal, y condujo a una disminución de la función glomerular y a diuresis53. La TRR puede alterar la Pk de los antibióticos betalactámicos, ya que aumenta la eliminación del antibiótico y el volumen de distribución54. Todo esto depende de algunos factores, como la velocidad de flujo del dializado, el tipo de diálisis, el tipo de membrana de diálisis, la duración de la diálisis, así como las propiedades fisicoquímicas del antibiótico y el grado de unión a las proteínas55. Los pacientes con lesión renal aguda reciben varias formas de TRR, pero la terapia continua de reemplazo renal (TCRR) sigue siendo la más común para los pacientes críticos en la UCI56,57. La TCRR no suele aplicarse de manera uniforme y, por tanto, el aclaramiento del antibiótico puede variar mucho, por lo que la concentración plasmática puede ser inferior a lo previsto inicialmente con la dosis prescrita48,57. En la actualidad no es posible hacer recomendaciones de dosificación definitivas para los pacientes críticos con TCRR, pero, como regla general, los antibióticos con un volumen elevado de distribución (1 l/kg o superior) o altamente ligados a proteínas (80% o superior) se eliminan de forma deficiente58. Los datos actuales sugieren que una proporción significativa de pacientes sometidos a TCRR tienen un mayor riesgo de infraexposición o sobreexposición a los antibióticos4.
Otra forma de intervención mecánica en la UCI es la oxigenación por membrana extracorpórea (ECMO). Se trata de asistencia respiratoria y/o cardíaca artificial y temporal realizada de forma extracorpórea (es decir, mediante derivación cardiopulmonar) en pacientes con insuficiencia cardiorrespiratoria resistente a los tratamientos médicos convencionales59. Su uso ha aumentado de forma continua, especialmente durante la actual pandemia de la COVID-19, ya que la Organización Mundial de la Salud recomienda su uso en pacientes con COVID-19 e hipoxemia profunda (con o sin hipercapnia) no susceptibles de recibir ventilación protectora del pulmón60. Datos previos en pacientes neonatales y pediátricos sugieren que la ECMO puede alterar la Pk de muchos antibióticos importantes, incluidos los betalactámicos61. Los circuitos extracorpóreos de ECMO formados por tubos de conducción proporcionan un “compartimento” adicional a través del cual pueden distribuirse los antibióticos betalactámicos62. Los tubos del circuito, así como la membrana del oxigenador, constituyen superficies adicionales a las que los antibióticos betalactámicos pueden adherirse y ser secuestrados. Esto es particularmente problemático para los antibióticos lipófilos63, los altamente ligados a proteínas (por ejemplo, la ceftriaxona64) o los químicamente inestables (por ejemplo, el meropenem65). El proceso de cebado del circuito ECMO también puede diluir y secuestrar el fármaco66. Se cree que eso conduce a un aumento del volumen de distribución de los betalactámicos y posiblemente al fracaso del tratamiento debido a una concentración insuficiente65. Además, los pacientes sometidos a ECMO presentan un aclaramiento menor del fármaco, en comparación con los pacientes no sometidos a ECMO67. Sin embargo, según la evidencia clínica actual: 1) los circuitos ECMO modernos tienen un impacto mínimo en la Pk de la mayoría de los antibióticos, incluidos los betalactámicos; 2) los cambios en la Pk de los pacientes sometidos a ECMO son más un reflejo de la enfermedad crítica que de la propia ECMO, y 3) aparte de los antibióticos lipofílicos y altamente ligados a proteínas, es probable que el impacto de la ECMO en la Pk y los requisitos de dosificación sea mínimo68-73.
En conclusión, es habitual una alteración importante de la Pk de los antibióticos betalactámicos en los pacientes críticos, especialmente en los que reciben asistencia mecánica en algún órgano. No obstante, la dosificación actual de los antibióticos se basa principalmente en los estudios de búsqueda de dosis, en los que la mayoría de los participantes están sanos y no son pacientes críticos. Es cada vez más patente que dicho enfoque aumenta el riesgo de una exposición subóptima a los antibióticos betalactámicos en un gran número de pacientes en estado crítico74,75.
Farmacodinámica de los antibióticos betalactámicos
A grandes rasgos, los antibióticos pueden clasificarse en tres grupos de farmacocinética/farmacodinámica (Pk/Pd) en función del modo en que eliminan las bacterias76: agentes dependientes de la concentración, dependientes del tiempo y dependientes tanto de la concentración como del tiempo. En el caso de los antibióticos dependientes de la concentración, existe una relación directa entre la concentración del antibiótico y la eficacia, ya que el aumento de la concentración aumenta la eliminación de las bacterias. Para estos antibióticos (por ejemplo, los aminoglucósidos y las fluoroquinolonas), la concentración máxima (Cmax) en relación con la concentración mínima inhibitoria (Cmáx/CMI) es la que mejor describe su actividad. En el caso de los antibióticos dependientes del tiempo (por ejemplo, los betalactámicos), prolongar la duración de la exposición mejora la eliminación de las bacterias, y es el porcentaje del intervalo de dosificación en el que las concentraciones de fármaco libre permanecen por encima de la CMI (%ƒT>CMI) lo que determina su eficacia. En el caso de los antibióticos que presentan características de eliminación dependientes tanto de la concentración como del tiempo, el cociente entre el área bajo la curva concentración-tiempo (AUC) y la CMI (AUC/CMI), es la que mejor describe su actividad. En el caso de los antibióticos, alcanzar estos índices Pk/Pd puede aumentar la probabilidad de una respuesta microbiológica y clínica.
El índice Pk/Pd asociado a la actividad óptima de los antibióticos betalactámicos es %ƒT>CMI (40-70%)77. Los antibióticos betalactámicos muestran una mayor eliminación de bacterias cuanto más tiempo permanece la concentración del fármaco por encima de la CMI del patógeno. Los datos clínicos de pacientes críticos sugieren que pueden beneficiarse de exposiciones a betalactámicos más prolongadas (por ejemplo, 100%ƒT>CMI) y más elevadas (por ejemplo, 2 - 5 x CMI) que las descritas previamente en estudios in vitro o in vivo con modelos animales77.
Optimización de los antibióticos betalactámicos en pacientes críticos
Cambios farmacocinéticos de los antibióticos betalactámicos en pacientes críticos
Dos estudios clínicos multicéntricos publicados recientemente han ilustrado la escasa consecución de los objetivos de Pk/Pd de los antibióticos betalactámicos en pacientes críticos48,74. En el estudio DALI, un extenso estudio Pk de prevalencia puntual de antibióticos betalactámicos en el que participaron 384 pacientes, se observaron variaciones de hasta 500 veces en las concentraciones de fracción libre de los antibióticos betalactámicos analizados74. De ellos, 248 (64,5%) pacientes fueron tratados por infección y 40 (16,0%) de ellos no alcanzaron el objetivo Pk/Pd predefinido (50%ƒT>CMI) y la probabilidad de obtener un resultado clínico positivo fue un 32,0% inferior. Del mismo modo, se observó una baja consecución del objetivo en el estudio SMARRT, un amplio estudio prospectivo y multinacional de Pk, en el que participaron 381 pacientes sometidos a TRR que recibieron meropenem, piperacilina-tazobactam o vancomicina48. No se logró alcanzar las concentraciones mínimas deseadas en hasta el 55% de los casos, y se observaron tasas de fracaso más elevadas (hasta el 72,0%) en las concentraciones mínimas objetivo más altas. Las concentraciones mínimas se asociaron de forma inversa con el aclaramiento renal total estimado de la TRR y el aclaramiento renal residual. Además, en este estudio se observaron concentraciones mínimas muy variables (hasta 8 veces).
Estrategias para mejorar la consecución de los objetivos de Pk/Pd
Estrategia de modificación de la dosificación mediante infusión prolongada
Numerosos estudios han demostrado una mejor consecución del objetivo de Pk/Pd con infusión prolongada (IP) o continua (IC) de antibióticos betalactámicos en comparación con la dosificación en bolo intermitente (BI)78,79. La estrategia de dosificación alterada aumenta el porcentaje de tiempo que las concentraciones de betalactámicos libres permanecen por encima de la CMI objetivo para un intervalo de dosificación determinado, lo que permite una mayor eliminación bacteriana80. Roberts et al. demostraron concentraciones medias en equilibrio de 16,6 mg/l con la IC de piperacilina en comparación con concentraciones Cmin medias de 4,9 mg/l tras la dosificación BI, a pesar de una dosis diaria total IC más baja (25% menos que los regímenes de BI)79. Cabe destacar que, en términos de beneficio para la supervivencia, las revisiones sistémicas y los metaanálisis que comparan la dosificación con IC/IP y con BI de los antibióticos betalactámicos han mostrado resultados mixtos81-87. Sin embargo, cuando los estudios se limitan a pacientes con sepsis grave que recibieron dosis equivalentes de antibióticos betalactámicos en ambos brazos (BI frente a IC/IP), se comprueba una menor mortalidad intrahospitalaria en los pacientes que recibieron la IC81.
Antes de poner en marcha la dosificación por IC o IP de los antibióticos betalactámicos en la UCI, los médicos deben considerar lo siguiente: 1) el uso de una dosis de carga; 2) la estabilidad del antibiótico; 3) el volumen residual o espacio muerto; 4) la compatibilidad con otros fármacos; 5) la acumulación del fármaco en pacientes con disfunción renal, y 6) la población diana y los datos de susceptibilidad antibiótica destinados al programa de IP. La aplicación de la dosis de carga acortaría el tiempo de exposición terapéutica88,89. Una dosis de carga es una dosis de corta duración administrada en forma de bolo intermitente (30-60 min) seguida de la dosis diaria total recomendada, administrada por IP o IC90. La duración de la infusión, la concentración de antibióticos betalactámicos (en los que las concentraciones finales más bajas tras la reconstitución son más estables que las concentraciones más altas), los tipos de diluyentes y el envase utilizado para la reconstitución pueden afectar a la estabilidad de los betalactámicos y, por lo tanto, deben tenerse en cuenta antes de poner en marcha la administración de antibióticos betalactámicos mediante IC/IP en la UCI. De los antibióticos betalactámicos que se han estudiado para la IP, tanto el meropenem como el imipenem presentan una estabilidad más corta (de 4 a 9 horas tras la reconstitución con agua para inyección)91,92. También se ha notificado que otros antibióticos betalactámicos, como la amoxicilina, la bencilpenicilina y la ceftazidima, son estables durante menos de 24 horas93-95. Por lo tanto, cuando se utilizan estos agentes, es necesario administrar múltiples infusiones durante 24 horas. Además, el volumen residual tras la infusión de betalactámicos puede reducir la cantidad total de betalactámicos administrada a los pacientes. Bolla et al. demostraron que si el volumen residual no se infundiese de nuevo a los pacientes al final de la infusión, se perdería más del 10% del antimicrobiano en 26 de los 39 antibióticos estudiados96. Cabe destacar que la purga rápida de la vía intravenosa para administrar el “espacio muerto de la vía de infusión” a los pacientes, es contrario al principio de la IP, ya que el volumen residual se administrará en forma de bolo en lugar de como una infusión prolongada97. Por lo tanto, el volumen residual debe infundirse a una velocidad adecuada y ello supone dar instrucciones claras de administración al personal de enfermería. Otra estrategia que puede utilizarse es la administración de dosis más elevadas para compensar por la pérdida del volumen residual98. Según nuestro conocimiento, aún no se ha publicado ningún estudio de Pk que evalúe la eficacia de estas estrategias para mejorar la exposición a los antibióticos betalactámicos en pacientes en los que hay espacio muerto en la vía de infusión. Cuando los betalactámicos no pueden administrarse a través de una vía dedicada, otra consideración es la compatibilidad de estos antibióticos betalactámicos con otros fármacos intravenosos. La cuestión puede abordarse de tres maneras: 1) la coadministración de un fármaco o varios fármacos de probada compatibilidad con los antibióticos betalactámicos; 2) la colocación de una vía intravenosa adicional, y 3) la reducción del tiempo de infusión de los betalactámicos (es decir, menos de 24 horas), ajustando así la duración de la administración para permitir la administración de fármacos incompatibles99.
Estrategia basada en la monitorización farmacoterapéutica
La personalización de la dosis de los antibióticos betalactámicos guiada por la monitorización farmacoterapéutica sigue siendo objeto de investigación, ya que, a diferencia de los aminoglucósidos y la vancomicina, los antibióticos betalactámicos tienen un amplio espectro terapéutico y un perfil de seguridad favorable. Sin embargo, dada la elevada variabilidad de la Pk observada con estos antibióticos en pacientes críticos19, la monitorización farmacoterapéutica podría ser útil para optimizar la exposición al fármaco, ya que la variabilidad podría conducir a concentraciones subterapéuticas o supraterapéuticas. También podría ser útil en determinados grupos de pacientes críticos, por ejemplo, aquellos con obesidad, inmunodepresión, o infecciones por cepas bacterianas resistentes, o que reciben TRR o presentan un aumento del aclaramiento renal100-103. Estos pacientes corren un riesgo elevado de recibir una dosis insuficiente. Sin embargo, sólo existen dos ensayos controlados aleatorios publicados sobre la monitorización farmacoterapéutica de los antibióticos betalactámicos, y ambos se enfocan en el logro de los objetivos Pk/Pd en vez de en criterios de valoración clínicos (por ejemplo, supervivencia)104,105. Actualmente, existen dos ensayos controlados aleatorios en curso que investigan si la monitorización farmacoterapéutica de los antibióticos betalactámicos mejora los resultados clínicos106,107.
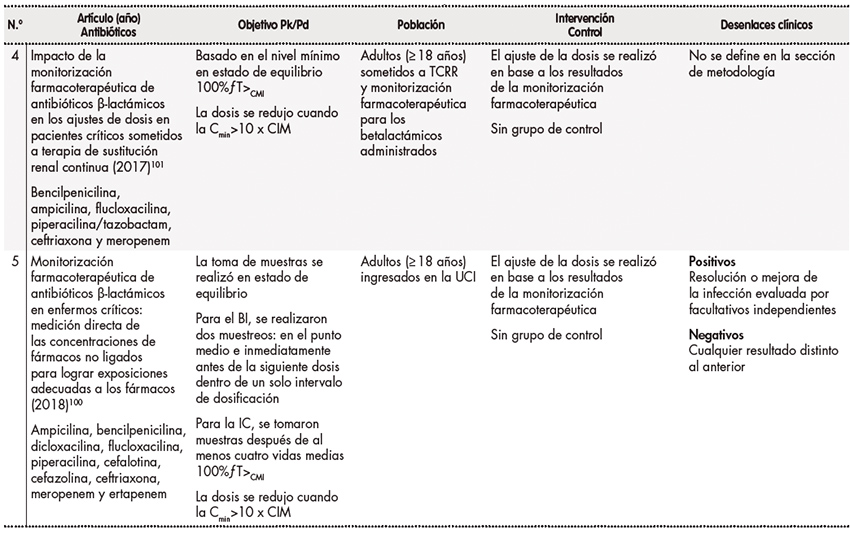
Se han publicado varios estudios observacionales sobre la monitorización farmacoterapéutica de antibióticos betalactámicos (Tabla 1)108-112. En estos estudios, las muestras para la monitorización farmacoterapéutica se tomaron en estado de equilibrio antes de la siguiente dosis (es decir, a concentración mínima o Cmín), excepto en un estudio, en el que se realizaron muestreos a mitad de la dosis y en estado de equilibrio en pacientes que recibían dosificación con BI de betalactámicos (en el mismo estudio, el muestreo se realizó en el grupo de IC en estado de equilibrio)108. Se utilizaron objetivos de Pk/Pd variables, y se realizaron ajustes de la dosis en los pacientes que no alcanzaron los objetivos predefinidos. Por ejemplo, Wong et al. aumentaron la frecuencia de dosificación de los betalactámicos entre un 25% y un 50% o cambiaron la estrategia de infusión de BI a IP/IC cuando las concentraciones de betalactámicos estaban por debajo del objetivo de Pk/Pd (es decir, 100%ƒT>CMI)108. Por el contrario, la dosis se disminuyó en un 50% o la frecuencia se redujo entre un 25% y un 50% de la misma dosis diaria cuando las exposiciones Pk/Pd fueron superiores al 100%ƒT>CMI. Las tasas de consecución del objetivo Pk/Pd para el 100%ƒT>CMI y el 100%ƒT>4 X CMI fueron del 66,9% y del 36,6%, respectivamente, para los siete antibióticos betalactámicos estudiados. En su conjunto, estos estudios mostraron que un número significativo de pacientes en estado crítico no alcanzó los objetivos Pk/Pd deseados. La escasa consecución de dichos objetivos, incluso con una estrategia de dosificación alternativa (por ejemplo, la administración con IP)108 en algunos estudios, subraya la dificultad de conseguir la dosis adecuada en los pacientes críticos. Por lo tanto, la aplicación de un régimen de dosificación inicial agresivo (por ejemplo, regímenes de dosis altas mediante IC o IP durante el tratamiento provisional) junto con la monitorización farmacoterapéutica puede ser actualmente la mejor estrategia para optimizar la exposición a los antibióticos betalactámicos en los pacientes críticos.
Tabla 1. Estudios observacionales de monitorización farmacoterapéutica de los betalactámicos

BI: bolo intermitente; IC: infusión continua; MCI: concentración inhibitoria mínima; TCRR: terapia continua de reemplazo renal; UCI: unidad de cuidados intensivos.
Conclusión
La dosificación adecuada de los antibióticos betalactámicos continúa siendo un reto en los pacientes críticos, que poseen un elevado riesgo de mortalidad debido a la sepsis y al shock séptico. Estos pacientes suelen ser tratados en la UCI, donde son frecuentes las infecciones por patógenos resistentes, especialmente por microorganismos gramnegativos. Esto hace que la consecución del objetivo Pk/Pd en este grupo sea aún más difícil. Por lo tanto, deben considerarse estrategias de dosificación alternativas para los antibióticos betalactámicos en estos pacientes, y eso puede incluir el uso de la administración con IP o IC. La dosificación personalizada guiada por la monitorización farmacoterapéutica también puede mejorar el objetivo Pk/Pd en un paciente individual, y serán necesarios los datos de los ensayos aleatorizados en curso para respaldar la práctica global de la monitorización farmacoterapéutica de los antibióticos betalactámicos en pacientes críticos.
REFERENCIAS
1. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016;315:801-10. DOI: 10.1001/jama.2016.0287 [ Links ]
2. Sakr Y, Jaschinski U, Wittebole X, Szakmany T, Lipman J, Ñamendys-Silva SA, et al. Sepsis in intensive care unit patients: worldwide data from the intensive care over nations audit. Open Forum Infect Dis. 2018;5:313. DOI: 10.1093./ofid/ofy313 [ Links ]
3. Martin GS, Mannino DM, Eaton S, Moss M. The epidemiology of sepsis in the United States from 1979 through 2000. N Eng J Med. 2003;348:1546-54. DOI: 10.1056/NEJMoa022139 [ Links ]
4. Kaukonen KM, Bailey M, Suzuki S, Pilcher D, Bellomo R. Mortality related to severe sepsis and septic shock among critically ill patients in Australia and New Zealand, 2000-2012. JAMA. 2014;311:1308-16. DOI: 10.1001/jama.2014.2637 [ Links ]
5. Rhee C, Dantes R, Epstein L, Murphy D, Seymour CW, Iwashyna TJ, et al. Incidence and Trends of Sepsis in US Hospitals Using Clinical vs Claims Data, 2009-2014. JAMA. 2017;318:1241-9. DOI: 10.1001/jama.2017.13836 [ Links ]
6. SepNet Critical Care Trial Group. Incidence of severe sepsis and septic shock in German intensive care units: the prospective, multicentre INSEP study. Intensive Care Med. 2016;42:1980-9. DOI: 10.1007/s00134-016-4504-3 [ Links ]
7. Sakr Y, Elia C, Mascia L, Barberis B, Cardellino S, Livigni L, et al. Epidemiology and outcome of sepsis syndromes in Italian ICUs: a muticentre, observational cohort study in the region of Piedmont. Minerva Anestesiol. 2013;79:993-1002. [ Links ]
8. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Crit Care Med. 2017;45:486-552. DOI: 10.1097/CCM.0000000000002255 [ Links ]
9. Seymour CW, Gesten F, Prescott HC, Friedrich ME, Iwashyna TJ, Pjillips GS, et al. Time to treatment and mortality during mandated emergency care for sepsis. N Eng J Med. 2017;376:2235-44. DOI: 10.1056/NEJMoa1703058 [ Links ]
10. Sievert DM, Ricks P, Edwards JR, Schneider A, Patel J, Srinivasan A, et al. Antimicrobial-resistant pathogens associated with healthcare-associated infections: summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2009-2010. Infect Control Hosp Epidemiol. 2013;34:1-14. DOI: 10.1086/668770 [ Links ]
11. Blot SI, Pea F, Lipman J. The effect of pathophysiology on pharmacokinetics in the critically ill patient—concepts appraised by the example of antimicrobial agents. Adv Drug Deliv Rev. 2014;77:3-11. DOI: 10.1016/j.addr.2014.07.006 [ Links ]
12. Jochberger S, Mayr V, Luckner G, Fries DR, Mayr AJ, Friesenecker BE, et al. Antifactor Xa activity in critically ill patients receiving antithrombotic prophylaxis with standard dosages of certoparin: a prospective, clinical study. Crit Care. 2005;9:1-8. DOI: 10.1186/cc37923 [ Links ]
13. Mehta RL. Fluid balance issues in the critically ill patient. Fluid Overload. 2010;164:69-78. DOI: 10.1159/000313722 [ Links ]
14. Conil J, Georges B, Brenden A, Segonds C, Lavit M, Seguin T, et al. Increased amikacin dosage requirements in burn patients receiving a once-daily regimen. Int J Antimicrob Agents. 2006;28:226-30. DOI: 10.1016/j.ijantimicag [ Links ]
15. Marik P. Aminoglycoside volume of distribution and illness severity in critically ill septic patients. Anaesth Intensive Care. 1993;21:172-3. DOI: 10.1177/0310057X9302100206 [ Links ]
16. Buerger C, Plock N, Dehghanyar P, Joukhadar C, Kloft C. Pharmacokinetics of unbound linezolid in plasma and tissue interstitium of critically ill patients after multiple dosing using microdialysis. Antimicrob Agents Chemother. 2006;50:2455-63. DOI: 10.1128/AAC.01468-05 [ Links ]
17. Roberts JA, Abdul-Aziz MH, Lipman J, Mouton JW, Vinks AA, Felton TW, et al. Individualised antibiotic dosing for patients who are critically ill: challenges and potential solutions. Lancet Infect Dis. 2014;14:498-509. DOI: 10.1016/S1473.3099(14)70036.-2 [ Links ]
18. De Winter S, Van Hest R, Dreesen E, Annaert P, Wauters J, Meersseman W, et al. Quantification and Explanation of the Variability of First-Dose Amikacin Concentrations in Critically Ill Patients Admitted to the Emergency Department: A Population Pharmacokinetic Analysis. Eur J Drug Metabol Pharmacokin. 2011;1:11. DOI: 10.1007/s13318-021-00698-w [ Links ]
19. Goncalves-Pereira J, Povoa P. Antibiotics in critically ill patients: a systematic review of the pharmacokinetics of beta-lactams. Crit Care. 2011;15:R206. DOI: 10.1186/cc10441 [ Links ]
20. Taccone FS, Laterre PF, Spapen H, Dugernier T, Delattre I, Layeux B, et al. Revisiting the loading dose of amikacin for patients with severe sepsis and septic shock. Crit Care. 2010;14:1-10. DOI: 101186/cc8945 [ Links ]
21. Delattre IK, Hites M, Laterre PF, Dugernier T, Spapen H, Wallemacq PE, et al. What is the optimal loading dose of broad-spectrum β-lactam antibiotics in septic patients? Results from pharmacokinetic simulation modelling. Int J Antimicrob Agents. 2020;56:106-13. DOI: 10.1016/j.ijantimicag.2020.106113 [ Links ]
22. Tsuji BT, Pogue JM, Zavascki AP, Paul M, Daikos GL, Forrest A, et al. International consensus guidelines for the optimal use of the polymyxins. Pharmacotherapy. 2019;39;10-39. DOI: 10.1002/phar.2209 [ Links ]
23. Goncalves-Pereira J, Martins A, Povoa P. Pharmacokinetics of gentamicin in critically ill patients: pilot study evaluating the first dose. Clin Microbiol Infect. 2010;16:1258-63. DOI: 10.11/j.1469-0691.2009.03-074.x [ Links ]
24. Sato M, Chida K, Suda T, Gemma H, Nakumura H, Muramatsu H, et al. Recommended initial loading dose of teicoplanin, established by therapeutic drug monitoring, and outcome in terms of optimal trough level. J Infect Chemother. 2006;12:185-9. DOI: 10.1007/s10156-006-0446-Y [ Links ]
25. Álvarez O, Plaza-Plaza JC, Ramírez M, Peralta A, Amador CA, Amador R, et al. Pharmacokinetic assessment of vancomycin loading dose in critically ill patients. Antimicrob Agents Chemother. 2017;61:e00280-00217. DOI: 10.1128/AAC.00280-17 [ Links ]
26. Ulldemolins M, Roberts JA, Wallis SC, Rello J, Lipman J. Flucloxacillin dosing in critically ill patients with hypoalbuminaemia: special emphasis on unbound pharmacokinetics. J Antimicrob Chemother. 2010;65:1771-8. DOI: 10.1093/jac/dkq184 [ Links ]
27. Schleibinger M, Steinbach C, Töpper C, Kratzer A, Liebchen U, Kees F, et al. Protein binding characteristics and pharmacokinetics of ceftriaxone in intensive care unit patients. Br J Clin Pharmacol. 2015;80:525-33. DOI: 10.1111/bcp.12636 [ Links ]
28. Brink A, Richards G, Schillack V, Kiem S, Schentag J. Pharmacokinetics of oncedaily dosing of ertapenem in critically ill patients with severe sepsis. Int J Antimicrob Agents. 2009;33:432-6. DOI: 10.1016/j.ijantimicag.2008.10.005 [ Links ]
29. Gregoire N, Chauzy A, Buyck J, Rammaert B, Couet W, Marchand S, et al. Clinical Pharmacokinetics of Daptomycin. Clin Pharmacokinet. 2021;60:271-81. DOI: 10.1007/s40262-020-00968-x [ Links ]
30. Ocampos-Martinez E, Penaccini L, Scolleta S, Abdelhadii A, Devigli A, Cianferoni S, et al. Determinants of early inadequate vancomycin concentrations during continuous infusion in septic patients. Int J Antimicrob Agents. 2012;39:332-7. DOI: 10.1016/j.ijantimicag.2011.12.008 [ Links ]
31. Conil JM, Georges B, Lavit M, Laguerre J, Samii K, Houin G, et al. A population pharmacokinetic approach to ceftazidime use in burn patients: influence of glomerular filtration, gender and mechanical ventilation. Br J Clin Pharmacol. 2007;64:27-35. DOI: 10.1111/j.1365-2125.2007.02857.x [ Links ]
32. Hites M, Dell'Anna AM, Scolletta S, Taccone FS. The challenges of multiple organ dysfunction syndrome and extra-corporeal circuits for drug delivery in critically ill patients. Adv Drug Deliv Rev. 2014;77:12-21. DOI: 10.1016/j.addr.2014.05.007 [ Links ]
33. Adnan S, Xuanhui J, Wallis S, Rudd M, Jarret P, Paterson D, et al. Pharmacokinetics of meropenem and piperacillin in critically ill patients with indwelling surgical drains. Int J Antimicrob Agents. 2013;42:90-3. DOI: 10.1016/j.ijantimicag.2013.02.023 [ Links ]
34. Ronchera-Oms CL, Tormo C, Ordovás JP, Abad J, Jiménez NV. Expanded gentamicin volume of distribution in critically ill adult patients receiving total parenteral nutrition. J Clin Pharm Ther. 1995;20:253-8. DOI: 10.1111/j.1365-2710.1995.tb00659.x [ Links ]
35. Claus B, Colpaert K, Hoste E, Decruyenaere J, De Waele J. Increased glomerular filtration in the critically ill patient receiving anti-infective treatment. Crit Care. 2010;14:1-2. [ Links ]
36. Bilbao-Meseguer I, Rodríguez-Gascón A, Barrasa H, Isla A, Solinís MÁ. Augmented renal clearance in critically ill patients: a systematic review. Clin Pharmacokinet. 2018;57:1107-21. DOI: 10.1007/s40262-018-0636-7 [ Links ]
37. Fuster-Lluch O, Gerónimo-Pardo M, Peyró-García R, Lizán-García M. Glomerular hyperfiltration and albuminuria in critically ill patients. Anaesth Intensive Care. 2008,36:674-80. DOI: 10.1177/0310057X0803600507 [ Links ]
38. Udy AA, Jarret P, Lassing-Smith M, Stuart J, Starr T, Dunlop R, et al. Augmented Renal Clearance in Traumatic Brain Injury: A Single-Center Observational Study of Atrial Natriuretic Peptide, Cardiac Output, and Creatinine Clearance. J Neurotraum. 2017;34:137-44. DOI: 10.1089/neu.2015.4328 [ Links ]
39. Carrie C, Petit L, D´Houdain N, Sauvage N, Cottenceau V, Laffite M, et al. Association between augmented renal clearance, antibiotic exposure and clinical outcome in critically ill septic patients receiving high doses of beta-lactams administered by continuous infusion: a prospective observational study. Int J Antimicrob Agents. 2018;51:443-9. DOI: 10.1016/j.ijantimicag.2017.11.013 [ Links ]
40. Huttner A, Von Dach E, Renzoni A, Huttner BD, Affaticati M, Pagani L, et al. Augmented renal clearance, low beta-lactam concentrations and clinical outcomes in the critically ill: an observational prospective cohort study. Int J Antimicrob Agents. 2015;45:385-92. DOI: 10.1016/j.ijantimicag.2014.12.017 [ Links ]
41. Bakke V, Sporsem H, Von der Lippe E, Nordoy I, lao Y, Nyrerod HC, et al. Vancomycin levels are frequently subtherapeutic in critically ill patients: a prospective observational study. Acta Anaesthesiol Scand. 2017;61:627-35. DOI: 10.1111/aas.12897 [ Links ]
42. Hirai K, Ishii H, Shimosshikiryo T, Shimomura T, Tsuji D, Inoue K, et al. Augmented Renal Clearance in Patients With Febrile Neutropenia is Associated With Increased Risk for Subtherapeutic Concentrations of Vancomycin. Ther Drug Monit. 2016;38:706-10. DOI: 10.1097/FTD.0000000000000346 [ Links ]
43. Baptista JP, Sousa E, Martins PJ, Pimentel JM. Augmented renal clearance in septic patients and implications for vancomycin optimisation. Int J Antimicrob Agents. 2012;39:420-3. DOI: 10.1016/j.ijantimicag.2011.12.011 [ Links ]
44. Eyler RF, Mueller BA. Antibiotic dosing in critically ill patients with acute kidney injury. Nat Rev Nephrol. 2011;7:226-35. DOI: 10.1038/nrneph.2011.12 [ Links ]
45. Jamal JA, Udy AA, Lipman J, Roberts JA. The impact of variation in renal replacement therapy settings on piperacillin, meropenem, and vancomycin drug clearance in the critically ill: an analysis of published literature and dosing regimens. Crit Care Med. 2014;42:1640-50. DOI: 10.1097/CCM.0000000000000317 [ Links ]
46. Medellín-Garibay SE, Romano-Moreno S, Tejedor-Prado P, Rubio-Álvaro N, Rueda-Naharro A, Blasco-Navalpotro MA, et al. Influence of mechanical ventilation on the pharmacokinetics of vancomycin administered by continuous infusion in critically ill patients. Antimicrob Agents Chemother. 2017;61:e01249-01217. DOI: 10.1128/AAC.01249-17 [ Links ]
47. Conil JM, Georges B, Labit M, Laguerre J, Samii K, Houin G, et al. A population pharmacokinetic approach to ceftazidime use in burn patients: influence of glomerular filtration, gender and mechanical ventilation. Br J Clin Pharmacol. 2007;64:27-35. DOI: 10.1111/j.1365-2125.2007.02857.x [ Links ]
48. Roberts JA, Goynt GM, Lee A, Choi G, Bellomo R, Kanji S, et al. The effect of renal replacement therapy and antibiotic dose on antibiotic concentrations in critically ill patients: data from the multinational sampling antibiotics in renal replacement therapy study. Clin Infect Dis. 2021;72:1369-78. DOI: 10.1093/cid/ciaa224 [ Links ]
49. Burdet C, Pajot O, Couffignal C, Armand-Lefèvre L, Foucrier A, Laouènan C, et al. Population pharmacokinetics of single-dose amikacin in critically ill patients with suspected ventilator-associated pneumonia. Eur J Clin Pharmacol. 2015;71:75-83. DOI: 10.1007/s00228-014-1766-y [ Links ]
50. Der Merwe F, Wallis S, Udy A. Understanding the impact of critical illness on drug pharmacokinetics-scientifically robust study design. J Clinic Toxicol. 2012;S4:2161-0495. [ Links ]
51. Georges B, Conil JM, Seguin T, Ruiz S, Minville V, Cougot P, et al. Population pharmacokinetics of ceftazidime in intensive care unit patients: influence of glomerular filtration rate, mechanical ventilation, and reason for admission. Antimicrob Agents Chemother. 2009;53:4483-9. DOI: 10.1128/AAC.00430-09 [ Links ]
52. Martin C, Lambert D, Bruguerolle B, Saux P, Freney J, Fleurette J, et al. Ofloxacin pharmacokinetics in mechanically ventilated patients. Antimicrob Agents Chemother. 1991;35:1582-5. DOI: 10.1128/AAC.35.8.1582 [ Links ]
53. Perkins MW, Dasta JF, Dehaven B. Physiologic implications of mechanical ventilation on pharmacokinetics. DICP. 1989;23:316-23. DOI: 10.1177/106002808902300408 [ Links ]
54. Roberts JA, Joynt GM, Lee A, Choi G, Bellomo R, Kanji S, et al. The Effect of Renal Replacement Therapy and Antibiotic Dose on Antibiotic Concentrations in Critically Ill Patients: Data From the Multinational Sampling Antibiotics in Renal Replacement Therapy Study. Clin Infect Dis. 2021;72:1369-78. DOI: 10.1093/cid/ciaa224 [ Links ]
55. Pistolesi V, Morabito S, Di Mario F, Regolisti G, Cantarelli C, Fiaccadori E. A guide to understanding antimicrobial drug dosing in critically ill patients on renal replacement therapy. Antimicrob Agents Chemother. 2019;63:e00583-00519. DOI: 10.1128/AAC.00583-19 [ Links ]
56. Legrand M, Darmon M, Joannidis M, Payen D. Management of renal replacement therapy in ICU patients: an international survey. Intensive Care Med. 2013;39:101-8. DOI: 10.1007/s00134-012-2706-x [ Links ]
57. Bellomo R, Cass A, Cole L, Finfer S, Gallaher M, Goldsmith D, et al. Renal replacement therapy for acute kidney injury in Australian and New Zealand intensive care units: a practice survey. Crit Care Resusc. 2008;10:225-30. [ Links ]
58. Sime FB, Roberts JA. Antibiotic dosing in critically ill patients receiving renal replacement therapy. Expert Rev Clin Pharmacol. 2016;9:497-9. DOI: 10.1586/17512433.2016.1133290 [ Links ]
59. Gattinoni L, Carlesso E, Langer T. Clinical review: Extracorporeal membrane oxygenation. Crit Care. 2011;15:1-6. DOI: 10.1186/cc10490 [ Links ]
60. World Health Organization. Clinical management of severe acute respiratory infection when novel coronavirus (2019-nCoV) infection is suspected: interim guidance. in Clinical management of severe acute respiratory infection when novel coronavirus (2019-nCoV) infection is suspected: Interim guidance 21-21 (2020). [ Links ]
61. Sherwin J, Heath T, Watt K. Pharmacokinetics and Dosing of Anti-infective Drugs in Patients on Extracorporeal Membrane Oxygenation: A Review of the Current Literature. Clin Therap. 2016;38:1976-94. DOI: 10.1016/j.clinthera.2016.07.169 [ Links ]
62. Cheng V, Abdul-Aziz MH, Roberts JA, Shekar K. Optimising drug dosing in patients receiving extracorporeal membrane oxygenation. J Thorac Dis. 2018;10:S629. DOI: 10.21037/jtd.2017.09.154 [ Links ]
63. Wildschut E, Ahsman M, Allegaert K, Mathot R, Tibboel D. Determinants of drug absorption in different ECMO circuits. Intensive Care Med. 2010;36:2109-16. DOI: 10.1007/s00134-010-2041-z [ Links ]
64. Shekar K, Roberts JA, Barnett AG, Diab S, Wallis SC, Fung YL, et al. Can physicochemical properties of antimicrobials be used to predict their pharmacokinetics during extracorporeal membrane oxygenation? Illustrative data from ovine models. Crit Care. 2015;19:1-11. DOI: 10.1186/s13054-015-1151-y [ Links ]
65. Shekar K, Roberts JA, McDonald CI, Fisquet S, Barnett AG, Mullany DV, et al. Sequestration of drugs in the circuit may lead to therapeutic failure during extracorporeal membrane oxygenation. Crit Care. 2012;16:1-7. DOI: 10.1186/cc11679 [ Links ]
66. Buck ML. Pharmacokinetic changes during extracorporeal membrane oxygenation. Clin Pharmacokinet. 2003;42:403-17. DOI: 10.2165/00003088-200342050-00001 [ Links ]
67. Shekar K, Fraser JF, Smith MT, Roberts JA. Pharmacokinetic changes in patients receiving extracorporeal membrane oxygenation. J Crit Care. 2012;27:741-9. DOI: 10.1016/j.jcrc.2012.02.013 [ Links ]
68. Cheng V, Abdul-Aziz MH, Burrows F, Buscher H, Cho YJ, Corley A, et al. Population Pharmacokinetics of Piperacillin and Tazobactam in Critically Ill Patients Receiving Extracorporeal Membrane Oxygenation: an ASAP ECMO Study. Antimicrob Agents Chemother. 2021;65:e0143821. DOI: 10.1128/AAC.01438-21 [ Links ]
69. Cheng V, Abdul-Aziz MH, Burrows F, Buscher H, Cho YJ, Corley A, et al. Population pharmacokinetics of vancomycin in critically ill adult patients receiving extracorporeal membrane oxygenation (an ASAP ECMO study). Antimicrob Agents Chemother. 2021;AAC0137721. DOI: 10.1128/AAC.01377-21 [ Links ]
70. Cheng V, Abdul-Aziz MH, Burrows F, Buscher H, Corley A, Dielh A, et al. Population pharmacokinetics of cefepime in critically ill patients receiving extracorporeal membrane oxygenation (an ASAP ECMO study). Int J Antimicrob Agents. 2021;58:106466. DOI: 10.1016/j.ijantimicag.2021.106466 [ Links ]
71. Dhanani JA, Lipman J, Pincus J, Townsend S, Livermore A, Wallis SC, et al. Pharmacokinetics of fluconazole and ganciclovir as combination antimicrobial chemotherapy on ECMO: a case report. Int J Antimicrob Agents. 2021;106431. DOI: 10.1016/j.ijantimicag.2021.106431 [ Links ]
72. Dhanani JA, Lipman J, Pincus J, Townsend S, Livermore A, Wallis SC, et al. Pharmacokinetics of Sulfamethoxazole and Trimethoprim During Venovenous Extracorporeal Membrane Oxygenation: A Case Report. Pharmacotherapy. 2020;40(7):713-7. DOI: 10.1002/phar.2413 [ Links ]
73. Dhanani JA, Lipman J, Pincus J, Townsend S, Livermore A, Wallis SC, et al. Pharmacokinetics of Total and Unbound Cefazolin during Veno-Arterial Extracorporeal Membrane Oxygenation: A Case Report. Chemotherapy. 2019;64:115-8. DOI: 10.1159/000502474 [ Links ]
74. Roberts JA, Paul SK, Akova M, Bassetti M, De Waele JJ, Dimopoulos G, et al. DALI: defining antibiotic levels in intensive care unit patients: are current β-lactam antibiotic doses sufficient for critically ill patients? Clin Infect Dis. 2014,58:1072-83. DOI: 10.1093/cid/ciu027 [ Links ]
75. Blot S, Koulenti D, Akova M, Bassetti M, De Waele JJ, Dimopoulos G, et al. Does contemporary vancomycin dosing achieve therapeutic targets in a heterogeneous clinical cohort of critically ill patients? Data from the multinational DALI study. Crit Care. 2014;18:1-12. DOI: 10.1186/cc13874 [ Links ]
76. Craig WA. Pharmacokinetic/pharmacodynamic parameters: rationale for antibacterial dosing of mice and men. Clin Infect Dis. 1998;26:1-10. DOI: 10.1086/516284 [ Links ]
77. Abdul-Aziz MH, Alffenaar JWC, Bassetti M, Bracht H, Dimopoulos G, Marriot D, et al. Antimicrobial therapeutic drug monitoring in critically ill adult patients: a Position Paper. Intensive Care Med. 2020;46:1127-53. DOI: 10.1007/s00134-020-06050-1 [ Links ]
78. Abdul-Aziz MH, Sulaiman H, Mat-Nor MB, Rai V, Wong KK, Hasan MS, et al. Beta-Lactam Infusion in Severe Sepsis (BLISS): a prospective, two-centre, open-labelled randomised controlled trial of continuous versus intermittent beta-lactam infusion in critically ill patients with severe sepsis. Intensive Care Med. 2016;42:1535-45. DOI: 10.1007/s00134-015-4188-0 [ Links ]
79. Roberts JA, Roberts MS, Robertson TA, Dalley AJ, Lipman J. Piperacillin penetration into tissue of critically ill patients with sepsis—bolus versus continuous administration? Crit Care Med. 2009;37:926-33. DOI: 10.1097/CCM.0b013e3181968e44 [ Links ]
80. Eagle H, Fleischman R, Musselman AD. Effect of Schedule of Administration on the Therapeutic Efficacy of Penicillin. Importance of the Aggregate Time Penicillin remains at Effectively Bactericidal Levels. Am J Med. 1950;9:280-99. DOI: 10.1016/0002-9343(50)90425-6 [ Links ]
81. Roberts JA, Abdul-Aziz MH, Davis JS, Dulhunty JM, O Cotta M, Myburgh J, et al. Continuous versus intermittent β-lactam infusion in severe sepsis. A meta-analysis of individual patient data from randomized trials. Am J Respir Crit Care Med. 2016;194(6):681-91. DOI: 10.1164/rccm.201601-0024OC [ Links ]
82. Roberts JA, Webb S, Paterson D, Ho KM, Lipman J. A systematic review on clinical benefits of continuous administration of β-lactam antibiotics. Crit Care Med. 2009;37:2071-8. DOI: 10.1097/CCM.0b013e3181a0054d [ Links ]
83. Kasiakou SK, Sermaides GJ, Michalopoulos A, Soteriades ES, Falagas ME. Continuous versus intermittent intravenous administration of antibiotics: a meta-analysis of randomised controlled trials. Lancet Infect Dis. 2005;5:581-9. DOI: 10.1016/S1473-3099(05)70218-8 [ Links ]
84. Falagas ME, Tansarli GS, Ikawa K, Vardakas KZ. Clinical outcomes with extended or continuous versus short-term intravenous infusion of carbapenems and piperacillin/tazobactam: a systematic review and meta-analysis. Clin Infect Dis. 2013;56:272-82. DOI: 10.1093/cid/cis857 [ Links ]
85. Teo J, Liew Y, Lee W, Kwa ALH. Prolonged infusion versus intermittent boluses of β-lactam antibiotics for treatment of acute infections: a meta-analysis. Int J Antimicrob Agents. 2014;43:403-11. DOI: 10.1016/j.ijantimicag.2014.01.027 [ Links ]
86. Yusuf E, Spapen H, Piérard D. Prolonged vs intermittent infusion of piperacillin/ tazobactam in critically ill patients: a narrative and systematic review. J Crit Care. 2014;29:1089-95. DOI: 10.1016/j.jcrc.2014.07.033 [ Links ]
87. Shiu JR, Wang E, Tejani AM, Wasdell M. Continuous versus intermittent infusions of antibiotics for the treatment of severe acute infections. Cochrane Database Syst Rev. 2013(3):CD008481. DOI: 10.1002/14651858.CD008481.pub2 [ Links ]
88. Rhodes NJ, MacVane SH, Kuti JL, Scheetz MH. Impact of loading doses on the time to adequate predicted beta-lactam concentrations in prolonged and continuous infusion dosing schemes. Clin Infect Dis. 2014;59:905-7. DOI: 10.1093/cid/ciu402 [ Links ]
89. Roberts JA, Paul SK, Akova M, Bassetti M, De Waele JJ, Dimopoulos G, et al. Reply to Rhodes et al. Clin Infect Dis. 2014,59:907-8. DOI: 10.1093/cid/ciu403 [ Links ]
90. Paul M, Theuretzbacher U. β-lactam prolonged infusion: it's time to implement! Lancet Infect Dis. 2017;18:13-4. DOI: 10.1016/S1473-3099(17)30614-X [ Links ]
91. Bigley FP, Forsyth RJ, Henley MW. Compatibility of imipenem-cilastatin sodium with commonly used intravenous solutions. Am J Hosp Pharm. 1986;43:2803-9. [ Links ]
92. Patel PR, Cook SE. Stability of meropenem in intravenous solutions. Am J Health Syst Pharm. 1997;54:412-21. DOI: 10.1093/ajhp/54.4.412 [ Links ]
93. Cook B, Hill S, Lynn B. The stability of amoxycillin sodium in intravenous infusion luids. J Clin Pharm Ther. 1982;7:245-50. DOI: 10.1111/j.1365-2710.1982. tb01029.x [ Links ]
94. Stiles ML, Allen LV. Stability of nafcillin sodium, oxacillin sodium, penicillin G potassium, penicillin G sodium, and tobramycin sulfate in polyvinyl chloride drug reservoirs. Am J Health Syst Pharm. 1997;54:1068-70. DOI: 10.1093/ajhp/54.9.1068 [ Links ]
95. Stewart JT, Warren FW, Johnson SM, Fox JL, Mullaney J. Stability of ceftazidime in plastic syringes and glass vials under various storage conditions. Am J Hosp Pharm. 1992;49:2765-8. [ Links ]
96. Bolla B, Buxani Y, Wong R, Jones L, Dube M. Understanding IV antimicrobial drug losses: the importance of flushing infusion administration sets. JAC-Antimicrobial Resistance. 2020,2:dlaa061. DOI: 10.1093/jacamr/dlaa061 [ Links ]
97. Peyko V. An Unrecognized Problem in Optimizing Antimicrobial Therapy: Significant Residual Volume Remaining in Intravenous Tubing With Extended-Infusion Piperacillin–Tazobactam. J Pharm Pract. 2021:08971900211033462. DOI: 10.1177/08971900211033462 [ Links ]
98. Lam WJ, Bhowmick T, Gross A, Vanschooneveld TC, Weinstein MP. Using higher doses to compensate for tubing residuals in extended-infusion piperacillin-tazobactam. Ann Pharmacother. 2013;47:886-91. DOI: 10.1345/aph.1R721 [ Links ]
99. Hermsen ED, Fehrenbacher L. Antibiotic Stewardship and Applications of Pharmacodynamics. Antibiotic Pharmacodynamics. 2016;633-47. [ Links ]
100. Udy AA, Roberts JA, Lipman J, Blot S. The effects of major burn related pathophysiological changes on the pharmacokinetics and pharmacodynamics of drug use: An appraisal utilizing antibiotics. Adv Drug Deliv Rev. 2018;123:65-74. DOI: 10.1016/j.addr.2017.09.019 [ Links ]
101. Alobaid AS, Wallis SC, Jarrett P, Starr T, Stuart J, Lassig-Smith M, et al. Population pharmacokinetics of piperacillin in nonobese, obese, and morbidly obese critically ill patients. Antimicrob Agents Chemother. 2017;61:e01276-01216. DOI: 10.1128/AAC.01276-16 [ Links ]
102. Roberts JA, Udy AA, Jarrett P, Wallis SC, Hope WW, Sharma R, et al. Plasma and target-site subcutaneous tissue population pharmacokinetics and dosing simulations of cefazolin in post-trauma critically ill patients. J Antimicrob Chemother. 2015;70:1495-502. DOI: 10.1093/jac/dku564 [ Links ]
103. Weber N, Jackson K, McWhinney B, Ungerer J, Kennedy G, Lipman J, et al. Evaluation of pharmacokinetic/pharmacodynamic and clinical outcomes with 6-hourly empiric piperacillin-tazobactam dosing in hematological malignancy patients with febrile neutropenia. J Infect Chemother. 2019;25:503-8. DOI: 10.1016/j.jiac.2019.02.014 [ Links ]
104. Sime FB, Roberts MS, Tiong IS, Gardner JH, Lehman S, Peake SL, et al. Can therapeutic drug monitoring optimize exposure to piperacillin in febrile neutropenic patients with haematological malignancies? A randomized controlled trial. J Antimicrob Chemother. 2015;70:2369-75. DOI: 10.1093/jac/dkv123 [ Links ]
105. De Waele JJ, Carrette S, Carlier M, Stove V, Boelens J, Claeys G, et al. Therapeutic drug monitoring-based dose optimisation of piperacillin and meropenem: a randomised controlled trial. Intensive Care Med. 2014:40:380-7. DOI: 10.1007/s00134-013-3187-2 [ Links ]
106. Hagel S, Fiedler S, Hohn A, Brinkmann A, Frey OR, Hoyer H, et al. Therapeutic drug monitoring-based dose optimisation of piperacillin/tazobactam to improve outcome in patients with sepsis (TARGET): a prospective, multi-centre, randomised controlled trial. Trials. 2019;20:330. DOI: 10.1186/s13063-019-3437-x [ Links ]
107. Abdulla A, Ewoldt TM, Hunfeld NGM, Muller AE, Rietdijk WJR, Polinder S, et al. The effect of therapeutic drug monitoring of beta-lactam and fluoroquinolones on clinical outcome in critically ill patients: the DOLPHIN trial protocol of a multicentre randomised controlled trial. BMC Infect Dis. 2020;20:57. DOI: 10.1186/s12879-020-4781-x [ Links ]
108. Wong G, Briscoe S, McWhinney B, Ally M, Ungerer J, Lipman J, et al. Therapeutic drug monitoring of β-lactam antibiotics in the critically ill: direct measurement of unbound drug concentrations to achieve appropriate drug exposures. J Antimicrob Chemother. 2018;73:3087-94. DOI: 10.1093/jac/dky314 [ Links ]
109. Economou CJP, Wong G, McWhinney B, Ungerer JPJ, Lipman J, Roberts JA, et al. Impact of β-lactam antibiotic therapeutic drug monitoring on dose adjustments in critically ill patients undergoing continuous renal replacement therapy. Int J Antimicrob Agents. 2017;49:589-94. DOI: 10.1016/j.ijantimicag.2017.01.009 [ Links ]
110. Fournier A, Eggimann P, Pagani JL, Revelly JP, Decosterd LA, Marchetti O, et al. Impact of the introduction of real-time therapeutic drug monitoring on empirical doses of carbapenems in critically ill burn patients. Burns. 2015;41:956-68. DOI: 10.1016/j.burns.2015.01.001 [ Links ]
111. Patel BM, Paratz J, See NC, Muller MJ, Rudd M, Paterson D, et al. Therapeutic drug monitoring of beta-lactam antibiotics in burns patients—a oneyear prospective study. Ther Drug Monit. 2012;34:160-4. DOI: 10.1097/FTD.0b013e31824981a6 [ Links ]
112. Roberts JA, Ulldemolins M, Roberts M, Roberts MS, McWhinney B, Ungerer J, et al. Therapeutic drug monitoring of β-lactams in critically ill patients: proof of concept. Int J Antimicrob Agents. 2010;36:332-9. DOI: 10.1016/j.ijantimicag.2010.06.008 [ Links ]
Recibido: 04 de Diciembre de 2021; Aprobado: 06 de Febrero de 2022; : 25 de Marzo de 2022











 texto em
texto em