Introducción
Las úlceras corneales se originan como consecuencia de la rotura o defecto del epitelio corneal con inflamación subyacente, dando lugar en ocasiones a la necrosis del estroma y constituyendo una causa importante de morbilidad ocular a nivel mundial1. Entre los síntomas asociados destacan irritación, sensación de cuerpo extraño, edema conjuntival, hiperemia y visión borrosa2. Es fundamental un diagnóstico temprano y el inicio precoz de un tratamiento adecuado, ya que pueden provocar pérdida de visión al originar opacidad corneal y defectos epiteliales persistentes3.
Los defectos epiteliales persistentes se definen como alteraciones de la córnea que no mejoran después de 2 semanas de tratamiento convencional. Esta ausencia de epitelización de la superficie corneal se puede producir por múltiples causas, tales como infecciones, medicamentos, alteraciones en la adhesión epitelial o traumatismos4,5.
El tratamiento de este tipo de lesiones comienza con una lubricación intensiva, retirada de tratamientos que ocasionen toxicidad epitelial, antibióticos profilácticos, así como el empleo de vendajes oclusivos o lentes de contacto terapéuticas5-7. En caso de refractariedad, se puede recurrir a la administración oftálmica de suero autólogo o plasma rico en plaquetas8.
En los últimos años se ha incrementado la búsqueda de factores de crecimiento para la cicatrización de heridas corneales, dada la presencia de receptores para estas moléculas en células epiteliales de la córnea9,10. Recientemente, el factor de crecimiento epidérmico, el factor de crecimiento nervioso y la insulina han mostrado ser útiles en el tratamiento de este tipo de lesiones por sus propiedades promotoras del crecimiento epitelial11.
El empleo de insulina en las úlceras corneales fue propuesto por primera vez por Aynsley en 1945 en la reepitelización de úlceras refractarias al tratamiento habitual12. Actualmente, el uso tópico de insulina en úlceras corneales se centra fundamentalmente en pacientes diabéticos, tanto en defectos epiteliales corneales postoperatorios como en defectos epiteliales no quirúrgicos13,14. En pacientes no diabéticos, se ha descrito el empleo de insulina en el tratamiento de úlceras corneales neurotróficas refractarias a tratamiento convencional y en defectos epiteliales persistentes tras la resección de un neurinoma15,16. En lo que concierne a la seguridad de la insulina, no se han descrito efectos secundarios ni alteración en los niveles sanguíneos de glucosa, presión intraocular o epitelio corneal como consecuencia de su administración a largo plazo17,18.
En situaciones de vacío terapéutico es frecuente recurrir a la reformulación de medicamentos para su adaptación a una vía de administración diferente a la original. Actualmente, no se dispone de ningún colirio comercial de insulina en nuestro país, por lo que debe recurrirse a la formulación magistral partiendo de una solución inyectable de insulina humana de acción rápida para administración subcutánea o intravenosa.
Hasta la fecha no se ha publicado ningún artículo científico sobre la estabilidad de las formulaciones de insulina oftálmicas empleadas en el tratamiento de los defectos epiteliales persistentes, por lo que este trabajo se postula como el primero en su campo. El objetivo es determinar la estabilidad de dos tipos de colirio de insulina 25 UI/ml elaborados con suero salino fisiológico (SSF) o balanced salt solution (BSS®) bajo diferentes condiciones de conservación durante 120 días.
Métodos
Preparación de colirios de insulina
Se procedió a la elaboración del colirio de insulina 25 UI/ml con dos vehículos diferentes. Para ello, se empleó insulina Actrapid® [100 Ul/ml] (Novo Nordisk®, Bagsværd, Dinamarca), conteniendo entre sus excipientes meta-cresol (m-cresol). Como vehículo se adicionó BSS® (Alcon Laboratories®, Texas, Estados Unidos) o SSF (Grifols®, Barcelona, España).
Se elaboraron 200 ml de cada formulación, adicionando 50 ml de insulina Actrapid® a 150 ml de BSS® o SSF en un Vacuflasc® de 250 ml. Se elaboraron tres lotes de cada vehículo. Posteriormente, se procedió a la homogeneización de las soluciones durante 30 segundos mediante agitación y a su envasado en viales de 5 ml de vidrio topacio tipo 1. Todo el proceso se realizó en condiciones asépticas bajo flujo laminar horizontal y se consideró el día de elaboración de las formulaciones como el día 0 del estudio.
Condiciones de conservación
Las condiciones de conservación fueron: temperatura ambiente (25 °C), refrigeración (entre 2 y 8 °C) o congelación (–20 °C). Para asegurar que las condiciones de temperatura se mantuvieran constantes durante todo el estudio, los viales conservados a temperatura ambiente se almacenaron en una cámara climática ICH L (Memmert GmbH + Co®, Schwabach, Alemania) que mantiene constantes la temperatura (25 °C) y la humedad (60%), mientras que la nevera y el congelador se encontraban equipados con una sonda de temperatura Siemens®. Todos los viales se conservaron protegidos de la luz.
Caracterización físico-química
Determinación y cuantificación de insulina
La determinación y cuantificación de la insulina se llevó a cabo mediante cromatografía líquida de ultra alta resolución (UHPLC) utilizando un ACQUITY UPLC H Class Plus® (Waters) en fase reversa con detector de matriz de fotodiodos (PDA) en los días 0, 3, 7, 15, 30, 60, 90 y 120. El método analítico empleado se validó en cuanto a linealidad, exactitud, precisión y límites de detección y cuantificación. Se realizó una recta de calibrado lineal para ambos diluyentes en un rango de concentraciones de 0,3-10,0 UI/ml (R2 = 0,999). Los límites de detección y cuantificación fueron 0,15 UI/ml y 0,30 UI/ml, respectivamente, para ambos diluyentes. Asimismo, se comprobó que el método cumple con los criterios de precisión y exactitud. Todo ello, de acuerdo con los criterios de validación analítica estipulados por la European Medicines Agency19.
Se empleó una columna ACQUITY UHPLC BEH C18 1,7 µm (2,1 x 50,0 mm), temperatura de la columna de 35 °C, temperatura de la muestra de 8 °C, velocidad de flujo de 0,5 ml/min y volumen de muestra inyectado de 10 µl. Para la fase móvil se empleó ácido fórmico (AF) 0,1% en agua (Milli-Q calidad UHPLC Merck Millipore®, Madrid, España) y AF 0,1% en acetonitrilo (ACN) (VWR Chemicals®, Pensilvania, Estados Unidos). El método cromatográfico empleado fue en gradiente, empezando con una proporción de 80% de AF 0,1% en agua y un 20% de AF 0,1% en ACN, alcanzando en el minuto 6 una composición de 30-70%, respectivamente. Para cuantificar la insulina, fue necesaria una dilución 1:10 de las muestras y su posterior filtrado a través de filtros Acrodisc® de 13 mm de baja adsorción a proteínas (0,2 µm). El procesamiento de los datos obtenidos se realizó a través de Empower® 3 software. Bajo esas condiciones, el tiempo de retención de la insulina se sitúa entre 2,1 minutos a una longitud de onda de 220 nm (Figura 1).
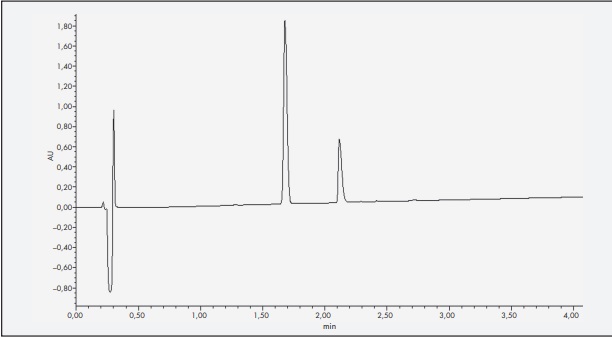
Figura 1. Cromatograma de insulina en suero salino fisiológico obtenido con el método de cromatografía líquida de ultra alta resolución. Tras el frente de disolvente (minuto 0,3), se observa un primer pico correspondiente con meta-cresol (minuto1,6). El segundo pico corresponde a la insulina (minuto 2, 1).
Determinación de osmolalidad y pH
La determinación de la osmolalidad se llevó a cabo con un osmómetro crioscópico (OsmoSpecial 1, Astori Tecnica®, Poncarale, Italia), depositando en un tubo eppendorf® una alícuota de 150 µl de cada muestra. Las medidas de pH se realizaron con un pHmeter Basic 20 (Crison®, Barcelona, España). Ambas variables se determinaron en los días 0, 3, 7, 15, 30, 60, 90 y 120.
Estabilidad microbiológica
Se retiraron 3 ml de cada una de las formulaciones y condiciones de conservación a tiempos 0, 15, 30, 60, 90 y 120. Los medios de cultivo empleados para evaluar la esterilidad de las formulaciones fueron caldo tioglicolato (Merck®, Damrstadt, Alemania), agar sangre Columbia (Merck®, Damrstadt, Alemania) y agar Sabouraud (Merck®, Darmstadt, Alemania). Se incubaron en una estufa a 37 °C en condiciones anaerobias. El tiempo empleado en la incubación del tioglicolato fue de 10 días, y del agar sangre y agar Sabouraud de 48 horas. Una vez completado el tiempo de incubación en estufa, las placas con agar Sabouraud se volvieron a incubar durante 13 días en condiciones de aerobiosis.
Rango de variación y análisis estadístico
La caducidad de las formulaciones se ha establecido de acuerdo con las normas dictadas por el Codex Farmacéutico20, estableciendo el periodo de validez cuando el porcentaje de principio activo del mismo está comprendido entre el 90 y el 110% con respecto a la concentración inicial21-23. Para los valores de osmolalidad y pH, cambios fuera de los límites aceptados en las formulaciones oftálmicas se consideraron inaceptables, así como la existencia de crecimiento microbiano en las muestras evaluadas21-24.
Resultados
Cuantificación de insulina
La concentración de insulina determinada a cada uno de los tiempos para las formulaciones con SSF y con BSS® se encuentran detalladas en la figura 2, expresadas en forma de porcentaje con respecto a la concentración inicial (25 UI/ml).
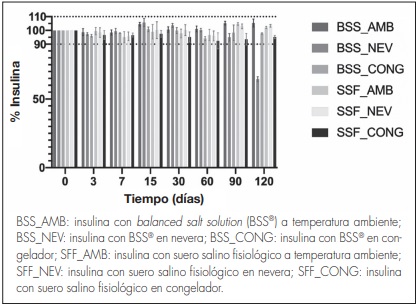
Figura 2. Porcentaje de insulina (media y desviación estándar) en las formulaciones a las diferentes temperaturas de conservación frente al tiempo.
En la formulación elaborada con BSS® la concentración de insulina detectada descendió por debajo del 90% a los 120 días en el caso de la conservación en refrigeración. Sin embargo, se mantuvieron dentro del rango aceptado hasta los 120 días a temperatura ambiente y en congelación. Por el contrario, la formulación elaborada con SSF presentó concentraciones de insulina dentro del rango aceptado hasta los 120 días en las tres condiciones de temperatura estudiadas (ambiente, refrigeración y congelación), asegurando su estabilidad físico-química durante todo el periodo de estudio.
Determinación de osmolalidad y pH
El pH se ha mantenido constante sin variaciones significativas durante todo el estudio (Figura 3). Con respecto a la formulación en BSS®, el valor de pH promedio considerando todas las condiciones de temperatura fue de 7,21 ± 0,21, mientras que el valor de pH obtenido para la formulación de insulina en SSF fue de 7,05 ± 0,20.
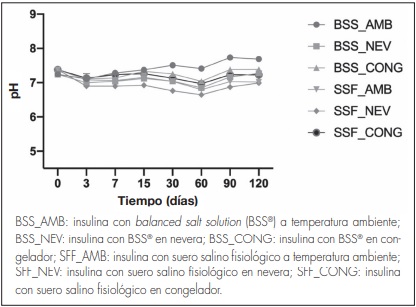
Figura 3. Medidas de pH (media y desviación estándar) en las formulaciones de insulina a las diferentes temperaturas de conservación frente al tiempo.
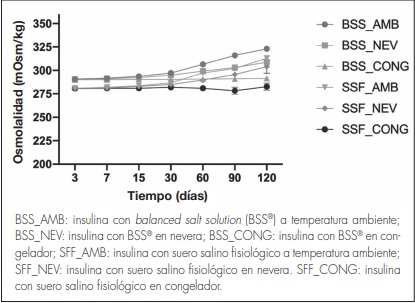
Con respecto a la osmolalidad, no se han detectado variaciones relevantes durante el periodo de estudio (Figura 4). En el caso de la formulación de insulina en BSS®, la osmolalidad obtenida fue de 296,01 ± 9,04 mOsm/kg, considerando las tres condiciones de conservación. En la formulación en SSF se observó una tendencia similar, pero en este caso los valores de osmolalidad fueron relativamente más bajos, con un valor de 288,46 ± 9,02 mOsm/kg.
Discusión
En ocasiones, el arsenal terapéutico convencional empleado para el abordaje de defectos epiteliales persistentes resulta insuficiente, por lo que es necesario recurrir a alternativas terapéuticas con propiedades promotoras del crecimiento epitelial, como es el caso de la insulina. La ausencia de una presentación comercial de colirio de insulina hace necesaria su elaboración como fórmula magistral. Hasta la fecha, diversos estudios han mostrado su eficacia25, aunque no se acompañan de datos de estabilidad físico-química ni microbiológica.
En lo que respecta a la concentración del colirio de insulina, la literatura científica reporta concentraciones muy variables que oscilan desde 1 UI/ml hasta 50 UI/ml15,25. En este sentido, se ha seleccionado la concentración de 25 UI/ml en base al artículo publicado en 2017 por Fai S et al.13. Debido a que la insulina no está incluida como principio activo en el Registro Unificado de Empresas de Sustancias Activas26, se debe partir de una solución inyectable de insulina humana de acción rápida diseñada para ser administrada por vía subcutánea o intravenosa. Los requerimientos que deben cumplir las preparaciones inyectables de insulina están descritos en las diferentes Farmacopeas21-23. Estas preparaciones deben contener entre el 90 y el 110% de la cantidad de insulina inicial, ser lo más isotónicas posibles y presentar un pH comprendido entre 6,9 y 7,8. Teniendo esto en cuenta, los criterios de isotonicidad, esterilidad y pH que requieren las formulaciones oftálmicas ya se solventan empleando esta preparación inyectable como base24.
En lo que concierne a la osmolalidad de las preparaciones oftálmicas, a pesar de que el fluido lacrimal presenta valores alrededor de 300,5 ± 7,2 mOsm/kg, el ojo permite un amplio rango de valores de presión osmótica24, existiendo colirios comercializados con amplias variaciones de osmolalidad que van desde 260 a 330 mOsm/kg27. Con respecto al pH, el fluido lacrimal se encuentra entre los valores de 7,4 y 7,7. Sin embargo, el ojo neutraliza con relativa rapidez soluciones con un amplio margen de pH (3,5-10,5); no obstante, cuanto más se aleje el pH de la solución administrada del valor fisiológico de las lágrimas, más tardará en alcanzarse la neutralización24.
En el caso de nuestras formulaciones, el pH y la osmolalidad se encuentran dentro de los rangos establecidos y apenas sufren variaciones a lo largo del periodo de estudio. No obstante, en la osmolalidad se observa una ligera tendencia ascendente que podría estar vinculada con la degradación de insulina, hecho que podría ser objeto de futuros estudios.
Otro importante aspecto que considerar es la presencia de determinados excipientes. Concretamente, la insulina Actrapid® 100 UI/ml contiene como excipiente m-cresol, el cual se ha asociado a reacciones de hipersensibilidad e irritación, lo que podría suponer un problema a nivel ocular27. Este excipiente actúa como estabilizante de la molécula de insulina en su forma hexamérica, impidiendo su agregación28.29. Se ha descrito que el m-cresol en una concentración del 5% produjo toxicidad ocular grave en animales, mientras que al 1% no se observaron daños a nivel ocular30. No obstante, el m-cresol se emplea como conservante antimicrobiano a concentraciones más bajas, entre 0,15-0,30%. Concretamente, en Actrapid® 100 UI/ml, el m-cresol supone un 0,3%, por lo que no supondría un problema de seguridad el empleo de esta presentación para la elaboración de la formulación magistral29
En lo que respecta a las limitaciones de este trabajo, cabe resaltar que el estudio de estabilidad se limita a la concentración de 25 UI/ml, la cual representa solo una de las diferentes concentraciones recogidas en la literatura. Asimismo, la máxima temperatura ambiente evaluada son 25 °C, la cual se puede ver fácilmente superada en determinadas áreas geográficas. Por otro lado, el mecanismo de degradación que hace que la insulina en BSS® sea menos estable en nevera que a temperatura ambiente debería ser objeto de futuros estudios.
Los resultados obtenidos en el presente trabajo muestran por primera vez la estabilidad de dos formulaciones oftálmicas de colirio de insulina 25 UI/ml en SSF y BSS®. Ambos colirios son estables durante 120 días en todas las condiciones de conservación, a excepción del elaborado con BSS® y conservado en nevera, cuya estabilidad es de 90 días.
Aportación a la literatura científica
Este trabajo constituye el primer estudio en el que se evalúa la estabilidad físico-química y microbiológica de insulina oftálmica elaborada como formulación magistral. Por tanto, se trata de un importante punto de inflexión para que este colirio pueda ser elaborado por los servicios de farmacia, garantizando su adecuada estabilidad y que, de este modo, su empleo en defectos epiteliales persistentes pueda implementarse en práctica clínica habitual.