Introducción
La diabetes mellitus 2 (DM2) es una enfermedad metabólica caracterizada por un mal control glucémico causado por un incremento en la resistencia a insulina, por lo que existe una necesidad de terapias simples y adecuadas, así como seguras y eficaces1. Además, la principal causa de muerte en pacientes con DM2 son las complicaciones cardiovasculares (CV) y cerebrovasculares1, lo que resalta la necesidad de nuevos fármacos que reduzcan el riesgo de eventos CV en pacientes con DM2.
La GLP-1 es una hormona de la familia de las incretinas que se sintetiza en las células L del intestino y es secretada en respuesta a las comidas. Actúa aumentando la secreción pancreática de insulina en respuesta a la glucosa, reduce la secreción de glucagón y suprime el apetito actuando a nivel central2.
En general, para mantener un adecuado control glucémico, es fundamental las modificaciones en el estilo de vida, tales como dieta y ejercicio, pérdida de peso y fármacos que ayuden a reducir la glucemia. En adición a este control glucémico, varias terapias farmacológicas como los agonistas GLP-1 (aGLP-1) y los inhibidores de la glucosa renal (iSGLT-2i) han mostrado protección macrovascular junto a una reducción de eventos cardiovasculares mayores (MACE) y hospitalización por Insuficiencia Cardiaca (IC)3,4,5.
Semaglutida (oral y subcutáneo) es un aGLP-1 de nueva generación con alto grado de similitud al GLP-1 humano1. Los estudios clínicos han demostrado que la semaglutida oral es segura y bien tolerada y proporciona una reducción dosis dependiente de la HbA1c y del peso corporal de acuerdo al uso en las indicaciones especificadas6-10.
Resulta difícil comparar los resultados de los distintos estudios con análogos GLP-1 por sus diferencias en los diseños, duración y variabilidad en la definición de la variable principal. Asumiendo la hipótesis que semaglutida produce una mayor reducción de peso frente a los otros, se presenta este estudio en el que se evalúa la reducción de peso de los diferentes aGLP-1 en vida real en sujetos que inician tratamiento con aGLP-1. Por otro lado, debido a la alta tasa de eventos gastrointestinales y posible abandono terapéutico, se pretende ver si la reducción de peso o posibles cambios en la calidad de vida y actividad física pueden repercutir en un menor fracaso terapéutico.
El objetivo principal del estudio será evaluar los cambios en la pérdida de peso, tanto en reducción de peso (Kg) como en % de peso, así como cambios en el Índice de Masa Corporal (IMC), en pacientes con DM2 tratados con semaglutida frente a tratados con otros agonistas GLP-1.
Objetivos secundarios:
Métodos
El estudio SEVERAL es un estudio multicéntrico y de seguimiento prospectivo con un diseño epidemiológico de cohortes, una formada por pacientes tratados con semaglutida (oral y subcutáneo) y otra formada por sujetos tratados con otros análogos de la GLP-1 (subcutáneos). Es un estudio de carácter multidisciplinar y de ámbito entre niveles asistenciales. El estudio será promovido y coordinado desde un Servicio de Cardiología del sistema nacional de salud (SNS). Se reclutarán pacientes de 10 centros del SNS. Se incluirán un total de 360 pacientes en el estudio, unos 36 pacientes por centro. El reclutamiento será competitivo y se cerrará una vez alcanzado. Teniendo en cuenta estadísticas previas de prescripciones, se estima que los grupos entre semaglutida y otros análogos serán aproximadamente iguales (aproximadamente el 50% de los sujetos financiados, se les prescribe semaglutida actualmente).
La población diana del presente estudio es la población con DM2 de la Comunidad Autónoma donde se llevará a cabo el estudio.
Criterios de selección
Fase de reclutamiento y visita de selección
Los farmacéuticos homologadores de cada centro serán los encargados de incluir los pacientes tras la firma del consentimiento informado. La asignación de un paciente a una estrategia terapéutica concreta no está decidida de antemano por el protocolo del estudio, sino que está determinada por la práctica habitual de la medicina. No se aplicará a los pacientes ninguna intervención, ya sea diagnostica o de seguimiento, que no sea la habitual de la práctica clínica.
Seguimiento
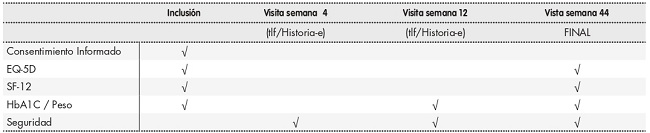
Los pacientes serán seguidos en las visitas relatadas a continuación, con una ventana de +/- 2 semanas. Las visitas 4 y 12 serán telefónicas y/o a través de historia médica electrónica (cuando se disponga). Para la visita de la semana 12, en caso de no disponer la variable de peso, se citará al paciente en consulta. La visita de la semana 44 será realizada en consulta. Las variables de HbA1c serán recogidas por práctica clínica habitual y siempre el valor más cercano a la consulta (Tabla 1).
Recogida de datos:
Los farmacéuticos de cada centro serán los encargados de incluir los pacientes y de recoger los posibles eventos adversos y diferentes variables (incluida la medicación e historial médico) a través de historia clínica y/o entrevista telefónica. La base de datos será electrónica y anonimizada. El promotor del estudio será el responsable de la validez y custodia de los datos.
Análisis estadístico
Tamaño muestral. Para responder el objetivo principal de este estudio, evaluar la reducción de peso en pacientes con DM2 con semaglutida frente a otros agonistas GLP-1, se espera incluir durante el periodo de estudio 360 sujetos. Se ha calculado que se incluirán unos 36 pacientes por centro (10 centros), en un periodo de 6 meses. Este cálculo se ha basado en datos previos del número de homologaciones mensuales en los centros participantes. En estudios previos11-15 en los que se evaluó la pérdida de peso en pacientes con diabetes mellitus tipo 2 tratados con semaglutida y otros agonistas GLP-1 se observó una perdida media en los pacientes con semaglutida de 3,6-4,9 kg, mientras que con otros agonistas GLP-1 la perdida fue menor, entre 0,86-2,96 kg. En base a estos datos y asumiendo un nivel de significación del 5%, una media de pérdida de peso en el grupo de agonistas GLP1 de 2,5 kg, media en el grupo de semaglutida de 4,2 kg y desviación conjunta de 3,0kg, al incluir 360 sujetos habrá una potencia estadística por encima del 90% para detectar diferencias mediante una prueba t de Student para muestras independientes. Por otra parte, asumiendo un porcentaje de posibles pérdidas en el seguimiento de hasta el 20%, la muestra se podría ver reducida hasta en 72 sujetos. En esta situación la potencia estadística para detectar diferencias en la pérdida de peso entre los grupos de estudio seguiría siendo superior al 90%. La estimación de la potencia estadística basada en el tamaño de muestra se ha realizado con el paquete estadístico SPSS 3.0.
Se realizará una descripción de las variables de estudio presentando las variables cualitativas como frecuencia y porcentaje y las cuantitativas como media y desviación estándar o mediana y rango intercuartílico si no se ajustan a distribución normal. El ajuste a la normalidad se determinará con el test de Kolmogorov-Smirnov.
El objetivo general se evaluará a través de la pérdida de peso en cada uno de los grupos. Se analizará si existen otras variables asociadas a la pérdida de peso, para lo que empleará la prueba t de student para variables cuantitativas y la prueba chi-cuadrado para las cualitativas. Se realizarán análisis de regresión lineal multivariante para ajustar la pérdida de peso respecto a las variables que hayan presentado una asociación estadísticamente significativa en el análisis univariante. De igual forma los objetivos específicos se estudiarán mediante análisis univariante y multivariante. Las variables de agrupación serán categóricas, de tal forma que para las variables continuas se empleará el test de Student o ANOVA mientras que si las variables son de naturaleza categórica se aplicara el test de chi cuadrado. Con las variables que resulten significativas se llevaran a cabo modelos de regresión logística multivariante.
Cuestionarios (ver anexo 1 y 2)
En las visitas señaladas en el cronograma, se le entregaran en consulta los cuestionarios Test EQ-5D-5L y Test SF-12 que deberán ser completados por el participante.
Este estudio ha sido aprobado por el Comité Ético de Investigación Clínica Autonómico (CEICm) el 22/12/2021 y N.º 2021/471. El Registro Español de Estudios Clínicos (GESTO) con identificador 0065-2021-OBS (N.º AEMPS 21-0022) y también ha sido registrado en https://www.clinicaltrials.gov. Cuenta con la aprobación de las gerencias sanitarias.
Discusión
El estudio SEVERAL pretende evaluar las posibles diferencias entre los aGLP-1 disponibles, con datos en vida real relativos a: 1) Efectividad: reducción de peso y 2) cambios en calidad de vida, actividad física y seguridad y tolerabilidad.
La hipótesis de partida es que existen diferencias de clase relativas a la reducción de peso y a tolerabilidad, si bien es esperable un aceptable nivel de seguridad como se reporta en los estudios pivotales. Estos resultados se cree van a ser de interés clínico para los profesionales encargados de la prescripción y dispensación de estas moléculas prometedoras para la prevención y tratamiento de los pacientes diabéticos y con enfermedades cardiovasculares. Actualmente además del semaglutida (en presentación oral y subcutáneo), se encuentran disponibles cuatro fármacos de la familia aGLP-1: dulaglutida, exenatida, liraglutida, lixisenatida (subcutáneos). Sin embargo, no se dispone de evidencia relativa a las diferencias en reducción de peso en vida real y principalmente en qué medida se adhieren al tratamiento como consecuencia de la elevada tasa de eventos gastrointestinales fuera del contexto de los ensayos clínicos.
Ensayos Clínicos con análogos de la GLP-1
En la actualidad se han publicados varios ensayos clínicos con aGLP‑1. Todos ellos han demostrado efectividad en la reducción de la variable HbA1c tanto en monoterapia como combinados a otros antidiabéticos orales y/o insulina. En cuanto a la reducción de peso: dulaglutide se asoció con una reducción de –0,35 kg a –2,90 kg8. En relación con exenatide, un 3% de los pacientes experimentaron al menos un periodo de pérdida de peso rápida (superior a 1,5 kg/semana)8. Respecto a liraglutida la reducción de peso fue más significativa cuanto mayor era el IMC basal8. La reducción de peso con lixisenatida oscilo entre 1,76 kg y 2,96 kg8. Finalmente, con semaglutida, se alcanzó una pérdida de peso ≥ 5% y ≥ 10% en más sujetos tratados con semaglutida que con los comparadores activos dulaglutida y exenatida (SUSTAIN 7 y SUSTAIN 3)12-13. La reducción de peso en el ensayo SUSTAIN 69,10 fue de –3,6 kg a –4,9 kg. Tras los resultados del estudio STEP1, donde la reducción de peso fue de un –14,9% y el cambio en el peso basal fue de –15,3 kg10, semaglutida ha sido aprobado por la FDA para el tratamiento de la obesidad tanto en pacientes diabéticos como no diabéticos. Posteriormente se ha publicado los resultados del ensayo STEP 8 (semaglutida subcutáneo semanal VS Liraglutida), donde se observó una reducción de peso de –15,8% en semgaglutide frente a –6,4% en liraglutida11.
Tras valorar estos datos se puede concluir que todos los aGLP-1 reducen en mayor o menor medida el peso corporal, pero los ensayos clínicos que los han aprobado presentan algunas limitaciones que podrían condicionar la validez externa de los resultados y su extrapolación a la práctica clínica real. Las poblaciones de estudio son diferentes en cada uno de los ensayos y han sido diseñados con metodologías diferentes y variabilidad en la variable principal. Así mismo fueron diseñados en su gran mayoría para evaluar como variable principal la reducción en HbA1c y eventos cardiovasculares, pero no para evaluar la reducción de peso como variable principal a excepción del estudio STEP 110. No se ha comparado la efectividad de todos los aGLP-1 en el mismo estudio como pretende realizar el estudio SEVERAL.
Seguridad de los aGLP-1
Estos efectos en la pérdida de peso han venido acompañados de determinados eventos adversos, entre los más comunes en ficha técnica destacan los eventos adversos gastrointestinales, tales como náuseas, vómitos, diarrea, dispepsia o estrenimiento8. En el último estudio publicado, el STEP 811, se produjo una discontinuación del tratamiento con semaglutida del 13,5% y del 27,6% para liraglutida. Los eventos gastrointestinales fueron reportados en un 84,1% para semaglutida y 82,7% para liraglutida. La mayoría de los eventos fueron de leves a moderados y no conllevaron a una discontinuación permanente, ocurriendo en su mayor parte de duración corta y durante la escalada de dosis, lo que deja constancia de la posible falta de adherencia en vida real, fuera del entorno y del control a los que están expuestos los pacientes incluidos en los ensayos clínicos. Esta premisa supone una de las motivaciones principales del presente estudio, la evaluación en términos de seguridad de estos fármacos en la vida real.
El estudio SEVERAL ha sido diseñado de tal manera que recogerá todos los posibles eventos adversos tanto en el periodo de escala de dosis como en el de seguimiento. Al mismo tiempo se recogerán datos de calidad de vida y actividad física y se correlacionarán con el posible fracaso terapéutico y efectividad clínica.
Limitaciones
El presente estudio presenta varias limitaciones que habrán de ser tenidas en cuenta a la hora de la interpretación de los datos. La primera de ellas es la ausencia de aleatorización, por lo que no se podrán obtener conclusiones comparativas si no simplemente orientar sobre la situación actual, tasa de prescripción, resultados en su toma y tolerabilidad. Si del presente estudio se apreciasen diferencias marcadas de clase se podría plantear un estudio randomizado dirigido.
En segundo lugar, existe un importante sesgo potencial derivado de la posible pérdida de seguimiento, de forma que aquellos pacientes con peor tolerancia al fármaco lo abandonen, contaminando de esa manera los resultados. Para evitar este sesgo se ha estimado un límite < 20% a la hora del cálculo del tamaño muestral. En nuestra comunidad se cuenta con historia electrónica en el 100% de los pacientes por lo que es posible comprobar en la receta electrónica la retirada del fármaco, lo cual va a ser de gran ayudar a validar la adherencia (como se viene realizando en la práctica clínica diaria).
Es preciso mencionar que el presente grupo de trabajo formado exclusivamente por unidades de farmacia asegurara la minimización de pérdidas de inclusión, pues supone el mayor núcleo de control de las dispensaciones, evitando el sesgo que podría acontecer si este estudio fuese iniciado desde las unidades de cardiología o endocrinología por ejemplo donde sería más difícil asegurar la correcta inclusión de todos los pacientes de nuestra comunidad a los que se les prescriba aGLP1.
En conclusión, este estudio intentará aportar información sobre la efectividad en reducción de peso, cambios en calidad de vida, actividad física y seguridad de los aGLP1 en pacientes con DM2 que inician tratamiento con estos fármacos en la vida real. Este trabajo pretende comparar los diferentes a-GLP1 en términos de efectividad y seguridad para una posterior mejor elección en la prescripción de estos fármacos en pacientes con patología cardiovascular.