My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Medifam
Print version ISSN 1131-5768
Medifam vol.13 n.3 Mar. 2003
EN COLABORACIÓN CON...
Urología
Abordaje de la hiperplasia benigna de próstata. Actuación
Atención Primaria-Especializada
M. BLASCO VALLE, A. TIMÓN GARCÍA1, V. LÁZARO MUÑOZ2
Doctor en Medicina. Médico Especialista en MFyC. Centro de Salud Delicias Sur.
1Médico Especialista en Urología. H.C.U. 2Médico Residente de MFy C.
Centro de Salud Delicias Sur. Zaragoza
| RESUMEN Las manifestaciones clínicas de la hiperplasia benigna de próstata (HBP) se presentan preferentemente a partir de los 50 años. Diferenciar la sintomatología según sean sus características "irritativas" (componente dinámico) u "obstructivas" (componente estático) dirigirá la instauración individualizada hacia uno u otro tratamiento farmacológico (alfabloqueantes-hormonoterapia). La valoración de la clínica y de la calidad de vida, mediante el cuestionario (I-PSS-L), la realización de tacto rectal y la cuantificación de los niveles del antígeno prostático específico (PSA) son elementos necesarios para que el médico de Atención Primaria (AP) decida qué paciente es tributario de atención en ese medio o debe ser derivado. Se propone un esquema de actuación consensuado como guía ante este tipo de patología. Palabras clave: Hiperplasia próstatica. Enfermedades de la próstata. | Bening prostatic hyperplasia approaching Primary Health Care-Especialized Care ABSTRACT The benign prostatic hyperplasia's clinic manifestations appear preferentially since 50 years of age. Key words: Prostatic hyperplasia. Prostatic diseases. |
Recepción: 27-08-02
Aceptación: 22-11-02
INTRODUCCIÓN
La próstata cumple durante la vida sexual activa del varón unas funciones definidas, pero con la edad, su tamaño aumenta y con él la prevalencia de los síntomas. La hiperplasia benigna de próstata (HBP) es el tumor benigno más frecuente en el varón mayor de 50 años. Supone la segunda causa de ingreso para intervención quirúrgica y la primera causa de consulta en los servicios de urología. Aunque en España se han publicado algunos estudios de su prevalencia1 existen dudas sobre su fiabilidad, al carecerse de criterios definidos y parámetros objetivos, para definir qué casos se pueden incluir en el diagnóstico de hiperplasia benigna de próstata (HBP).
A pesar de ello, y dado que hay más de 6.500.000 españoles mayores de 65 años, se estima que más de 1.500.000 precisan atención médica anual debido a procesos prostáticos2.
Por otro lado, el coste de estos tratamientos en España, ha aumentado desde los 2.920 millones de pesetas (17,5 millones de euros) para el año 1992 a 5.663 millones de pesetas (34,04 millones de euros) en 1995 llegando hasta los 9.000 millones (55 millones de euros) en 1998. En Estados Unidos supone una cifra de 4.000 millones de dólares anuales3.
El desarrollo de la HBP comienza alrededor de la cuarta década de la vida con un fenómeno focal de origen estromal4. A partir de la quinta década se produce un aumento global y rápido del volumen debido a un incremento de las células del tejido fibromuscular y glandular, tanto, de la zona periuretral como transicional5. No se conoce claramente la causa pero parecen ser necesarios, por lo menos, dos factores; la edad y la presencia de hormonas androgénicas producidas por los testículos6. Actualmente se asume que, con los años, varía el índice estrógenos / testosterona, aumentando los primeros y descendiendo la segunda lo que predispondría a estos cambios. La teoría de la "célula primordial" explica la HBP como una alteración del balance del crecimiento de células nuevas y la maduración y muerte de las más viejas7.
SINTOMATOLOGÍA
Aunque el concepto de HBP engloba el agrandamiento de la próstata y el obstáculo mecánico al flujo miccional, no hay siempre relación directa entre el volumen de la hiperplasia y la intensidad de los síntomas8. Próstatas mayores de 40 cm3/40 g pueden no originar síntomas y otras menores son fuente de intensas molestias. Los síntomas prostáticos se agrupan según sus características, en obstructivos o irritativos (Tabla I). Aunque no siempre es fácil diferenciar una situación de otra es importante para individualizar los tratamientos adoptando una elección farmacológica adecuada entre alfabloqueantes o inhibidores de la 5-alfa-reductasa9.
DIAGNÓSTICO DIFERENCIAL
No toda la sintomatología del tracto urinario inferior es debida a HBP. Una correcta historia clínica conteniendo antecedentes personales y familiares (enfermedades como el Parkinson, diabetes, ingesta de fármacos anticolinérgicos o antidepresivos) delimitará el diagnóstico así como el de otros procesos similares (Tabla II).
EXPLORACIÓN
Debe incluir, al menos, una exploración abdominogenital para descartar la existencia de globo vesical así como anomalías peneanas (fimosis, estenosis del meato) y un tacto rectal. El tacto rectal es imprescindible e irá encaminado a descartar la presencia de lesiones sospechosas de malignidad. Debe incluir la valoración de la Sensibilidad, el Tamaño, la Consistencia, los Límites y la Movilidad de la próstata. Una regla nemotécnica útil para no olvidar estos aspectos es la de Se-Ta-Con-Li-Mo. La palpación de la próstata debe ser indolora. Su tamaño aproximado es de 3 cm de diámetro, la consistencia similar a la de la eminencia tenar cuando el pulgar se opone al meñique y los límites deben estar conservados y bien definidos, así como el del surco medio que sólo desaparece en grandes adenomas7. Una superficie irregular, el aumento de la consistencia, la existencia de nódulos o unos límites mal definidos sugieren patología de carácter maligno y obligan a la derivación del paciente.
EXPLORACIONES INSTRUMENTALES
La realización de ecografía no es necesaria si el paciente presenta una clínica leve o moderada, si el tacto rectal no es sospechoso y si los niveles de antígeno prostático específico (PSA) y creatinina se encuentran en los límites de la normalidad10.
La urografía, la uretrografía retrógrada, la ureterocistoscopia y el estudio urodinámico son técnicas que el especialista aplicará en casos definidos con criterios que, para el médico de AP, significan la necesidad de derivación (hematuria, infecciones urinarias de repetición, insuficiencia renal, litiasis vesical, elección de cirugía). Si no se dan estas circunstancias, no se recomiendan estudios de imagen porque el 75% de los mismos es normal10.
--Analítica: además de una analítica general se deberá solicitar creatinina sérica (valorar posible insuficiencia renal secundaria a obstrucción) y sedimento urinario con cultivo si procede (valorar la existencia de piuria, cristaluria y hematuria).
El PSA, una glicoproteína con actividad serinproteasa, sintetizada por las células epiteliales, no es un marcador específico de carcinoma sino de tejido prostático. Su determinación está sujeta a variaciones pero en general se admite que en la HBP rara vez se eleva por encima de 4 ng/ml (elevaciones superiores deben ser consultadas con el especialista)11. El efecto del tacto rectal sobre los niveles de PSA es origen de controversia. Para algunos autores12 no sería necesario un plazo entre éste y su determinación, pero otros establecen quince días de intervalo para evitar falsos positivos13 (similares precauciones se tienen con el sondaje vesical).
La determinación del PSA es útil en el control y seguimiento del paciente con HBP pero insuficientemente específico para distinguir la hiperplasia del carcinoma14. Si consideramos un rango de normalidad de 0-4 ng/ml, un valor alterado, tiene una sensibilidad de un 70-80% y una especificidad del 48-90%.
Se ha intentado mejorar la utilidad clínica del PSA realizando estudios en relación con la densidad prostática (cifra de PSA/gramos de tejido prostático estimado por ecografía), así como valorando la velocidad de su elevación en el tiempo, pero en ambos casos no se han llegado a establecer criterios unánimemente aceptados para su aplicación clínica14.
Las conclusiones de la última reunión de expertos de la OMS15 sobre el PSA se limitan a afirmar que:
--La medida del PSA sérico sumado al tacto rectal aumenta la capacidad de detección del cáncer de próstata respecto a cada una de estas exploraciones por separado.
--Se recomienda la determinación del PSA sérico en la evaluación de los pacientes con expectativas de vida superiores a 10 años y en aquéllos en los que un posible diagnóstico positivo de cáncer implique un cambio de actitud terapéutica.
--Debe informarse al paciente de los beneficios y los riesgos que va a implicar determinar el PSA incluyendo la posibilidad de falsos positivos con las posibles complicaciones de una eventual biopsia indicada, sin necesidad, por estos resultados analíticos (también se deben comentar la existencia de falsos negativos).
Siendo la principal función del médico de Atención Primaria descartar la existencia de un carcinoma de próstata, el tacto rectal (con una especificidad del 84-98% y una sensibilidad del 69-89% pero con un valor predictivo positivo bajo -22-34%-); si se une a la determinación del PSA se acepta como útil (por encima de los 50 años) para dirigir sospechas de patología maligna hacia el especialista12.
TEST DE AUTOVALORACIÓN
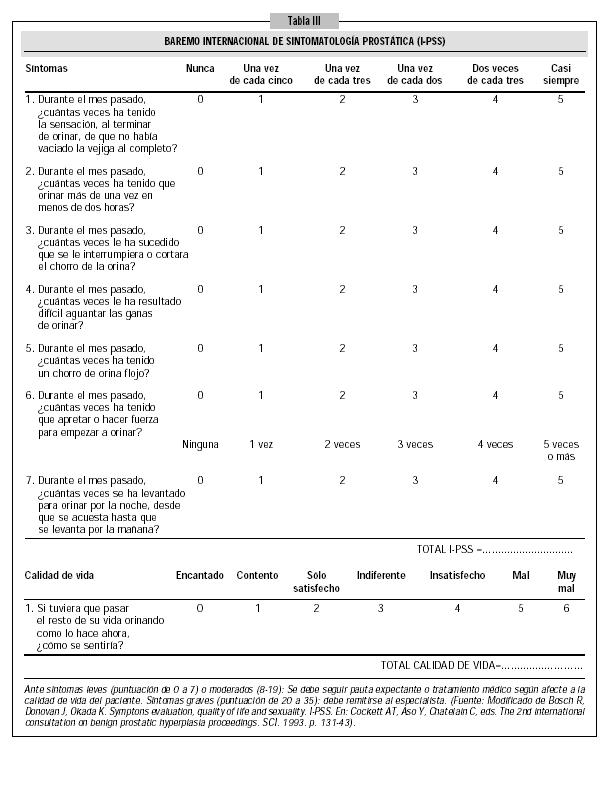
Existen cuestionarios autoadministrados que facilitan la evaluación inicial de los síntomas, así como la respuesta al tratamiento y la progresión de la enfermedad en el periodo de seguimiento. El más utilizado es el I-PSS-L (International Prostate Symptom Score- Quality of Life)16 (Tabla III) el cual consta de 8 preguntas que deben ser completadas por el paciente. Las 7 primeras hacen referencia a los síntomas. Cada pregunta tiene 6 posibles respuestas (según la severidad) valoradas entre 0 y 5, pudiendo estar la puntuación total entre 0 y 35. La última se relaciona con la calidad de vida del paciente y su valor está entre 0 y 6.
Según los resultados el paciente puede ser clasificado como portador de sintomatología leve (0-7) moderada (8-19) o grave (20-35).
Con un I-PSS menor o igual a 7 se puede proponer control anual sin terapia activa. Con un I-PSS de 8-19 se podrá optar, según casos, por esperar, instaurar un tratamiento farmacológico o indicar la posibilidad de consulta especializada. Con un I-PSS de 20-35 se deberá optar por tratamiento médico o quirúrgico individualizando su indicación y siempre en colaboración con el especialista. La escala de puntuación no sólo sirve para considerar el inicio del tratamiento, sino también para constatar su efectividad ya que si ésta es real deberán darse descensos en la escala de puntuación de síntomas del 25% (o más) y disminuciones de 3 puntos (al menos) en la mejoría subjetiva del paciente.
TRATAMIENTO FARMACOLÓGICO
Como se ha apuntado, en la HBP la decisión de optar por un tratamiento activo (farmacológico o quirúrgico) frente a una conducta expectante dependerá de la intensidad de los síntomas y del grado de calidad de vida del paciente17. El tratamiento farmacológico se basa en diversos agentes clasificados como: fitoterápicos, alfabloqueantes y hormonoterápicos (Tabla IV).
Fitoterapia
Los preparados fitoterápicos son extractos de plantas (Pygeum Africanum, Serenoa repens,...) que contienen fitoesteroles y citoesteroles. Se sugiere que actúan por diversos mecanismos como son la interferencia con la síntesis y metabolismo de prostaglandinas (efecto antiinflamatorio), acción antiestrogénica y antiandrogénica (disminución de la globulina transportadora de testosterona) e incluso una inhibición de los factores de crecimiento, pero no existe unanimidad en cuanto a sus acciones y efectos beneficiosos18-20.
Algunas conferencias de la OMS21,22 recomiendan que se prosigan los estudios con este grupo farmacéutico para poderse pronunciar en el sentido de la recomendación de su uso.
Bloqueantes de los receptores alfa:
Pueden ser no selectivos alfa1-alfa2 (fenoxibenzamina, fentolamina).
Alfa1 selectivos de vida media corta (nicergolina, prazosina, alfuzosina).
Alfa1 selectivos de acción prolongada (terazosina, doxazosina).
Alfa1A supraselectivos (tamsulosina).
Actualmente se consideran para el tratamiento de la HBP los uroselectivos de acción prolongada (doxazosina, terazosina y tamsulosina).
Los alfabloqueantes bloquean los receptores adrenérgicos alfa, abundantes en las fibras musculares del cuello vesical y en el estroma de la hiperplasia de próstata, reduciendo la resistencia a la salida de la orina. Actúan pues sobre el componente dinámico de la obstrucción vesical mediante relajación del músculo liso prostático y reducción de la resistencia uretral intraprostática23. Se consideran más eficaces cuando en la clínica predominan los síntomas irritativos (polaquiuria, nicturia, urgencia). El alivio de los síntomas se produce rápidamente, en los primeros días, pero desaparece pronto tras suspender el tratamiento. No son curativos pero minimizan los síntomas en pacientes no candidatos todavía a cirugía. Pueden modificar la tensión arterial y se enumeran entre sus efectos secundarios vértigos, cefalea, mareos, astenia, congestión nasal y palpitaciones. Se debe comenzar con dosis bajas y elevarlas progresivamente. Terazosina y doxazosina, de larga duración, sólo precisan una toma y pueden ingerirse por la noche (al acostarse). Ambos modifican los parámetros lipídicos disminuyendo el colesterol total y el colesterol LDL24,25.
Tamsulosina bloquearía selectivamente los receptores alfa1-A que constituyen el 70% de los existentes en la próstata originando menos efectos secundarios26.
En general son fármacos bien tolerados que no modifican las cifras de PSA. Su contraindicación absoluta es la hipotensión ortostática y como relativas se valoran la historia de síncopes y/o existencia de un proceso cerebrovascular reciente23 (Tabla IV).
Hormonoterapia
Esta terapéutica incluye también los análogos de la LH-RH, los antiandrógenos, los estrógenos y los inhibidores de la aromatasa pero su utilización pertenece al campo especializado. Sin embargo, Finasteride®, aun siendo un fármaco de prescripción con visado, está presente en la clínica asistencial primaria. Actúa inhibiendo selectivamente la enzima 5-alfa-reductasa a nivel prostático impidiendo así la conversión de testosterona en dihidrotestosterona (DHT), necesaria para el crecimiento prostático. Tras meses de uso reduce un 20% el volumen prostático, actuando sobre el componente estático (anatómico) de la obstrucción vesical. Se considera más eficaz sobre próstatas grandes (>40 g) con predominio de síntomas obstructivos (disuria, micción débil, sensación de vaciado incompleto, interrupciones involuntarias de la micción, necesidad de ayudarse con la musculatura abdominal)27. Su acción tarda en apreciarse más tiempo que la de los alfabloqueantes, (valorar en seis meses) pero también persisten más tras su supresión. Sus efectos secundarios están relacionados con la esfera sexual. Se describe la reducción de la libido, disfunción eréctil (afecta a menos de un 5% de los tratados a largo plazo siendo reversible al abandonar el tratamiento) menor volumen de eyaculado y reducción en un 50% de los niveles de PSA (para controles adecuados doblar valores séricos si se lleva un tratamiento de al menos 6 meses y tenerlo también en cuenta cuando se use como antialopécico en algunos varones).
Es el único fármaco que ha demostrado mejoría a los siete años de tratamiento y una posible alteración de la evolución natural de la enfermedad reduciendo el tamaño prostático en un 30% y el riesgo de padecer retención urinaria en un 57% así como en un 52% el de ser sometido a tratamiento quirúrgico26,28 (Tabla IV).
Tratamiento combinado
El tratamiento médico combinado es fisiopatológicamente aceptable al pensar que el uso de alfabloqueantes y Finasteride® podría arrojar mejores resultados al actuar sobre el componente estático y dinámico de la HBP pero, actualmente, existen escasas referencias en la bibliografía por lo que su elección dependerá de una aplicación individualizada.
Tratamiento quirúrgico
La indicación del mismo y la técnica más apropiada será decidida por el especialista dependiendo del tamaño y morfología prostática, pero el médico de AP debe conocer sus indicaciones así como las incidencias que pueden suceder tras el mismo con objeto de informar al paciente. Conviene recordar que, en ocasiones, la mejora sintomática no se produce hasta pasadas unas semanas tras la intervención y que la cirugía de la HBP se extirpa el adenoma y no la cápsula. Siendo ésta el origen de la mayoría de los carcinomas de próstata, el paciente intervenido no está totalmente protegido de padecerlo, debiéndose someter a las mismas normas de control que los no intervenidos10.
En 1997, la 4ª Reunión patrocinada por la OMS sobre HBP (15) recoge las recomendaciones del Comité Científico Internacional que indica el tratamiento quirúrgico cuando aparecen complicaciones secundarias a la obstrucción como retención de orina, deterioro de los parámetros de la función renal, residuo postmiccional elevado, incontinencia paradójica ("por rebosamiento"), formación de litiasis vesicales, infecciones urinarias frecuentes, hematurias y divertículos vesicales (Tabla V).
El tratamiento quirúrgico de la hiperplasia de próstata y concretamente el tratamiento endoscópico transuretral (fundamentalmente la resección transuretral -RTU-) es considerado como el tratamiento estándar definitivo y el patrón con el que se comparan los demás tratamientos, médicos y quirúrgicos29,30.
La mejoría, tanto clínica como urodinámica tras la RTU supera el 80% cuando se trata de sintomatología leve/moderada31 y es mayor del 90% tras el tratamiento de casos severos32. El incremento medio del flujo en estudios randomizados33 es del 125% (prácticamente 10 ml/sg) y el residuo postmiccional se reduce un 60% cuando el previo a la cirugía es superior a 100 cc. La hemorragia es una de las complicaciones de la técnica, se estima en 7-20 ml por gramo resecado y 0,4-4,5 ml por minuto de cirugía34 variando estas cifras en función de la experiencia del equipo quirúrgico y el tamaño prostático principalmente35. La mortalidad de la técnica es muy baja, prácticamente nula, en seguimientos de más de 1.000 pacientes36.
Otras técnicas
--La cervicotomía endoscópica, uretrocervicotomía, prostatotomía, miocapsulotomía o incisión transuretral de la próstata se realiza normalmente bajo anestesia raquídea aunque hay publicaciones con local37,38. Consisten en realizar una incisión con cuchillete eléctrico (o fotocoagulaciones y vaporizaciones con láser) desde la proximidad del meato ureteral hasta la hendidura prostática lateral al verumontanum. El objetivo quirúrgico consiste en la sección de la zona fibroestromal del cuello vesical. Las opiniones varían en cuanto al número de cortes, localización de los mismos, asociación o no de resección (al menos en parte) del adenoma prostático manteniéndose el consenso de que puede ser útil en próstatas de pequeño tamaño (20-30 g) y en ausencia de un lóbulo medio cuando se intenta evitar la eyaculación retrógrada (jóvenes). La escasa hemorragia quirúrgica39 es una de las ventajas que se le atribuyen sobre la RTU, precisando transfusión excepcionalmente40,41.
--El láser (Ligh Amplification by Stimulated Emission of Radiation) es una energía lumínica que se transforma en energía térmica en los tejidos produciendo cambios histológicos. La lesión depende de la temperatura. Por encima de 50 ºC se desnaturalizan las proteínas produciendo necrosis tisular. Entre 60 y 100 ºC se produce fotocoagulación proteica sin vaporización ni carbonización. Cuando el aumento de temperatura es brusco, se ocasiona una necrosis inmediata pudiendo llegar a la vaporización tisular. Sus indicaciones son superponibles a las de la RTU con la ventaja de que, en principio, pueden tratarse pacientes susceptibles de mayor hemorragia (anticoagulados). Sus limitaciones se establecen en próstatas superiores a 40-60 gramos. La importante disuria postoperatoria que aparece supone una desventaja.
--La transurethral ultrasound-guided laser induced prostatectomy (TULIP) es una técnica de haz de láser móvil. Consiste en una sonda que dispone de una fibra láser con terminación en un prisma de zafiro de emisión lateral y transductores ecográficos uretrales con un efecto de coagulación uniforme del tejido prostático.
--La termoterapia transuretral de la próstata se realiza con un generador de micro-ondas (Prostatron®) que transmite energía a una antena (sonda uretral refrigerada) focalizando un aumento de temperatura en la profundidad de la glándula prostática donde se alcanzan 45-55 ºC, lo que produce una necrosis suburetral en una profundidad de unos 17 mm. El tratamiento se realiza en una hora sin anestesia ni hospitalización y se obtienen buenos resultados entre el 33 y el 56% de los tratamientos.
--La hipertermia de la próstata: se realiza mediante generadores transrectales y transureterales que originan temperaturas inferiores a 45 ºC sin producir necrosis tisular. Los cambios histológicos consisten en infiltrado inflamatorio intersticial y edema. Generalmente se aplica en ciclos de 5 sesiones de unos 90 minutos sin anestesia ni hospitalización. Se publican tasas muy dispares de buenos resultados, entre un 7 y un 65%42,43.
--Los ultrasonidos: en 1987 se presentó un instrumento endoscópico44,45 capaz de aspirar la próstata, tumores vesicales y cálculos. Con esta técnica se evita mejor la eyaculación anterógrada que con la RTU. Los ultrasonidos focalizados de alta intensidad (HIFU) no se consideran una opción de tratamiento en la última reunión de expertos patrocinada por la OMS.
--El TUNA (transurethral needle ablation) utiliza radiofrecuencia a través de unas agujas que se introducen en el tejido prostático mediante visión endoscópica. Produce necrosis focales por coagulación. El procedimiento es bien tolerado, se puede realizar con anestesia tópica o sedación y dura aproximadamente media hora (10-15 minutos cada punción). Produce un aumento del flujo miccional en más del 50% de pacientes junto a una mejoría de síntomas, pero no está indicado en próstatas grandes.
Prótesis endouretrales: el uso de prótesis metálicas autoexpansibles en patología vascular46 supuso el precedente de las primeras aplicaciones en urología47,48. Las prótesis pueden ser metálicas (Uroespiral, Prostacath, Urocoil ) o de poliuretano (Nissenkorn). Están fabricadas de material con buena tolerancia biológica y repelente de depósitos calcáreos a pesar de lo cual son mal toleradas por un 12-14% de pacientes produciéndose un 2-4% de depósitos calcáreos y un 6-12% de desplazamientos.
Se utilizan como alternativa a la cirugía y al sondaje permanente consiguiendo superar la obstrucción a largo plazo en el 60-80% de casos49.
Dilatación con balón de alta presión. La dilatación uretral con catéter balón se propuso en 198050. Puede tener utilidad en caso de que no se pueda realizar cirugía. La anestesia puede ser raquídea o local. En ocasiones es suficiente la sedación e incluso algunos autores han defendido que las dilataciones se las puede realizar el propio paciente de forma ambulatoria51.
Los resultados publicados a los 12 meses son relativamente satisfactorios pero los fracasos aumentan a medida que se repite el procedimiento52.
Cirugía a cielo abierto. La cirugía a cielo abierto está indicada principalmente en próstatas sintomáticas de gran volumen (de forma orientativa superiores a 60 gramos) y cuando se pueden abordar otros problemas asociados por esta técnica en el mismo tiempo quirúrgico (existencia de voluminosas litiasis vesicales, indicación de resolver grandes divertículos vesicales). Las técnicas más habituales son la adenomectomía prostática suprapúbica o transvesical (técnica de Freyer) y la retropúbica (técnica de Millin).
Tras este comentario de los métodos quirúrgicos, cuyo conocimiento puede solventar las dudas que propongan nuestros pacientes, se propone como guía de actuación para el médico de AP la contenida en la figura 1 (aunque pueda variar según las características del medio asistencial) y se fijan como criterios de derivación los contenidos en la tabla VI.
CORRESPONDENCIA:
Mariano Blasco Valle
Paseo María Agustín nº 72, 3º B
50003- Zaragoza.
Tfnos. 976-442809
630-339-336
e-mail: mblascov@meditex.es
Bibliografía
1. Hunter DJW, Berra-Unamuno A, Martín-Gordo A. Prevalence of urinary syntoms and other urological conditions in Spanish men 50 years old or older. J Urol 1996; 155: 1965-8. [ Links ]
2. Jiménez Cruz F. Presentación. En: Vicente R, J. HBP 2001. Hiperplasia Benigna de Próstata. Madrid: Ed. Acción Médica, 2002. p. 5. [ Links ]
3. Holtgrewe HL. Transurethral prostatectomy. Urol Clin North Am 1995; 22: 357-68. [ Links ]
4. Burgos Rodríguez R, Chicharro Molero JA. Hiperplasia Benigna de Próstata. En: Jiménez Cruz JF, Rioja Sanz LA. Tratado de Urología. Barcelona: Ed. J.R. Prous, 1993. p. 1035-50. [ Links ]
5. Resel L, Vela R, Conejero J, Jiménez Cruz, Vicente J, Rioja LA. Hiperplasia benigna de próstata. Bases diagnósticas y terapéuticas. Madrid: Ed. Enar, 1993. [ Links ]
6. Lepor, Lawson. Enfermedades de la próstata. Buenos Aires: Ed. Panamericana, 1994. [ Links ]
7. Hernández C, Moncada I. Hiperplasia benigna de próstata. Madrid: Ed. Luzán, 1999. [ Links ]
8. Carballido JA, Rodríguez J, Llano J. Hiperplasia prostática benigna y medicina basada en la evidencia. Med Clin (Barc) 2000; 114 (Supl. 2): 96-104S. [ Links ]
9. Barry MJ, Wiiliford WO, Fowler FJ. American Urological Association Symptom index: The value of their distinction in a Veterans Affairs randomised trial of medical therapy in men with a clinical diagnosis of benign prostatic hyperplasia. J Urol 2000; 164: 1559-64. [ Links ]
10. Castro Díaz D, Postius Robert J. Urología en AP. Barcelona: Ed. Pulso, 2001. [ Links ]
11. Bedós F, Cibert J. Adenoma de próstata. En: Urología. La terapéutica y sus bases. Barcelona: Espaxs ed., 1989. p. 997-1048. [ Links ]
12. Morote J, Ruibal A, Pont A. Valor del antígeno prostático específico en la predicción del cáncer prostático. Actas Urol Esp 1988; 12: 10-4. [ Links ]
13. Jiménez Cruz JF, Rodríguez Vallejo JM, López Solsona A, Frías Jimeno S. Los médicos de Atención Primaria y la patología prostática. Encuesta nacional. Actas Urológicas Españolas 1996. p. 624-9. [ Links ]
14. Laguna P, Alivizatos G. Antígeno prostático específico e hiperplasia prostática benigna. Curr Opin Urol 2000; 10: 3-8. [ Links ]
15. Denis L, McConnell J, Yoshida O, Khoury S, Abrams P, Barry M, et al. Recommendations of the International Scientific Committee: The Evaluation and Treatment of Lower Urinary Tract Symptoms (LUTS) suggestive of Benign Prostatic Obstruction. En: Denis L, Griffiths K, Khoury S, Cockett ATK, McConnell J, Chatelain C, Murphy G, Yoshida O. 4th International Consultation on Benign Prostatic Hyperplasia (BPH). París: Ed. SCI, 1998. p. 674. [ Links ]
16. Bosch R, Donovan J, Okada K. Symptons evaluation, quality of life and sexuality. I-PSS. The 2nd international consultation on benign prostatic hyperplasia proceedings. En: Cockett AT, Aso Y, Chatelain C (eds). SCI. 1993. p. 131-143. [ Links ]
17. Postius J, Castro D. Tratamiento farmacológico de la HBP basado en la evidencia. Rev Clin Esp 1999; 199 (2): 58-61. [ Links ]
18. Vergeles-Blanca JM, Pozuelos G, Buitrago F. Controversias en el tratamiento de la hiperplasia benigna de próstata. FMC- Formación Médica Continuada en Atención Primaria 1996: 215. [ Links ]
19. Berges RR, Windeler J, Trampisch HJ, Senge T. Randomised, placebo-controlled, double bind clinical trial of beta-sitosterol in patients with benign prostatic hyperplasia. Beta-sitosterol Study Group. Lancet 1995; 1529-32. [ Links ]
20. Wilt TJ, Ishani A, Stark G, MacDonald R, Mulrow C, Sau J. Serenoa repens for benign prostatic hyperplasia. Cochrane Database Syst Rev 2000; 2: CD001423. [ Links ]
21. Cockett ATK. The 3rd International Consultation on Benign Prostatic Hyperplasia (BHP). World Health Organization. Mónaco 1995. [ Links ]
22. World Health Organization Fourth International Consultation on Benign Prostatic Hyperplasia. Procedingss. Paris 1997. [ Links ]
23. Lepor H. The treatment of benign prostatic hyperplasia with alpha-1-blockers. Curr Opin Urol 1994; 4: 16-21. [ Links ]
24. Pool JL. Effects of doxazosin on serum lipids. A review of the clinical data and molecular basis for altered lipid metabolism. Am Heart J 1991; 121: 251. [ Links ]
25. Christensen M, Bendix Holme J, Rassmunsen PC. Doxazosin treatment in patients with prostate obstruction. Scand J Urol 1993; 27: 39. [ Links ]
26. Abrams P, Schulman CC, Vaage S. European Tamsulosin Study Group. Tamsulosin a selective alpha-1c adrenoreceptor antagonist. Br J Urol 1995; 76: 325. [ Links ]
27. Finasteride Study Group. Finasteride in the treatment of benign prostatic hyperplasia. Prostate 1993; 22: 91. [ Links ]
28. Mc Connell JD, Bruskwitz R, Walsh P, Adriole G, Lieber M, Holtgrewe L, et al. The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia. N Eng J Med 1998; 338: 557-63. [ Links ]
29. Mebust WK. Selection of the surgical procedure for management of benign prostatic hyperplasia. Prog Clin Biol Res 1994; 386: 369-84. [ Links ]
30. Errando C, Laguna P, Salvador J, Vicente J. Litotricia endoscópica mediante Lithoclast. Arch Esp Urol 1995; 48: 621-4. [ Links ]
31. Lepor H, Rigaud G. The efficacy of transurethral resention of the prostate in men with moderate symptoms of prostatism. J Urol 1990; 143: 533-7. [ Links ]
32. Fowler FJ. Patient reports of symptoms and quality of life following prostate surgery. Eur Urol 1991; 20 (Supl. 1): 44-9S. [ Links ]
33. Madersbacher S, Marberger M. Is transurethral resection of the prostate still justified? BJU Int 1999; 83: 227-37. [ Links ]
34. Perkins JB, Miller HC. Blood loss during transurethral prostatectomy. J Urol 1969; 101: 93-7. [ Links ]
35. Uchida T, Ohori M, Soh S. Factors influencing morbidity in patients undergoing transurethral resection of the prostate. J Urol 1999; 53: 98-195. [ Links ]
36. Horninger W, Unterlechner H, Strasser H, Bartsch G. Transurethral prostatic resection: mortality and morbidity. Prostate 1996; 28: 195-200. [ Links ]
37. Orandi A. Urological endoscopic surgery under local anesthesia: a cost-reducing idea. J Urol 1984; 132: 1142-6. [ Links ]
38. Loughlin KR, Yalla SU, Belldegaunt GT. Transurethral incision and resection under local anesthesia. J Urol 1987; 60: 185-7. [ Links ]
39. Soler Roselló A, Vila J, Conejero J, Sarrias F, Ahmad A, Reig C. Trigonocervicoprostatotomías. Arch Esp Urol 1991; 44: 601-9. [ Links ]
40. Soonawalla PF, Pardanani DS. Transurethral incision versus transurethral resection of the prostate. A subjective and objective analysis. Br J Urol 1992; 70: 174-7. [ Links ]
41. Vicente J, Sánchez-Martín F, Palou J. Resección versus incisión transuretral en la HBP. Valoración crítica. Arch Esp Urol 1994; 47: 915-24. [ Links ]
42. Stromaier B, Bichler K, Fluchter S. Local microwave hypertermia of benign prostatic hyperplasia. J Urol 1990; 144: 913-7. [ Links ]
43. Linder A, Braf F, Lev A. Local hypertermia of the prostate gland for the treatment of benign prostatic hypertrophy and urinary retention. Br J Urol 1990; 65: 201-3. [ Links ]
44. Krawitz DR, Addonizio JC. Ultrasonic aspiration of prostate, bladder tumors and stones. Urology 1987; 30: 579-80. [ Links ]
45. Malloy T, Carpinello V, Wein A. Bladder outlet treated with transurethral ultrasonic aspiration. Urology 1991; 37: 412-515. [ Links ]
46. Sigwart U, Puel, Mirkovitch V. Intravascular stents prevent occlusion and restenosis after transluminal angioplasty. N Engl Med 1987; 316: 701-6. [ Links ]
47. Milroy EJ, Cooper JE, Wallsten H. A new treatment for urethral strictures. Lancet 1988; 25: 1424-7. [ Links ]
48. Milroy EJ, Chapple CR, Eldin A. A new stent for the treatment of urethral strictures. Preliminary report. Brit J Urol 1989; 63: 392-6. [ Links ]
49. Parra R, Boullier J, Cummings J. Endoluminal Urethra Stent: a review. J Endourol 1993; 7: 117-23. [ Links ]
50. Russinovich NA, Lloyd LR, Griggs WP. Balloon dilatation of urethral strictures Urol Radiol 1980; 2: 33-37. [ Links ]
51. Fishman IJ. Experience with hydraulic balloon urethral dilator for office on self-dilatation. J Urol 1992; 147: 287-90. [ Links ]
52. Nielsen T, Moore RG, Alfert HJ. Alternative endoscopic management in the treatment of urethral strictures. J Endourol 1995; 9: 31-9. [ Links ]