Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.11 no.6 Madrid ago./sep. 2004
REVISIÓN
La estimulación eléctrica de la corteza motora para el tratamiento del dolor central
y dolor periférico por desaferentización
J. V. Pesudo y J. M. González-Darder1
| Pesudo JV, González-Darder JM. Electrical stimulation of the motor cortex for the management of central pain and peripheral pain caused by desafferentiation. Rev Soc Esp Dolor 2004; 11: 370-379.
| ||
| SUMMARY Central pain and peripheral pain caused by desafferentation are difficult to treat even with last generation drugs. Electric stimulation of several structures has shown to be scarcely effective in general. Stimulation of motor cortex is a relatively new technique that seems to offer promising results in these disorders. While it is a simple technique from the surgical point of view, the adequate location of the motor cortex is not so easy, this being a significant condition for its effectiveness. In this paper we review the literature that has been published on the matter. Currently, its major indications are central pain, mainly thalamic, and trigeminal pain caused by desafferentation. The response to barbiturates without response to opiates, the relative preservation of motor and sensitive pathways and the response to transcranial magnetic stimulation predict a good result. Several methods are used to determine the area that has to be stimulated: SSEP, intraoperatory stimulation, neuronavegation, functional MRI. The stimulation parameters recommended vary according to the author. Its mechanism of action is still not well understood, but the most accepted theories are the activation of areas that modulate pain and the inhibition of the transmission of nociceptive stimuli at the medullar level. © 2004 Sociedad Española del Dolor. Published by Arán Ediciones, S.L. Key words: Electric stimulation. Motor cortex. Desefferentation.
| RESUMEN El dolor central y el dolor periférico por desaferentización son de difícil tratamiento incluso con fármacos de última generación. La estimulación eléctrica sobre diversas estructuras ha demostrado en general ser poco efectiva. La estimulación sobre la corteza motora es una técnica relativamente nueva que parece ofrecer resultados prometedores en estos cuadros. Aunque desde el punto de vista quirúrgico es una técnica sencilla, no lo es tanto la localización adecuada de la corteza motora, lo cual es una condición importante para su efectividad. En este trabajo ofrecemos una revisión bibliográfica sobre ella. Sus indicaciones fundamentales actualmente son el dolor central fundamentalmente talámico, y el dolor trigeminal por desaferentización. La respuesta a barbitúricos sin respuesta a opioides, la conservación relativa de las vías motoras y sensitivas, y la respuesta a la estimulación magnética transcraneal predicen un buen resultado. Diversos métodos son utilizados para determinar la zona a estimular: PESS, estimulación intraoperatoria, neuronavegación, RNM funcional. Los parámetros de estimulación recomendados varían de unos autores a otros. Su mecanismo de actuación no es en la actualidad bien conocido aunque las teorías más aceptadas son la activación de zonas que modulan el dolor y la inhibición de la transmisión de los estímulos nociceptivos a nivel medular. © 2004 Sociedad Española del Dolor. Publicado por Arán Ediciones, S.L. Palabras clave: Estimulación eléctrica. Corteza motora. Desaferentización.
|
1Servicio de Neurocirugía. Hospital General de Castelló
Recibido: 10-03-04.
Aceptado: 25-06-04.
1. INTRODUCCIÓN
Brodmann en 1925 estableció que la corteza motora se encuentra en situación inmediatamente anterior a la cisura central o de Rolando, sobre el llamado giro precentral o circunvolución frontal ascendente. Posteriormente, Penfield describió la distribución de las diferentes áreas corporales, en forma de un homúnculo invertido en el que la cabeza y la mano ocupan una superficie mucho mayor que el resto.
Penfield y Jaspers (1) observaron que la estimulación del giro precentral producía respuestas sensitivas cuando la correspondiente porción del giro adyacente postcentral era resecada. Ello demostraba la existencia de una relación funcional del córtex a un lado y otro de la cisura central. Anecdóticamente se observó que un paciente con clínica dolorosa mejoró con la resección del giro postcentral y, cuando el dolor recidivó, con la resección del giro precentral. White y Sweet practicaron girectomías postcentrales con pobres resultados. Lende y cols. (1) publicaron casos de dolores neuropáticos faciales mejorados con resección del giro precentral y el adyacente postcentral.
En un intento de mejorar dolores crónicos intratables mediante técnicas no ablativas, se introdujeron diversas técnicas de estimulación eléctrica. En 1973 Hosobuchi y cols. (2-4) en San Francisco y Mazars y cols. (5-7) en París, comunicaron de forma independiente el tratamiento de pacientes afectados de anestesia dolorosa facial mediante estimulación talámica y de la cápsula interna. Adams y Hosobuchi y cols. (8-10), así como Richardson y Akil (11,12) comunicaron resultados prometedores en el tratamiento de síndromes dolorosos mediante la estimulación de la sustancia gris periacueductal y periventricular en humanos. Los mismos grupos aportaron evidencias de que dicho efecto era debido a la activación de sustancias opioides endógenas (8-10,13). Hardy y Haigler (14) en 1985 estimularon la corteza prefrontal de ratas observando un aumento en la latencia dolorosa. Hosobuchi (15) implantó electrodos en la zona subcortical somatosensorial para el tratamiento de dolor disestésico crónico. En general, los resultados obtenidos mediante estas técnicas fueron limitados.
En 1991, Tsubokawa y cols. (16,17) introdujeron la estimulación de la corteza sensorio-motora como tratamiento para el dolor central por desaferentización, aunque posteriormente comprobaron que lo que mejores resultados proporcionaba era la estimulación de la corteza motora (en inglés "motor cortex stimulation" y que llamaremos en adelante MCS). Desde entonces, diversos autores han aportado modificaciones a la técnica original y han ampliado las indicaciones.
2. TÉCNICA
2.1. Selección de pacientes
Los pacientes subsidiarios de la MCS son aquellos afectados de dolor crónico central o periférico, con componente desaferentizativo y con mala respuesta a otros tratamientos. Dentro de esta indicación genérica, hay ciertos cuadros donde la técnica está especialmente indicada, bien porque existe más experiencia o porque han demostrado responder mejor a la misma, como se analizará más tarde al comentar los resultados.
Algunos aspectos han demostrado ser capaces de predecir, al menos parcialmente, el resultado de la MCS. Generalmente se acepta que la preservación de la vía corticoespinal total o casi totalmente, con ausencia de atrofia muscular es un factor predictivo favorable (18-21). Algunos autores, sin embargo, no han confirmado este hecho (22,23). Una respuesta positiva a barbitúricos sin respuesta a opioides (17,24,25) también predeciría un mejor resultado. Asimismo, en la mayoría de los casos en los que se obtiene mejoría significativa del dolor tras estimulación magnética transcraneal de corteza motora, se produce un buen resultado tras la MCS y, también a la inversa, los pacientes que no responden a la estimulación magnética transcraneal, generalmente no lo harán a la MCS (20,26-29).
2.2. Técnica quirúrgica
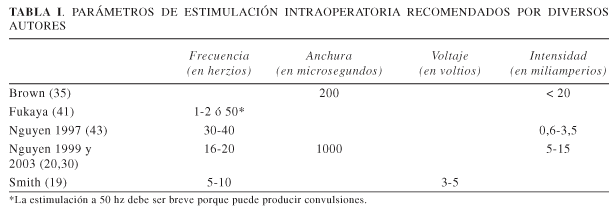
La técnica, tal como fue descrita originalmente por Tsubokawa en 1991 (16), consta de las siguientes maniobras. Bajo anestesia local se introduce un electrodo de 4 contactos del tipo utilizado para la estimulación epidural raquídea, a través de un orificio de trépano. El electrodo es colocado en situación epidural y sobre la zona de la corteza motora, que es identificada por RNM preoperatoria. Se realizan PESS con estimulación del nervio mediano, registrados sobre dicho electrodo. La polaridad del registro de los potenciales 20 ms después de la estimulación del nervio mediano a nivel de la muñeca está invertida a ambos lados del surco central (N20/P20). La zona correspondiente al potencial P20 está situada anteriormente a dicho surco y corresponde a la zona de la corteza motora encargada de la movilidad de la mano. Los PESS de miembro inferior (nervio tibial) o cara (comisura labial) son más difíciles de obtener e interpretar y son menos utilizados para identificar el surco central. Tras identificar la zona de la corteza motora correspondiente a la mano, teniendo en cuenta la somatotopía del homúnculo de Penfield, se infiere la localización de la corteza motora que se intenta estimular. Para confirmar dicha localización se estimula eléctricamente y se observa la existencia de contracciones musculares en la zona dolorosa. Tras la intervención se estimula durante varios días y en el caso de que el resultado sobre el dolor sea positivo, se conecta el sistema a un estimulador que se implanta subcutáneamente a nivel infraclavicular.
Aunque la técnica básica de la MCS sea sencilla desde el punto de vista quirúrgico, su dificultad es la localización correcta de la zona a estimular y este es un aspecto esencial para obtener buenos resultados. Desde la descripción original de Tsubokawa, se han descrito diversas variantes técnicas con la intención de aumentar la comodidad del paciente, la seguridad de la técnica y fundamentalmente su efectividad. Evidentemente, estas variantes se relacionan con el armamentario técnico de que se disponga en cada centro. Comentaremos las variantes más significativas tras dividir la técnica en sus pasos fundamentales:
1. Determinación preoperatoria de la zona a estimular.
2. Intervención quirúrgica y determinación intraoperatoria de la zona a estimular.
3. Colocación de electrodo para la estimulación.
4. Periodo de prueba postoperatorio para determinar la efectividad.
5. Conexión del sistema al estimulador, si la fase anterior ha resultado satisfactoria.
2.2.1. Determinación preoperatoria de la zona a estimular
El área cerebral a estimular es la corteza motora primaria, que anatómicamente se sitúa inmediatamente anterior a la cisura central o de Rolando, sobre la circunvolución frontal ascendente o giro precentral. La estimulación de otras áreas corticales adyacentes, como la corteza sensitiva y la corteza motora suplementaria ha demostrado ser menos útil (17).
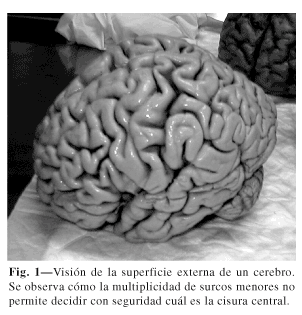
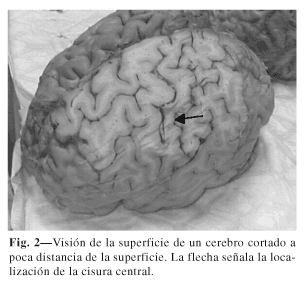
La localización de la corteza motora es difícil, incluso en los especimenes anatómicos. Como señala Nguyen (20), cuando se observa la cara externa de un cerebro, no es fácil determinar cuál es la cisura de Rolando ante la multiplicidad de surcos menores (Fig. 1). Sin embargo, cuando se realizan cortes oblícuos, a unos 5 mm de la superficie se puede observar bien la cisura de Rolando, llegando prácticamente por abajo hasta la cisura de Silvio y por arriba hasta la cisura interhemisférica (Fig. 2).
La situación de la cisura central se puede estimar desde la superficie externa de la cabeza mediante determinadas referencias anatómicas. Las más utilizadas son las llamadas líneas de Taylor-Haughton. A pesar de ello, previamente a la intervención quirúrgica es necesario realizar los habituales estudios de neuroimagen, especialmente la RNM, con el fin de visualizar la corteza precentral y descartar anomalías anatómicas. En la actualidad, muchos autores utilizan sistemas de neuronavegación, mediante los cuales se pueden correlacionar las estructuras observadas intraoperatoriamente, con aquellas obtenidas con la RNM (20,30-35). Aunque el neuronavegador es un instrumento útil para estos fines, no parecen existir hasta el momento diferencias estadísticamente significativas en la efectividad de la estimulación en los casos realizados con o sin neuronavegador (36). La RNM puede realizar reconstrucciones curvas de la superficie cortical en las que se observa muy bien la estructura de surcos, cisuras y cirvunvoluciones, pero dicha información no puede ser integrada en los neuronavegadores actuales. Por ello, Nguyen (20,30), recomienda realizar cortes planos oblicuos más o menos cercanos a la cisura de Silvio o a la cisura interhemisférica, según la zona del homúnculo que se pretenda estimular. El punto superior de la cisura de Rolando es más fácil de determinar, por llegar casi siempre hasta la cisura interhemisférica, mientras que el inferior es más difícil ya que está situado a variable distancia del surco lateral o de Silvio (37).
Ya se ha comentado que la estimulación magnética transcraneal posee una capacidad predictiva importante sobre la efectividad de la estimulación. Hay que señalar además, su utilidad para la localización de la corteza motora. Algunos sistemas permiten la integración de la información proporcionada por la estimulación magnética transcraneal a un sistema de neuronavegación (33).
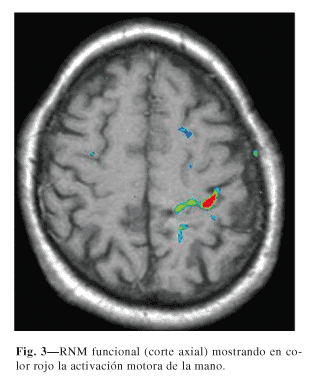
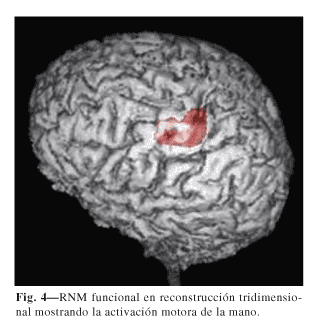
Finalmente, algunos autores conceden especial importancia a la realización de RNM funcional para la determinación de la corteza motora (32,36,38). En situaciones en las que se produce una reorganización somatotópica, como en los casos de miembro fantasma, podría tener una utilidad importante (39,40). En las figuras 3 y 4 se muestran 2 ejemplos de RNM funcional.
2.2.2 Intervención quirúrgica y determinación intraoperatoria de la zona de estimulación
En la técnica original de Tsubokawa se realiza un orificio de trépano bajo anestesia local sobre la zona que se supone que corresponde a la corteza motora a estimular. En la actualidad se realiza más frecuentemente una craneotomía de unos 4 ó 5 cm de diámetro, en lugar de orificio de trépano (19,20,30,32,35, 39,41,42). El motivo es que este último, aunque aparentemente menos agresivo que la craneotomía, raras veces coincide sobre la zona en la que se debe estimular, por lo que se debe ir desplazando el electrodo a lo largo de un superficie más o menos grande del espacio epidural. Este despegamiento de la duramadre podría implicar un mayor riesgo de hematoma epidural que la realización de una craneotomía reglada, con posterior suspensión de la duramadre. Otra posibilidad es realizar 2 orificios de trépano a lo largo de la cisura central anclando el electrodo en el puente óseo que queda entre ellos (36). La incisión de la piel puede ser lineal (35,36) o en herradura (19,33).
La craneotomía se puede hacer con anestesia general o local. Algunos son partidarios de la primera (32,35), otros de la segunda (31,33,39,43,44) y otros utilizan indistintamente una u otra (36). Otros realizan una craneotomía con anestesia general que es reabierta bajo anestesia local al cabo de varios días para la detección de la corteza motora y la colocación del electrodo (19). En favor de la anestesia general está el ser más cómoda para el paciente. La anestesia local, sin embargo, permite una detección más fácil de las contracciones musculares tras la estimulación al no estar el paciente bajo efectos farmacológicos, y además el propio paciente puede colaborar indicando si nota dichas contracciones o incluso reducción del dolor (43). En el caso de hacer anestesia general es conveniente detener la administración de relajantes musculares previamente a la estimulación (35). Es posible que el desarrollo de métodos para detectar de forma más exacta la corteza motora acabe por hacer preferible la anestesia general.
La realización de PESS con la detección de la inversión de polaridad N20/P20, que forma parte de la técnica original de Tsubokawa sigue siendo utilizada rutinariamente por todos los autores. En la actualidad, dado que habitualmente se realiza craneotomía, se suele utilizar un electrodo en manta para su detección. Sin embargo, esta técnica localizadora no carece de dificultades. En una serie de 12 pacientes (32) se consideró que el registro de PESS había sido óptimo en 6 casos, subóptimo en 4 y nulo en 2. Fue más útil en los casos en que el registro se hizo con estímulo en miembro superior. Como dato anecdótico que ilustra las dificultades de la técnica, hay que señalar que en la primera intervención que se intentó se detectaron tantas interferencias que fue imposible la realización de los PESS, por lo que se suspendió la operación. Esta fue practicada al cabo de varios días en otro quirófano pudiéndose entonces detectar los PESS y partir de entonces se reservó dicho quirófano para este tipo de intervenciones.
Junto a la realización de PESS, la otra técnica esencial para la localización del área diana es la estimulación intraoperatoria. Con ella se pretende la obtención de contracciones musculares sobre la zona dolorosa. Algunos autores realizan simultáneamente EMG para objetivarlas (20,30,33,35). Como hemos señalado anteriormente, si el paciente no se encuentra bajo anestesia general, puede referir la sensación que le producen dichas contracciones, o incluso notar disminución del dolor. Sin embargo, las contracciones motoras pueden no obtenerse, o al contrario, desencadenarse tras la estimulación de la corteza somatosensorial o área motora suplementaria (24). Actualmente es raro que se desencadene una crisis epiléptica, aunque en las primeras series comunicadas fue frecuente (22). Se recomienda administrar rutinariamente antiepilépticos preoperatoria y postoperatoriamente para evitar este hecho. En la Tabla I se resumen algunos parámetros para la estimulación intraoperatoria recomendados por diversos autores.
2.2.3 Colocación del electrodo para la estimulación
Una vez determinada la zona a estimular, se debe decidir el tipo y colocación del electrodo para la estimulación definitiva. Generalmente se coloca un electrodo de 4 contactos como el usado para la estimulación eléctrica medular con laminectomía. Han comenzado a utilizarse electrodos específicos de forma circular y que contienen 8 contactos. El electrodo se deja en situación epidural o más raramente subdural. En algún caso fue necesario colocar en situación subdural un electrodo ubicado inicialmente en el espacio epidural y que por haberse rodeado de tejido fibroso había dejado de ser efectivo (45). Habitualmente se emplea un solo electrodo pero pueden utilizarse 2 en paralelo (en cuyo caso serán posteriormente conectados a un estimulador de doble canal). El electrodo se deja en posición aproximadamente perpendicular a la cisura central (35,39) o paralela (19,30,36) a ella. La ventaja de la primera disposición es que se pueden estimular diferentes áreas funcionales correspondientes a la misma localización somatotópica además de la corteza motora primaria (área somatosensorial, área motora suplementaria) que podrían colaborar al efecto analgésico. La ventaja de la segunda es que se puede estimular una zona más amplia del homúnculo de la corteza motora primaria.
Tras decidirse la colocación del electrodo, este es suturado a la duramadre. Algunos prefieren denervar la duramadre bien mediante coagulación (44) o bien mediante incisión (32) para evitar posteriormente molestias locales.
2.2.4. Periodo de prueba postoperatorio para determinar la efectividad
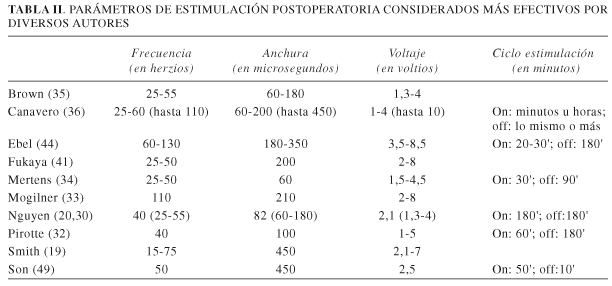
Tras el implante del electrodo, el paciente es sometido a un periodo de estimulación de prueba. La duración recomendada de este periodo varía según los diferentes autores: desde 2 a 5 días (33,35,43,44), 1 semana (31,36,41), hasta varias semanas (32). La valoración del resultado se suele hacer mediante la escala visual analógica (VAS). En esta fase hay que determinar los parámetros de estimulación más efectivos. En la Tabla II se resumen los parámetros de estimulación que se han demostrado más efectivos para diferentes autores. Se reseña la frecuencia, anchura de onda, voltaje y ciclo de estimulación cuando es referido. Se observa bastante variabilidad sobre todo en la anchura de onda y los ciclos de estimulación. Las frecuencias tienden a ser más bien bajas. En un estudio se observó que la estimulación a 10 o 100 hz producía la misma analgesia, pero la última frecuencia se asociaba a fatiga de los miembros (46). El voltaje utilizado es el que consiga el efecto analgésico sin llegar a producir contracciones motoras. Se observa habitualmente un retraso de 10-15 minutos hasta obtener el efecto analgésico (20,30,32,43). Tras cesar la estimulación, el efecto permanece durante un tiempo variable de 15 a 120 minutos (media de 51 minutos) (32). Esta permanencia de la analgesia puede prolongarse incluso hasta 3 días en los primeros 2 meses de estimulación (36). También, el efecto analgésico tiende a disminuir con el tiempo (36).
2.2.5. Conexión del sistema al estimulador
En el caso de que la estimulación se considere efectiva, se procede a conectar al sistema el estimulador definitivo que se implanta subcutáneamente en situación infraclavicular.
Un protocolo que se aparta bastante del esquema general descrito es el propuesto por Saitoh (45,47). Este autor implanta una manta de electrodos tras lo cual procede a realizar múltiples variantes de estimulación a lo largo de varias semanas. Posteriormente implanta un electrodo definitivo de 4 contactos en la localización más conveniente.
3. RESULTADOS
3.1. Resultados favorables
Aunque la MCS no es efectiva en todos los casos, resulta una técnica muy útil en casos seleccionados. Las dos grandes indicaciones actualmente son el dolor central y el dolor trigeminal. Su efectividad parece ir más allá del efecto placebo. Así, en varios estudios a doble ciego (19,43) se pidió a pacientes en los que la MCS era efectiva, que identificasen en qué momentos el sistema estaba encendido o apagado, basándose exclusivamente en su percepción del dolor. Se comprobó una alta correlación entre ambos hechos, incluso teniendo en cuenta los fenómenos de la latencia en la aparición del efecto analgésico y la persistencia del mismo.
3.1.1. Dolor central
Es la indicación para la que originariamente desarrolló Tsubokawa la técnica. La mayoría de casos son secundarios a dolor talámico, bien por lesión isquémica, hemorrágica o por otras causas, como absceso o TCE (17,18,26,30). También ha sido utilizado la MCS en otros casos de dolor central, en ausencia de un evidente componente talámico, como tras la resección de una malformación arteriovenosa parietal (48) y tras un infarto bulbar (18). Sobre 159 casos publicados se obtuvo mejoría de > 50% en el VAS en un 52% (20).
3.1.2. Dolor trigeminal
La mayor parte de los casos fueron pacientes con dolor secundario a la realización de técnicas percutáneas para el tratamiento de la neuralgia del trigémino y, en otros, a cirugía del seno maxilar, fosa posterior o seno cavernoso (20,30,32,39,44). Globalmente, en todos los casos publicados se ha obtenido una mejoría > 50% en el VAS en el 73% (20).
3.1.3. Otras indicaciones
La MCS ha sido utilizada en el tratamiento del miembro fantasma, aunque con resultados discordantes. Globalmente, sobre 19 casos publicados se han obtenido mejorías > 50% en el VAS en el 53% (20). Sin embargo, en la serie de Katayama (42), sólo fueron mejorados el 20% de los pacientes. Este autor prefiere la estimulación talámica para esta patología, en la que obtiene un 60% de buenos resultados. Es posible que en este cuadro exista una reorganización somatotópica que explique que en casos en los que se ha utilizado la RNM funcional como técnica de localización del área motora, se obtengan resultados mucho mejores (38,40). En lesiones de plexo braquial se han obtenido resultados algo peores, con un 44% de mejoría. Es posible que exista también aquí un problema de reorganización somatotópica (20). Paradójicamente, en casos de paraplejía o tetraplejía, en los que podría ocurrir lo mismo, se han obtenido resultados mucho mejores (mejoría en 7 de 8 pacientes) (20). Se han comunicado en torno a 5 casos de lesión nerviosa periférica (19,30,49). Globalmente respondieron bien al tratamiento un 80%. Uno de ellos fue un caso de síndrome de dolor regional complejo tipo II con afectación de todo un hemicuerpo y que comenzó tras una amputación de la articulación interfalángica proximal de un dedo índice y que respondió bien al tratamiento. Se ha descrito un caso aislado de siringomielia, con discreta respuesta al tratamiento.
Además de en el tratamiento del dolor, la MCS puede tener utilidad en los movimientos anormales. Katayama y cols. (50,51) analizaron los efectos de la MCS en pacientes con movimientos anormales secundarios a accidente cerebro-vascular y llegaron a la conclusión de que la MCS es efectiva. Más de la mitad de los pacientes mejoraron de la atetosis, temblor e hipertonía. También se ha descrito la mejoría de un paciente con distonía en la mano asociado a lesión talámica (31).
3.2. Efectos indeseables
En las primeras series se describían con frecuencia crisis epilépticas durante la estimulación intraoperatoria (22), pero son raras en las series más recientes. Afortunadamente en ningún caso tuvieron consecuencias graves. Con el fin de prevenir las crisis se administran rutinariamente fármacos antiepilépticos en el preoperatorio y postoperatorio. Sólo se ha comunicado una crisis generalizada durante la estimulación postoperatoria, que no volvió a repetirse (52).
Se han registrado 2 hematomas epidurales: uno asintomático que no requirió tratamiento quirúrgico (43) y otro que debió ser evacuado, quedando en este caso disfasia como secuela neurológica (22).
En el 15% de los casos el sistema debió de ser explantado a causa de infección y en 0,5% se produjeron dehiscencias en la herida infraclavicular. Las malfunciones del sistema han sido excepcionales (36).
Una complicación especialmente reseñable es el dolor a nivel del electrodo que ocurre en el 5% de los casos (36). Puede revertir disminuyendo el voltaje, aunque ello puede condicionar que disminuya la efectividad sobre el dolor neuropático. Como se comentó antes, para evitarlo, algunos practican la denervación de la duramadre.
Se ha comentado anteriormente que parece existir tendencia a disminución del efecto analgésico (19). En una serie (30) esto ocurrió en un 18,7% durante los 6 primeros meses (6 pacientes). En 5 de ellos se decidió que el electrodo no se encontraba en situación correcta y tras su recolocación volvieron a mejorar.
3.3. Efectos paradójicos
Algunos fenómenos que se han observado de modo ocasional son: analgesia ipsilateral a la MCS (36,53), analgesia bilateral obtenida mediante estimulación unilateral (20,30), dolor bilateral y de la misma distribución que el dolor original producido por MCS unilateral (54) y, finalmente, sensaciones parestésicas ipsilaterales a la MCS inducidas por modificaciones en la polaridad de los electrodos. Es importante destacar que en una serie se observó que en un 9% de pacientes el dolor desapareció totalmente, a pesar de tener el sistema desconectado durante 2 años (54).
4. MECANISMO DE ACCIÓN
El mecanismo de acción de la MCS no se conoce con exactitud. Se ha comentado previamente la existencia de interrelaciones funcionales entre la corteza motora y la somatosensorial. En la hipótesis inicial de Tsubokawa la corteza motora activaría a la de corteza somatosensorial, que actuaría retrógradamente sobre el tálamo. Sin embargo, con estudios de tomografía de emisión de protones (PET) no se ha comprobado tal activación somatosensorial. Con esta técnica se ha observado activación de los núcleos talámicos ventral anterior y lateral, que están en relación con la corteza motora y que podría explicar el efecto sobre los trastornos del movimiento (20,23,55). Se ha observado también aumento en el flujo sanguíneo de estructuras implicadas en el control del dolor: núcleos talámicos mediales, circunvolución del cíngulo, ínsula, porción superior del tronco (23). Estas estructuras parecen estar implicadas en la modulación del dolor. Otro mecanismo que se propone es un efecto tipo "gate-control", por la acción inhibitoria descendente del haz piramidal sobre el asta posterior.
Por otro lado, en pacientes que responden a MCS hay conservación al menos relativa de los umbrales para estímulos no nociceptivos o estos umbrales son aumentados por la MCS, lo que hablaría de que la MCS actuaría al menos en parte modulando y restaurando las conexiones anatómicas y fisiológicas entre estímulos nociceptivos y no nociceptivos (29).
Sería interesante saber sobre qué estructuras de la corteza cerebral actúa la MCS, concretamente cuerpos celulares y/o axones y sobre qué capas. Tal vez este conocimiento abriría nuevas posibilidades al tratamiento, al poder determinar los patrones de estimulación más efectivos.
5. CONCLUSIONES
La MCS es una técnica prometedora para el tratamiento de dolores de difícil solución. Su efectividad parece haberse demostrado en ciertos casos. Es indudable que para obtener buenos resultados es necesario, en primer lugar, una buena selección de los pacientes y, en segundo lugar, una apropiada colocación del electrodo. Estos hechos condicionan en buena parte la complejidad de la técnica, que desde el punto de vista quirúrgico es relativamente sencilla. El conocimiento de sus mecanismos de actuación, la mejora de los métodos de localización y de los parámetros de estimulación pueden mejorar notablemente los resultados y abrir nuevas vías de investigación en el terreno de la neuromodulación cerebral.
| CORRESPONDENCIA: J. V. Pesudo Martínez Servicio de Neurciencias Hospital General de Castellón Avda. Benicassim, s/n 12004 Castellón Telf.: 964 726 500 Fax: 964 726 645/3 |
BIBLIOGRAFÍA
1. Lende RA, Kirsch WM, Druckman R. Relief of facial pain after combined removal of precentral and postcentral cortex. J Neurosurg 1971; 34: 537-43. [ Links ]
2. Hosobuchi Y, Adams JE, Rutkin B. Chronic thalamic stimulation for the control of facial anesthesia dolorosa. Arch Neurol 1973; 29: 158-61. [ Links ]
3. Hosobuchi Y. Chronic brain stimulation for the treatment of intractable pain. Res Clin Stud Headache 1978; 5: 122-6. [ Links ]
4. Hosobuchi Y. Subcortical electrical stimulation for control of intractable pain in humans. Report of 122 cases (1970-1984). J Neurosurg 1986; 64: 543-53. [ Links ]
5. Mazars GJ, Merienne L, Ciolocca C. Stimulations thalamiques intermittentes antalgiques. Note preliminaire. Rev Neurol 1973; 128: 273-9. [ Links ]
6. Mazars GJ, Merienne L, Ciolocca C. Treatment of certain types of pain by implantable thalamic stimulators. Neurochirurgie 1974; 29: 117-27. [ Links ]
7. Mazars GJ. Intermittent stimulations of nucleus ventralis posterolateralis for intractable pain. Surg Neurol 1975; 4: 93-5. [ Links ]
8. Adams JE. Naloxone reversal of analgesia produced by brain stimulation in the human. Pain 1976; 2: 161-6. [ Links ]
9. Hosobuchi Y, Adams JE, Linchitz R. Pain relief by electrical stimulation of the central gray matter in humans and its reversal by naloxone. Science 1977; 197: 183-6. [ Links ]
10. Hosobuchi Y, Ressier J, Bloom F, et al. Stimulation of human periaqueductal gray for pain relief increases immunoreactive beta-endorphin in ventricular fluid. Science 1979; 203: 279-81. [ Links ]
11. Richardson DE, Akil H. Pain reduction by electric brain stimulation in man. I. Acute administration in periaqueductal and periventricular sites. J Neurosurg 1977; 47: 178-83. [ Links ]
12. Richardson DE, Akol H. Pain reduction by electric brain stimulation in man. II. Acute administration in periaqueductal and periventricular sites. J Neurosurg 1977; 47: 184. [ Links ]
13. Akil H, Richardson DE, Barchas JD, et al. Appearance of Betaendorphin-like immunoreactivity in human ventricular cerebrospinal fluid upon analgesic electrical stimulation. Proc Natl Acad Sci USA 1978; 75: 5170-2. [ Links ]
14. Hardy SG, Haigler HJ. Prefrontal influences upon the midbrain: a possible route for pain modulation. Brain Res 1985; 339: 285-93. [ Links ]
15. Hosobuchi Y. Subcortical electrical stimulation for control of intractable pain in humans. Report of 122 cases. J Neurosurg 1986; 64: 543-53. [ Links ]
16. Tsubokawa T, Katayama Y, Yamamoto T, Hirayama T, Koyama S. Chronic motor cortex stimulation for the treatment of central pain. Acta Neurochir Suppl 1991; 52: 137-9. [ Links ]
17. Tsubokawa T, Katayama Y, Yamamoto T, Hirayama T, Koyama S. Chronic motor cortex stimulation in patients with thalamic pain. J Neurosurg 1993; 78: 393-401. [ Links ]
18. Katayama Y, Fukaya C, Yamamoto T. Poststroke pain control by chronic motor cortex stimulation: neurological characteristics predicting a favorable response. J Neurosurg 1998; 89: 585-91. [ Links ]
19. Smith H, Joint C, Schlugman D, Nandi D, Stein JF Aziz TZ. Motor cortex stimulation for neuropathic pain. Neurosurg Focus 2001; 11: 1-9. [ Links ]
20. Nguyen JP, Lefaucheur JP, Keravel Y. Motor cortex stimulation. In: Simpson BA. Electrical Stimulation and the Relief of Pain. Pain Research and Clinical Management, vol 15. Editorial Elsevier Science BV, 2003. p. 197-209. [ Links ]
21. Carroll D, Joint C, Maartens N, et al. Motor cortex stimulation for chronic neuropathic pain: a preliminary study of 10 cases. Pain 2000; 84: 431-7. [ Links ]
22. Meyerson BA, Lindblom U, Lind G, Herregodts P. Motor cortex stimulation as treatment of trigeminal neuropathic pain. Acta Neurochir Suppl 1993; 58: 150-3. [ Links ]
23. Garcia-Larrea L, Peyron R, Mertens P, Gregoire MC, Lavenne F, Le Bars D, et al. Electrical stimulation of motor cortex for pain control: a combined PET-scan and electrophysiological study. Pain 1999; 83 (2): 259-73. [ Links ]
24. Canavero S, Bonicalzi V. Cortical stimulation for central pain. J Neurosurg 1995; 83: 1117. [ Links ]
25. Yamamoto T, Katayama Y, Hirayama T, et al. Pharmacological classification of central post-stroke pain: comparison with the results of chronic motor cortex stimulation therapy. Pain 1997; 72: 5-12. [ Links ]
26. Migita K, Tohru U, Kazunori A, Shuji M. Transcranial magnetic coil stimulation in patients with central pain. Technique and application. Neurosurgery 1995; 36: 1037-40. [ Links ]
27. Lefaucheur JP, Drouot X, Keravel Y, Nguyen JP. Pain relief induced by repetitive transcranial magnetic stimulation of precentral cortex. Neuroreport 2001; 12: 1-3 [ Links ]
28. Lefaucheur JP, Drouot X, Nguyen JP. Interventional neurophysiology for pain control: duration of pain relief following repetitive transcranial magnetic stimulation of the motor cortex. Neurophysiol Clin 2001; 31: 247-52. [ Links ]
29. Drouot X, Nguyen JP, Peschanski M, Lefaucheur JP. The antalgic efficacy of chronic motor cortex stimulation is related to sensory changes in the painful zone. Brain 2002; 125: 1660-4. [ Links ]
30. Nguyen JP, Lefaucheur JP, Decq P, Uchiyama T, Carpentier A, Fontaine D, et al. Chronic motor cortex stimulation in the treatment of central and neuropathic pain. Correlations between clinical, electrophysiological and anatomical data. Pain 1999; 82 (3): 245-51. [ Links ]
31. Franzini A, Ferroli P, Servello D, Broggi G. Reversal of thalamic han syndrome by long-term motor cortex stimulation. J Neurosurg 2000; 93: 873-5. [ Links ]
32. Pirotte B, Voordecker P, Joffroy F, Massager N, Wikler D, Baleriaux D, et al. The Zeiss-MKM system for frameless image-guided approach in epidural motor cortex stimulation for central neuropathic pain. Neurosurg Focus 2001; 11: 1-6. [ Links ]
33. Mogilner A, Rezai A. Epidural motor cortex stimulation with functional imaging guidance. Neurosurg Focus 2001; 11: 1-4. [ Links ]
34. Mertens P, Nuti C, Sindou M, Guenot M, Peyron R, García-Larrea L, et al. Precentral cortex stimulation for the treatment of central neuropathic pain. Stereotactic and Functional Neurosurgery. Stereotact Funct Neurosurg 1999; 73: 122-5. [ Links ]
35. Brown J. Motor cortex stimulation. Neurosurg Focus 2001; 11: 1-5. [ Links ]
36. Canavero S, Bonicalzi V. Therapeutic extradural cortical stimulation for central and neurophatic pain: a review. The Clinical Journal of Pain 2002; 18: 48-55. [ Links ]
37. Herregodts P, Stadnik T, De Ridder F, D'Haens J. Cortical stimulation for central neuropathic pain: 3-D surface MRI for easy determination of the motor cortex. Acta Neurochir Suppl 1995; 64: 132-5. [ Links ]
38. Sol JC, Casaux J, Roux FE, Lotterie JA, Bousquet P, Verdié JC, et al. Chronic motor cortex stimulation for phantom limb pain: correlations between pain relief and functional imaging studies. Stereotact Funct Neurosurg 2001; 77: 172-6. [ Links ]
39. Rainov N, Heidecke V. Motor cortex stimulation for neuropathic facial pain. Neurol Res 2003; 25: 153-61. [ Links ]
40. Roux FE, Ibarrola D, Lazorthes Y, Berry I. Chronic motor cortex stimulation for phantom limb pain: a functional magnetic resonance imaging study: technical case report. Neurosurgery 2001; 48; 681-8. [ Links ]
41. Fukaya C, Katayama Y, Yamamoto T, Kobayashi K, Kasai M, Oshima H. Motor cortex stimulation in patients with post-stroke pain: conscious somatosensory response and pain control. Neurol Res 2003; 25: 153-6. [ Links ]
42. Katayama Y, Yamamoto T, Kobayashi K, Kasai M, Oshima H, Fukaya C. Motor cortex stimulation for phantom limb pain: comprehensive therapy with spinal cord and thalamic stimulation. Stereotact Funct Neurosurg 2001; 77: 159-62. [ Links ]
43. Nguyen JP, Keravel Y, Feve A, Uchiyama T, Cesaro P, Le Guerinel C, et al. Treatment of deafferentation pain by chronic stimulation of the motor cortex: report of a series of 20 cases. Acta Neurochir Suppl 1997; 68: 54-60. [ Links ]
44. Ebel H, Rust D, Tronnier V, Böker D, Kunze S. Chronic precentral stimulation in trigeminal neuropathic pain. Acta Neurochir 1996; 138: 1300-6. [ Links ]
45. Saitoh Y, Shibata M, Hirano S, Hirata M, Mashimo T, Yoshimine T. Motor cortex stimulation for central and peripheral deafferentation pain. J Neurosurg 2000; 92: 150-5. [ Links ]
46. Fujii M, Ohmoto Y, Kitahara T, et al. Motor cortex stimulation therapy in patients with thalamic pain. No Shinkei Geka 1997; 25: 315-9. [ Links ]
47. Saitoh Y, Hirano S, Kato A, Kishima H, Hirata M, Yamamoto K, et al. Motor cortex stimulation for deafferentation pain. Neurosurg Focus 2001; 11: 1-5. [ Links ]
48. Hosobuchi Y. Motor cortical stimulation for control of central deafferentation pain. Adv Neurol 1993; 63: 215-7. [ Links ]
49. Son UC, Kim MC, Moon DE, Kang JK. Motor cortex stimulation in a patient with intractable complex regional pain syndrome type II with hemibody involvement. Case report. J Neurosurg 2003; 98 (1): 175-9. [ Links ]
50. Katayama Y, Fukaya C, Yamamoto T. Control of poststroke involuntary and voluntary movement disorders with deep brain or epidural cortical stimulation. Stereotact Funct Neurosurg 97; 69: 73-9. [ Links ]
51. Katayama Y, Oshima H, Fukaya C, Kawamata T, Yamamoto T. Control of post-stroke movement disorders using chronic motor cortex stimulation. Acta Neurochir Suppl 2002; 79: 89-92. [ Links ]
52. Rainov NG, Fels C, Heidecke V, et al. Epidural electrical stimulation of the motor cortex in patients with facial neuralgia. Clin Neurol Neurosurg 1997; 99: 205-9. [ Links ]
53. Parrent AG, Tasker RR. Can the ispsilateral hemis-phere mediate pain in man? Acta Neurochir 1992; 58: 150-3. [ Links ]
54. Tsubokawa T, Katayama Y, Yamamoto T, et al. Effective mechanisms and follow up results of chronic motor cortex stimulation for relief of central deafferentation pain. In: abstracts of the 3rd International Congress of the International Neuromodulation Society, Orlando, 1996. p. 123. [ Links ]
55. Nguyen JP, Pollin B, Feve A, Geny C, Cesaro P. Improvement of action tremor by chronic cortical stimulation. Mov Disord 1998; 13 (1): 84-8. [ Links ]